Почему в 2021 году наблюдалось доминирование дельта-штамма SARS-CoV-2

Уникальное сочетание мутаций дельта-штамма служит объяснением тому, почему последствия его появления в мире оказались такими опустошительными.
2021 год стал годом различных штаммов коронавируса.
▶ Читать по теме: Насколько страшен Омикрон? Что ученым известно на данный момент
Год начался с марша альфа- и бета-штаммов, вслед за которыми последовали еще несколько вызывающих опасения вариантов вируса; завершается же год все более распространяющимся омикроном. Какое влияние окажет последний на дальнейшее развитие пандемии, остается неясным. Однако даже по мере все большего распространения омикрона общий ход пандемии определяется пока что не им, а тем, который к середине года доминировал по всему миру (чего никогда не было с альфа и бета); и это дельта.
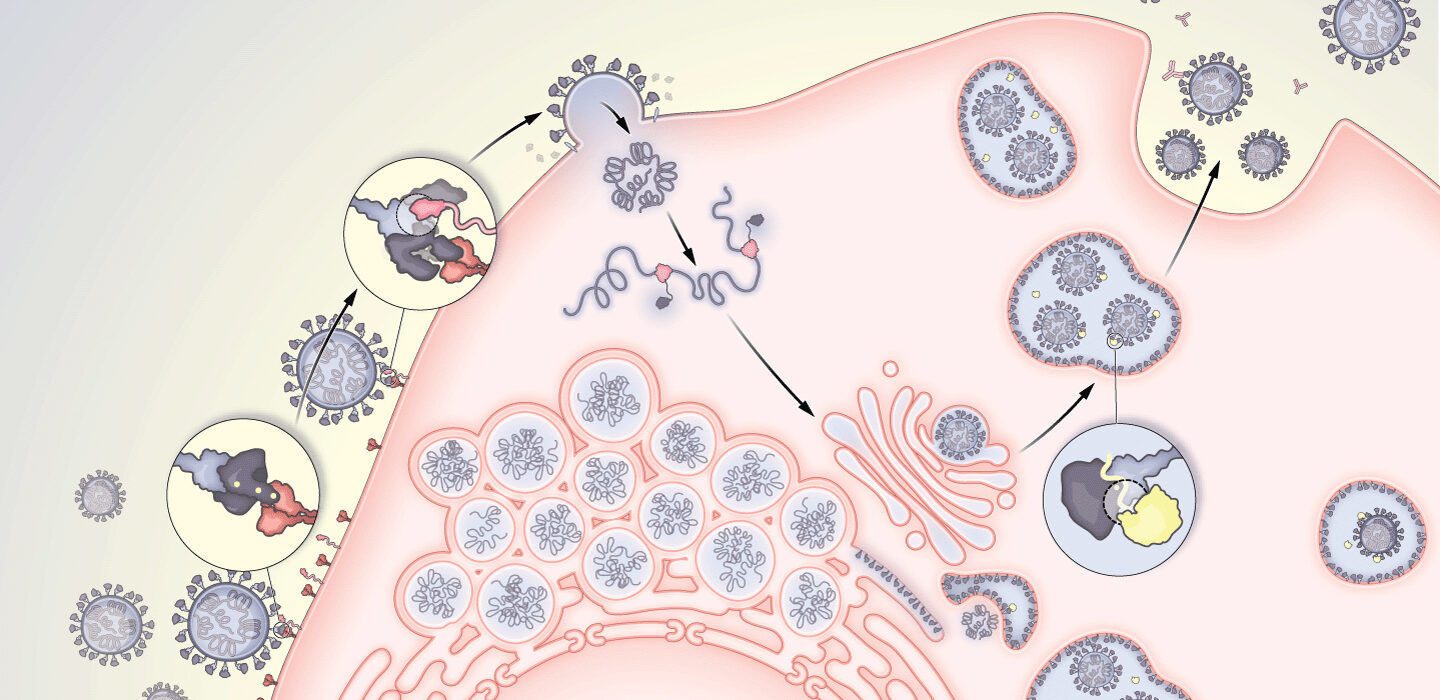
В конце весны и начале лета 2021 года, через полтора года после начала пандемии COVID-19, казалось, что ситуация в некоторых странах начинает изменяться в лучшую сторону. В Соединенных Штатах, например, были вакцинированы миллионы людей, число случаев заболевания сокращалось, наблюдался постепенный возврат активности социального взаимодействия к обычному уровню до пандемии.
Однако внезапно начал активно выявляться дельта-штамм. Впервые обнаруженный в Индии в октябре 2020 года, этот вариант коронавируса SARS-CoV-2 быстро распространился по всему миру, вытеснив другие штаммы вируса в 2021 году. Это привело к перегрузке системы здравоохранения, новым вспышкам среди невакцинированного населения, а впоследствии выяснилось, что даже вакцинированные лица тоже уязвимы.
Вскоре стало ясно, почему так стремительно распространялся дельта-штамм. Как сообщалось в августе в журнале Clinical Infectious Diseases, люди, зараженные им, выделяют больше вирусных частиц и распространяют его дольше, чем те, кто инфицирован другими штаммами. В результате заразность инфекции повысилась. Рассмотрим два сценария в популяции, где ни у кого нет иммунитета к коронавирусу: человек, зараженный наиболее ранним штаммом вируса — тем, который впервые был выявлен в городе Ухань (Китай) и стал причиной самой пандемии, — может заразить им двоих или троих. Однако человек, зараженный дельта-штаммом, может инфицировать вирусом пятерых-шестерых людей.
Такими особенностями вирус обладает вследствие мутаций в генах, кодирующих некоторые его белки. Например, мутация под названием R203M в нуклеокапсиде коронавируса или N-белке, расположенном внутри вириона. По сообщениям ученых в ноябре в журнале Science, эта мутация приводит к увеличению количества реплицируемой вирусной РНК или к упрощению сборки вирусных частиц посредством N-белка (упаковка РНК во вновь собранные вирусные частицы).
Мутации, сходные с теми, которые возникли у дельта-штамма, появлялись и у других вариантов вируса, что приводило к более быстрому и широкому заражению людей, а также к приобретению вирусом способности уклоняться от иммунной защиты организма по сравнению с исходной формой вируса. В их число входят альфа, впервые зарегистрированный в Соединенном Королевстве; бета, впервые описанный в Южной Африке; гамма, впервые зафиксированный в Бразилии. У недавно обнаруженного омикрона, впервые зарегистрированного в Южной Африке и Ботсване, также присутствуют подобные мутации.
Некоторые из мутаций дельта-штамма идентичны мутациям, выявленным у других вариантов вируса; другие же приводят к замене определенной аминокислоты (структурного компонента белка) или появлению новой аминокислоты в той же части вируса. Например, у штаммов альфа и омикрон выявлена аналогичная мутация 203-й аминокислоты в N-белке, но подобной замены аминокислоты не наблюдается у дельта-штамма. А некоторые мутации у последнего совершенно уникальны.
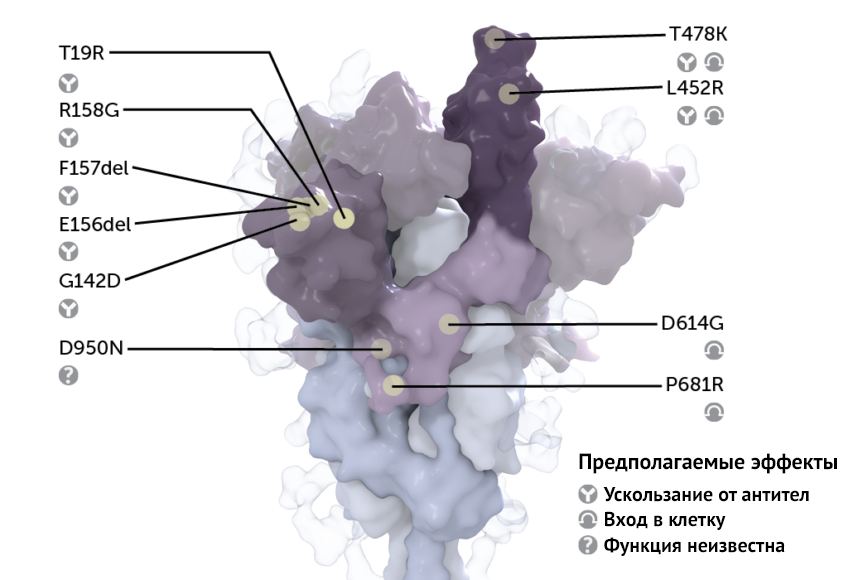
Еще до конца не известно, как все эти изменения влияют на репликативные способности дельта-штамма или на его способность передаваться среди людей. Более того, эволюция дельты продолжается, что со временем приведет к новым изменениям. Однако большинство исследований сосредоточены на уникальном сочетании мутаций, изменяющих шипиковый S-белок вируса. Это белок узловатой формы, присущий каждому коронавирусу, благодаря которому он может прикрепляться к клеткам человека и проникать в них. То, что выглядит как отдельная «ручка», на самом деле состоит из трех одинаковых структур, сочетающихся друг с другом, в каждой из которых находится один и тот же набор мутаций.
Некоторые из мутаций шипикового белка дельта-штамма способствуют облегченному проникновению вируса в клетки, где он превращает внутриклеточные структуры в «фабрики» по производству вирусных частиц. Две из них, названные T478K и L452R, преимущественно расположены на рецептор-связывающем домене. Это область шипикового белка, которая соединятеся с AПФ2 на поверхности клетки.
Иные мутации выявлены в области шипикового белка, называемой N-концевым доменом; хорошо известно, что эта область является мишенью для нейтрализующих антител иммунной системы человека. Благодаря этим мутациям вирус может ускользать от этих антител, которые препятствуют его проникновению внутрь клеток.
И даже две другие мутации, P681R и D614G, способствуют выходу вновь собранных вирусных частиц из клетки и дальнейшему инфицированию макроорганизма. Мутированные аминокислотные последовательности расположены в непосредственной близости с линией разделения двух областей S-белка: S1 и S2. Эти структуры должны быть разделены для облегчения адсорбции вируса (это необходимо для слияния вириона с мембраной потенциальной клетки-хозяина организма).

Рисунок 3 | Ключевые участки шипикового белка коронавируса
Человеческие клетки действительно участвуют в этом процессе: внутри инфицированных клеток внутриклеточный белок фурин производит разрез шипикового белка между сегментами S1 и S2, что раскрывает рецептор-связывающий домен для лучшего захвата АПФ2. Мутации P681R и D614G облегчают разрезание шипикового белка фурином. С более коротким S-белком вновь собранные вирусы начинают заражение других клеток.
Вместе эти мутации способствуют быстрому проникновению вируса дельта-штамма в клетки, а также с большей вероятностью лучшему (относительно жизнедеятельности самого вируса) протеканию всех реакций самосборки вирусных частиц. В итоге к 2021 году дельта стал доминирующим штаммом в мире.
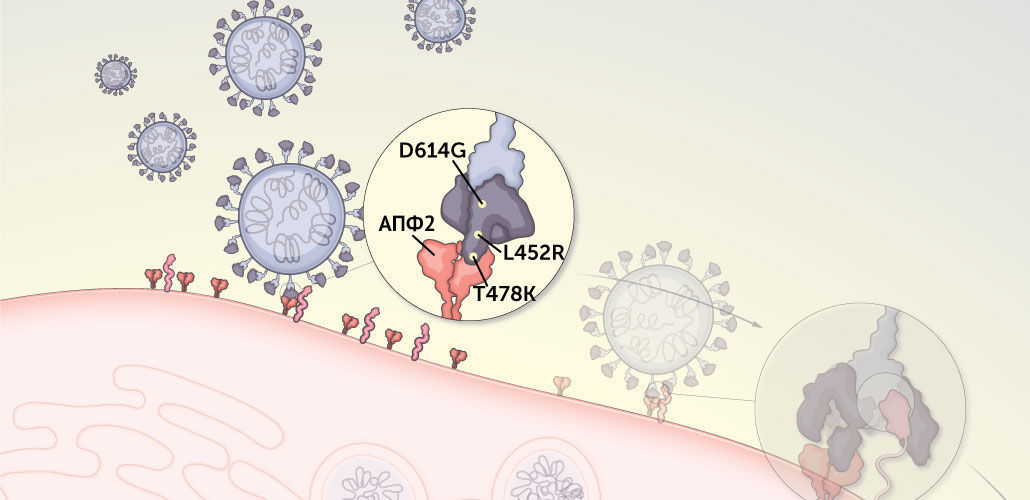
Рисунок 4 | Рецептор-связывающий домен шипикового белка фиксируется на белке АПФ2 на поверхности клетки человека
▶ Читать по теме: Как SARS-CoV-2 впервые адаптировался к организму человека?
Каким образом конкретные мутации шипикового белка дельта-штамма способствуют победе вируса над клеткой
1. Благодаря определенным мутациям шипиковый белок вируса способен лучше прикрепляться к поверхности клеток.
Жизненный цикл коронавируса начинается с прикрепления к внеклеточному белку под названием АПФ2, который во множестве представлен на поверхности многих типов человеческих клеток. Благодаря трем перечисленным ниже мутациям захват АПФ2 вирусом дельта-штамма оказывается более надежным по сравнению с другими штаммами вируса.
D614G нарушает некоторые молекулярные взаимодействия в шипиковом белке поблизости от шарнира, контролирующего пространственное расположение рецептор-связывающего домена: в закрытом положении он защищен от контакта с антителами, а в открытом способен к захвату АПФ2. При мутации D614G возникает ситуация, при которой с большей вероятностью одна или несколько частей шипикового белка оказываются доступны для взаимодействия с АПФ2.
L452R может усиливать взаимодействие между AПФ2 и шипиковым белком, повышая вероятность заражения вирусом клеток. Это изменение переключает заряд аминокислоты (структурной единицы белка) в ключевой части шипикового белка с нейтрального на положительный. Таким образом, словно магнит, притягивающийся к металлу, мутация способствует более прочной связи между шипиковым белком и той частью АПФ2, которая несет отрицательный заряд.
T478K уникальна для дельта-штамма. Пока неясно, к чему она приводит, однако, как и L452R, вероятно, способствует более надежному сцеплению шипикового белка с АПФ2.
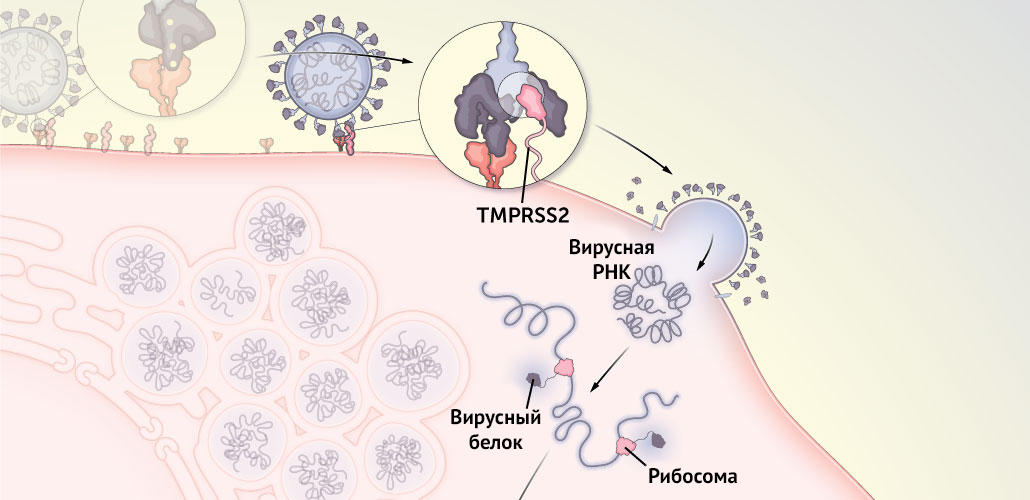
Рисунок 5 | Человеческий белок TMPRSS2 отрезает часть шипикового белка, благодаря чему происходит слияние коронавируса с клеточной мембраной и попадание вирусной РНК внутрь клетки для репродукции вируса
2. Некоторые мутации способствуют лучшему слиянию коронавируса с клеточной мембраной, что облегчает ему введение генетического материала в клетку.
Как только дельта фиксируется на АПФ2, человеческий белок TMPRSS2 отрезает часть шипикового белка. В результате одна его часть (S1) отсоединяется, высвобождая вторую часть (S2), благодаря чему становится возможным следующий шаг жизненного цикла: слияние с клеткой. Согласно некоторым данным, дельта может полностью избавляться от S1, что облегчает проникновение в клетку.
L452R способствует лучшему слиянию вируса с мембраной клетки. Это позволяет ему ввести в клетку свой генетический материал и начать захват внутриклеточного молекулярного аппарата, чтобы начать производство как можно большего количества своих копий.
P681R способствует синтезу ряда основных аминокислот, благодаря которым вирус лучше сливается с клеточной мембраной, и, соответственно, большее количество вирусов проникает внутрь большего количества клеток.
В результате этих и других изменений, как заявили исследователи в октябре в выпуске журнала Science, дельта способен быстрее попадать внутрь клеток, в том числе внутрь тех, у кого меньшее количество белков АПФ2 на поверхности.
После слияния вириона с клеткой он вводит в нее свою РНК и превращает свое новое пристанище в фабрику по созданию вирусных копий: производится копирование вирусной РНК, рибосомы клетки производят вирусные белки, а клетка производит практически идентичные копии коронавируса. По мере копирования генетической информации вируса с его РНК возникают ошибки. Иногда такие генетические ошибки «на руку» вирусу, что приводит к появлению таких штаммов, как дельта. Но не все изменения полезны для самого вируса. Вследствие некоторых опечаток при копировании генетической информации вирусные белки могут повреждаться, а это означает, что вирусы, несущие такие мутации в своем геноме, не могут заражать новые клетки. Определенная часть генетических изменений оказываются нейтральными (т. е. никак не влияют на вирус).
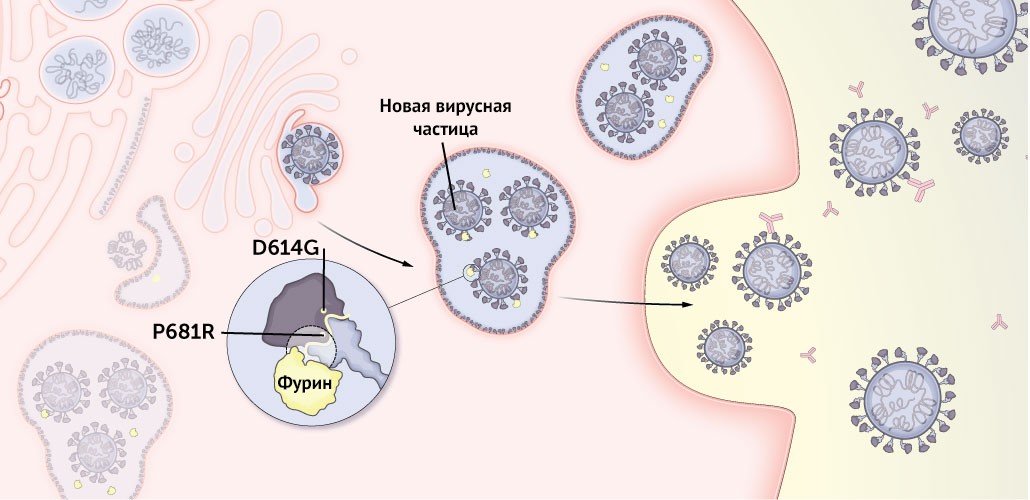
Рисунок 6 | Человеческий белок фурин отсекает S-белок от вновь собранных вирусов, облегчая им заражение других клеток
3. Некоторые мутации дельта-штамма облегчают вновь собранным вирусным частицам процесс заражения клеток.
Прежде чем новые вирусы выйдут из клетки, человеческий белок фурин надрезает шипиковый белок между его частями S1 и S2. Это позволяет ему принимать правильную конформацию для того, чтобы зацепиться за клетки, а также благодаря этому шипиковый белок надежнее сливается с клеточной мембраной.
Шипиковый белок коронавируса дельта-штамма может быть более коротким, чем у других вариантов.
Мутации D614G и P681R могут приводить к увеличению количества шипиковых белков, разрезанных фурином, на каждой вновь собранной вирусной частице, что облегчает их проникновение в другие клетки.
D614G способствует лучшему нарезанию посредством фурина. Такое предварительное нарезание происходит в ином месте, чем разрез с помощью TMPRSS2. Также эта мутация может приводить к увеличению количества шипиковых белков на каждой копии вируса.
Подобно D614G, P681R также может способствовать увеличению количества шипиковых белков, разрезанных человеческим белком фурином, облегчая заражение новых клеток недавно собранным вирусам.
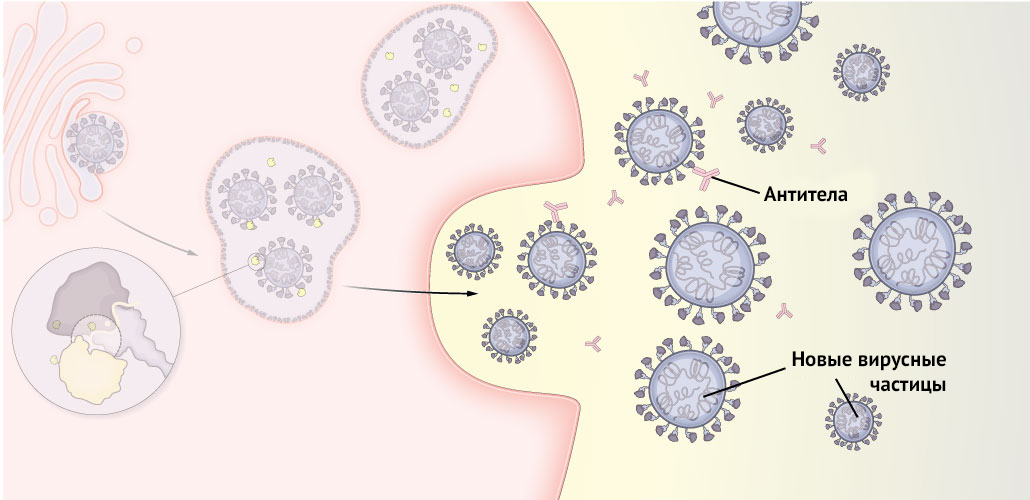
Рисунок 7 | Антитела могут скапливаться на S-белках, чтобы предотвратить проникновение вируса в клетки, однако мутации в критически важных точках могут способствовать уклонению вируса из-под атаки иммунной системы
4. Благодаря некоторым мутациям вновь собранные вирусные частицы могут ускользать от антител по мере того, как вирусы ищут другие подходящие им клетки для заражения.
Иммунная система людей, перенесших коронавирусную инфекцию, или вакцинированных, вырабатывает антитела к SARS-CoV-2. Некоторые из мутаций дельта-штамма могут помочь вирусу уклониться от этих антител, которые в противном случае блокировали бы проникновение вируса в клетки.
Мутации T19R, G142D, R158G в двух участках шипикового белка, называемых E156del и F157del, в которых отсутствуют аминокислоты, могут скрывать структуры вируса от антител, что облегчает ему преодоление этого этапа иммунной защиты макроорганизма.
T478K — мутация, уникальная для дельта-варианта, находится близко к тому же месту, что и E484K (мутация, которая была задействована в стратегии уклонения от антител бета-штамма).
