Что нового о человеческом иммунитете узнают ученые благодаря омикрону
Иммунологи продолжают работу над тем, как защитить организм человека от различных вариантов SARS-CoV-2. Данное исследование принесло им множество идей и даже несколько сюрпризов.
Для всех стало неожиданностью то, с какой скоростью штамм омикрон распространился по миру. Хотя во многих странах волна заражения этим вариантом коронавируса уже начинает спадать, по всему миру число случаев заболевания все еще растет. За неделю с 24 по 30 января было выявлено около 23 миллионов новых случаев; в ходе предыдущих волн максимальные пики заболеваемости составляли порядка 5 миллионов случаев в неделю. Сотрудники служб общественного здравоохранения все еще изо всех сил пытаются ограничить распространение вируса, чтобы уменьшить количество госпитализаций по причине COVID-19.

Работница здравоохранения на Филиппинах готовит дозу вакцины против COVID-19 к введению (фото сделано в период вспышки омикрона в январе 2022)
Омикрон также поставил перед иммунологами новую задачу, с которой необходимо справиться в кратчайшие сроки. Согласно изначальным сведениям, существующие вакцины, разработанные на основе исходного штамма SARS-CoV-2, не обеспечивают достаточной степени защиты от заражения омикроном, даже при определенном снижении риска госпитализации или развития летального исхода. Защита, формируемая после введения двух доз мРНК-вакцины, снижается менее чем до 40 % уже через несколько месяцев после введения второй дозы [1, 2]. Но, похоже, введение человеку третьей дозы (т. н. «бустерной дозы», т. е проведение ревакцинации) может решить эту проблему. Согласно данным одного исследования, спустя две недели от введения третьей дозы формируется 60–70 % степень иммунологической защиты от инфекции [1], а защита от развития тяжелой формы заболевания COVID-19 оказывается надежной [2].
По словам иммунолога из Oregon Health & Science University в Портленде Марка Слифки, это представляет значительный интерес. Почему третий контакт организма с вакциной, нацеленной на шипиковый белок исходного штамма вируса (шипиковый, или S-белок коронавирус использует для проникновения в клетки), должен оказаться эффективным и привести к формированию иммунитета к штамму, у которого более 30 мутаций в гене шипикового белка?
Способность иммунной системы человека запоминать перенесенные ранее инфекции является одной из ее отличительных черт, однако устойчивый иммунный ответ может и не сформироваться. В случае некоторых инфекций как иммунизация, так и факт перенесенного заболевания приводят к формированию пожизненной защиты. Тем не менее, в иных ситуациях формируемая иммунная реакция выражена умеренно, и возникает необходимость регулярного введения инфекционных агентов (в той или иной форме) в формате ревакцинации. Благодаря COVID-19 у ученых появился шанс изучить отдельные аспекты этого сложного и важного биологического явления. Как заявила Донна Фарбер, иммунолог из Колумбийского университета в Нью-Йорке, это удивительный эксперимент в естественных условиях и уникальная возможность посмотреть на иммунные реакции человека в режиме реального времени.
Несмотря на то, что сейчас у человечества имеется около 10 миллиардов единиц вакцин против COVID-19 от порядка десятка производителей, пять штаммов, вызывающих беспокойство, бушуют на планете, и ученые изо всех сил пытаются ответить на ключевые вопросы. На какой срок вакцинация способна сформировать защиту? Какой окажется эта защита? Как вакцина, разработанная против исходного штамма SARS-CoV-2, может противостоять другим штаммам, таким как омикрон?
По словам Джона Верри, иммунолога из Медицинской школы Перельмана Пенсильванского университета в Филадельфии, исследователи находятся только в начале волны открытий. Те выводы, которые удастся получить, окажутся решающими не только для борьбы с COVID-19, но и для понимания некоторых фундаментальных особенностей иммунной памяти.
Как иммунитет запоминает инфекции
Запуск иммунной системы происходит почти незамедлительно после того, как возбудитель попадает в организм. Но может пройти несколько дней, прежде чем специализированные клетки, нацеленные на вирусы и бактерии, присоединятся к борьбе. Эти В- и Т-лимфоциты непосредственно уничтожают инфекционный агент; после завершения борьбы они способны помнить захватчика «в лицо».
По словам Али Эллебеди, иммунолога из Медицинской школы Вашингтонского университета в Сент-Луисе (штат Миссури), первыми реагируют В-клетки. Во время первого контакта с патогеном активированные В-клетки быстро делятся и дифференцируются в плазматические клетки, которые вырабатывают белки, называемые антителами. Антитела могут как помечать патогены для последующего уничтожения, так и связываться с определенной частью патогена, что полностью предотвращает заражение им клеток. Последние называются «нейтрализующими» антителами. Шейн Кротти, иммунолог из Института иммунологии Ла-Хойя в Калифорнии, продолжает, что это единственный результат стерильного иммунитета (т. е. иммунитета, сопровождающегося полной элиминацией инфекционного агента, — прим. перев.). Вот почему исследователи обычно используют присутствие таких антител в качестве показателя иммунной защиты.
К сентябрю 2020 года в нескольких исследованиях [3, 4] сообщалось о снижении уровня нейтрализующих антител у людей, выздоровевших от COVID-19. Некоторые эксперты выразили опасение по поводу того, что иммунитет к SARS-CoV-2 может оказаться временным.
Однако для иммунологов это не стало удивительным. После инфекции титр антител должен снижаться. Короткоживущие В-клетки, которые быстро вырабатывают антитела, быстро отмирают. Как сообщает Рафи Ахмед, иммунолог и директор Центра вакцинологии Эмори в университете Эмори в Атланте (штат Джорджия), такое развитие событий не новость для иммунологов.
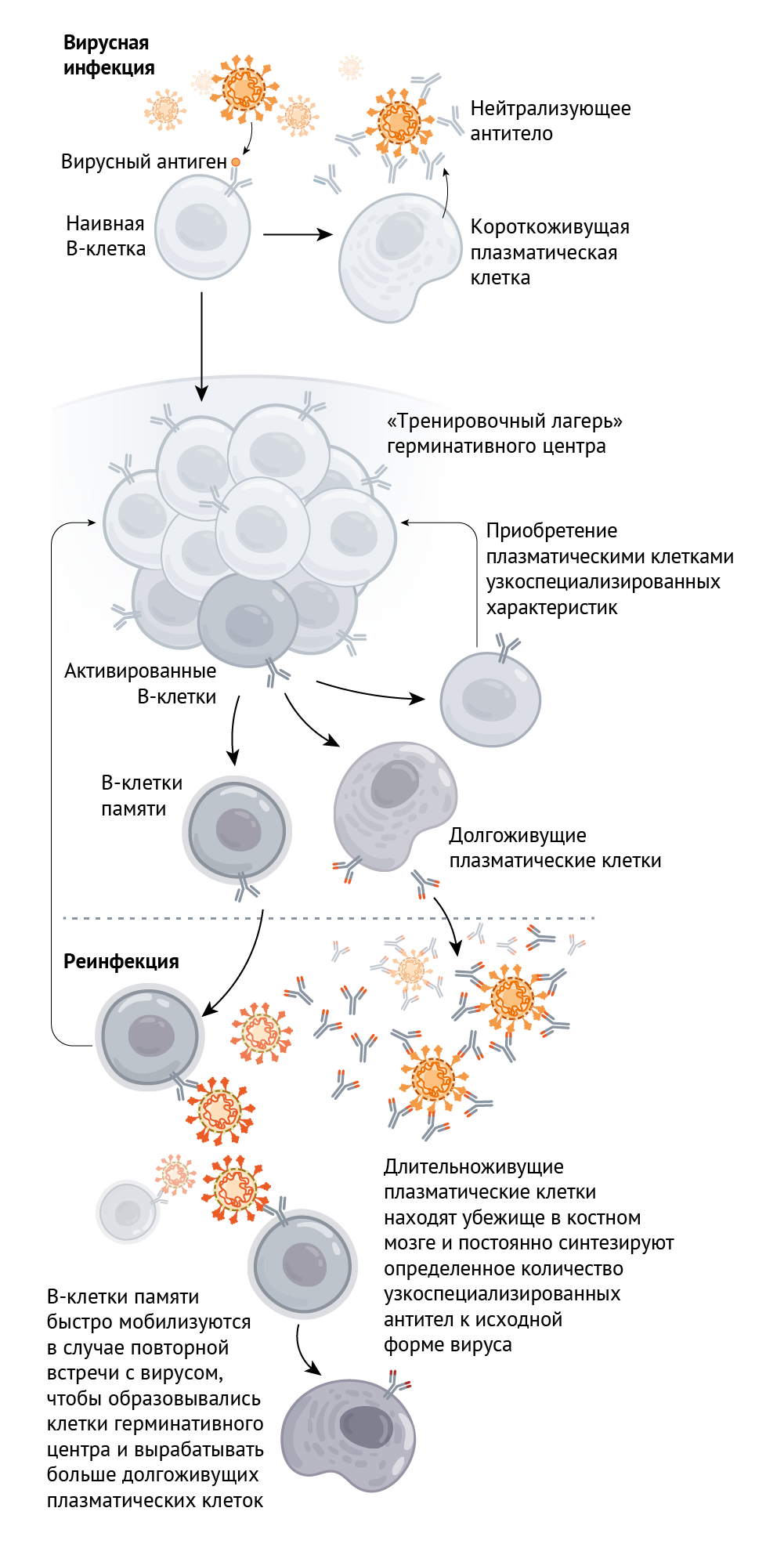
Имеет значение следующее: вырабатываются ли длительноживущие В-лимфоциты, способные нацеливаться на патоген при его повторном появлении. Обычно такие клетки развиваются внутри структур, называемых герминативными центрами лимфатических узлов, во время инфекции и являются своего рода тренировочным лагерем В-клеток. В них клетки размножаются и приобретают определенный набор мутаций. Выживают только те клетки, которые вырабатывают лучшие антитела, т. е. те, которые могут наиболее надежно прикрепляться к поверхности вируса. По словам Эллебеди, это самый настоящий отбор среди клеток.
Примерно в течение месяца некоторые клетки, вырабатывающие эти антитела, становятся циркулирующими по кровотоку В-клетками памяти (см. рис. 1). Они не вырабатывают антитела, однако при столкновении с вирусом или с его белковыми компонентами они начинают быстро делиться и превращаются в плазматические клетки. Другие В-лимфоциты становятся долгоживущими плазматическими клетками, которые находятся в основном в костном мозге и выделяют небольшое количество (однако практически постоянно) высокоаффинных антител. Эллебеди сообщает, что такие клетки остаются в организме почти на всю оставшуюся жизнь.
Падение уровня антител после инфекции является нормальным явлением. Иммунологам необходимо выяснить, на каком уровне остановится это снижение и произойдет ли это вообще. В апреле 2020 года Ахмед и его команда начали работу с людьми, выздоровевшими от COVID-19. Ученые обнаружили, что титр антител у этих людей быстро снижался в течение первых 2–3 месяцев после перенесенной инфекции. Но затем, примерно через четыре месяца, кривая начала выравниваться. Ученые опубликовали результаты о первых восьми месяцах иммунологического статуса реконвалесцентов [5], однако теперь авторы располагают сведениями о 450 днях, и эти результаты воодушевляют команду Ахмеда. Пока он сообщает, что динамика титров антител выглядит по-настоящему хорошо: она действительно довольно стабильна.
Иммунный ответ после вакцинации в большей или меньшей степени имитирует то, что происходит после заражения, с одним существенным отличием. При инфицировании SARS-CoV-2 иммунные клетки сталкиваются со всем вирусом целиком. Однако в самых эффективных вакцинах используется только один вирусный белок, чтобы вызвать ответную иммунную реакцию: S-белок. Будет ли наблюдаться стабилизация уровня антител после вакцинации, пока не ясно. Верри с соавт. анализировали иммунный ответ у 61 человека в течение шести месяцев после введения первой дозы и обнаружили, что уровень антител достиг пика примерно через неделю после введения второй дозы вакцины. Впоследствии наблюдалось его быстрое снижение в течение нескольких месяцев. После этого титр антител снижался медленнее [6].
Со снижением уровня антител согласуется и снижение иммунной защиты. Вакцины, которые стали широко доступны в некоторых странах еще в декабре 2020 года, поначалу демонстрировали впечатляющую эффективность, но к июлю 2021 года начали появляться сообщения о новых вспышках. Согласно сведениям из Израиля, где проводилась активная кампания по вакцинации с использованием мРНК-вакцины компании Pfizer-BioNTech, иммунная защита от развития инфекции, формируемая этой вакциной, снизилась с 95 % до 39 % в течение пяти месяцев (см. go.nature.com/3hjdxtn; информация предоставлена на иврите и на английском).
Эти данные свидетельствуют о том, что эффективность вакцины не безупречна. Исследователи отмечают, что со временем она теряет свою способность сдерживать развитие инфекции. Однако вакцины по-прежнему способны предотвращать развитие тяжелых форм заболевания. Хоть защита от развития инфекции и ослабевает, но снижение риска госпитализации сохраняется. Вероятно, как сообщает Кротти, защитный иммунитет в популяции в целом сохранится на долгое время.
Клетки — наше спасение
Иммунная память зависит не только от антител. Даже когда титр антител падает, В-клетки памяти могут распознать вернувшегося захватчика, быстро поделиться и начать вырабатывать антитела для борьбы с ним. По крайней мере, в краткосрочной перспективе, функция В-клеток памяти с течением времени улучшается. Спустя шесть месяцев после вакцинации у участников исследования команды Верри оказалось повышенном количество В-клеток памяти, которые реагировали не только на исходный штамм SARS-CoV-2, но и на три других варианта вируса (которые получили статус «вызывающие обеспокоенность») [6].
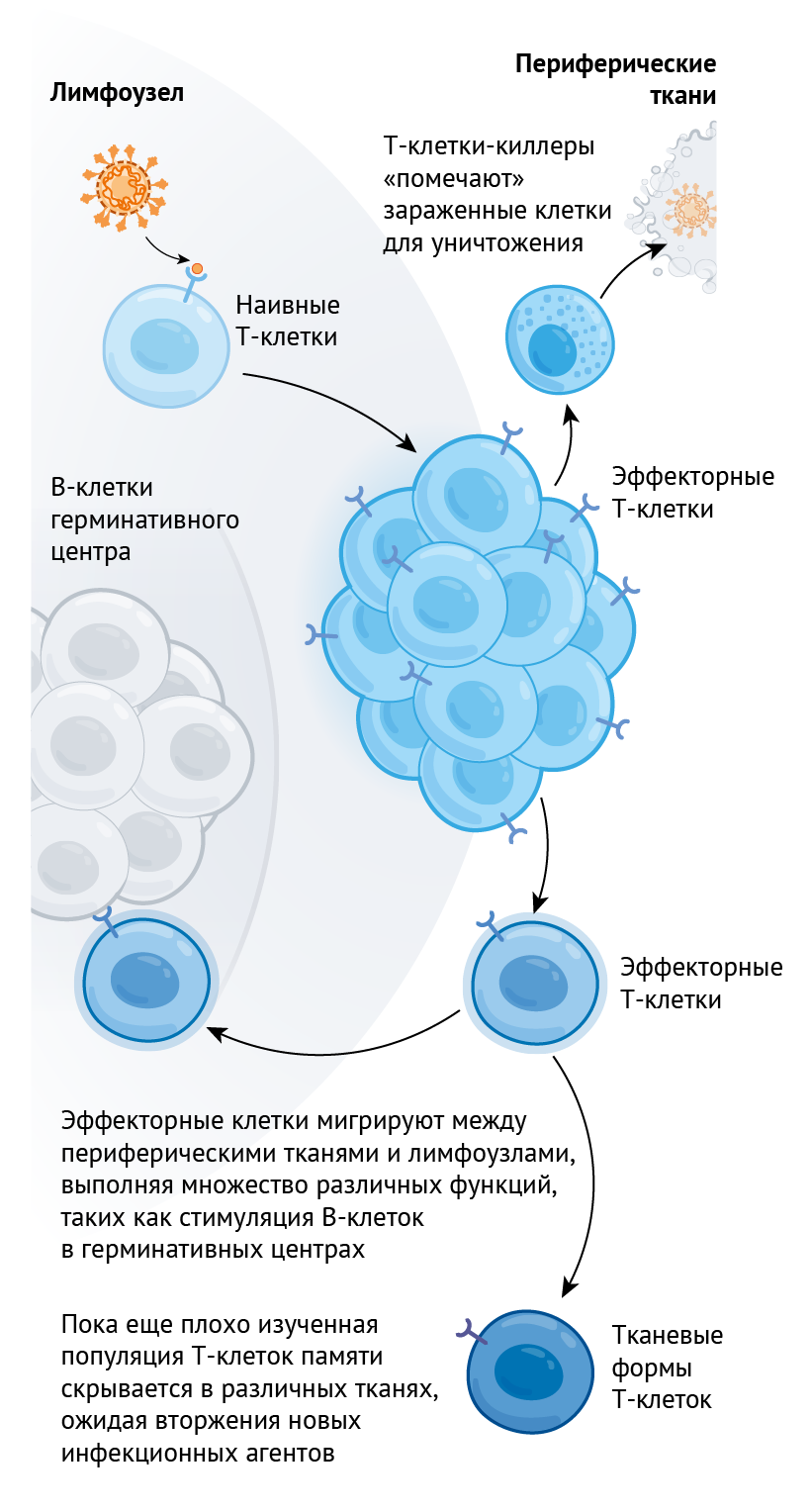
Помимо этого, существуют еще и Т-клетки — третий столп, на котором держится иммунная память. Контактируя с антигеном, они делятся и формируют пул эффекторных клеток, которые способствуют элиминации инфекции. Т-лимфоциты-киллеры быстро делятся, чтобы уничтожать инфицированные клетки, а различные типы Т-хелперов выделяют сигнальные молекулы, которые стимулируют другие звенья иммунной системы, например, В-клетки. После того, как угроза миновала, некоторые из этих клеток сохраняются в виде Т-клеток памяти (см. рис. 2).
У некоторых людей могут быть Т-клетки памяти после перенесенных ранее острых респираторных вирусных инфекций, среди возбудителей которых часто встречаются и разные виды коронавирусов. Такие клетки могут распознавать и SARS-CoV-2, помогая в борьбе с инфекцией или даже способствуя полной элиминации возбудителя. Согласно данным одного исследования [7], у медицинских работников, которые подверглись воздействию SARS-CoV-2, но у которых в результате ПЦР-тестов никогда не выявлялся данный вирус, обнаруживались признаки иммунологической реакции на эту инфекцию. Исследователи предполагают, что перекрестно-реактивные Т-клетки способствуют торможению развития инфекции. Как сообщает Мала Майни, иммунолог из Университетского колледжа Лондона, которая руководила исследованием, согласно серологическим данным, у этих лиц действительно протекала инфекция в самом широком смысле этого слова, но, вероятно, вирусная нагрузка не оказалась достаточной для развития клинически значимой формы инфекции, поэтому иммунной системе удалось затормозить ее развитие.
Эта идея все еще является спорной, а подобное явление достаточно редкое. Клетки памяти, как правило, не способны блокировать развитие инфекции так, как это могут нейтрализующие антитела, но это и не обязательно. При COVID-19 заражение происходит быстро, однако же требуется некоторое время, чтобы развилось клинически выраженное заболевание. Благодаря этому Т-клетки памяти успевают активизироваться и начать выполнение своих функций. По словам Кротти, при повторном воздействии вируса или при ревакцинации эти клетки начинают работать с перегрузкой, «пролиферируют, как сумасшедшие». За 24 часа количество Т-клеток памяти может возрасти десятикратно. Вероятно, это не слишком быстро, чтобы в значительной степени повлиять на развитие заболевания, однако этого вполне хватает, чтобы предотвратить развитие тяжелых форм болезни, и, как следствие, снизить риск госпитализации.
Так вирусу гораздо труднее найти способ обойти Т-клеточную реакцию. Это связано с тем, что Т-клетки у одного человека распознают разные части вируса; и у каждого человека процесс такого распознавания индивидуален. Таким образом, вирус может мутировать, чтобы ускользнуть от Т-клеточного ответа у одного человека, однако эта же мутация не позволит ему скрыться от Т-клеток у другого человека. Кротти продолжает, что на популяционном уровне такое ускользание оказывается неэффективным для вируса. Ведь помимо этого Т-клетки способны распознавать те части вируса (или его шипиковый белок), которые не могут распознать антитела; также такой способностью обладают Т-клетки и в отношении частей вируса, наименее подверженных мутациям.
Согласно результатам нескольких исследований, у людей, которые были вакцинированы или перенесли инфекцию SARS-CoV-2, выявлялся примерно такой же Т-клеточный ответ на омикрон, как и на дельта-штамм, несмотря на большое количество мутаций у первого [8, 9]. Согласно наблюдениям за распространением омикрона, можно предполагать, что это так. Возможно, Т-клеточный ответ также ответственен за явление, называемое «расщеплением». В тех регионах, где у людей наблюдается более высокий уровень иммунитета вследствие перенесенных инфекций или же вакцинации, число случаев заболевания омикроном росло быстро, однако число госпитализаций и летальных исходов росло гораздо медленнее.
Иммунитет эволюционирует
Идеальная вакцина должна вызывать иммунный ответ, который будет не только стойким, но и полиспецифичным (т. е. способным защищать от вновь мутирующих и эволюционирующих форм вируса). По мере того, как на планете бушует омикрон, кажется, что вакцины немного сдают свои позиции. Но у иммунной системы все еще есть ряд приемов для борьбы с постоянно видоизменяющимися вирусами.
Один из них формируется внутри герминативных центров. Там В-клетки обучаются не только для выработки таких антител, которые будут обладать совершенной способностью связываться со своей исходной мишенью; в ходе развития в герминативных центрах В-клетки приобретают способность вырабатывать антитела с увеличенным количеством распознаваемых ими сайтов связывания. Это увеличивает вероятность идентификации нового варианта антигена.
Эллебеди добавляет, что косвенно весь успех вакцинации зависит от того, насколько «крепким» оказывается зародышевый центр. Согласно теоретическим основам иммунологии, без зародышевого центра нет и иммунологической памяти.
Но это может быть и не совсем так. По словам Стефани Эйзенбарт, директора Центра иммунобиологии человека в Медицинской школе Файнберга Северо-Западного университета в Чикаго (штат Иллинойс), иммунная система обладает целым набором других путей: они более узконаправленные и менее изученные. Исследование Эйзенбарт с соавт. свидетельствует, что даже у генетических линий мышей, лишенных формировать герминативные центры, вырабатываются долгоживущие плазматические клетки [10]. Не совсем ясно, из какого источника происходят эти клетки, но, как и плазматические клетки, проходящие свое развитие в герминативном центре, они оказываются способными к выработке антител, которые прочно связываются со своими мишенями.
Тем не менее, согласно новым данным, омикрон способен избегать антител, выработанных после перенесенной инфекции или вакцинации. Компания Pfizer предоставила сведения о том, что у лиц, привитых двухкомпонентной вакциной, нейтрализующая способность антител относительно штамма омикрон снизилась в 25 раз по сравнению с исходным вариантом вируса SARS-CoV-2. Не совсем понятно, почему третья доза может восстановить защиту.
Вполне возможно, что третья доза просто в равной степени повышает титры всех антител, включая ту небольшую часть, которая может распознавать фрагменты S-белка омикрона, структура которых не претерпела изменений. По словам Верри, согласно некоторым данным, опубликованных компаниями, известно, что продукция антител усиливается очень эффективно. Но вполне вероятно, что введение третьей дозы в действительности расширяет спектр иммунного ответа.

В январе властями Израиля было разрешено вводить четвертую дозу вакцины против COVID-19 с целью улучшить иммунологическую память людей
В одном исследовании [11] ученые изучали образцы крови людей, которым вводили вакцины компаний Moderna, Pfizer-BioNTech или Johnson & Johnson, чтобы оценить, способны ли их антитела нейтрализовать шипиковый белок, содержащийся в разных штаммах SARS-CoV-2. Антитела, содержащиеся в крови лиц, привитых одной или двумя дозами вакцины, были способны нейтрализовать омикрон лишь в незначительной степени, но антитела крови людей, ревакцинированных мРНК-вакциной, оказались эффективны для борьбы с этим штаммом вируса. Нейтрализующая способность этих антител относительно омикрона оказалась лишь в 4–6 раз ниже по сравнению с таковой относительно исходного штамма.
У лиц, привитых двумя дозами вакцины, обнаруживаются В-клетки памяти, способные связываться с омикроном [12]. Возможно, введение третьей дозы стимулирует эти клетки памяти к выработке антител. Кротти поясняет, что одна из основных задач В-клеток памяти заключается в хранении «планов» о возможной структуре различных вариантов антигена.
Верри предлагает другое объяснение. Ревакцинация может стимулировать формирование герминативных центров, вызывая целый каскад мутаций среди В-клеток. Чтобы проверить это, как заявляет ученый, планируется пристальное наблюдение за молекулярными основами этих процессов.
Слифка утверждает, что первая доза вакцины стимулирует выработку антител, которые надежно связываются с легко различимыми структурами S-белка. Когда вводят следующие дозы, уже существующие антитела быстро связываются с этими легко доступными структурами, оставляя менее доступные структуры в качестве мишеней для В-клеток памяти. Это позволяет последним выработать антитела для связывания уже с ними.
Однако следует сделать оговорку. Не ясно то, как долго бустерная доза сможет поддерживать иммунную защиту. Согласно сведениям из Великобритании, таковая может довольно быстро снизиться [13]. Изначально было известно, что три дозы вакцины Pfizer-BioNTech формировали 70 % защиту, но к 10 неделе защита от инфекции снижалась до 45 %. Согласно сведениям из Израиля, четвертая доза бустера в незначительной степени усиливает иммунную защиту. Это свидетельствует о том, что лучшим последующим шагом может стать разработка специфичных для омикрона вакцин-бустеров.
Компании Pfizer и Moderna уже работают над версиями таких мРНК-вакцин. В январе исполнительный директор Pfizer Альберт Бурла заявил, что специфичная для омикрона вакцина должна быть готова к массовому производству уже к марту. Однако к тому времени многие люди или заболеют этим штаммом, или уже переболеют им, и таким образом приобретут некоторый иммунитет. Также компания Pfizer работает над вакциной, которая будет включать в себя последовательности шипикового белка как от исходного штамма, так и от омикрона. Конечно, финальная цель состоит в том, чтобы разработать такую вакцину, которая бы обеспечила формирование длительного иммунитета без необходимости проведения многочисленных ревакцинаций.
Волшебный ингредиент
SARS-CoV-2 предоставляет другие возможности для изучения путей совершенствования вакцинации. В 2019 году Слифка и его коллега Йэн Аманна опубликовали обзор [14], в котором авторы рассмотрели различные типы вакцин и попытались выявить закономерности, которые могут помочь предсказать, почему одни вакцины приводят к формированию стойкого иммунитета, а другие — нет.
Из всех типов вакцин, которые рассмотрели авторы, самую длительную защиту, как правило, обеспечивали вакцины на основе живого вируса. В их составе находятся патогены, измененные таким образом, что не вызывают развитие заболевания. Поскольку они так хорошо имитируют реальную инфекцию, формируемый ими иммунный ответ довольно стойкий. Но вакцины на основе целого инактивированного вируса или фрагментов вирусных белков также формировали хорошую иммунную память. Что, по-видимому, имеет значение, как сообщает Слифка, так это время, в течение которого антиген может сохраняться. Суть в том, чтобы стимуляция иммунной системы поддерживалась в течение определенного периода времени, но организм не был инфицирован хронически.
Слифка и Аманна не включили мРНК-вакцины в свой обзор: данная технология не была в тот момент широко распространена; однако тенденция верна и в отношении этих вакцин. В случае мРНК-вакцин сам антиген вырабатывается непосредственно клетками организма на основе мРНК-матрицы. Антиген персистирует всего несколько недель. Имеющиеся на сегодняшний день данные свидетельствуют о том, что иммунитет также может оказаться временным. Тем не менее, РНК-вакцины, способные реплицироваться в организме, могут сформировать более длительный иммунитет.
Продолжающаяся пандемия COVID-19 создала условия для выпуска целого ряда вакцин, наблюдения за их действием и их сравнения. Эти вакцины в своем составе содержат или цельный инактивированный вирус, или вирусный белок, или мРНК. Помимо этого, существуют вакцины на основе аденовируса, такие как препараты компаний Oxford-AstraZeneca или Johnson & Johnson. Здесь и начинаются сюрпризы. Например, иммунная реакция после введения вакцины Johnson & Johnson является более слабой по сравнению с мРНК-вакциной, однако с течением времени ситуация начинает улучшаться. Дипта Бхаттачарья, иммунолог из Аризонского университета в Тусоне, продолжает, что в этой ситуации вступает в действие какой-то неизвестный ранее механизм.
Ученые также стремятся понять, что происходит, когда люди эмпирически смешивают и сравнивают вакцины. Британское исследование Com-CoV сосредоточено на изучении этого явления с самого начала пандемии. Согласно самым последним данным [15], у людей, вакцинированных первой дозой либо Oxford-AstraZeneca, либо Pfizer-BioNTech, а второй дозой — Moderna, наблюдался более высокий титр антител по сравнению с теми, кто был вакцинирован второй дозой такого же препарата, что и первой. Верри сравнивает такой подход с кросс-тренингом. Смешивание и эмпирическое сравнение различных видов вакцин может способствовать формированию более гибкого иммунного ответа и иммунной памяти.
Включение дополнительных мишеней также может сформировать более качественную степень защиты. По словам Бали Пулендрана, иммунолога из Стэнфордского университета в Калифорнии, наиболее эффективные современные вакцины нацелены на шипиковый белок, но Т-клетки могут распознавать весь вирус целиком. Он сравнивает иммунологическую память с огромной люстрой, подвешенной на трех тонких проводах: первый — это антительная реакция, второй — В-клетки памяти, а третий — Т-клетки памяти. Трудно переоценить их все, а при разработке вакцин важно и учитывать их все. Пулендран задает риторический вопрос: устоит ли человек под такой люстрой, если один или два провода будут разорваны?
Создание вакцины с широкой и стойкой нейтрализующей активностью против SARS-CoV-2 остается сложной задачей. Во многом это связано с природой самого вируса. Ахмед сообщает, что если посмотреть с исторической точки зрения, все респираторные вирусные инфекции крайне трудно предотвратить. Это относится и к гриппу, и к респираторно-синцитиальному вирусу, и даже к обычным респираторным вирусам, вызывающим то, что в обществе называют простудой. При системной инфекции, такой как корь, вирусу требуется время, чтобы распространиться по организму и вызвать заболевание. При респираторных инфекциях этот процесс начинается прямо в зоне проникновения возбудителя. В случае таких патогенов защита от развития тяжелой формы инфекции может быть лучшим вариантом, на что можно надеяться.
Однако многие все еще сохраняют оптимизм. По словам Скотта Хенсли, иммунолога из Медицинской школы Перельмана, сейчас все люди интересуются темой вируса SARS-CoV-2. Этот всплеск интереса выразился в удивительном прогрессе в иммунологии в контексте анализа иммунного ответа. Наконец, эти идеи могут способствовать открытию вакцины, обеспечивающей иммунную защиту — длительную и широкого спектра действия.
«Какой же должна быть эта волшебная микстура?» — вновь задает риторический вопрос Пулендран. В ответе на него скрыта глубокая загадка; это та фундаментальная проблема, решение которой преобразит вакцинологию.
