Исследование безопасности и иммуногенности вакцины «Спутник Лайт»
Открытое нерандомизированное клиническое исследование I/II фазы для оценки безопасности, переносимости и иммуногенности однокомпонентной вакцины «Спутник Лайт» для профилактики коронавирусной инфекции у здоровых взрослых
Резюме
Предпосылки к исследованию
Мир охвачен очередной волной пандемии COVID-19. Нехватка лицензированных вакцин затрудняет процесс глобальной вакцинации. В попытке удовлетворить спрос на вакцинные препараты, российские исследователи разработали новую однокомпонентную вакцину «Спутник Лайт» на основе рекомбинантного вектора аденовируса типа 26 (rAd26). Вектор несет ген для S-белка — спайк-гликопротеина коронавируса SARS-CoV-2, вызывающего тяжелый острый респираторный синдром второго типа.
Методы
Ученые провели открытое проспективное нерандомизированное исследование 1/2 фазы с целью оценки безопасности, переносимости и иммуногенности вакцины «Спутник Лайт» в одном из исследовательских центров в России. Авторы выбрали две первичные конечные точки. Первая — это уровень антигенспецифического гуморального иммунитета. Его оценивали по титру антител к рецептор-связывающему домену (RBD-домену) S-белка SARS-CoV-2 на 1, 10, 28 и 42 день. Титр антител измерялся с помощью иммуноферментного анализа ELISA. Вторая первичная конечная точка — безопасность вакцины, которую оценивали по количеству участников с нежелательными явлениями, отслеживаемыми на протяжении всего исследования. Вторичные конечные точки — антиген-специфический клеточный иммунитет (оценивался по антигензависимой пролиферации CD4+ и CD8+ Т-лимфоцитов, количеству антиген-специфичных клеток, продуцирующих IFN-γ, а также по концентрации IFN-γ при рестимуляции антигеном) и изменению титра нейтрализующих антител (измерено в реакции нейтрализации SARS-CoV-2).
Выводы
Большинство побочных реакций были легкими (66,4 % от всех вакцинированных), некоторые — умеренными (5,5 %). Серьезных нежелательных явлений не выявлено. Измерение антител к RBD-домену SARS-CoV-2 выявило людей с уже существующим иммунитетом к SARS-CoV-2. Это позволило разделить все данные о безопасности и иммуногенности на группы в зависимости от наличия или отсутствия иммунитета к SARS-CoV-2. Между группами наблюдались заметные различия в иммуногенности вакцины. Вакцинация серопозитивных (N = 14) добровольцев довольно быстро увеличила титр RBD-специфических IgG. Были рассчитаны обратные величины средних геометрических титров антител (СГТ). Среднее геометрическое титра антител — показатель напряженности коллективного иммунитета, средний уровень антител в группе людей — прим. ред. Исходный СГТ увеличился с 594,4 до 26 899 по сравнению с 29,09 в серонегативной группе (N = 96) к 10 дню. К 42 дню частота сероконверсии достигла 100 % (93/93) в серонегативной группе с СГТ = 1648. В то же время в серопозитивной группе частота сероконверсии к 42 дню составила 92,9 % (13/14) с СГТ = 19986. Анализ нейтрализующих антител к SARS-CoV-2 показал уровень сероконверсии 81,7 % (76/93) и 92,9 % (13/14) к 42 дню со средним реципрокным СГТ 15,18 и 579,7 у серонегативных и серопозитивных группы соответственно. Антиген-специфическая пролиферация Т-лимфоцитов, образование IFNy-продуцирующих клеток и секреция IFNy наблюдались у 96,7 % (26/27), 96 % (24/25) и 96 % (24/25) серонегативной группы соответственно и у 100 % (3/3), 100 % (5/5) и 100 % (5/5) серопозитивных вакцинированных соответственно.
Интерпретация полученных данных
Однокомпонентная вакцина против COVID-19 на основе вектора rAd26 «Спутник Лайт» имеет благоприятный профиль безопасности и вызывает интенсивный гуморальный и клеточный иммунный ответ как у серонегативных, так и у серопозитивных участников исследования.
Финансирование
Российский фонд прямых инвестиций (РФПИ)
Контекст исследования
Данные, полученные до исследования
Несмотря на огромный прогресс в разработке и производстве вакцин, существующий спрос на вакцины против COVID-19 требует новых эффективных вакцинных препаратов, которые легко производить, распространять и применять. Это необходимо для ускорения глобального контроля над продолжающейся пандемией. Для разработки высокоиммуногенной вакцины с хорошим профилем безопасности, которая, помимо этого, была бы еще и рентабельной и имела эффективное производство, логистику и простой способ введения, исследователи сосредоточились на разработке однокомпонентной вакцины c нереплицирующимся аденовирусным вектором.
Авторы проводили поиск на сайтах ClinicalTrials.gov и PubMed вплоть до 23 июня 2021 г., используя различные комбинации терминов «COVID-19» или «SARS-CoV-2» и «вакцина», и «клиническое испытание», и «разовая доза» и «нереплицирующийся вирус», без ограничений по дате или языку. Исследователи обнаружили опубликованные данные клинических испытаний однокомпонентных вакцин-кандидатов против COVID-19. В качестве основы использовались два нереплицирующихся рекомбинантных аденовируса человека типа 5 (Ad5) и типа 26 (Ad26) в дозе 1×1011 вирусных частиц. Вакцины разработаны CanSino Biologics и Janssen Pharmaceuticals соответственно. Кроме того, исследовано применение вакцины ChAdOx1 nCoV-19, произведенной Oxford — AstraZeneca на основе нереплицирующегося аденовируса шимпанзе (ChAd) в режиме однократной дозы (5×1010 вирусных частиц). Доказано, что все они безопасны и иммуногенны, и эти вакцины уже одобрены в ряде стран.
По составу вакцина «Спутник Лайт» аналогична первому компоненту двухкомпонентной вакцины «Спутник V» (Гам-КОВИД-Вак), безопасность и иммуногенность которой была оценена в ряде завершенных и продолжающихся клинических исследований. В I фазе исследования вакцины «Спутник V» участвовали девять испытуемых. Добровольцам была введена одна доза вакцины на основе вектора rAd26-S в количестве 1×1011 вирусных частиц. Частота сероконверсии на 28 день составила 66,7 %. Серьезных побочных эффектов зарегистрировано не было.
Отдельная I/II фаза клинических испытаний однокомпонентной вакцины на основе rAd26 «Спутник Лайт» была организована для получения убедительных данных о ее безопасности и иммуногенных свойствах.
Дополнительная ценность этого исследования
Авторы считают, что, благодаря более простому производству, чем у гетерологичной вакцины «Спутник V» с прайм-бустом, и режиму однократного введения, вакцина «Спутник Лайт» может способствовать ускорению темпов вакцинации как в России, так и в других странах, учитывая отсутствие достаточного количества вакцин.
В данном исследовании авторы сообщают предварительные результаты (до 42 дня после вакцинации) о безопасности, реактогенности и иммуногенности вакцины «Спутник Лайт» у 110 здоровых добровольцев в возрасте 18–59 лет. Результаты показывают, что вакцина переносилась хорошо и вызывала как гуморальный, так и клеточный иммунный ответ как у серонегативных, так и у серопозитивных здоровых взрослых. Однократной иммунизации серонегативных добровольцев было достаточно для быстрой индукции иммунного ответа против SARS-CoV-2 (100 % частота сероконверсии достигается к 42 дню). Интересно, что «Спутник Лайт» быстро индуцировал (к 10 дню) более выраженный иммунный ответ в серопозитивной группе добровольцев по сравнению с серонегативной, а также выздоравливающей.
Не было зарегистрировано никакой корреляции антиген-специфических IgG или нейтрализующих антител с возрастом или с ранее существовавшими нейтрализующими антителами к Ad26.
Значение имеющихся доказательств
Однокомпонентные вакцины против SARS-CoV-2 с простым и легким введением компенсируют нехватку вакцинных препаратов, позволяя достичь коллективного иммунитета в более короткие сроки, тем самым способствуя предотвращению новых волн пандемии COVID-19 во всем мире.
Результаты исследования показывают, что вакцина «Спутник Лайт» безопасна и иммуногенна как для серонегативных, так и для серопозитивных здоровых взрослых людей. Таким образом, «Спутник Лайт» можно рассматривать не только для первичной вакцинации, но и в качестве эффективного инструмента для дальнейшей ревакцинации или вакцинации после перенесенной инфекции COVID-19. Эти данные побудили авторов начать международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование III фазы с целью дальнейшей оценки эффективности вакцины (NCT04741061).
Введение
С тех пор, как 11 марта 2020 года была объявлена пандемия COVID-19, во всем мире было зарегистрировано более 179 миллионов случаев заболевания и 3,8 миллиона смертей, связанных с заболеванием, и эти цифры продолжают расти [1]. Внезапное появление вируса SARS-CoV-2 и его быстрое распространение с высокими показателями заболеваемости и смертности потребовали принятия чрезвычайных мер для разработки вакцины. К концу 2020 года так было зарегистрировано несколько препаратов, лицензированных для использования в чрезвычайных ситуациях [2]. В настоящее время существуют обнадеживающие примеры, которые доказывают, что быстрая и массовая вакцинация является наиболее эффективным способом предотвратить распространение SARS-CoV-2 и остановить экономический ущерб и рост смертности. К 26 мая 2021 года в Израиле значительно снизилась заболеваемость COVID-19 (22 случая на почти девять миллионов человек в сутки) — это результат вакцинации примерно 60 % всего населения хотя бы одной дозой вакцины [3]. Однако несмотря на подобные локальные успехи, глобальная программа вакцинации все еще находится на начальной стадии и уже сталкивается с определенными проблемами. К ноябрю 2021 года только около 23,7 % населения мира получили хотя бы одну дозу вакцины от COVID-19, что свидетельствует о большом несоответствии между различными регионами [4]. В то время как у стран с высоким уровнем доходов были вполне реальные шансы завершить вакцинацию к концу 2021 года (ОАЭ и Португалия, кстати, практически справились с задачей, завершив программу вакцинации на своих территориях), страны с низким уровнем доходов, на долю которых приходится лишь 1 % всех вакцинаций, по-прежнему остаются беззащитными перед новой волной COVID-19 [5].
Существуют очевидные ограничения для увеличения масштабов производства вакцин. К ним относятся сложный производственный процесс, особые условия логистики и хранения, требующие сверхнизких температур. Вдобавок к этим ограничениям, двухкомпонентный режим многих лицензированных вакцин дополнительно затрудняет обеспечение полного процесса вакцинации, а также увеличивает стоимость по сравнению с однокомпонентными вакцинами.
Чтобы увеличить масштабы вакцинации во всем мире для борьбы с инфекцией SARS-CoV-2, была разработана новая вакцина против COVID-19. В данной публикации авторы представляют промежуточные результаты клинического испытания I/II фазы относительно безопасности, переносимости и иммуногенности новой вакцины «Спутник Лайт», которая базируется на аденовирусном векторе, содержащем полноразмерную спайковую вставку SARS-CoV-2. Авторы считают, что однокомпонентная вакцина против COVID-19 расширит профиль лицензированных вакцин против COVID-19, тем самым внося свой вклад в поставку вакцин, необходимых для достижения коллективного иммунитета как на национальном, так и на мировом уровне.
Методы
Дизайн исследования и его участники
Авторы провели открытое проспективное нерандомизированное исследование I/II фазы для оценки безопасности, реактогенности и иммуногенности вакцины против COVID-19 с аденовирусным вектором Ad26 («Спутник Лайт») в едином клиническом центре Eco-Safety. Центр расположен в Санкт-Петербурге, Россия. Письменное информированное согласие было получено от каждого участника перед скринингом. Процедура скрининга представляла собой медицинский осмотр, при котором собирались анамнез, демографические и антропометрические данные; оценивались соответствующие жизненно важные показатели (например, артериальное давление, частота сердечных сокращений и температура в подмышечных впадинах). Добровольцы были оценены по категории риска заражения COVID-19 (высокий, средний и общий) и прошли лабораторные исследования: общий анализ крови и биохимия, тестирование на инфекции (ВИЧ, гепатит и сифилис), диагностику на COVID-19 (ПЦР, качественный ИФА на IgM/IgG) и анализ мочи на содержание наркотических веществ, алкоголя и для определения беременности у женщин. Добровольцы считались подходящими, если они оказывались здоровыми в результате скрининга, не имели в анамнезе COVID-19 или ранее контактировали с пациентами с COVID-19 в течение 14 дней после участия в исследовании, не получали никаких других прививок в течение 30 дней, не получали терапию стероидами, иммуноглобулинами или любыми другими препаратами и компонентами крови в течение 30 дней, не употребляли никаких иммунодепрессантов более трех месяцев и не имели аллергии на иммунобиологические препараты, включая любой компонент вакцины. Полный список критериев включения в исследование и исключения из него доступен в протоколе. В исследование были включены первые 110 подходящих добровольцев.
Исследование было одобрено местным этическим комитетом и проводилось с одобрения Министерства здравоохранения Российской Федерации в соответствии с рекомендациями Международной конференции по гармонизации и национальной надлежащей клинической практике и Хельсинкской декларацией. Исследование зарегистрировано на ClinicalTrials.gov, NCT04713488.
Процедура проведения исследования
Вакцина «Спутник Лайт» была разработана и произведена Национальным исследовательским центром эпидемиологии и микробиологии им. Н. Ф. Гамалеи (Москва, Россия) в соответствии с принципами надлежащей производственной практики (стандарты GMP). Вакцина-кандидат включает рекомбинантный аденовирус типа 26 (rAd26), несущий полноразмерный ген гликопротеина S SARS-CoV-2 (rAd26-S). Вакцина была изготовлена в виде жидкого препарата, содержащего 10 вирусных частиц (viral particles, vp) на 0,5 мл/доза. В комбинированном клиническом протоколе I и II фазы все 110 участников получили полную дозу внутримышечно по схеме однократного введения, после чего были оценены на предмет безопасности, реактогенности (до 28 дня) и иммуногенности (до 42 дня) в течение всего периода исследования (180 дней). В данной работе не проводилась рандомизация или специальная стратификация. Процедура скрининга начиналась с момента получения информированного согласия и длилась не более семи дней, прежде чем доброволец был признан подходящим и включенным в исследование. Участники прошли медицинский осмотр во время скрининга, в день вакцинации (день 1) и на 10, 28 и 42 дни. Лабораторные анализы крови (общий анализ крови, СОЭ, АЛТ, АСТ, общий белок, билирубин, общий холестерин, ЛДГ, щелочная фосфатаза, протромбиновый индекс, глюкоза, мочевина и креатинин) и мочи (pH, прозрачность, содержание белка, глюкозы, кетонов, клеточные элементы, кристаллы) были выполнены в рамках скрининга и на 28-й день.
Общие параметры иммунитета (абсолютное и относительное количество клеток CD3+, CD4+, CD8+, CD16+, CD19+, CD4+/CD8+, общий IgM, IgG, IgA, IgE) анализировали при скрининге и на 28-ой день. ПЦР-тест на COVID-19 проводили в день скрининга и в день 1, 10 и 28-ой после вакцинации. В день вакцинации добровольцам выдали дневники самонаблюдения, которые проверялись при каждом посещении (дни 10, 28, 42). Специфические иммунные реакции на COVID-19 оценивались с использованием методов, описанных в приложении (см. Приложение). Вкратце, то антитела анти-S/N IgM и анти-S IgG оценивались во время периода скрининга в местной лаборатории исследовательского центра с помощью наборов полуколичественного ИФА для оценки предварительно существующего иммунитета добровольцев. Поствакцинальный гуморальный иммунный ответ исследовали путем измерения антител против RBD и нейтрализующих антител в центральной лаборатории. Для измерения титров RBD-специфических антител на 1, 10, 28-ой и 42-ой день был разработан и изготовлен набор для количественного ИФА в Национальном исследовательском центре эпидемиологии и микробиологии им. Н. Ф. Гамалеи. Титры нейтрализующих антител были исследованы перед вакцинацией в 1-ый день (исходный уровень) и на 28-ой и 42-ой день с помощью анализа микронейтрализации с использованием вируса SARS-CoV-2 . Поствакцинальный гуморальный иммунный ответ (IgG к RBD-SARS-CoV-2, а также нейтрализующие вирус антитела) сравнивали с ответом, который возникал естественным образом после перенесенной инфекции SARS-CoV-2. 56 образцов плазмы крови выздоравливающих доноров были получены из НИИ скорой помощи им. Н.В. Склифосовского Департамента здравоохранения Москвы.
Клеточно-опосредованный иммунный ответ изучали перед вакцинацией на 1 день (исходный уровень) и на 10 день путем обнаружения антиген-специфических пролиферирующих CD4 + и CD8 + Т-лимфоцитов с помощью проточной цитометрии и путем количественной оценки высвобождения интерферона-γ мононуклеарными клетками периферической крови (PBMC) при рестимуляции антигена с использованием методов ELISA и ELISpot.
Конечные точки исследования
Первичные конечные точки исследования — безопасность, реактогенность и иммуногенность вакцины «Спутник Лайт». Первичная конечная точка безопасности включала количество и характеристики нежелательных явлений в течение всего исследования. Первичным критерием оценки иммуногенности было изменение по сравнению с исходным уровнем уровней антиген-специфических антител на 10, 28, 42, 90 и 180 дни, измеренное с помощью ELISA. Критерии вторичной иммуногенности заключались в изменении титров вирусонейтрализующих антител по сравнению с исходным уровнем (на 28 и 42 дни) и определение антиген-специфического клеточного иммунитета (антигенспецифической пролиферации CD4 + и CD8 + Т-клеток, количество продуцирующих интерферон-γ клеток, измеренное с помощью ELISPOT, а также продукцию интерферона-γ PBMC, измеренную с помощью ELISA) на 10 день.
Статистический анализ
Все статистические расчеты проводились в GraphPad Prism 8 (GraphPad Software, США). Нормальность распределения данных оценивалась с помощью теста д'Агостино-Пирсона. Авторы использовали парный тест Вилкоксона для сравнения титров антител (в %), пролиферирующих клеток CD4+ и CD8+, а также увеличения концентраций IFN-γ в одной и той же группе добровольцев в разные промежутки времени (например, до и после вакцинации). Авторы применили U-критерий Манна – Уитни для сравнения результатов, полученных в разных группах (например, серонегативные/серопозитивные, вакцинированные/выздоравливающие). Чтобы гарантировать статистическую значимость анализа ELISPOT, был проведен двусторонний дисперсионный анализ ANOVA с апостериорным тестом множественных сравнений Тьюки для сравнения количества ореолообразующих клеток нестимулированными и антиген-стимулированными образцами, полученными до и после иммунизации. Корреляционный анализ проводился с помощью теста Спирмена, коэффициент корреляции r показывает взаимодействие между двумя наборами данных и демонстрирует значения от 0 до 1 (в случае положительной корреляции) или от -1 до 0 (в случае отрицательной корреляции).
Роль источника финансирования
Спонсор исследования не принимал участия в планировании исследования, сборе данных, анализе данных, интерпретации данных или написании отчета. Все авторы имели полный доступ к данным исследования и несли окончательную ответственность за решение об отправке исследования для публикации.
Полученные результаты
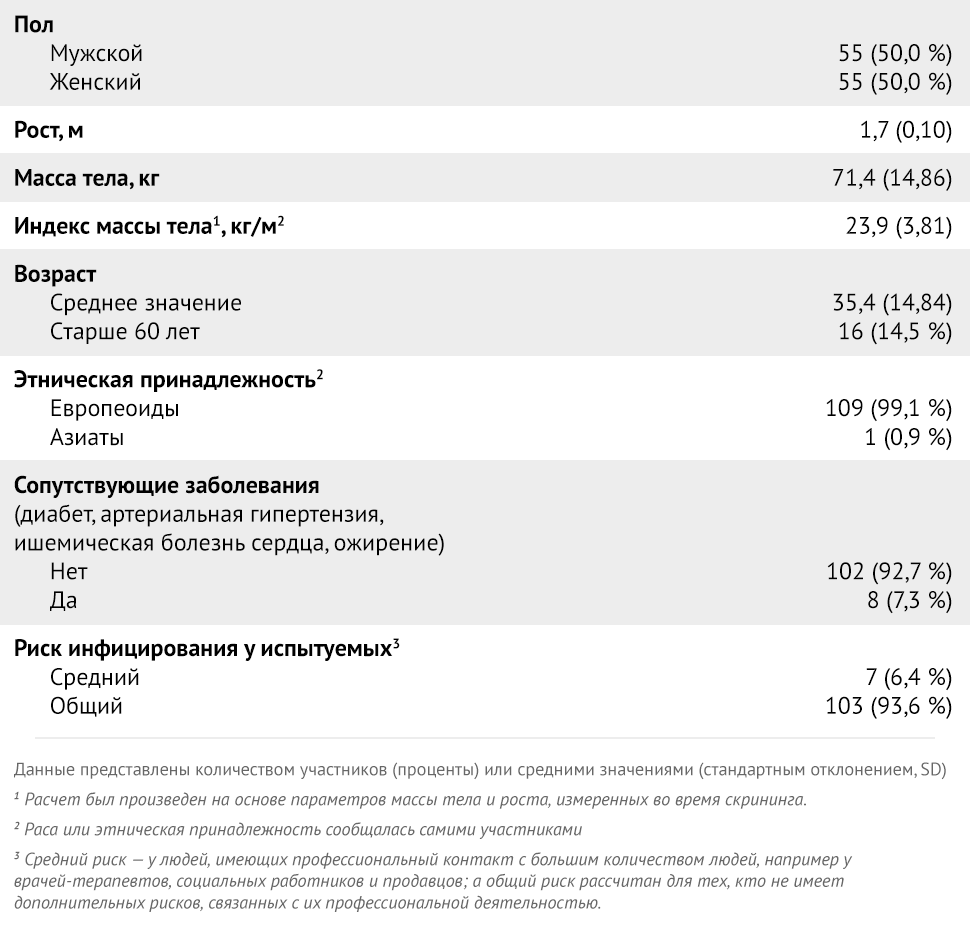
В период с 14 по 27 января 2021 года было отобрано 150 участников, из 110 человек были включены в исследование. Демографические характеристики зачисленных участников представлены в таблице 1.
Таблица 1 | Исходные характеристики
Из 40 первоначально прошедших скрининг лиц, которые были исключены, 24 были положительными на SARS-CoV-2 по результатам ПЦР или наличию антител, у 1 были отклонения от нормы лабораторных показателей, 1 был исключен врачами, 8 добровольно отозвали свое согласие на участие. Из-за конкурсного набора 6 человек, прошедших скрининг и признанных соответствующими критериям, не были зачислены (рис. 1).
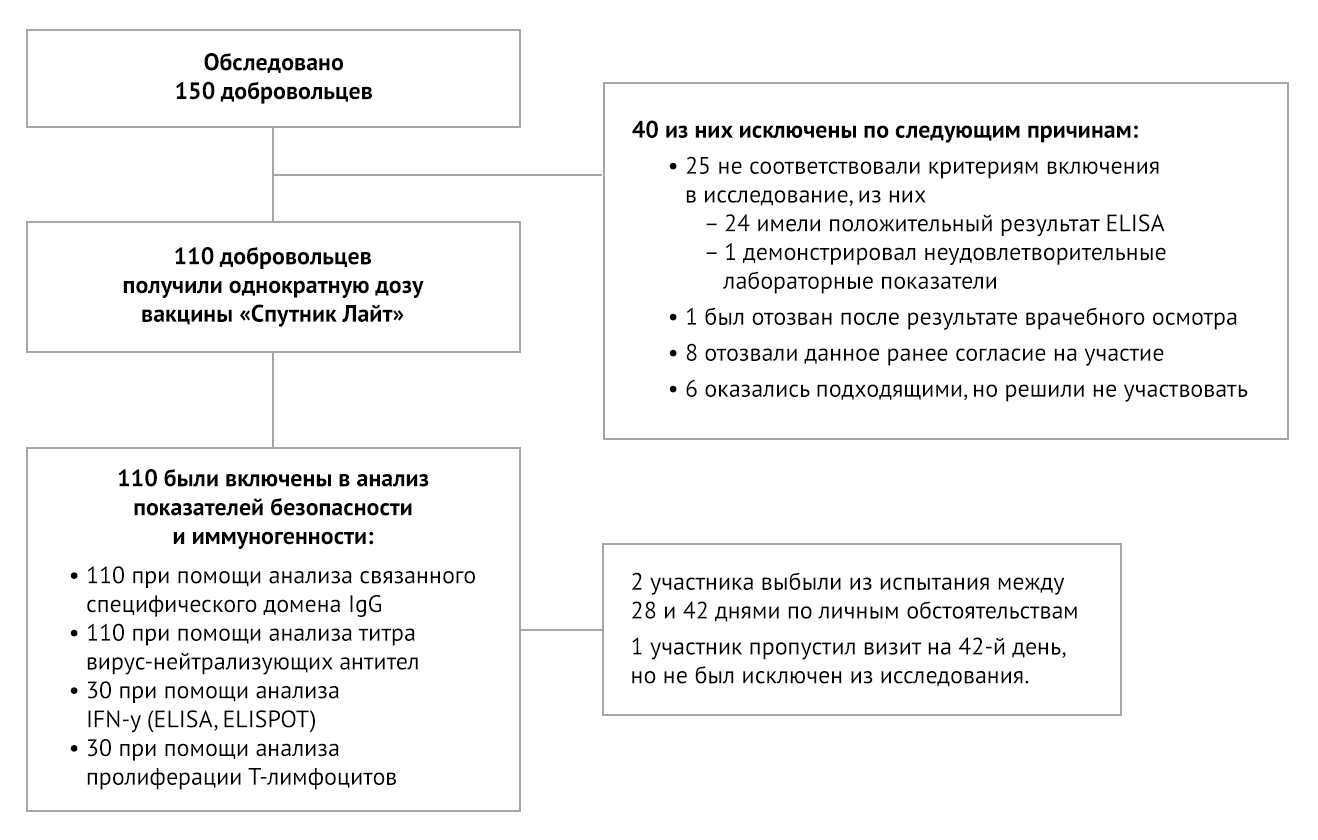
Рисунок 1 | Схема клинического исследования
Два участника, получивших вакцинацию, завершили свое посещение и скрининг на 28-й день, но отозвали согласие на участие в исследовании по личным причинам до своего посещения на 42-й день. Один участник пропустил визит на 42-й день, но продолжал участвовать в исследовании.
Анализы безопасности включали регистрацию предполагаемых местных и системных побочных реакций в течение первых 28 дней после инъекции, а также изменения лабораторных параметров, связанных с безопасностью вакцины. В целом нежелательные явления соответствовали зарегистрированным в клинических испытаниях аналогичных вакцин на основе рекомбинантных вирусных векторов (например, «Спутник V») [6].
Общая частота побочных реакций составила 74 (67,2 %) из 110 участников (таблица 2). У некоторых добровольцев было несколько нежелательных явлений разной степени тяжести. Большинство зарегистрированных, запрошенных системных и местных побочных реакций были легкими (73 [66,4 %]). Только 6 участников (5,5 %) имели нежелательные явления средней степени тяжести. О серьезных нежелательных явлениях не сообщалось.
Таблица 2 | Системные и местные нежелательные реакции в течение 28 дней после первой дозы вакцины (110 участников)
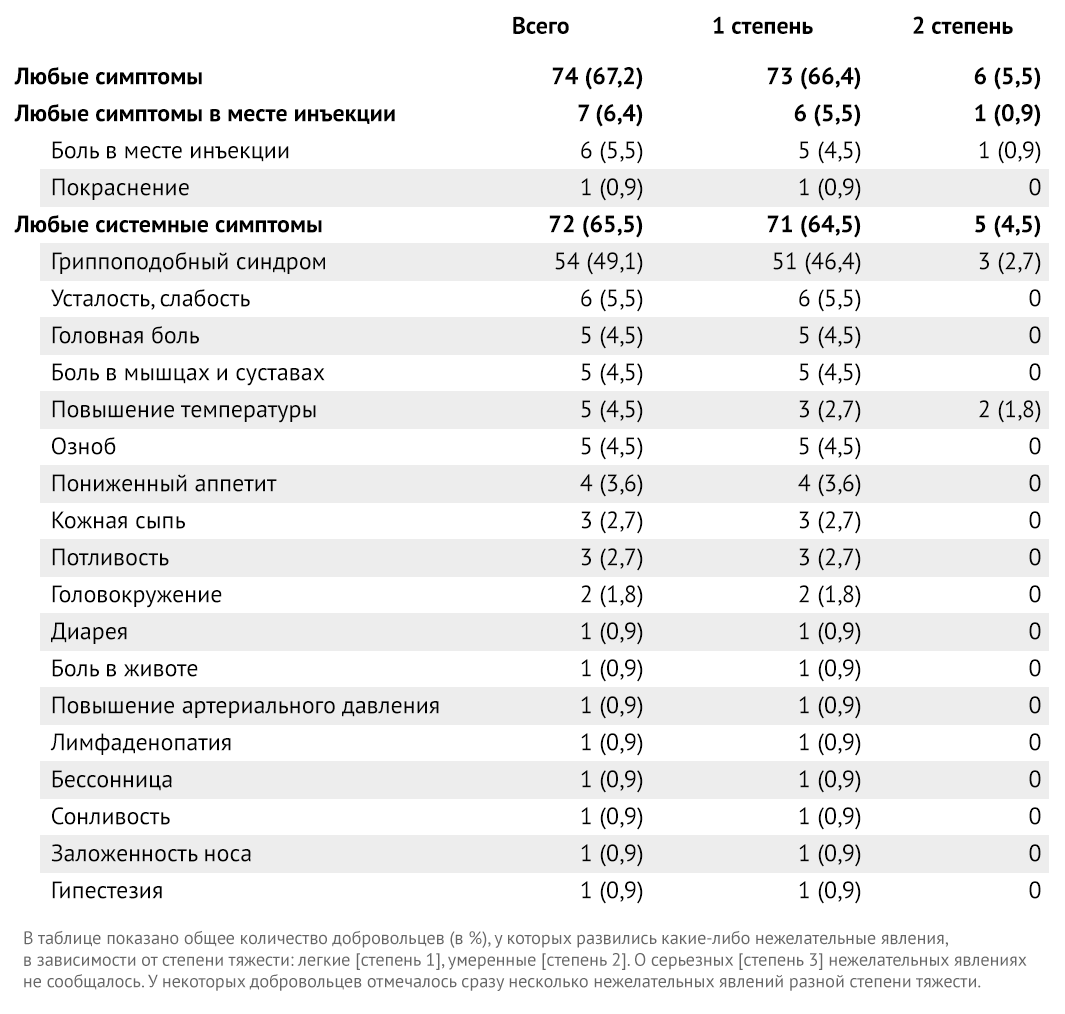
Местные реакции выражались только болью в месте инъекции (7 добровольцев из 110 [6,4 %]) и покраснением (1 [0,9 %]). Наиболее частой запрошенной системной реакцией было гриппоподобное заболевание, определяемое как комплекс из более чем одного симптома, включая лихорадку, озноб, головную боль, боли в мышцах, кашель, боль в горле, насморк, усталость, тошноту, рвоту или диарею (72 [65,5 %]). Другие частые (> 1 %) системные побочные эффекты включали усталость (6 [5,5 %]), головную боль (5 [4,5 %]), боль в мышцах и суставах (5 [4,5 %]), гипертермию ( 5 [4,5 %]), озноб (5 [4,5 %]), снижение аппетита (4 [3,6 %]), сыпь (3 [2,7 %]), гидроз (3 [2,7 %]) и головокружение (2 [1,8 %]).
Лабораторный анализ показал, что у 11 участников (10 %) наблюдались легкие транзиторные изменения скорости оседания эритроцитов (4 [3,5 %]), изменения концентрации аланинаминотрансферазы (2 [1,8 %]), аспартатаминотрансферазы (3 [ 2,7 %]), лактатдегидрогеназы (2 [1,8 %]), количество лейкоцитов (увеличение у 1 участника [0,8 %]), количество лимфоцитов (увеличение у 1 участника [0,9 %] и снижение у 1 участника [0,9 %]), количество нейтрофилов (увеличение у 1 участника [0,9 %] и снижение у 2 участников [1,8 %]), увеличение общей концентрации IgE (1 [0,9 %]). Также на 28-й день у одного участника была протеинурия (0,9 %) и у одного лейкоцитурия (0,9 %).
Сыворотку крови для выявления антител, специфичных к SARS-CoV-2 RBD, отбирали перед иммунизацией (в день 1, в дополнение к стандартному тесту на IgM / IgG, который проводился в местной лаборатории во время скрининга) и на 10, 28 и 42 дни. Анализ был проведен сразу после получения образцов с 42-го дня. В то время как критерии протокола исключали субъектов с перенесенным COVID-19 посредством отрицательного полуколичественного ELISA-теста SARS-CoV-2 IgM / IgG при скрининге, другой количественный анализ ELISA, проведенный при оценке иммуногенности вакцины, выявил группу серопозитивных субъектов (N = 14) с исходным средним геометрическим титром (GMT) 594,4 SARS-CoV-2 RBD-специфических антител, указывающих на ранее перенесенную инфекцию COVID-19. Принимая во внимание, что ранее существовавший иммунитет к SARS-CoV-2 влияет на все данные по безопасности и иммуногенности, авторы представляют все результаты, включая RBD-специфический ответ (IgG) у всех участников, вакцинированных «Спутником Лайт», а также разделенных ранее на основании существовавших антител к RBD SARS-CoV-2 на исходном уровне (рис. 2).
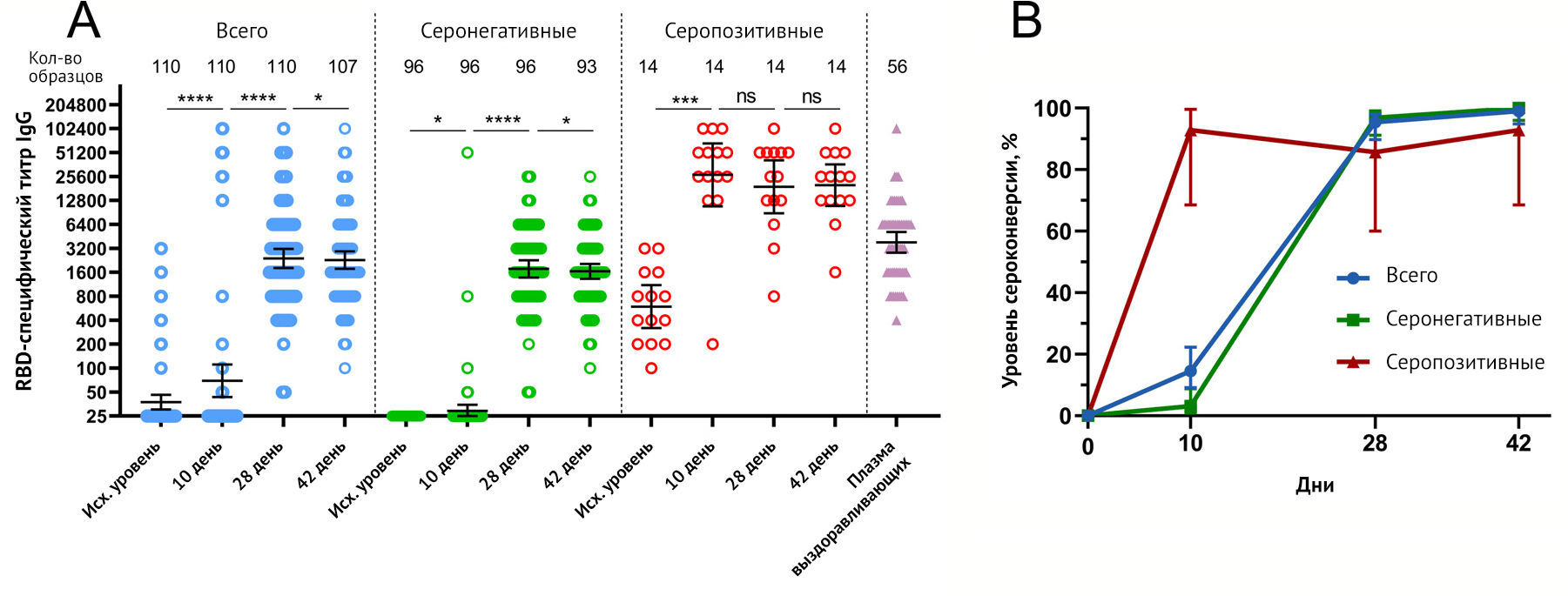
(B) Показатели сероконверсии (в %) участников в разные моменты времени. Сероконверсия определялась как по крайней мере четырехкратное увеличение титра после вакцинации по сравнению с исходным уровнем. whiskers - это 95% доверительный интервал, рассчитанный по методу Уилсона / Брауна.
Вакцинация всех 110 участников «Спутником Лайт» привела к увеличению RBD-специфических IgG уже на 10-й день (GMT 69,39), достигнув максимальных уровней на 28-й день (GMT 2395) и 42-й день (GMT = 2285). Кинетика титров RBD-специфических IgG в серонегативных и серопозитивных группах различалась. Серонегативные участники демонстрировали минимальное (но тем не менее значительное) увеличение титра, специфичного для RBD, на 10-й день (GMT = 29, p <0,05), достигнув плато между 28-м (GMT = 1770) и 42-м днем (GMT = 1648). Имея GMT RBD-специфических IgG 594 на исходном уровне, серопозитивные участники продемонстрировали быстрый ответ на вакцинацию, показав большое количество на 10-й день (GMT 26899) с незначительным снижением титра на 28-й (GMT = 19021) и 42-й день (GMT = 19986). Во всех временных точках средние геометрические титры антител у участников с ранее существовавшим иммунитетом были значительно выше, чем у участников без ранее существовавшего иммунитета. Различия в кинетике ответа (IgG) также отражались в различных кривых сероконверсии (рис. 2b). В то время как общий уровень сероконверсии составил 14,55 % для всех вакцинированных участников (16 участников из 110) на 10-й день, и только 3,13 % (3/96) сероконверсии произошли в серонегативной группе по сравнению с 92,86 % (13/14) в серопозитивной группе в один и тот же момент времени. На 42-й день сероконверсия в серонегативной группе достигла 100 % (93/93) по сравнению с 92,86 % (13/14) в серопозитивной группе, в среднем 99,07 % [106/107]) у всех вакцинированных участников. Сравнение ответов антител к SARS-CoV-2 после иммунизации с титрами в плазме выздоравливающих от 56 человек (GMT 3805) показало, что титры ELISA после вакцинации в серонегативной группе были ниже, чем титры после COVID-19 во все моменты времени. В то же время вакцинация серопозитивных участников однократной дозой «Спутник-Лайт» привела к значительно более высоким титрам во всех временных точках по сравнению с выздоравливающими. Описательная статистика титров RBD-специфических IgG представлена в приложении (см. Приложение). Сравнивая корреляцию между RBD-специфическим ответом IgG и возрастом вакцинированных, авторы не обнаружили значимой корреляции между этими параметрами (см. Приложение).
Анализ титра нейтрализующих антител к SARS-CoV-2 во всей группе участников показал 62,7 % (69/110) и 83,2 % (89/107) сероконверсии к 28 и 42 суткам соответственно (рис. 3).
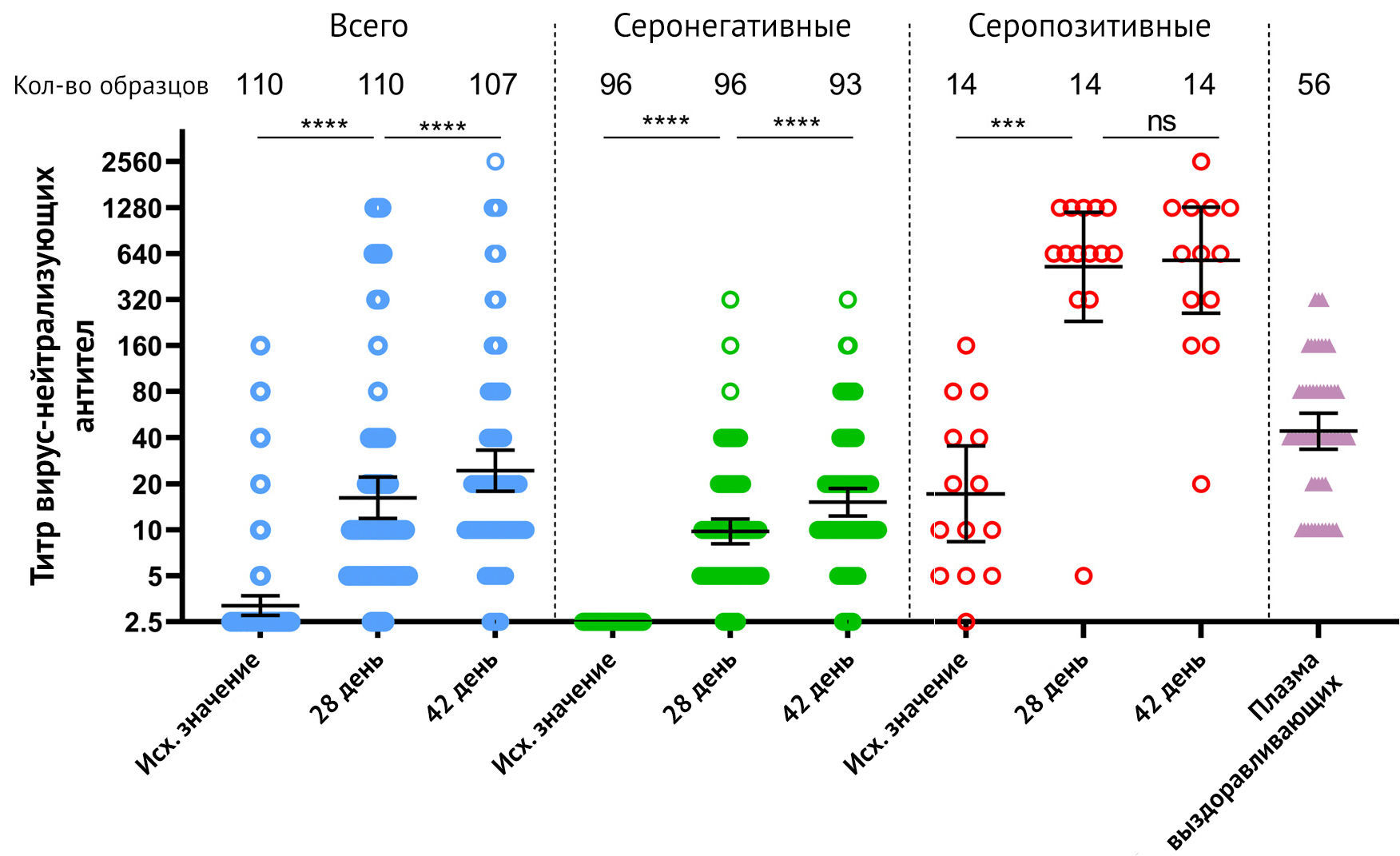
Среди всех 110 участников авторы выделили 13 человек с повышенными титрами нейтрализующих антител к SARS-CoV-2 до вакцинации (все соответствуют серопозитивной группе согласно ранее существовавшим RBD-специфическим IgG). Сероконверсия у реципиентов серонегативной вакцины составила 58,3 % (56/96) на 28-й день и увеличилась до 81,7 % (76/93) к 42-му дню. В серопозитивной группе сероконверсия достигла 92,8 % (13/14) на 28-й день и не изменились на 42-й день. Геометрические средние титры нейтрализующих антител непрерывно росли после иммунизации, достигая 16,25 к 28-му дню (p <0,00001 по сравнению с исходным уровнем) и 24,45 к 42-му дню (p <0,02). 0001 по сравнению с 28-м днем) во всей группе. В серонегативной группе нейтрализующие антитела GMT также увеличивались с течением времени: 9,79 (p <0,0001 по сравнению с исходным уровнем) на 28-й день и 15-18 (p <0,0001 по сравнению с 28-м днем) на 42-й день, соответственно. Вакцинация «Спутник Лайт» значительно увеличила количество нейтрализующих антител GMT у серопозитивных вакцинированных с 17,24 (до иммунизации) до 525,0 (p <0,00001 по сравнению с исходным уровнем) к 28-му дню. Однако на 42-й день не было зафиксировано статистически значимого повышения титров нейтрализующих антител (GMT 579,7) в этой группе (p = 0,58). По сравнению с плазмой выздоравливающих (GMT 44,16) однократная вакцинация приводит к более низкому нейтрализующему ответу антител на максимуме (42 день) в серонегативной группе (p <0,00001). Однако в серопозитивной группе после вакцинации титры нейтрализующих антител были значительно выше как на 28 (p <0,00001), так и на 42 день (p <0,00001), чем титры после заболевания COVID-19. Описательная статистика титров нейтрализующих антител представлена в приложении. При оценке корреляции между ответом нейтрализующих антител и возрастом вакцинированных авторы не обнаружили значимой корреляции между этими параметрами (приложение p7, таблица S4). Авторы также проанализировали корреляцию между титрами SARS-CoV-2 RBD ELISA и титрами нейтрализующих антител. В соответствии с предыдущими исследованиями авторы отметили сильную корреляцию между этими переменными в разные моменты времени (см. Приложение) [7].
Наконец, в связи с растущей угрозой появления новых штаммов SARS-CoV-2, авторы изучили вирус-нейтрализующую активность сывороток добровольцев, вакцинированных «Спутник Лайт», в отношении двух штаммов, вызывающих озабоченность (variants of concern, VOC) и имеющих международное значение: альфа (B.1.1. 7) и бета (B.1.351) с целью оценки потенциальной перекрестной защиты вакцины, сравнивая ответы с ответами от варианта исходной генетической линии (B.1.1.1) (см. Приложение).
Используя образцы сыворотки, полученные на 28 день от серонегативных вакцинированных участников (N = 96), авторы обнаружили небольшое, но статистически значимое снижение в 1,11 (p < 0,05) и 1,99 раз (p < 0,00001) титров вируснейтрализующих антител против штаммов B.1.1.7 и B.1.1.351, соответственно, по сравнению с титрами против исходного штамма B.1.1.1. Ссылаясь на недавно опубликованные данные с использованием сывороток, полученных от людей, вакцинированных «Спутник V», авторы ожидают, что вакцинация «Спутник Лайт» все еще сможет нейтрализовать B.1.617 VOC, но, очевидно, в пониженном титре [8].
Клеточный иммунный ответ у вакцинированных оценивали с использованием трех независимых методов:
- по пролиферативному ответу Т-хелперов (CD4+) и Т-киллеров (CD8+) на рестимуляцию антигена in vitro;
- по изменениям в продуцирующем IFN-γ антигенспецифическом клетки, измеренные с помощью ELISPOT;
- по изменениям секреции IFN-γ в мононуклеарных клетках периферической крови (МКПК), измеренным с помощью ELISA.
Для проведения каждого из вышеперечисленных методов от 30 разных добровольцев собирали МКПК до (день 1) и на 10 день после иммунизации. Серонегативные и серопозитивные добровольцы были отделены от общей группы в каждом анализе. Далее авторы описывали данные серонегативных добровольцев, чтобы представить иммуногенные свойства «Спутник Лайт», используемого в наивной популяции. CD4+ или CD8+ пролиферативные ответы на рестимуляцию гликопротеина S были обнаружены у 26 из 27 (96,3 %) добровольцев на 10-й день со средним значением 0-40 % CD4+ и 0,2 % CD8+ клеток (рис. 4A, B).
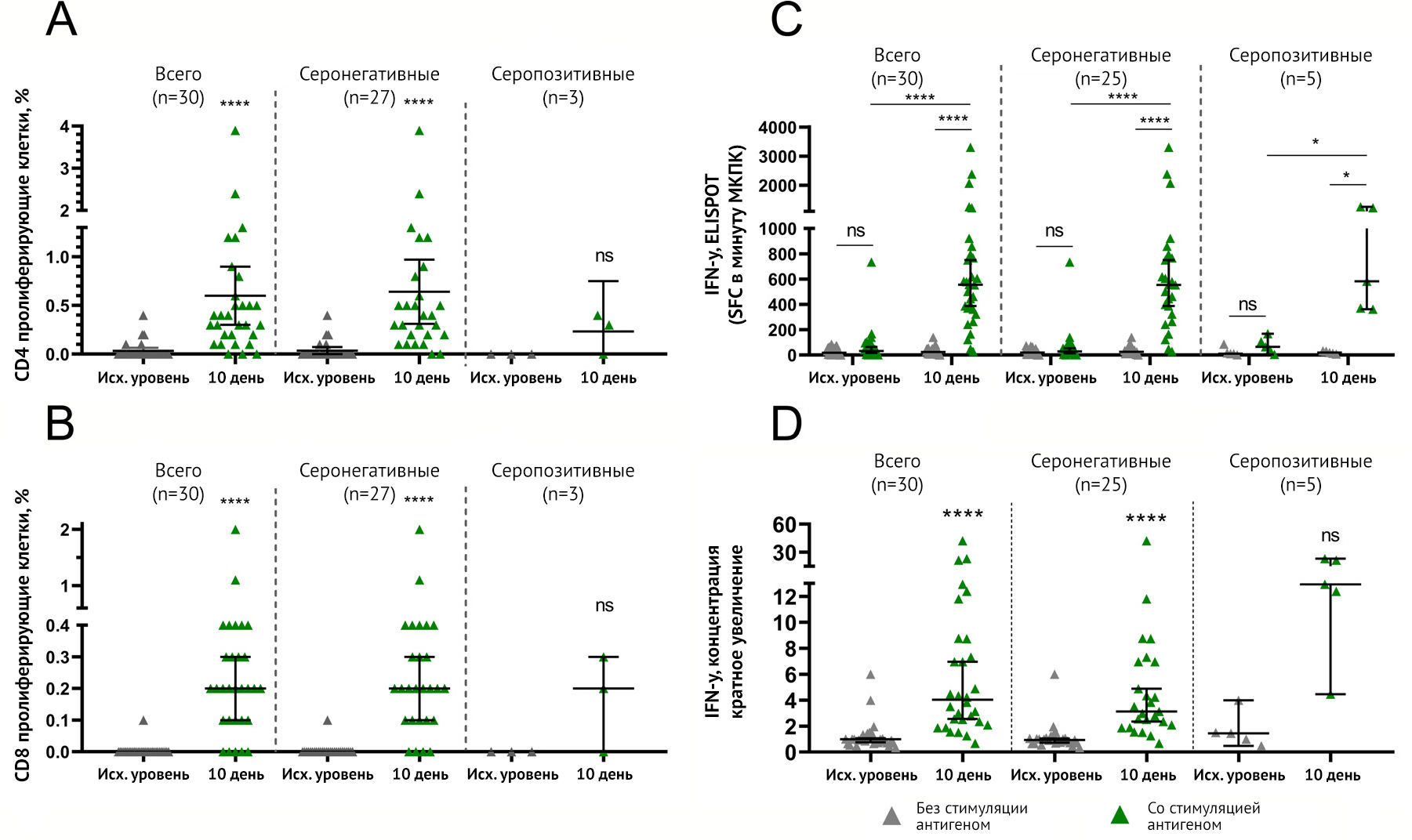
Формирование антигенспецифических МКПК, продуцирующих интерферон-γ , было обнаружено у 24 из 25 серонегативных добровольцев (96 %) со средним значением 554,3 на 1 миллион (млн) МКПК после рестимуляции антигеном (по сравнению с 25,71 в нестимулированных клетках) к 10-му дню после иммунизации (рис. 4С).
Секреция интерферона-γ МКПК представлена как кратное увеличение секреции при воздействии гликопротеина S SARS-CoV-2 (рис. 4D). Секреция антиген-специфического интерферона-γ была обнаружена у 24 из 25 серонегативных добровольцев (96 %) со средним увеличением в 3,122 раза по сравнению с нестимулированными клетками к 10-му дню после иммунизации. Таким образом, применение «Спутник Лайт» приводило к формированию клеточно-опосредованного ответа у 96 % серонегативных добровольцев, что демонстрировалось при каждом анализе. Из-за небольшого количества серопозитивных участников, оцениваемых в каждом тесте, авторы не получили достоверных статистических различий в данных в этой группе. Однако каждый тест показал, что у всех серопозитивных участников сформировался клеточный иммунитет после однократной вакцинации.
Количество участников с клеточно-опосредованными ответами на антиген, а также описательная статистика показаны в приложении (стр. 9-13). Индивидуальные репрезентативные данные участников ELISPOT представлены в Приложении.
Наконец, авторы оценили гуморальный ответ против Ad26 у добровольцев перед вакцинацией «Спутник Лайт» и на 28-й день. После вакцинации Ad26 нейтрализующий GMT увеличился с 18,2 до 782,9 к 28-му дню (рис. 5)
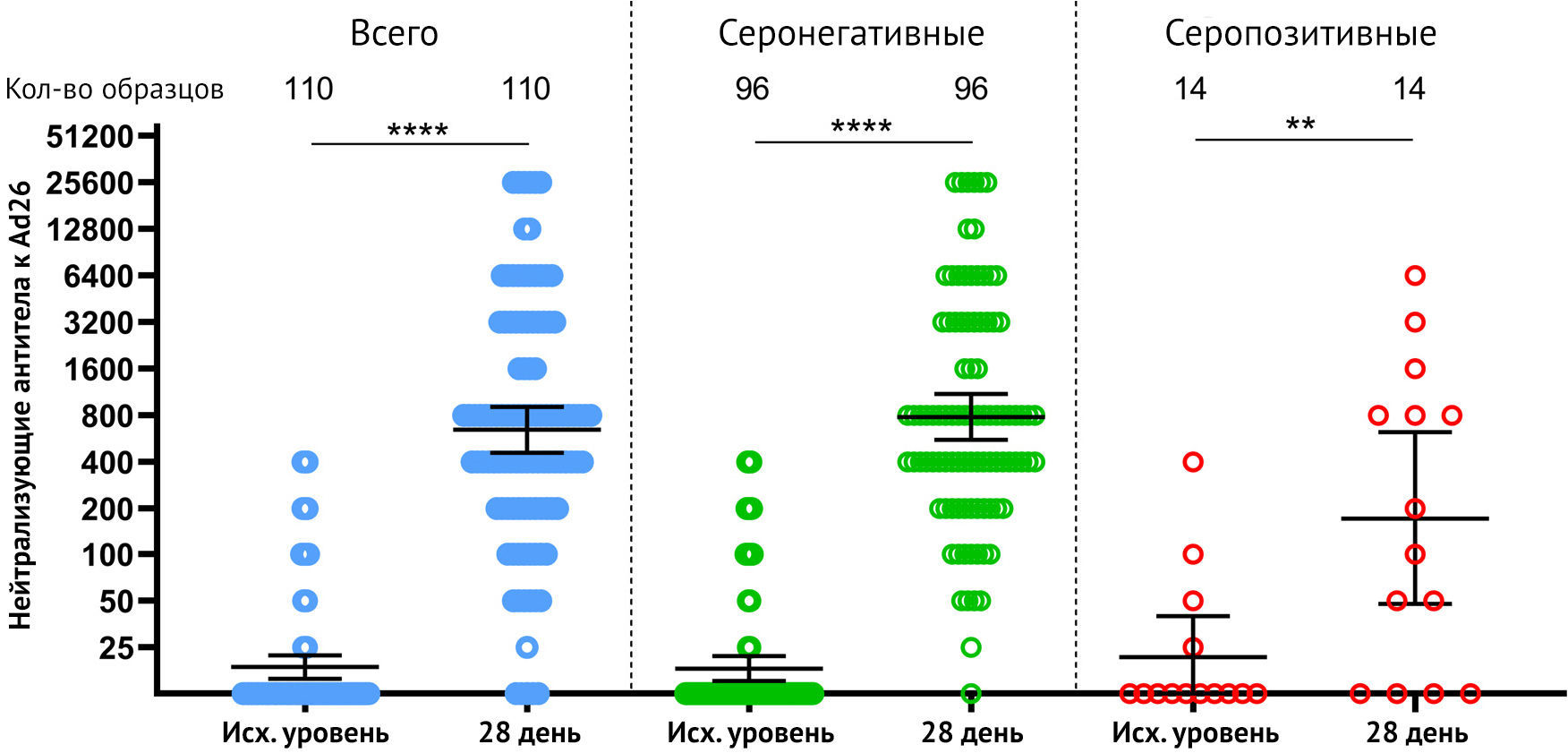
Описательная статистика нейтрализующих антител против вектора rAd26 представлена в Приложении.
Авторы заметили, что у некоторых добровольцев отмечался ранее существовавший иммунитет к Ad26 (N = 20), который не коррелировал с ранее существовавшим иммунитетом к SARS-CoV-2 (см. Приложение). Мы также оценили, могут ли существующие нейтрализующие антитела к вектору Ad26 препятствовать формированию гуморального ответа на полученный посредством введения вакцины антиген. Не было отмечено значительной корреляции между титром нейтрализующих антител к вирусному вектору Ad26 в 1-й день и титрами RBD-специфических IgG в образцах сыворотки участников на 10, 28 и 42 дни (см. Приложение). Было продемонстрировано интересное наблюдение слабой корреляции между титрами нейтрализующих антител к Ad26 и возрастом добровольцев (см. Приложение), что указывает на то, что у пожилых людей выше шансы заразиться инфекцией Ad26 естественным образом, что, однако, не влияет на иммунитет против SARS-CoV-2 при вакцинации «Спутник Лайт».
Обсуждение результатов
Доказано, что вакцинация против COVID-19 является наиболее эффективной мерой для прекращения пандемии. Также подтверждено, что вакцины против COVID-19 снижают тяжесть заболевания, уровень смертности, а также уменьшают интенсивность передачи коронавируса [9]. В этом контексте цена, которую человечество в конечном итоге заплатит за прекращение пандемии, в основном зависит от темпов всемирной кампании вакцинации. Внося вклад в глобальное внедрение вакцины, российские исследователи разработали новую однокомпонентную вакцину «Спутник Лайт» на основе нереплицирующегося рекомбинантного аденовируса типа 26 (Ad26). Здесь авторы сообщают промежуточные результаты по безопасности, переносимости и иммуногенности открытого нерандомизированного клинического исследования I/II фазы. После оценки антител IgG к RBD у 110 вакцинированных авторы определили группу участников с уже существующим иммунитетом к SARS-CoV-2 (N = 14). Данная группа позволила авторам оценить эффекты вакцины «Спутник Лайт» как препарата в схеме ревакцинации. Принимая во внимание, что первоначальные случаи COVID-19 были выявлены более полутора лет назад (31 декабря 2019 г.) и что первая группа вакцинированных добровольцев приближается к концу предполагаемого периода защиты от вакцины (например, первая вакцинация с использованием «Спутника V» начата 7 сентября 2020 г.), значит, по всей вероятности, в ближайшее время состоится ревакцинация [10,11]. Таким образом, оценка параметров безопасности и иммуногенности вакцины COVID-19 в предварительно иммунизированных группах имеет важное значение.
Что касается результатов безопасности, авторы обнаружили, что вакцина «Спутник Лайт» хорошо переносилась как в серонегативных, так и в серопозитивных группах (см. Приложение). Наиболее частым запрошенным системным побочным эффектом был гриппоподобный синдром, который одинаково проявлял себя как в серонегативной (47/96 [49,0 %]), так и серопозитивной (7/14 [50,0 %]) группах. Интересно, что только участники без какого-либо иммунитета к SARS-CoV-2 предъявляли жалобы на боли в мышцах и суставах после вакцинации (5/96 [5,2 %]). Наивные по отношению к SARS-CoV-2 участники также демонстрировали изменения в лабораторных показателях (10/96 [11,4 %]), тогда как в серопозитивной группе таковых не было вообще (0/14 [0 %]) (приложение p21). Эти данные показывают, что ревакцинация может вызывать более легкие побочные эффекты по сравнению с первичной иммунизацией против COVID-19. Важно отметить, что большинство наблюдаемых нежелательных эффектов были легкими (73/110 [66,4 %]), только 6 участников из 110 (5,5 %) имели побочные эффекты средней степени. Все наблюдаемые эффекты были временными. Во время исследования серьезных побочных эффектов не сообщалось.
«Спутник Лайт» продемонстрировал свою иммуногенность, вызывая как связывающие, так и нейтрализующие реакции антител у 100 % (93/93) и 81,7 % (76/93) серонегативных участников к 42-му дню соответственно. Авторы также обнаружили, что однократная доза вакцины «Спутник Лайт» вырабатывала более быстрый гуморальный иммунный ответ у серопозитивных участников, который в то же время был в 12 раз выше титров антител IgG к RBD-SARS-CoV-2 и в 54 раза выше по титрам нейтрализующих антител, чем у вакцинированных без ранее существовавшего иммунитета в тот же момент времени. По сравнению с выздоравливающими, авторы продемонстрировали, что иммунизация при помощи «Спутник Лайт» приводила к 2,9-кратному снижению среднего геометрического титра нейтрализующих антител SARS-CoV-2 в серонегативной группе, тогда как однократная доза вакцины в серопозитивной группе увеличивала среднее геометрическое титра антител до 13,1- кратного увеличения по сравнению с уровнем, наблюдаемым у выздоравливающих.
Недавно было доказано, что уровень нейтрализующих антител является высокопрогнозируемым показателем иммунной защиты от COVID-19 [12]. Рассчитав средний уровень нейтрализации (кратность выздоровления) в серонегативной группе (0,34), авторы получили 63,0 % [95 % ДИ = 54,8–71,2 %] эффективности вакцинации «Спутник Лайт» у наивных добровольцев. Высокие титры нейтрализации в серопозитивной группе после введения «Спутник Лайт» (который фактически повторяет режим ревакцинации) подразумевают, что уровень нейтрализации (13,72) выходит за пределы диапазона значений кривой, что дает теоретически беспрецедентную эффективность начальной защиты в 98,4 % [13].
Эти данные показывают, что «Спутник Лайт» — хороший кандидат для бустерной иммунизации (после первоначальной вакцинации или естественного заражения) против COVID-19, используемой в режиме ревакцинации. Этот вывод также подтверждается ранее опубликованными данными, показывающими, что вторая доза вакцины BNT162b2 [Pfizer] или «Спутник V» не приводит к дальнейшему увеличению титров антител у серопозитивных участников, и, таким образом, для эффективной ревакцинации требуется только однократная доза векторной вакцины [14,15].
В контексте других однокомпонентных векторных вакцин, разработанных Janssen Pharmaceuticals (99 %), [16] Oxford – AstraZeneca (100 %) [17] и CanSino Biologics (97 %) [18] вакцина «Спутник Лайт» продемонстрировала 100 % сероконверсию IgG к серонегативным веществам через 28-29 дней после вакцинации. Принимая во внимание промежуточные результаты безопасности, вакцина «Спутник Лайт» привела к самому низкому проценту всех зарегистрированных побочных реакций (67,2 %) по сравнению с Oxford – AstraZeneca (94,6 %) [19] Janssen Pharmaceuticals (89,9 %) [16 ] и CanSino Biologics (72,7 %) [18], что делает ее многообещающим кандидатом для людей, чувствительных к вакцинации или сомневающихся ее целесообразности.
Наконец, «Спутник Лайт» можно рассматривать как эффективную вакцину для людей старше 65 лет. Согласно недавно опубликованным результатам исследования, проведенного аргентинскими учеными, эффективность первого компонента (rAd26) «Спутник V» составила 78,6 % [95 % ДИ = 74,8– 81,7]; а для снижения количества госпитализаций и смертей была, соответственно, 87,6 % [95 % ДИ = 80,3–92,2] и 84,8 % [95 % ДИ = 75,0–90,7] [20]. В то же время эффективность аналогичных однокомпонентных вакцин в предотвращении симптоматической инфекции составляла 51-76 %, госпитализаций 66,9-91 % и смертности 85-91 % для мРНК BNT162b2 (Pfizer-BioNTech), ChAdOx1 nCoV-19 (Oxford – AstraZeneca), вакцины мРНК-1273 (Moderna) и Ad26.COV2.S (Janssen Pharmaceuticals) [21, 22, 23].
Результаты этого клинического исследования послужили основанием для предварительного одобрения вакцины для клинического использования, выданного 06 мая 2021 года (регистрация LP-006993) в соответствии с действующим Постановлением Правительства Российской Федерации от 3 апреля 2020 года № 441. Предварительное лицензирование позволило начать международное многоцентровое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование III фазы (NCT04741061) для оценки эффективности, иммуногенности и безопасности векторной вакцины «Спутник Лайт» при параллельном включении субъектов, проходящих профилактическое лечение. на инфекцию SARS-СoV-2. Это испытание с участием 6000 участников (4500 субъектов в группе вакцинированных и 1500 в плацебо-группе) поможет дополнительно изучить, может ли однократная доза вакцины «Спутник Лайт» стать хорошим вариантом для ревакцинации, обеспечивая эффективную защиту от инфекции SARS-CoV-2 у лиц с ранее существовавшим иммунитетом.
