Исследование метаболических путей для коррекции ожирения
Состояние здоровой белой жировой ткани зависит от пролиферации эндотелиальных клеток для поддержания гомеостаза и предотвращения чужеродного вторжения. Новое исследование сообщает, что эндотелиальные клетки связываются с адипоцитами через полиамины, чтобы обеспечить васкуляризацию жировой ткани, тем самым сводя на нет метаболические эффекты ожирения.
▶ Читайте также: Коррекция дислипидемии в среднем возрасте для снижения риска развития деменции в пожилом возрасте
Кровеносные сосуды в жировой ткани выстланы одним слоем неделящихся эндотелиоцитов, способных быстро переключаться и делиться для формирования новых кровеносных сосудов. Изменение от состояния покоя к пролиферации обеспечивается балансом проангиогенных факторов и их ингибиторов. Этим процессом управляют взаимодействия между эндотелиоцитами и адипоцитами, регулирующими ангиогенез и необходимыми для поддержания гомеостаза белой жировой ткани. В свежем выпуске журнала «Nature Metabolism» Monelli и соавт. продемонстрировали, что активация пути фосфоинозитид-3-киназы (PI3K) в эндотелиоцитах увеличивает пролиферацию эндотелиоцитов избирательно в белой жировой ткани, уменьшает жировую прослойку и улучшает системную толерантность к глюкозе. Кроме того, ученые сообщают, что ключевые медиаторы взаимодействия эндотелиоцитов и адипоцитов — это полиамины, выделяемые эндотелиоцитами. Это производные эндотелиоцитов, стимулирующие липолиз. Образующиеся свободные жирные кислоты (СЖК) затем поглощаются эндотелиоцитами и окисляются с выделением энергии для поддержания пролиферации. Эти наблюдения Monelli и коллег улучшают наше понимание биологии эндотелиоцитов белой жировой ткани и раскрывают, как микроокружение эндотелиоцитов может управлять их свойствами.
Жировая ткань обладает огромной пластичностью: она способна увеличиваться и уменьшаться в размерах в период взросления организма. Здоровая белая жировая ткань легко увеличивается в объеме и сохраняет депо липидов в виде липидных капель, предотвращая отложение липидов в других органах. Расширение ткани тесно связано с ангиогенезом, при котором эндотелиоциты пролиферируют и изменяются, образуя новые кровеносные сосуды. Ожирение и инсулинорезистентность часто связаны со снижением плотности сосудов жировой ткани, что приводит к снижению поступления кислорода и питательных веществ. В результате функционально несостоятельная жировая ткань демонстрирует неразрешенное воспаление и фиброз. Для определения потенциальных путей, которые могут нивелировать дисфункцию, вызванную ожирением в процессе увеличения ткани в размерах, крайне важно понять регуляцию ангиогенеза в белой жировой ткани.
Эндотелиоциты реагируют на разные сигналы, но особенно чувствительны к сигналам PI3K, зависящим от инсулина. Активация PI3K катализирует образование фосфатидилинозитол(3,4,5)-трифосфата (PIP3) — липида, активирующего протеинкиназу B (PKB, известную как AKT), что приводит к увеличению потребления глюкозы. При ожирении и диабете второго типа передача сигналов PI3K в эндотелиоцитах нарушена и ухудшает активацию капиллярной сети, индуцированную инсулином. Monelli и соавт. изучали связь между активностью PI3K в эндотелиоцитах и васкуляризацией белой жировой ткани. В процессе исследования авторы создали модели мышей с эндотелиоцит-специфическим гомологом фосфатазы и тензина (Pten) с делецией, индуцируемой введением тамоксифена новорожденным мышам. PTEN представляет собой липидфосфатазу, противоположную PI3K по действию. Утеря PTEN поддерживает устойчивую активность PI3K в эндотелиоцитах этих мышей.
Ученые кормили созданных мышей обычным кормом, питанием с высоким содержанием жиров, а также едой с высоким содержанием сахарозы. Инактивация PTEN при любом виде питания снижала массу тела и уменьшала жировую прослойку; отмечался меньший средний размер адипоцитов без существенных изменений в других тканях. Экспериментальные мыши продемонстрировали более чем двукратное увеличение плотности сосудов как в висцеральном, так и в подкожном депо белой жировой ткани; в бурой жировой ткани увеличение было меньше. Распространение эндотелиоцитов конкретно в белой жировой ткани влияло на тело и метаболизм. Эти данные согласуются с предыдущими исследованиями, в которых сообщалось, что экспрессия VEGF-A, специфичная для адипоцитов, приводит к усилению «сжигания» жировой ткани.
Авторы исследовали эндотелиоциты, взятые у мышиных моделей: в белой жировой ткани было отмечено повышенное окисление жирных кислот и усиление митохондриального дыхания, которое еще больше усилилось при добавлении липидов. Кроме того, подавление активности PTEN в эндотелиоцитах увеличивало экспрессию генов, обеспечивающих транспорт липидов, например, Cd36. Это наблюдение оказалось неожиданностью, так как эндотелиоциты обычно получают энергию путем гликолиза. Тем не менее, эти данные позволяют предположить, что у созданных мышиных моделей окисление жирных кислот необходимо для пролиферации эндотелиоцитов в жировой ткани. Очевидный источник СЖК для эндотелиоцитов — липолиз, процесс, посредством которого триацилглицеролы распадаются на глицерин и жирные кислоты. Авторы утверждают, что делеция PTEN в эндотелиоцитах стимулирует липолиз.
Но что стимулирует ангиогенез эндотелиоцитов, которые отвечают за стимулирование липолиза в белой жировой ткани? Ученые создали среду из эндотелиоцитов, отобранных у мышиных моделей, затем отфильтровали, чтобы убрать белки и внеклеточные везикулы. Таргетинг метаболомики выявил повышенный уровень полиаминов. Эта находка очень интересна, так как полиамины секретируются и могут действовать по паракринному механизму. Полиамины, такие как спермин, спермидин и путресцин, представляют собой небольшие положительно заряженные поликатионы, которые могут регулировать многие физиологические функции, включая пролиферацию клеток и дифференцировку. Потребление продуктов, богатых полиаминами, ассоциировано с высокой антиоксидантной активностью; особенно это касается тех, которые содержат спермин. Эти молекулы легко связываются с отрицательно заряженными молекулами, такими как ДНК, РНК, АТФ, белки и фосфолипиды. Хотя и установлено, что биосинтез полиаминов регулируется клетками и тканями, биологическая функция полиаминов до конца не понятна. О связи эндотелиоцитов с жировой тканью посредством полиаминов ранее не сообщалось.
Ученые исключили белки и внеклеточные везикулы из метаболического анализа кондиционированной среды, созданной с помощью мышиных моделей. Внеклеточные везикулы содержат множество белков и метаболитов, которые модулируют передачу сигналов между эндотелиоцитами и адипоцитами. Интересно, что предыдущий протеомный анализ мелких внеклеточных везикул, секретируемых белой жировой тканью, выявил большое количество белков, участвующих в метаболизме полиаминов. По этой причине интересно, могут ли эндотелиоциты в сообщении с белой жировой тканью доставлять полиамины через несколько путей, и могут ли другие типы клеток в стромально-васкулярной фракции жировой ткани также быть источником полиаминов.
Полиамин спермидин играет главную роль в адипогенезе, регулируя гены, необходимые для дифференцировки преадипоцитов. Таким образом, можно предположить, что полиамины, секретируемые эндотелиоцитами, также воздействуют на соседние преадипоциты или любой другой тип клеток белой жировой ткани. Это обращает внимание на недостаток подхода команды Monelli по использованию тамоксифена в качестве индуктора делеции PTEN в эндотелиоцитах. Тамоксифен изменяет модели адипогенеза и является липодистрофическим агентом, который сохраняет биодоступность в течение нескольких недель после введения. Таким образом, побочное влияние тамоксифена на адипогенез, а также липидный и глюкозный гомеостаз может затруднить интерпретацию этих моделей.
Команда ученых заявляет, что полиамин-опосредованную стимуляцию липолиза в белой жировой ткани удавалось ингибировать пропранололом, что позволяет предположить, что действие полиаминов на адипоциты частично зависит от β-адренорецепторов. Как правило, стимуляция передачи сигналов βАР увеличивает экспрессию гена разобщающего белка 1 (РБ-1) и уровень белка, в результате чего адипоциты становятся похожи на бурый жир и демонстрируют термогенный профиль экспрессии генов. Авторы подтверждают, что спермидин увеличивал синтез вторичного мессенджера βАР – цАМФ в белой жировой ткани, но, как ни парадоксально, мыши с делецией PTEN не демонстрировали РБ-1-зависимого или независимого «сжигания» белой жировой ткани. Результаты усиливают интригу вокруг вопроса о том, как полиамины взаимодействуют с βАР, или о том, что активность βАР возрастает вместе с метаболизмом полиаминов (рис. 1).
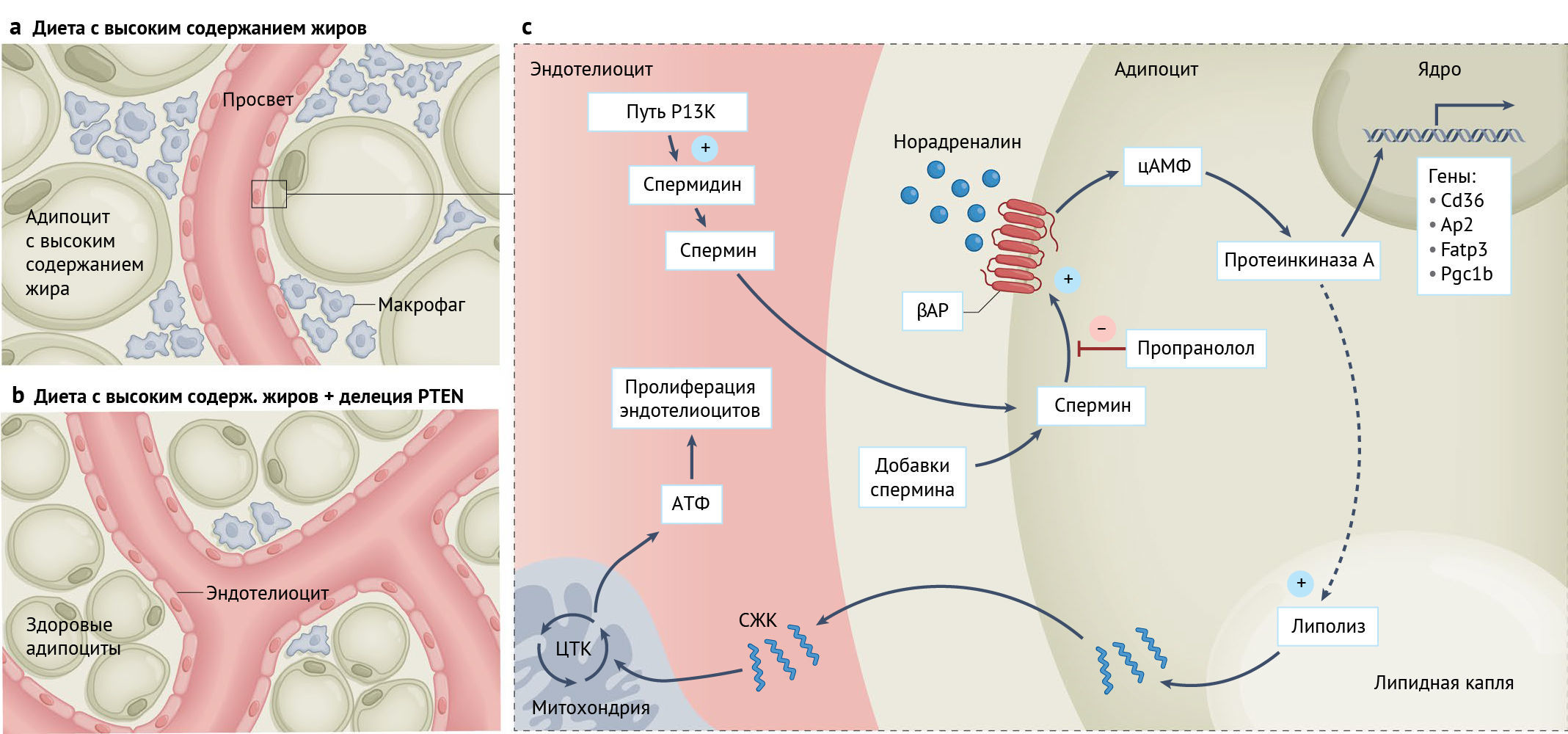
b | Делеция PTEN в эндотелиоцитах приводит к увеличению васкуляризации, особенно в белой жировой ткани. В результате функция жировой ткани восстанавливается, а снижение массы тела и жировой прослойки нивелирует патофизиологические последствия диеты с высоким содержанием жиров.
c | Делеция PTEN способствует передаче сигналов PI3K в эндотелиоцитах и стимулирует синтез полиаминов (а именно, спермина), небольших метаболитов поликатионов, способных к паракринной передаче сигналов. Эндотелиоциты и адипоциты находятся в прямом контакте с вовлечением клеточных перекрестных сигнальных путей. Спермин усиливает передачу сигналов βАР в адипоцитах и способствует липолизу и экспрессии генов, которые опосредуют транспорт СЖК. Следовательно, адипоциты высвобождают СЖК для соседних эндотелиоцитов, чтобы использовать их в качестве энергии для окисления жирных кислот, что необходимо для стимуляции пролиферации. Таким образом, эндотелиоциты осуществляют клеточно-автономную ангиогенную передачу сигналов в белой жировой ткани посредством секреции полиаминов, которые стимулируют липолиз в адипоцитах, являющихся источником СЖК для роста эндотелиоцитов.
ЦТК, цикл трикарбоновых кислот. Ap2 также известен как Fabp4; Fatp3 также известен как Slc27a3; Pgc1b также известен как Ppargc1b.
В целом выводы Monelli и коллег согласуются с предыдущими исследованиями, которые говорят о том, что добавление спермина улучшает метаболизм глюкозы, уменьшает жировую массу и улучшает адаптацию организма к диете с высоким содержанием жиров. Важно отметить, что полиамины запускают липолиз и окисление жирных кислот в белой жировой ткани одновременно. Несколько исследований показывают, что добавление полиаминов и катаболизм снижают количество ацетил-КоА и клеточной энергии, что приводит к расщеплению клеток белой жировой ткани, увеличению метаболизма глюкозы и липидов, делая ЦТК неэффективным. Эта возможность не была изучена в настоящем исследовании, но это также может способствовать улучшению обмена веществ у мышиных моделей с делецией PTEN. Тем не менее, авторы продемонстрировали, что эндотелиоциты регулируют внеклеточные полиамины в белой жировой ткани.
В настоящее время фармакологические методы лечения ожирения ограничены и малоэффективны. Понимание взаимодействия эндотелиоцитов и адипоцитов может помочь создать новый подход к лечению ожирения и сопутствующих ему заболеваний. Идея лечить ожирение и его осложнения, действуя на ангиогенные факторы, кажется очень заманчивой. Данные команды исследователей говорят о том, что мышиные модели ожирения демонстрируют низкие уровни полиаминов в белой жировой ткани, поэтому добавки полиаминов могут быть эффективны. Тем не менее, потенциальный недостаток такого терапевтического подхода заключается в неизбежной опасности того, что усиленный ангиогенез являет собой среду для роста опухоли.
