Новый недруг в метаболизме фолатов

Два исследования доказывают необходимость активности метионинсинтазы для работы фолатного цикла и пополнения пула тетрагидрофолата с помощью 5-метилтетрагидрофолата; таким образом синтезируются нуклеотиды, поддерживающие опухолевый рост. Изменения в рационе влияют на доступность фолатов и имеют практическое значение для ответа на противоопухолевую терапию.
▶ Читайте также: «Очерки клинической биохимии», глава 2 — Биосинтез макромолекул
Фолиевая кислота, также известная как витамин B9, — важный нутриент, получаемый с пищей, поскольку животные, в том числе человек, не обладают биохимической способностью к ее синтезу de novo. Дефицит фолиевой кислоты влияет на рост и развитие и может привести к дефектам нервной трубки и врожденным порокам сердца при развитии плода или мегалобластической анемии у взрослых [1]. Метаболизм фолиевой кислоты регулирует биодоступность различных вариантов фолатов и образует ключевую часть одноуглеродного метаболизма. Одоуглеродный метаболизм включает в себя набор смежных метаболических сетей — фолатный цикл, метиониновый цикл и путь транссульфирования, — которые опосредованы интермедиатами фолатов, переносящими одноуглеродные единицы. Последние участвуют в различных клеточных процессах, в том числе в биосинтезе пуринов и тимидина, регуляции окислительно-восстановительных реакций, а также регенерации метионина. Эти биосинтетические процессы, в свою очередь, поддерживают пролиферацию клеток, эмбриональное развитие и гомеостаз тканей.
Вследствие своей важности для синтеза нуклеиновых кислот, ингибирование фолатного обмена нарушает клеточную пролиферацию; это лежит в основе применения антагонистов фолатов в качестве терапевтических агентов. Подавление фолатного обмена и нижележащих путей синтеза нуклеотидов было краеугольным камнем химиотерапии на протяжении десятилетий. В широком смысле фолаты — семейство химически родственных соединений, включающих тетрагидрофолат (ТГФ), 5-метил-ТГФ, 5,10-метилен-ТГФ и 5-формил-ТГФ (или фолиевая кислота). Среди них основной формой, циркулирующей в крови человека, является 5-метил-ТГФ; в клетке он превращается в ТГФ метионинсинтазой (кодируется геном 5-метилтетрагидрофолатгомоцистеинметилтрансферазы, MTR), в то время как полученная синтетически фолиевая кислота из пищевых добавок сначала должна быть восстановлена до дигидрофолата (ДГФ) и затем — до ТГФ дигидрофолатредуктазой (ДГФР); лишь после этого она поступает в фолатный цикл (рис. 1). Проходя через ряд стадий, ТГФ приобретает одноуглеродную группу от серина в реакции, катализируемой серингидроксиметилтрансферазой (СГMT) и восстанавливается до 5,10-метилен-ТГФ, который в конечном счете и используется для синтеза нуклеотидов. Примечательно, что большинство природных фолатов в рационе и кровотоке представлены в восстановленной форме — в типичном случае 5-метил-ТГФ [2]. В контексте злокачественных новообразований определение лимитирующих стадий фолатного метаболизма может дать понимание контроля пролиферации опухолевых клеток в зависимости от физиологических источников фолатов, а также помочь объяснить далекий от идеала ответ на противофолатную терапию в клинических условиях и предложить подходы для преодоления этого ограничения.
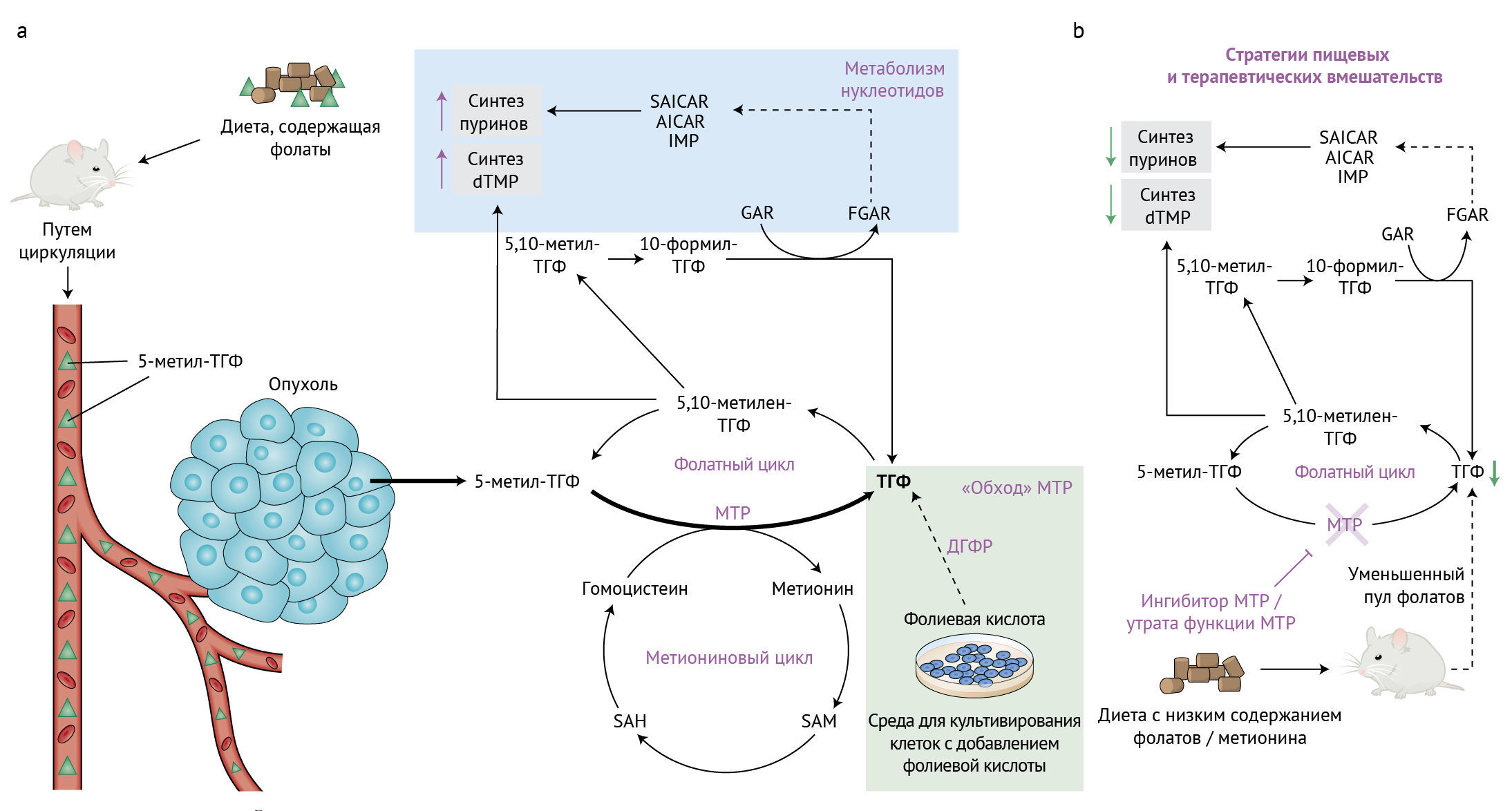
b. Диета с низким содержанием фолатов и метионина в комбинации с ингибированием МТР потенциально может снижать доступность пула ТГФ, что приводит к более серьезному нарушению синтеза нуклеотидов.
ТГФ — тетрагидрофолат; MTР — 5-метилтетрагидрофолаттрансфераза; SAICAR — N-сукцинил-5-аминоимидазол; AICAR — 5-аминоимидазол-4-карбоксамидрибонуклеотид; IMP — инозинмонофосфат; FGAR — формилглицинамидрибонуклеотид; GAR — глицинамидрибонуклеазы; SAM — S-аденозилметионин; SAH — S-аденозилгомоцистеин.
В этом выпуске Nature Metabolism пара исследований — Ванга с соавт. [3] и Салливана с соавт. [4] — сходятся на важности активности метионинсинтазы в условиях физиологических концентраций фолатов для роста опухоли путем поддержания пулов ТГФ в опухолевых клетках. Синтез ТГФ сопряжен с метиониновым циклом, в котором МТР катализирует перенос метильной группы от 5-метил-ТГФ на гомоцистеин (рис. 1). Это приводит к регенерации метионина и образованию ТГФ. Из метионина синтезируется 5-аденозилметионин, который служит ключевым субстратом для клеточных реакций метилирования, регулирующих эпигенетические процессы в злокачественных новообразованиях. Так или иначе, вопрос о том, зависит ли ток метионина от метионинсинтазы или служит для пополнения пула ТГФ, остается спорным. Чтобы в физиологических условиях оценить вклад метионина в реметилирование от гомоцистеина, Ванг с соавт. провели изящную серию экспериментов по отслеживанию потоков с помощью [U-13C]-меченого метионина в культуре клеток и в тканях мышей с аллотрансплнтантом аденокарциномы протоков поджелудочной железы после инфузии [U-13C]-метионина. Реметилированный метионин, синтезированный МТР, составлял лишь около 3 % общего клеточного пула метионина in vitro и приблизительно 10 % — в опухолях, тканях (кроме печени) и сыворотке, указывая таким образом, что роль МТР в поддержании пула метионина ограничена.
Чтобы исследовать физиологическую роль метионинсинтазы, авторы осуществили генетическую делецию MTR (ΔMTR) в клетках колоректального рака, рака печени и поджелудочной железы, после чего измерили их пролиферацию в присутствии либо 5-метил-ТГФ, либо фолиевой кислоты, обычно добавляемой в среду для культивирования клеток. Действительно, в присутствии только 5-метил-ТГФ пролиферативная способность клеток ΔMTR была ограничена в силу невозможности синтезировать ТГФ. Однако при добавлении фолиевой кислоты раковые клетки смогли обойтись без МТР, и их пролиферация восстанавливалась. У животных, у которых 5-метил-ТГФ представляет собой преобладающий вид фолатов, рост опухолей с ΔMTR подавился. Метаболомический анализ выявил повышенные уровни 5-метил-ТГФ, сопряженные с истощением других форм фолатов, таких как 5,10-метилен-TГФ и 10-формил-ТГФ, что напоминает явление, известное как «улавливание метила» и возникающее вследствие потери активности МТР. Сходный феномен был описан у лиц с мутацией гена MTR, результатом которой стало заболевание, называемое дефицитом метилкобаламина G типа [5]. В подтверждение «улавливания метила» Ванг с соавт. показали, что утрата МТР сопровождается накоплением интермедиатов синтеза пуринов и пиримидина с соответсвующим снижением уровня этих типов нуклеотидов. Рост опухоли можно восстановить путем добавления лейковорина (фолиниевой кислоты), — лекарственного препарата, одобренного для лечения фолатного дефицита, — что указывает на важный вклад метионинсинтазы в фолатный обмен.
Независимо от этих исследователей Салливан с соавт. заметили, что стандартные условия культивирования клеток включают фолиевую кислоту, которая для большинства тканей не является физиологическим источником. С точки зрения противофолатной терапии опухолей это может ограничивать интерпретацию ответа на терапию или маскировать влияние ферментов фолатного цикла, выполняющих ключевые физиологические функции in vivo. Говоря о недооцененный важности метионинсинтазы, связывающей фолатный и метиониновый циклы, авторы оспаривают роль 5-метил-ТГФ в качестве важного источника фолата в опухолях, который восполняет основной пул ТГФ. Экспериментальные культуральные условия, в которых добавление фолиевой кислоты позволяет синтезировать ТГФ с помощью ДГФР, искусственно снимают существенную в прочих случаях потребность в функции МТР. Клетки карциномы легкого ΔMTR оказались неспособны расти в присутствии 5-метил-ТГФ, но восстанавливали возможность пролиферировать при добавлении фолиевой кислоты, что согласуется с результатами Ванга с соавт. Уровень нуклеотидов аденозина и гуанозина в клетках ΔMTR, культивируемых в присутствии 5-метил-ТГФ, были значительно снижены по сравнению с таковыми у клеток, растущих в присутствии фолиевой кислоты. В серии экспериментов по спасению метаболитов добавление предшественников спасения пиримидинов (уридина и тимидина) и предшественника спасения пуринов (гипоксантина) обладало способностью восстанавливать рост клеток ΔMTR в присутствии 5-метил-ТГФ. Такое восстановление, тем не менее, оказалось короткоживущим, поскольку в одиночку гипоксантин не мог полностью восстановить синтез дТМФ в силу истощения общего пула предшественников фолатов. Эти результаты подчеркивают важность МТР для синтеза нуклеотидов de novo в опухолевых клетках.
ДГФР служит мишенью для химиотерапевтического агента метотрексата. Многие биологические исследования, выполненные на культурах клеток, показали, что метотрексат подавляет рост опухолевых клеток. Тем не менее, в клинических условиях его эффективности может препятствовать дефицит ответа на терапию или приобретение устойчивости [6]. Это поднимает вопросы о физиологическом источнике фолатов, восполняющем пул ТГФ и таким образом участвующем в выработке антифолатной резистентности in vivo. Если фолиевая кислота является важным источником фолатов в культуре клеток, метотрексат должен воздействовать на культивируемые клетки опухоли путем уменьшения пула ТГФ. Чтобы это выяснить, Салливан с соавт. применили объединенный анализ пролиферации с 489 штрихкодированными линиями опухолевых клеток человека (названный PRISM) [7] и продемонстрировали, что большинство линий опухолевых клеток обладает пролиферативной способностью в среде с фолиевой кислотой или с 5-метил-ТГФ вне зависимости от различий в уровне экспрессии МТР. Однако примечательно, что на уровне популяции или в ответ на терапевтический стресс клетки различных типов опухолей действительно более устойчивы к метотрексату, если они культивируются с 5-метил-ТГФ; это снова подчеркивает обширный вклад метионинсинтазы в метаболизм различных опухолей. Отчасти удивительно, что разница в экспрессии гена МТР не дает возможности предсказать ответ на метотрексат. Достаточно вероятно, что ток фолатного цикла определяется активностью МТР или других ферментов, включая те, что работают в метиониновом цикле. Такие результаты заставляют более настороженно относиться к исследованиям, в которых чувствительность к метотрексату интерпретируется только на основании данных по клеточным культурам, где клетки обычно выращиваются в присутствии фолиевой кислоты, ослабляющей их физиологическую потребность в метионинсинтазе.
Питание связано с развитием злокачественных новообразований. Корреляции подтверждаются множеством данных, но причинно-следственные механистические связи между рационом и метаболизмом опухолей часто трудно установить. Например, в исследованиях, направленных на определение роли кетогенной диеты для развития опухолей, часто получаются противоречивые результаты относительно ее канцерогенных или же противоопухолевых эффектов [8]. Изменения в составе рациона изменяют метаболизм всего тела. Системная доступность питательных веществ, в свою очередь, влияет на уровни метаболитов в опухолевом микроокружении. Ранее на основе рандомизированного клинического испытания было предположено, что высокий уровень фолатов в крови связан с повышенным риском рака предстательной железы [9]. Парадоксально, что в других эпидемиологических исследованиях сообщалось об обратном соотношении между употреблением фолатов и риском развития рака [10]. Неубедительные заключения о том, как фолаты влияют на возникновение и прогрессию злокачественной опухоли, подчеркнули необходимость более аккуратно исследовать вклад ферментов одноуглеродного метаболизма в контексте рака. Чтобы очертить влияние поступающего с пищей фолата и роль МТР в туморогенезе, Салливан с соавт. помещали мышей с ксентотрансплантатом опухоли на диету, в которой уровень фолиевой кислоты соответствовал таковому в типичном рационе человека. На физиологическом уровне «базового» содержания фолиевой кислоты хватало для роста опухолевых клеток дикого типа, но оно не смогло обеспечить туморогенез в соответствующих клетках ΔMTR. Тем не менее, примечательно, что повышение уровня циркулирующей фолиевой кислоты у мышей путем ее добавления в питьевую воду восстанавливало способность опухолей ΔMTR к росту. Это наблюдение поддерживает представление о том, что фолиевая кислота может, минуя активность метионинсинтазы, вносить прямой вклад в пул ТГФ, который затем используется для синтеза нуклеотидов (рис. 1).
Определение того, как изменения рациона могут влиять на метаболические пути для контроля прогрессирования заболеваний или улучшения терапевтического ответа — область с нереализованным потенциалом. Диета ограничением по метионину ингибирует синтез метионина de novo и, как считается, снижает активность метионинсинтазы; это повышает чувствительность мышиных моделей саркомы к облучению путем разобщения потока одноуглеродного и нуклеотидного обмена [11]. Обсуждается эффективность подобного ограничения по метионину по отношению к стволовым клеткам опухолей с зависимостью от экзогенного метионина [12]. Ключевые результаты Салливана с соавт. предполагают пользу ингибирования метионинсинтазы, для которой высокоспецифичный ингибитор еще не доступен. Сам по себе этот подход может не быть панацеей, поскольку потребляемая с пищей фолиевая кислота все еще может обеспечивать пул ТГФ для биосинтеза нуклеотидов de novo. Изменения рациона, такие как диета с низким содержанием фолатов или использование ингибитора ДГФР в комбинации с ингибированием МТР, потенциально могут обладать более мощной противоопухолевой активностью. Это подчеркивает необходимость разработать ингибиторы МТР, которые можно будет применять в клинике даже несмотря на то, что, как отмечают авторы данной статьи, некоторые из таких соединений были описаны ранее [13, 14]. В то время как диета с ограничением по метионину для людей достижима [11], на сегодняшний день мало данных, позволяющих предположить возможность реализации долгосрочной диеты с ограничением по фолатам. Поскольку ограничение по метионину сходным образом влияет на пути одноуглеродного и нуклеотидного метаболизма, можно быть уверенными в том, что будут проводиться дальнейшие исследования синергичного действия ограничения потребления метионина с пищей и ингибиторов МТР.
Результаты, полученные обеими группами исследователей, говорят о роли метионинсинтазы в качестве центрального регулятора смежных фолатного и метионинового циклов в контексте биологии опухолей наряду с опосредованием множественных эффектов по отношению к биодоступности различных предшественников нуклеотидов и аминокислот, используемых в биосинтетических путях. Тем не менее, механизм, с помощью которого МТР сильнее влияет на синтез пуринов по сравнению с тимидином, остается неясным. Ванг с соавт. отмечают истощение 5,10-метилен-ТГФ — предшественника для синтеза тимидина — при делеции MTR, однако в таких клетках уровень тимидина сохраняется. Напротив, синтез пуринов значительно ослабляется, даже несмотря на то, что содержание предшественника пуринов, 10-формил-ТГФ, уменьшается умеренно. Это поднимает вопрос о том, может ли накопление 5-метил-ТНФ оказывать более обширное влияние на метаболизм нуклеотидов, чем считается на данный момент. Она из возможностей включает ингибирование AICAR-трансформилазы, необходимой для превращения AICAR (5-аминоимидазол -4-карбоксамидрибонуклеотида) в FAICAR (5-формамидоимидазол-4-карбоксамидрибонуклеотид), и наконец, в инозинмонофосфат для синтеза пуринов вследствие накопления 5-метил-ТГФ [15]. Более полное понимание того, как 5-метил-ТГФ, обладающий структурным сходством с другими видами фолатов, проявляет свое ингибиторное действие, может помочь находить новые мишени в обмене нуклеотидов.
Аккуратное рассмотрение физиологического контекста доступности разных типов фолатов подорвало представление о метионинсинтазе как о центральном ферменте фолатного цикла для поддержания пула ТГФ в опухолях. Помимо потенциального значения в качестве мишени для лекарственного воздействия, новые данные открывают путь для разработки инновационных подходов к лечению злокачественных заболеваний, включающих регуляцию рациона совместно с противофолатной терапией, результатом которой может стать более продолжительный терапевтический ответ.
