Молекулярные механизмы взаимосвязи почек с другими органами
Взаимодействия между органами и тканями играют ключевую роль для поддержания гомеостаза в организме, однако они могут способствовать и развитию полиорганной недостаточности. Клинические данные говорят о том, что дисфункция почек участвует в нарушении функций отдаленных органов, однако об основных механизмах этого явления мало что известно. В нескольких работах, опубликованных в 2022 году, определены критические медиаторы взаимодействия почек с отдаленными органами.
▶ Читайте также: Роль почек в гомеостазе глюкозы
Известно, что нарушение функции почек влияет на гомеостаз отдаленных органов и наоборот. Однако из-за сложности проведения анализа при прогрессировании полиорганной недостаточности медиаторы взаимодействия между органами в значительной степени неизвестны.
Острая почечная недостаточность (ОПН) может вызывать вторичные осложнения в других органах — например, острое повреждение легких (ОПЛ). В ключевом исследовании, проведенном в 2022 году, изучался механизм взаимодействия между почками и легкими [1]. Авторы показали, что у мышей с двусторонним ишемически-реперфузионным повреждением (ИРП) почек наблюдалось воспаление легких с увеличением толщины стенки альвеол и накоплением иммунных клеток. Авторы провели секвенирование РНК одиночных клеток почек и легких этих мышей, а затем проанализировали образование пар «лиганд — рецептор». В результате было обнаружено, что остеопонтин, выделяемый поврежденными клетками почечных канальцев, может оказывать влияние на клетки легких во время развития ОПН-ОПЛ (рис. 1). Развитие ОПЛ после двусторонней ИРП почек можно предотвратить путем фармакологического или генетического ингибирования остеопонтина. Более того, трансплантация поврежденных почек повышала концентрацию остеопонтина в сыворотке и индуцировала ОПЛ у мышей-реципиентов. Это демонстрирует, что остеопонтин, выделяющийся из поврежденных почек, является ключевой молекулой в развитии ОПН-ОПЛ.
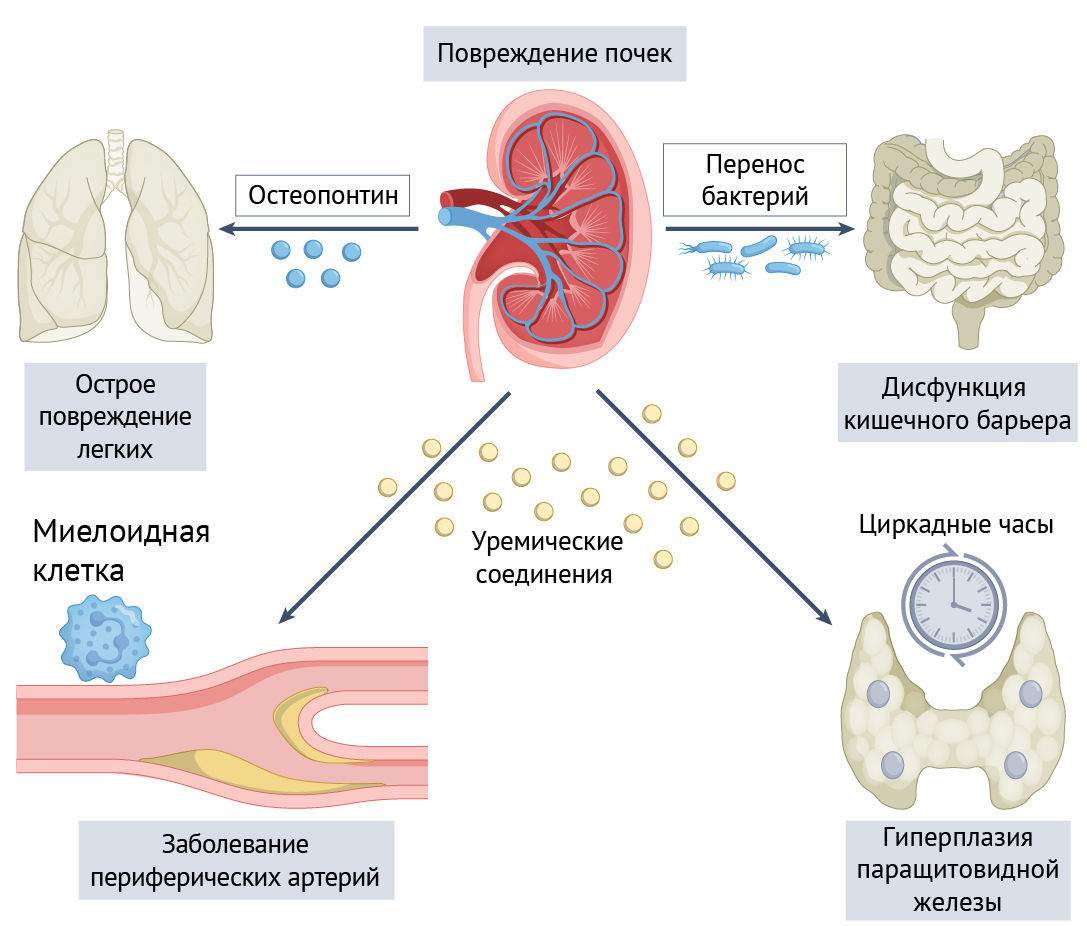
У пациентов с хронической болезнью почек (ХБП) часто развиваются сосудистые осложнения, как например, атеросклероз и последующее заболевание периферических артерий (ЗПА). В двух ключевых исследованиях, проведенных в 2022 году, изучались различные механизмы взаимодействия почек и сосудов. Хьюсинг с соавт. [2] исследовали атеросклеротические поражения и воспаление у мышей с дефицитом рецепторов липопротеинов низкой плотности (ЛПНП) (животных кормили пищей с высоким содержанием жиров). Они обнаружили, что атеросклеротические поражения аорты оказались в значительной степени более выраженными у мышей, перенесших одностороннее ИРП почек, чем у мышей из контрольной группы. Как в аорте с атеросклеротическими изменениями, так и в почке после ишемического повреждения параллельно выявлялось повышение содержания растворимых медиаторов воспаления, таких как хемокин CCL2 (от англ. C–C motif ligand 2). Секвенирование РНК одиночных клеток постишемической почки показало, что миелоидные клетки, экспрессирующие CCR2 (рецептор C–C-хемокинов 2), играют критически важную роль в синтезе растворимых медиаторов воспаления (рис. 1). Пересадка костного мозга с дефицитом CCR2 устраняла избыточное образование атеросклеротических бляшек в аорте после одностороннего ИРП почек, а также уменьшала степень воспалительных процессов в почках и аорте по сравнению с контрольной группой. Таким образом, сигналинг CCR2 в клетках миелоидного ряда опосредует прогрессирование атеросклероза после ОПН. Также известно, что миелоидные клетки участвуют во взаимодействии между почками и нервами посредством рецепторов нейромедиаторов на клеточной поверхности. Например, миелоидные клетки, экспрессирующие субъединицу α7 никотинового рецептора ацетилхолина или β2-адренорецептора, воспринимают нейромедиаторы от вегетативных нервов, и этот противовоспалительный сигнальный путь снижает степень выраженности ОПН [6]. Таким образом, сигнальные механизмы, опосредованные миелоидными клетками, являются важным звеном взаимодействия органов, а также потенциальной терапевтической мишенью.
В другом ключевом исследовании [3] изучались взаимодействия между почками и сосудами, осуществляемые посредством уремических соединений, которые накапливаются при ХБП. Хотя в ходе предыдущих исследований и было показано, что уремические соединения, представляющие собой производные триптофана, такие как индоксилсульфат и кинуренин, токсичны для эндотелиальных клеток [7], роль этих веществ в прогрессировании сосудистых заболеваний in vivo остается неясной. В 2022 году Аринзе с соавт. продемонстрировали, что метаболиты триптофана подавляют эндотелиальный Wnt-сигналинг, усиливая протеасомную деградацию β-катенина с участием арилуглеводородного рецептора (AHR) [3] (рис. 1). Модель ХБП у мышей с ишемией задних конечностей продемонстрировала снижение экспрессии β-катенина в капиллярах и уменьшение плотности капилляров, что было связано с повышением содержания метаболита триптофана в крови и активацией AHR в эндотелиальных клетках. Примечательно, что ингибирование AHR приводило к восстановлению постишемических ангиогенных реакций у мышей с ХБП. Кроме того, в когорте пациентов с ЗПА концентрации метаболитов триптофана в плазме оказались связаны с развитием будущих неблагоприятных эффектов, затрагивающих конечности. Согласно этим данным, падение уровня метаболита триптофана или ингибирование AHR может служить терапевтической стратегией для защиты от прогрессирования ЗПА у пациентов с ХБП.
Хотя дисбиоз кишечника и нарушение барьерной функции связаны со многими воспалительными и метаболическими заболеваниями, взаимодействие между почками и кишечником до конца не изучено. В ключевом исследовании, проведенном в 2022 году, авторы определяли роль взаимодействия между почками и кишечником в развитии диабетической нефропатии [4]. Линх с соавт. обнаружили, что в мышиной модели сахарного диабета делеция митохондриального противовирусного сигнального белка, важного регулятора кишечной проницаемости, усугубляла дисфункцию кишечного барьера и позволяла Klebsiella oxytoca и интерлейкину (IL)-17 переноситься из кишечника в кровь [4]. Такой перенос ускорял развитие повреждения почек отчасти за счет повышения уровня циркулирующего IL-17, что указывает на тесную связь между кишечной средой и прогрессированием диабетического заболевания почек (рис. 1). В предыдущем исследовании, проведенном в 2020 году, сообщалось, что ОПН вызывает дисбактериоз и воспаление кишечника, а также дисфункцию кишечного барьера в совокупности с бактериальной транслокацией [8]. Эти результаты указывают на двунаправленную связь между прогрессированием заболевания почек и дисфункцией кишечника. Поскольку среда внутри кишечника человека различается в зависимости от образа жизни и пищевых привычек, перенос этих выводов из исследований на животных в клиническую практику затруднительна. Однако определение точных механизмов взаимодействия между почками и кишечником в будущем может привести к разработке новых терапевтических средств.
Биологические (циркадные) часы млекопитающих регулируют поведение, физиологию и обмен веществ; в недавних исследованиях удалось выявить роль циркадных ритмов в развитии заболеваний почек и их осложнений. Например, работа центральных циркадных часов в супрахиазматическом ядре гипоталамуса нарушается в модели индуцированной аденином ХБП у мышей. Это приводит к ослаблению циркадных колебаний в периферических органах, таких как почки, печень и поднижнечелюстные железы [9]. Генетическое нарушение циркадных ритмов ускоряет прогрессирование ХБП у мышей, получавших аденин, что указывает на критическую роль циркадных часов в развитии заболевания почек [9]. Более того, нефрэктомия с удалением ⅚ почки изменяет экспрессию моноцитарных генов, связанных с циркадными ритмами, за счет повышения уровня ретинола и связывающего его белка в сыворотке крови, что ускоряет воспаление и фиброз сердечной мышечной ткани [10].
В ключевом исследовании, проведенном в 2022 году, изучалась роль периферических циркадных часов в развитии гиперплазии паращитовидной железы при ХБП [5]. Пролиферация клеток паращитовидной железы является осложнением ХБП, которое приводит к автономной секреции паратиреоидного гормона и повышает смертность. Эгстранд с соавт. проанализировали транскриптом паращитовидных желез мыши за 24 часа и обнаружили циркадную ритмичность в экспрессии многих сигнатурных генов паращитовидных желез [5]. После трех недель введения аденина у мышей со специфичным для паращитовидных желез нарушением циркадных ритмов наблюдалась более выраженная пролиферация ткани паращитовидных желез, чем у контрольной группы дикого типа. Это указывает на защитную роль периферического циркадианного ритма в поддержании гомеостаза паращитовидных желез в условиях уремии (рис. 1).
Таким образом, в 2022 году было идентифицировано несколько молекулярных механизмов и критических медиаторов взаимодействия почек с отдаленными органами. Авторы выражают надежду, что эти открытия и будущие достижения приведут к разработке новых терапевтических средств, нацеленных на такие механизмы.
