Живой щит: как микробиом влияет на кожные заболевания

Для некоторых обывателей это может прозвучать странно, однако любой человек с медицинским образованием знает, что кожа — это орган, состоящий из разных типов тканей, содержащий в себе различные добавочные структуры (придатки кожи) и представляющий собой особую экосистему.
Вспомним строение кожи
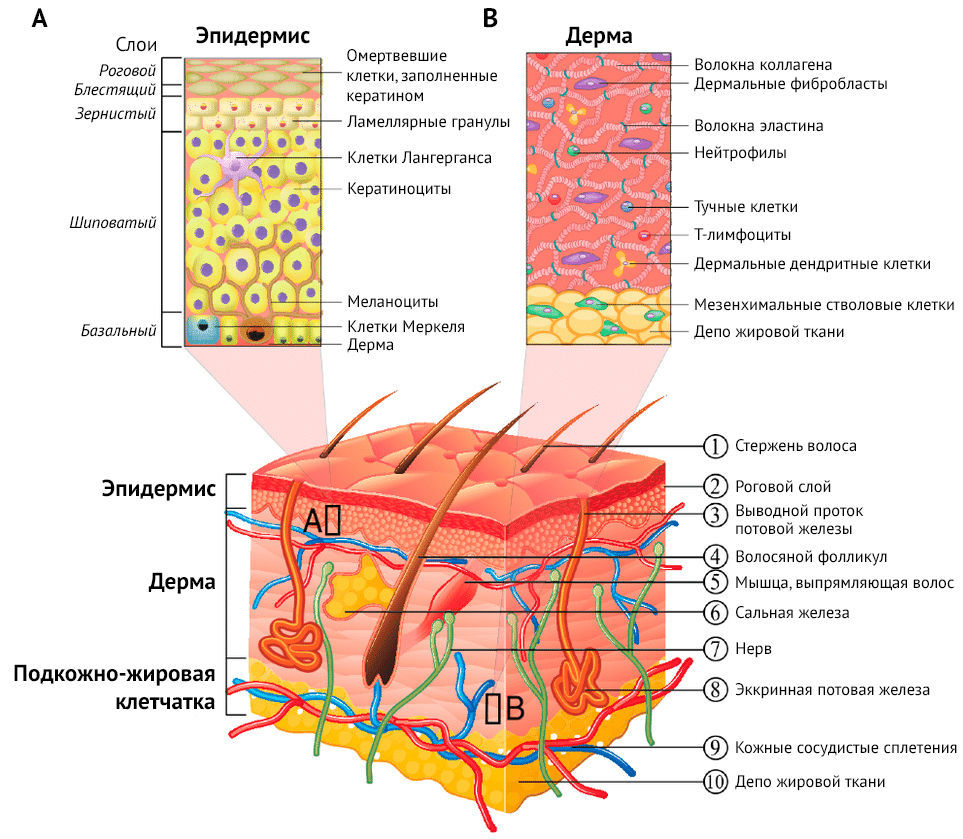
Рисунок 1 | Строение кожи
Кожа состоит из трех слоев — эпидермиса, дермы и гиподермы. Верхний слой, эпидермис, представлен многослойным плоским ороговевающим эпителием, который состоит из пяти слоев:
- базального;
- шиповатого;
- зернистого;
- блестящего (отсутствует на участках c тонкой кожей);
- рогового.
Дерма состоит из соединительной ткани и включает два слоя: сосочковый и сетчатый. Наконец, гиподерма — это самый глубокий слой, состоит из жировой ткани c прослойками рыхлой волокнистой соединительной ткани.
Есть у кожи и собственные добавочные структуры, или придатки кожи:
- сальные и потовые железы;
- волосы;
- ногти.
В коже находятся кровеносные и лимфатические сосуды, нервы и нервные окончания. Среди особых клеток, находящихся в коже, можно выделить меланоциты — пигментные отростчатые клетки, которые синтезируют меланин, а также клетки Лангерганса — антигенпрезентирующие клетки, которые осуществляют процессинг антигенов, предоставляют информацию о них лимфоцитам, приводя, если потребуется, к развитию иммунного ответа.
На различных участках тела кожа обладает разнообразной микросредой, которая отличается по реакции на ультрафиолетовое излучение, pH, восприятию температуры, влажности, интенсивности выделения себума (кожного сала) и топографии [2]. На основании этих характеристик все тело можно подразделить на условные категории:
- жирная (кожа лица, груди и спины);
- влажная кожа (сгиб локтя, тыльная сторона колена и пах);
- сухая (ладонной поверхности предплечья и ладони).
На характерные свойства этих участков влияет интенсивность работы потовых и сальных желез, a также наличие и количество волосяных фолликулов. Более многочисленные на влажных участках, потовые железы играют важную роль в терморегуляции за счет испарения воды. Сальные железы, связанные с волосяными фолликулами и более плотно расположенные на жирных участках кожи, выделяют богатое липидами кожное сало — гидрофобное вещество, которое создает «антибактериальный щит» против патогенных микроорганизмов.
Микробиом кожи: мы не одиноки!
Микробиом (также микрофлора, микробиота) кожи играет важную роль в защите от патогенов, работе местного иммунитета и метаболизме [3–5].
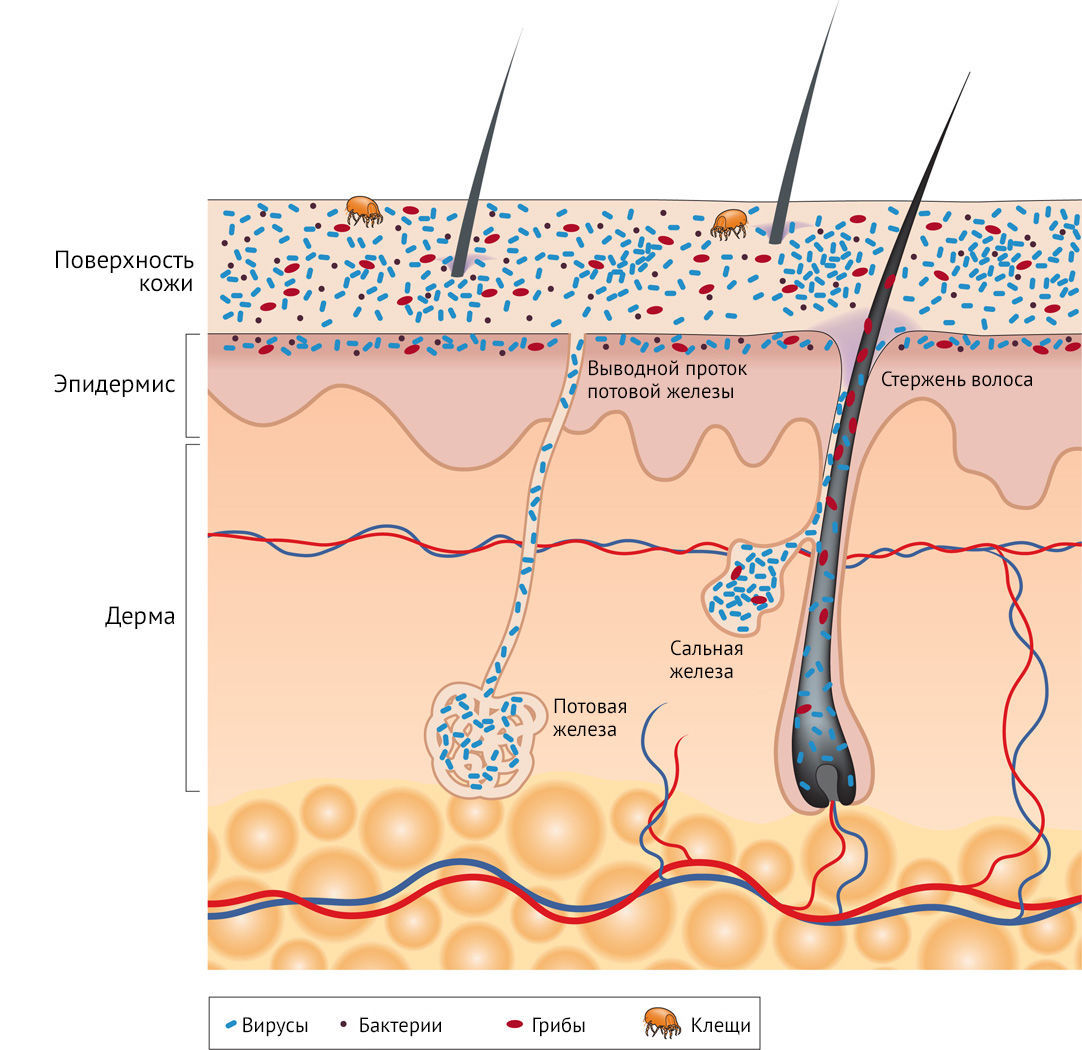
Рисунок 2 | Расположение микроорганизмов в различных слоях кожи
Будучи самым большим органом человеческого тела, кожа населена огромным количеством разнообразных, но, как правило, безвредных (зачастую даже полезных) микроорганизмов.
Традиционно микробиом кожи исследуют культуральными методами. Поскольку этот подход отбирает микроорганизмы, которые хорошо растут в искусственных средах, он не позволяет в полной мере представить общее разнообразие этой экосистемы. Например, эпидермальный стафилококк (Staphylococcus epidermidis) культивируется легче, чем пропионибактерии или коринебактерии, популяция которых часто недооценивалась в культуральных исследованиях [6]. Чтобы повысить качество исследований и зафиксировать полное разнообразие микробиома, ученые стали отходить от культурального метода и начали применять методы секвенирования.
Чем представлена кожная микрофлора?
В зависимости от метода, который используют для взятия образцов микробиоты кожи (мазок, биопсия участка кожи, соскоб с поверхности и т. д.), в биоматериал попадают микроорганизмы, находящиеся на разной глубине кожи или в ее разных частях [7,8]. Несмотря на то, что большинство основных таксонов бактерий идентифицируются одинаково, независимо от метода отбора проб [7], некоторые микроорганизмы в разной степени представлены в различных слоях кожи [9,10]. Вирусы, бактерии, грибы и клещи покрывают поверхность кожи и живут глубоко в ее придатках — волосяных фолликулах. На поверхности кожи, палочки и кокки, такие как Proteobacteria и Staphylococcus spp. соответственно, образуют сообщества, которые тесно переплетаются между собой и другими микроорганизмами. Грибы-комменсалы, такие как Malassezia spp. растут как в виде ветвящихся нитевидных гиф, так и в виде отдельных клеток. Вирусные частицы находятся в коже как свободно, так и в составе бактериальных клеток. Кожные клещи, например, Demodex folliculorum и Demodex brevis, являются одними из самых мелких членистоногих и живут в волосяных фолликулах [11,12].
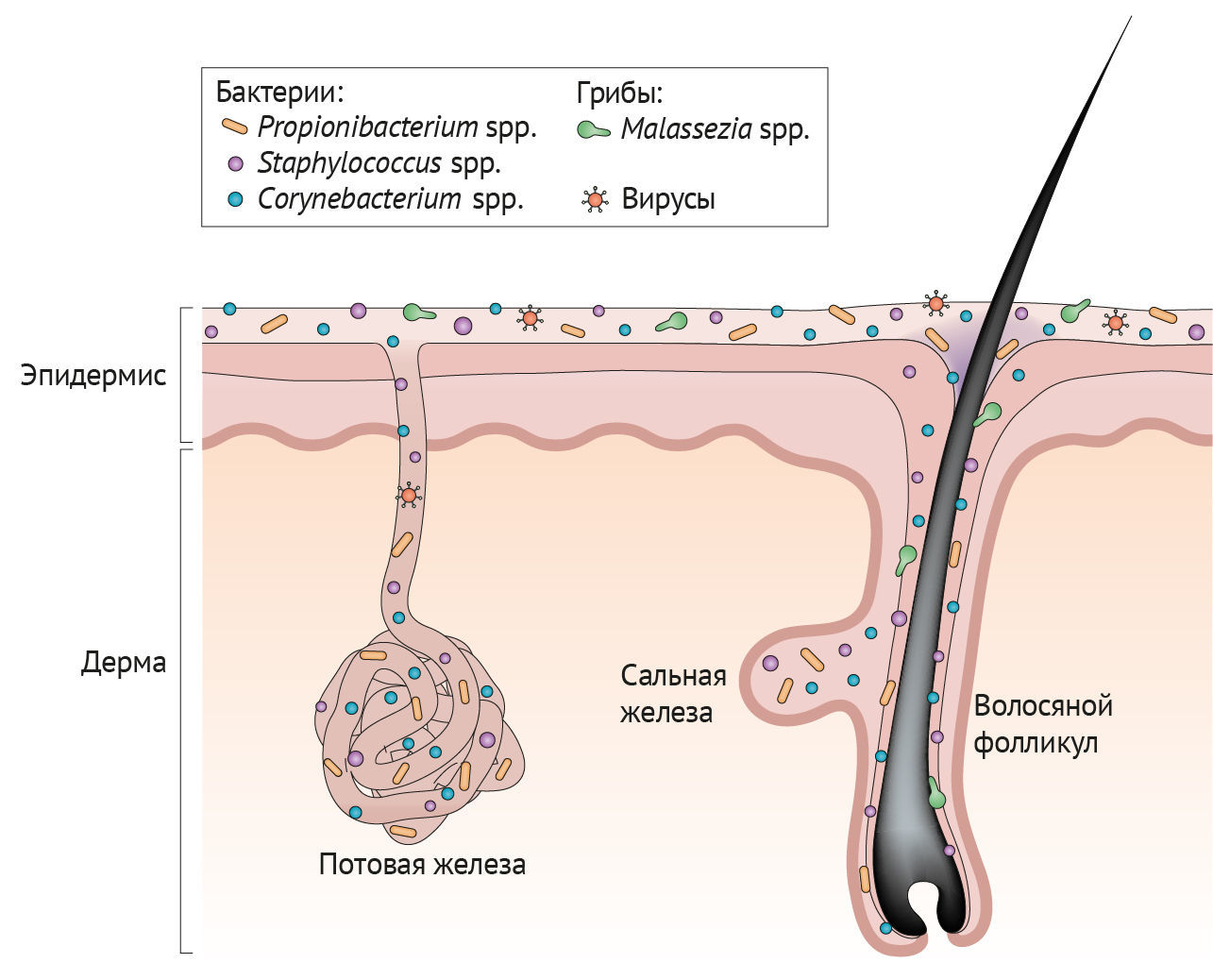
Рисунок 3 | Микроорганизмы, населяющие различные слои кожи
Что влияет на состав микробиома?
Физические и химические особенности кожи обусловливают уникальный состав микроорганизмов, адаптированных к той нише, которую они занимают. В целом некоторые микроорганизмы предпочитают заселяться в определенных местах, в зависимости от толщины кожи, наличия кожных складок, a также от количества волосяных фолликулов и желез [13]. Сальные железы связаны с волосяными фолликулами и выделяют себум (жир, кожное сало). Себум — это гидрофобное вещество, которое защищает и смазывает кожу, обеспечивает антибактериальную защиту, но в то же время стимулирует размножение Cutibacterium acnes — распространенных кожных комменсальных бактерий, ответственных за развитие акне [14]. Полное секвенирование генома C. acnes выявило множественные гены, кодирующие липазы, которые расщепляют липиды кожного сала. Размножение многих распространенных патогенов, таких как золотистый стафилококк (Staphylococcus aureus) и пиогенный стрептококк (Streptococcus pyogenes), ингибируются кислым pH, что способствует росту коагулазонегативных стафилококков и коринебактерий [15]. Известно, что окклюзия кожи (замедление испарения влаги с ее поверхности) приводит к повышению pH, что способствует росту S. aureus и S. pyogenes. Поскольку организм человека производят гораздо большее количество триглицеридсодержащего кожного сала, чем другие млекопитающие, логично, что C. acnes присутствует на нашей коже больше, чем у кого-либо еще [16].
Как мы уже отметили в начале обзора, кожа на разных участках тела имеет свои особенности, связанные c влажностью, количеством волосяных фолликулов, сальных и потовых желез, c наличием складок и т. д. Некоторые участки кожи большую часть времени частично окклюзированы — испарение влаги из-за соприкосновения с другими участками тела может замедляться, например, в паховой области, подмышечных впадинах и в межпальцевых промежутках. По данным культуральных исследований, установлено, что состав микрофлоры в этих участках кожи различен. В условиях повышенной температуры и влажности, характерных для этих частей тела, интенсивно размножаются грамотрицательные бактерии, стафилококки и коринебактерии, которые были преимущественно многочисленны во влажных областях, включая сгибы локтей и ступни. Плотность желез — еще один фактор, влияющий на микробиоту кожи в зависимости от части тела. В областях с высокой плотностью сальных желез, такими как грудь и спина, наблюдается рост липофильных микроорганизмов (например Propionibacterium spp. и Malassezia spp.). По сравнению с другими участками кожи, кожа рук и ног относительно сухая и испытывает на себе большие колебания температуры окружающей среды [17]. Используя все те же культуральные методы, было обнаружено, что на этих участках содержится меньше микроорганизмов, чем на более влажных участках поверхности кожи [18].
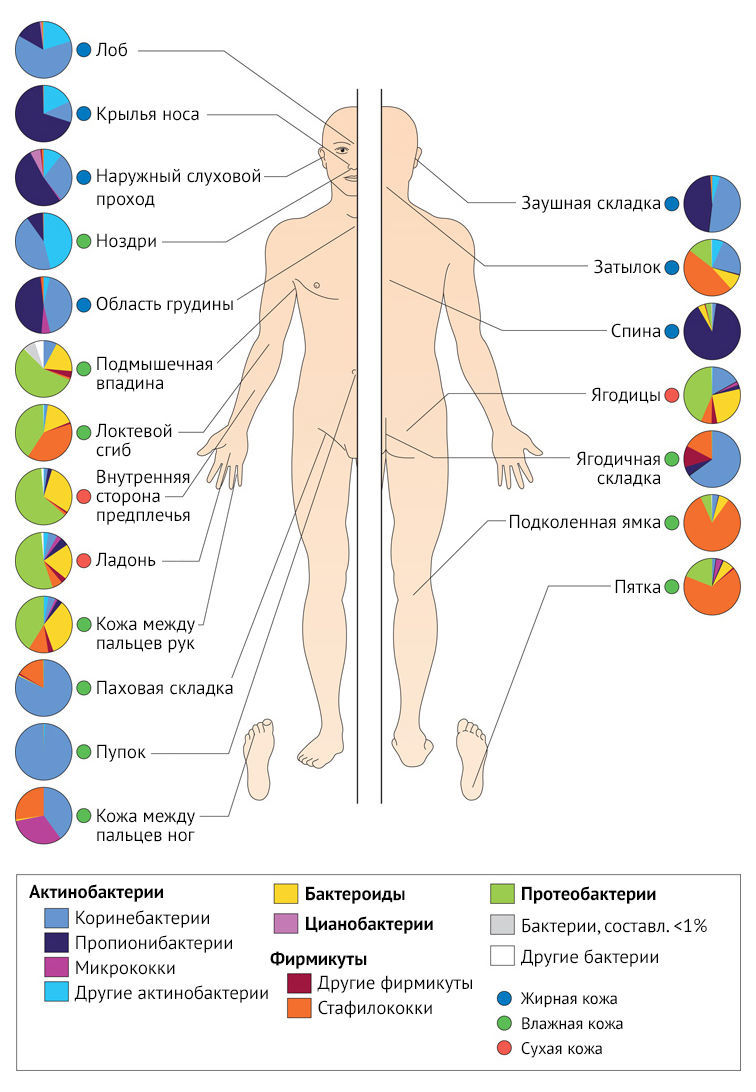
Рисунок 4 | Локальные особенности микробиома кожи [2]
Факторы, специфичные для конкретного человека, такие как возраст, место проживание и пол, также влияют на состав кожного микробиома. Возраст оказывает большое влияние на микроокружение кожи и, таким образом, на состав ее микрофлоры [19,20].
Внутриутробно кожные покровы плода стерильны, a у новорожденных начальная колонизация кожи микроорганизмами зависит от способа родоразрешения: младенцы, рожденные вагинальным путем, приобретают бактерии, которые колонизируют влагалище, тогда как рожденные с помощью кесарева сечения, приобретают микроорганизмы, которые связаны с кожей [21,22].
В период полового созревания изменения в выработке кожного сала пропорциональны количеству липофильных бактерий на коже [20]. Кожа после пубертата изобилует липофильными микроорганизмами, такими как Propionibacterium spp. и Corynebacterium spp. a также грибами Malassezia spp. [23]. Напротив, у детей препубертатного возраста наблюдается изобилие фирмикут (группы бактерий со строением клеточной стенки, характерным для грамположительных бактерий и низким содержанием нуклеотидов Г-Ц, например, Streptococcaceae spp.), Bacteroidetes и Proteobacteria (бета-протеобактерии и гамма-протеобактерии) и более разнообразное грибковое сообщество [24,25]. Остается неясным, приобретаются ли новые штаммы в период полового созревания или же меняется относительная распространенность существующих штаммов. В целом эти возрастные изменения микробиоты кожи интересны, поскольку многие кожные заболевания связаны с возрастом. Например, случаи атопического дерматита, вызванного стафилококками, уменьшаются у большинства детей до полового созревания, тогда как отрубевидный лишай, связанный с Malassezia, чаще встречается у взрослых, чем у детей [26,27]. Также необходимы дальнейшие исследования для характеристики микробиоты кожи пожилых людей по мере изменения физиологии и предрасположенности к кожным инфекциям. Факторы окружающей среды, в которой пребывает отдельно взятый человек, такие как род занятий, выбор одежды, использование косметики или антибиотиков, могут модулировать состав кожной микробиоты [22,28]. Косметика, мыло, увлажняющие средства также являются потенциальными факторами, влияющими на изменение микробиоты кожи. Агрессивные очищающие средства, злоупотребление процедурами, применение неподходящей косметики может привести к дисбиозу кожи, который, в свою очередь может запустить «порочный круг» и усугубить уже имеющиеся заболевания. Для сохранения баланса микрофлоры кожи следует выбирать мягкое очищение, не нарушающее гидролипидную мантию эпидермиса. Это относится как к коже лица, так и тела.

Ряд исследований продемонстрировал, что высокие температура и влажность связаны с повышенным количеством бактерий на спине, в подмышечных впадинах и на ступнях по сравнению с условиями высокой температуры и низкой влажности [29]. В том же исследовании высокая влажность и низкие температуры были связаны с более высокой частотой присутствия грамотрицательных бактерий на спине и ступнях. Ультрафиолетовое излучение проявляет выраженные бактерицидные свойства, и можно представить себе географическую изменчивость микробиоты кожи, коррелирующую с теми или иными регионами проживания [30].
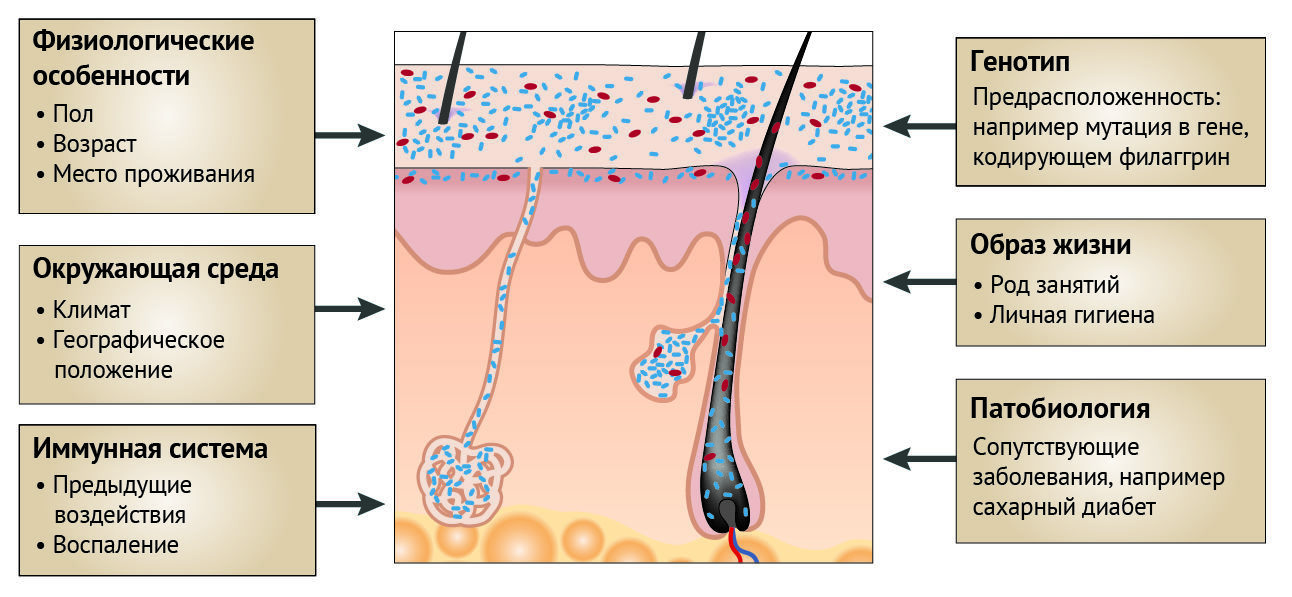
Рисунок 5 | Факторы, влияющие на микробиом кожи
Также существуют примеры взаимодействия кожных микроорганизмов друг c другом. Так, Corynebacterium accolens изменяет локальную среду кожи, подавляя рост Streptococcus pneumoniae [31]. Этот ответ объясняется тем, что C. accolens использует липазную активность белка LipS1 для высвобождения антибактериальных свободных жирных кислот из триацилглицеринов на поверхности кожи [32]. В другом исследовании анализ парного антагонизма проводили с изолятами из коллекций культур S. epidermidis и C. acnes. Ветвь C. acnes I-2 проявляла избирательно более высокую противомикробную активность против S. epidermidis, чем другие ветви С. acnes. И наоборот, большинство протестированных штаммов S. epidermidis были способны ингибировать рост C. acnes in vitro. Авторы этого исследования предположили ряд генетических особенностей, которые могут быть ответственны за этот фенотип у разных штаммов [33].
Микробиом кожи и кожные заболевания
В ходе многочисленных и сложных взаимодействий c организмом, окружающей средой и друг другом, представители кожного микробиома формируют резидентную флору и предотвращают колонизацию кожных покровов патогенными бактериями. Однако в определенных условиях микроорганизмы, которые обычно полезны для человека, могут стать патогенными. Многие распространенные кожные заболевания связаны с изменениями в микробиоте, которые носят название дисбиоз, который может приводить к возникновению акне, себорейному и атопическому дерматитам, вызывать хронические раны и другие заболевания [34]. Рассмотрим эти состояния подробнее.
Акне
Акне (acne vulgaris) — распространенное хроническое воспалительное заболевание кожи, часто дебютирующее в подростковом возрасте, связано с бактерией C. acnes — наиболее распространенным микроорганизмом в микробиоте здоровых взрослых [35]. Сально-волосяные фолликулы завершают свое формирование к моменту полового созревания и колонизируются липофильными микроорганизмами, особенно C. acnes, секретирующими липазы, протеазы и гиалуронидазы, которые повреждают тканевую выстилку волосяного фолликула и сальную железу [36]. Интересно, что на функциональном уровне профили экспрессии генов C. acnes различаются у людей с акне и у людей без акне [37]. Доказано, что кожа почти всех взрослых людей колонизирована C. acnes, но далеко не у всех есть акне, что подчеркивает важность изучения генетических особенностей организма-хозяина, дефектов иммунной или барьерной системы, микробиома и факторов окружающей среды [38]. Также с патофизиологией акне связана повышенная секреция кожного сала, поскольку скорость секреции коррелирует с тяжестью клинических симптомов. В исследовании с использованием флуоресцентной микроскопии для визуализации C. acnes было показано, что заболевание было в значительной степени связано с присутствием C. acnes в фолликулах и образованием ими биопленок [39]. Геном C. acnes кодирует различные иммуногенные факторы, в том числе белки клеточной поверхности с адгезивными свойствами и порфирины [40]. Кроме того, повреждение сально-волосяного фолликула, вызванное C. acnes, активирует классический и альтернативный пути комплемента и вызывает продукцию провоспалительных цитокинов и нейтрофильных хемотаксических факторов. C. acnes, принадлежащие к филогруппе типа 1A1, неизменно связаны с акне, что показано в исследованиях с использованием различных методов отбора проб и их анализа [41]. Штаммы в филогруппе типа 1А1 обладают повышенным воспалительным потенциалом, который, вероятно, обусловлен наличием факторов вирулентности, способствующих бактериальной адгезии и подавляющих иммунный ответ у организма-хозяина [42].
Атопический дерматит
Атопический дерматит (также известный как экзема) — хроническое рецидивирующее воспалительное заболевание с множеством этиологических факторов, включая нарушение эпидермального барьера, активацию иммунных клеток и изменения в сообществе ассоциированных кожных микроорганизмов. Атопический дерматит встречается у около 15 % детей и 2 % взрослых, причем его распространенность в промышленно развитых странах за последние три десятилетия выросла втрое без какой-либо понятной причины. Классический атопический дерматит возникает на локтевых сгибах и в подколенных ямках, где по сравнению с другими участками тела обитают сходные микроорганизмы [24]. Восприимчивость к атопическому дерматиту ассоциирована с мутациями в более чем 30 локусах, включая ген, кодирующий белок кожного барьера филаггрин, и гены, связанные с иммунной системой [43]. В дополнение к S. aureus, который обычно высевается с кожи людей с атопическим дерматитом, существуют дополнительные факторы, подтверждающие гипотезу о том, что микробиота играет важную роль в патогенезе заболевания [44]. Клинически атопический дерматит лечат смягчающими средствами, которые способствуют восстановлению гидролипидного барьера, и иммунодепрессантами, такими как топические кортикостероиды. В случаях персистирования инфекции предлагалось использовать антибактериальные препараты или лечебные ванны с гипохлоритом натрия. Было показано, что успех данных методов лечения коррелирует со снижением относительной численности S. aureus, однако их общая эффективность сомнительна [45,46]. В настоящее время многие исследования направлены на разработку новых методов лечения для замены используемых в настоящее время противомикробных препаратов широкого спектра действия.
Хроническая незаживающая рана
В дополнение к классическим кожным заболеваниям микроорганизмы, колонизирующие кожу, также влияют на заживление хронических ран, характерных для пожилых людей, страдающих диабетом или ожирением. Например, хорошо изучена роль микроорганизмов в патогенезе диабетических язв стопы. Это осложнение являются частым проявлением диабетической нейропатии и возникает у 15–25 % людей с диабетом [50], при этом в 15,6 % случаев пациентам требуется ампутация пораженной конечности [51]. Исследование показало, что бактериальные сообщества, колонизирующие диабетические язвы, коррелировали с теми или иными клиническими проявлениями. Например, неглубокие и относительно быстрозаживающие язвы были связаны с большей численностью Staphylococcus spp., особенно S. aureus, тогда как более глубокие и длительно заживающие язвы характеризовались большим микробным разнообразием и более высоким относительным содержанием анаэробных бактерий и грамотрицательных протеобактерий [52]. Кроме того, недостаточный контроль уровня глюкозы в крови был связан с увеличением количества Staphylococcus spp. и Streptococcus spp. в язвах [53]. В 80 % случаев в исследованных диабетических язвах стопы определялись грибы, при этом Cladosporium herbarum и Candida albicans были идентифицированы как наиболее распространенные виды. Хронические раны с неблагоприятным клиническим исходом отличались разнообразием грибов, часто обнаруживались полимикробные биопленки грибов и бактерий [54]. Тем не менее, особенности микробиома хронических незаживающих ран все еще остаются на стадии изучения.
Серая зона: кожные заболевания c невыясненной ролью микробиома
Уже упомянутые нами хронические диабетические язвы, a также пролежни, которые поражают малоподвижных пожилых и лежачих пациентов, — пример того, как взаимодействуют комменсальные микроорганизмы, которые становятся патогенными при нарушении целостности кожных покровов. Несмотря на то, что бактерии не являются первоначальной причиной кожного дефекта, или раны, считается, что они способствуют нарушению заживления и стойкому воспалению, которое возникает при хронических ранах. Молекулярные исследования до сих пор не смогли идентифицировать состав уникального микробиома, который колонизирует раны той же этиологии (например, диабетические язвы стопы или трофические язвы) [54]. Микробиом в хронических ранах отличается от ожоговых ран, в которых обычно легко определить возбудителя раневой инфекции. Ожоговые раны, как правило, инфицируются S. pyogenes, Enterococcus spp. или Pseudomonas aeruginosa, а также могут содержать грибы и/или вирусы [55].
Основная проблема при анализе данных о разнообразии микроорганизмов, которые населяют хронические раны — влияние факторов окружающей среды и генетических особенностей, которые могут исказить результаты, особенно когда отсутствуют точные данные клинического фенотипирования, которые можно было бы использовать для более точного распределения пациентов на группы.
Заключение
В данном обзоре мы рассмотрели роль микробиома кожи в норме и при различных заболеваниях. Однако остается много вопросов, касающихся функции микробиоты кожи: какую роль играют микроорганизмы в коже в поддержании здоровья или в развитии патологических состояний? Несмотря на общепринятое мнение, что микроорганизмы являются потенциальными виновниками многих кожных заболеваний, в том числе описанных здесь, мало что известно об их конкретном вкладе и о том, как он связан с генетическими и экологическими особенностями, которые также могут способствовать возникновению кожных заболеваний. Очевидно, что сохранение и баланс микробиома помогает поддерживать защитные функции кожи и позволяет ей самостоятельно бороться со многими состояниями, a дисбаланс микробиома может усугублять существующие проблемы. Помимо общих правил грамотного ухода за кожей, применение определенных компонентов также может помочь в восстановлении защитных свойств кожи, например, экстракт бактерий из термальной воды в составе компонента «Сфингобиома» или комплекс пребиотиков, сахаров, 5%-го пантенола и экстракта центеллы азиатской, известного своими уникальными восстанавливающими свойствами, входящих в состав компонента «Трибиома».
Многие распространенные состояния кожи связаны с определенным этапом жизни и/или определенными микроорганизмами. Также предстоит определить, обусловлена ли взаимосвязь c заболеваниями структурой эндогенного микробного сообщества. Еще один нерешенный вопрос — приносят ли облигатные кожные микроорганизмы пользу организму-хозяину, и являются ли они действительно симбиотическими или комменсальными? По мере того, как углубляются наши знания о микробиоте кожи, эти факторы и другие оставшиеся без ответа вопросы будут направлять будущие усилия исследователей на изучение сложных взаимодействий, регулирующих отношения между человеком и микроорганизмами, населяющими его кожные покровы.
Источники
- Massella, D.; Argenziano, M.; Ferri, A.; Guan, J.; Giraud, S.; Cavalli, R.; Barresi, A.A.; Salaün, F. Bio-Functional Textiles: Combining Pharmaceutical Nanocarriers with Fibrous Materials for Innovative Dermatological Therapies. Pharmaceutics 2019, 11, 403, doi:10.3390/pharmaceutics11080403.
- Grice, E.A.; Segre, J.A. The Skin Microbiome. Nat. Rev. Microbiol. 2011, 9, 244–253, doi:10.1038/nrmicro2537.
- Scharschmidt, T.C.; Fischbach, M.A. What Lives on Our Skin: Ecology, Genomics and Therapeutic Opportunities of the Skin Microbiome. Drug Discov. Today Dis. Mech. 2013, 10, e83–e89, doi:10.1016/j.ddmec.2012.12.003.
- The Intersection of Microbiome and Host at the Skin Interface: Genomic- and Metagenomic-Based Insights Available online: https://genome.cshlp.org/conte... (accessed on 28 December 2022).
- Dialogue between Skin Microbiota and Immunity | Science Available online: https://www.science.org/doi/10... (accessed on 28 December 2022).
- Kong, H.H.; Segre, J.A. Skin Microbiome: Looking Back to Move Forward. J. Invest. Dermatol. 2012, 132, 933–939, doi:10.1038/jid.2011.417.
- Whole Metagenome Profiling Reveals Skin Microbiome-Dependent Susceptibility to Atopic Dermatitis Flare | Nature Microbiology Available online: https://www.nature.com/article... (accessed on 28 December 2022).
- Kong, H.H.; Andersson, B.; Clavel, T.; Common, J.E.; Jackson, S.A.; Olson, N.D.; Segre, J.A.; Traidl-Hoffmann, C. Performing Skin Microbiome Research: A Method to the Madness. J. Invest. Dermatol. 2017, 137, 561–568, doi:10.1016/j.jid.2016.10.033.
- Nakatsuji, T.; Chiang, H.-I.; Jiang, S.B.; Nagarajan, H.; Zengler, K.; Gallo, R.L. The Microbiome Extends to Subepidermal Compartments of Normal Skin. Nat. Commun. 2013, 4, 1431, doi:10.1038/ncomms2441.
- Zeeuwen, P.L.; Boekhorst, J.; van den Bogaard, E.H.; de Koning, H.D.; van de Kerkhof, P.M.; Saulnier, D.M.; van Swam, I.I.; van Hijum, S.A.; Kleerebezem, M.; Schalkwijk, J.; et al. Microbiome Dynamics of Human Epidermis Following Skin Barrier Disruption. Genome Biol. 2012, 13, R101, doi:10.1186/gb-2012-13-11-r101.
- Cogen, A.L.; Nizet, V.; Gallo, R.L. Skin Microbiota: A Source of Disease or Defence? Br. J. Dermatol. 2008, 158, 442–455, doi:10.1111/j.1365-2133.2008.08437.x.
- Chiller, K.; Selkin, B.A.; Murakawa, G.J. Skin Microflora and Bacterial Infections of the Skin. J. Investig. Dermatol. Symp. Proc. 2001, 6, 170–174, doi:10.1046/j.0022-202x.2001.00043.x.
- Tagami, H. Location-Related Differences in Structure and Function of the Stratum Corneum with Special Emphasis on Those of the Facial Skin. Int. J. Cosmet. Sci. 2008, 30, 413–434, doi:10.1111/j.1468-2494.2008.00459.x.
- Leeming, J.P.; Holland, K.T.; Cunliffe, W.J. The Microbial Ecology of Pilosebaceous Units Isolated from Human Skin. J. Gen. Microbiol. 1984, 130, 803–807, doi:10.1099/00221287-130-4-803.
- Elias, P.M. The Skin Barrier as an Innate Immune Element. Semin. Immunopathol. 2007, 29, 3–14, doi:10.1007/s00281-007-0060-9.
- Webster, G.F.; Ruggieri, M.R.; McGinley, K.J. Correlation of Propionibacterium Acnes Populations with the Presence of Triglycerides on Nonhuman Skin. Appl. Environ. Microbiol. 1981, 41, 1269–1270, doi:10.1128/aem.41.5.1269-1270.1981.
- Oh, J.; Byrd, A.L.; Park, M.; NISC Comparative Sequencing Program; Kong, H.H.; Segre, J.A. Temporal Stability of the Human Skin Microbiome. Cell 2016, 165, 854–866, doi:10.1016/j.cell.2016.04.008.
- Oh, J.; Byrd, A.L.; Deming, C.; Conlan, S.; NISC Comparative Sequencing Program; Kong, H.H.; Segre, J.A. Biogeography and Individuality Shape Function in the Human Skin Metagenome. Nature 2014, 514, 59–64, doi:10.1038/nature13786.
- Leyden, J.J.; McGinley, K.J.; Mills, O.H.; Kligman, A.M. Age-Related Changes in the Resident Bacterial Flora of the Human Face. J. Invest. Dermatol. 1975, 65, 379–381, doi:10.1111/1523-1747.ep12607630.
- Somerville, D.A. The Normal Flora of the Skin in Different Age Groups. Br. J. Dermatol. 1969, 81, 248–258, doi:10.1111/j.1365-2133.1969.tb13976.x.
- Dominguez-Bello, M.G.; Costello, E.K.; Contreras, M.; Magris, M.; Hidalgo, G.; Fierer, N.; Knight, R. Delivery Mode Shapes the Acquisition and Structure of the Initial Microbiota across Multiple Body Habitats in Newborns. Proc. Natl. Acad. Sci. U. S. A. 2010, 107, 11971–11975, doi:10.1073/pnas.1002601107.
- Sarkany, I.; Gaylarde, C.C. Bacterial Colonisation of the Skin of the Newborn. J. Pathol. Bacteriol. 1968, 95, 115–122, doi:10.1002/path.1700950113.
- Jo, J.-H.; Deming, C.; Kennedy, E.A.; Conlan, S.; Polley, E.C.; Ng, W.-I.; NISC Comparative Sequencing Program; Segre, J.A.; Kong, H.H. Diverse Human Skin Fungal Communities in Children Converge in Adulthood. J. Invest. Dermatol. 2016, 136, 2356–2363, doi:10.1016/j.jid.2016.05.130.
- Topographical and Temporal Diversity of the Human Skin Microbiome - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 28 December 2022).
- Havlickova, B.; Czaika, V.A.; Friedrich, M. Epidemiological Trends in Skin Mycoses Worldwide. Mycoses 2008, 51 Suppl 4, 2–15, doi:10.1111/j.1439-0507.2008.01606.x.
- Kyriakis, K.P.; Terzoudi, S.; Palamaras, I.; Pagana, G.; Michailides, C.; Emmanuelides, S. Pityriasis Versicolor Prevalence by Age and Gender. Mycoses 2006, 49, 517–518, doi:10.1111/j.1439-0507.2006.01285.x.
- C, S.; Jp, B.; B, M. Updates on the Epidemiology of Dermatophyte Infections. Mycopathologia 2008, 166, doi:10.1007/s11046-008-9100-9.
- Dethlefsen, L.; Relman, D.A. Incomplete Recovery and Individualized Responses of the Human Distal Gut Microbiota to Repeated Antibiotic Perturbation. Proc. Natl. Acad. Sci. U. S. A. 2011, 108 Suppl 1, 4554–4561, doi:10.1073/pnas.1000087107.
- McBride, M.E.; Duncan, W.C.; Knox, J.M. The Environment and the Microbial Ecology of Human Skin. Appl. Environ. Microbiol. 1977, 33, 603–608, doi:10.1128/aem.33.3.603-608.1977.
- Faergemann, J.; Larkö, O. The Effect of UV-Light on Human Skin Microorganisms. Acta Derm. Venereol. 1987, 67, 69–72.
- Bomar, L.; Brugger, S.D.; Yost, B.H.; Davies, S.S.; Lemon, K.P. Corynebacterium Accolens Releases Antipneumococcal Free Fatty Acids from Human Nostril and Skin Surface Triacylglycerols. mBio 2016, 7, e01725-01715, doi:10.1128/mBio.01725-15.
- Christensen, G.J.M.; Scholz, C.F.P.; Enghild, J.; Rohde, H.; Kilian, M.; Thürmer, A.; Brzuszkiewicz, E.; Lomholt, H.B.; Brüggemann, H. Antagonism between Staphylococcus Epidermidis and Propionibacterium Acnes and Its Genomic Basis. BMC Genomics 2016, 17, 152, doi:10.1186/s12864-016-2489-5.
- Janek, D.; Zipperer, A.; Kulik, A.; Krismer, B.; Peschel, A. High Frequency and Diversity of Antimicrobial Activities Produced by Nasal Staphylococcus Strains against Bacterial Competitors. PLoS Pathog. 2016, 12, e1005812, doi:10.1371/journal.ppat.1005812.
- V, I.; V, T.; A, G.; F, S.; F, C.; M, T.; C, M.; C, C.; E, C.; F, P.; et al. Eubiosis and Dysbiosis: The Two Sides of the Microbiota. New Microbiol. 2016, 39.
- Leyden, J.J.; McGinley, K.J.; Mills, O.H.; Kligman, A.M. Propionibacterium Levels in Patients with and without Acne Vulgaris. J. Invest. Dermatol. 1975, 65, 382–384, doi:10.1111/1523-1747.ep12607634.
- Dessinioti, C.; Katsambas, A.D. The Role of Propionibacterium Acnes in Acne Pathogenesis: Facts and Controversies. Clin. Dermatol. 2010, 28, 2–7, doi:10.1016/j.clindermatol.2009.03.012.
- Kang, D.; Shi, B.; Erfe, M.C.; Craft, N.; Li, H. Vitamin B12 Modulates the Transcriptome of the Skin Microbiota in Acne Pathogenesis. Sci. Transl. Med. 2015, 7, 293ra103, doi:10.1126/scitranslmed.aab2009.
- Picardo, M.; Ottaviani, M.; Camera, E.; Mastrofrancesco, A. Sebaceous Gland Lipids. Dermatoendocrinol. 2009, 1, 68–71, doi:10.4161/derm.1.2.8472.
- Jahns, A.C.; Lundskog, B.; Ganceviciene, R.; Palmer, R.H.; Golovleva, I.; Zouboulis, C.C.; McDowell, A.; Patrick, S.; Alexeyev, O.A. An Increased Incidence of Propionibacterium Acnes Biofilms in Acne Vulgaris: A Case-Control Study. Br. J. Dermatol. 2012, 167, 50–58, doi:10.1111/j.1365-2133.2012.10897.x.
- Brüggemann, H.; Henne, A.; Hoster, F.; Liesegang, H.; Wiezer, A.; Strittmatter, A.; Hujer, S.; Dürre, P.; Gottschalk, G. The Complete Genome Sequence of Propionibacterium Acnes, a Commensal of Human Skin. Science 2004, 305, 671–673, doi:10.1126/science.1100330.
- McDowell, A.; Nagy, I.; Magyari, M.; Barnard, E.; Patrick, S. The Opportunistic Pathogen Propionibacterium Acnes: Insights into Typing, Human Disease, Clonal Diversification and CAMP Factor Evolution. PloS One 2013, 8, e70897, doi:10.1371/journal.pone.0070897.
- An Expanded Multilocus Sequence Typing Scheme for Propionibacterium Acnes: Investigation of “Pathogenic”, “commensal” and Antibiotic Resistant Strains - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 28 December 2022).
- Palmer, C.N.A.; Irvine, A.D.; Terron-Kwiatkowski, A.; Zhao, Y.; Liao, H.; Lee, S.P.; Goudie, D.R.; Sandilands, A.; Campbell, L.E.; Smith, F.J.D.; et al. Common Loss-of-Function Variants of the Epidermal Barrier Protein Filaggrin Are a Major Predisposing Factor for Atopic Dermatitis. Nat. Genet. 2006, 38, 441–446, doi:10.1038/ng1767.
- Staphylococcus Aureus in the Lesions of Atopic Dermatitis - PubMed Available online: https://pubmed.ncbi.nlm.nih.go... (accessed on 28 December 2022).
- Huang, J.T.; Abrams, M.; Tlougan, B.; Rademaker, A.; Paller, A.S. Treatment of Staphylococcus Aureus Colonization in Atopic Dermatitis Decreases Disease Severity. Pediatrics 2009, 123, e808-814, doi:10.1542/peds.2008-2217.
- Bath-Hextall, F.J.; Birnie, A.J.; Ravenscroft, J.C.; Williams, H.C. Interventions to Reduce Staphylococcus Aureus in the Management of Atopic Eczema: An Updated Cochrane Review. Br. J. Dermatol. 2010, 163, 12–26, doi:10.1111/j.1365-2133.2010.09743.x.
- Pierard, G.E.; Arrese, J.E.; Pierard-Franchimont, C.; DE Doncker, P. Prolonged Effects of Antidandruff Shampoos - Time to Recurrence of Malassezia Ovalis Colonization of Skin. Int. J. Cosmet. Sci. 1997, 19, 111–117, doi:10.1046/j.1467-2494.1997.171706.x.
- Leyden, J.J.; McGinley, K.J.; Kligman, A.M. Role of Microorganisms in Dandruff. Arch. Dermatol. 1976, 112, 333–338.
- Gupta, A.K.; Batra, R.; Bluhm, R.; Boekhout, T.; Dawson, T.L. Skin Diseases Associated with Malassezia Species. J. Am. Acad. Dermatol. 2004, 51, 785–798, doi:10.1016/j.jaad.2003.12.034.
- Prompers, L.; Huijberts, M.; Apelqvist, J.; Jude, E.; Piaggesi, A.; Bakker, K.; Edmonds, M.; Holstein, P.; Jirkovska, A.; Mauricio, D.; et al. High Prevalence of Ischaemia, Infection and Serious Comorbidity in Patients with Diabetic Foot Disease in Europe. Baseline Results from the Eurodiale Study. Diabetologia 2007, 50, 18–25, doi:10.1007/s00125-006-0491-1.
- Ramsey, S.D.; Newton, K.; Blough, D.; McCulloch, D.K.; Sandhu, N.; Reiber, G.E.; Wagner, E.H. Incidence, Outcomes, and Cost of Foot Ulcers in Patients with Diabetes. Diabetes Care 1999, 22, 382–387, doi:10.2337/diacare.22.3.382.
- Gardner, S.E.; Hillis, S.L.; Heilmann, K.; Segre, J.A.; Grice, E.A. The Neuropathic Diabetic Foot Ulcer Microbiome Is Associated with Clinical Factors. Diabetes 2013, 62, 923–930, doi:10.2337/db12-0771.
- Valensi, P.; Girod, I.; Baron, F.; Moreau-Defarges, T.; Guillon, P. Quality of Life and Clinical Correlates in Patients with Diabetic Foot Ulcers. Diabetes Metab. 2005, 31, 263–271, doi:10.1016/s1262-3636(07)70193-3.
- Frank, D.N.; Wysocki, A.; Specht-Glick, D.D.; Rooney, A.; Feldman, R.A.; St Amand, A.L.; Pace, N.R.; Trent, J.D. Microbial Diversity in Chronic Open Wounds. Wound Repair Regen. Off. Publ. Wound Heal. Soc. Eur. Tissue Repair Soc. 2009, 17, 163–172, doi:10.1111/j.1524-475X.2009.00472.x.
- Polavarapu, N.; Ogilvie, M.P.; Panthaki, Z.J. Microbiology of Burn Wound Infections. J. Craniofac. Surg. 2008, 19, 899–902, doi:10.1097/SCS.0b013e318175b4f0.
