Моющие средства и ополаскиватели для посудомоечных машин повреждают эпителиальный барьер кишечника
Общие сведения
Актуальность
Повышенная распространенность многих хронических воспалительных заболеваний, связанных с отсутствием «герметичности» эпителиального барьера кишечника, побудила авторов исследовать, какую роль играют широко распространенные средства для мытья посуды и посудомоечных машин, среди прочих факторов.
Целью работы было исследовать влияние применения профессиональных и бытовых посудомоечных машин и ополаскивателей на цитотоксичность, барьерную функцию, транскриптом и экспрессию белка в эпителиальных клетках желудочно-кишечного тракта.
Методы
На проницаемых подложках были установлены энтероцитарные границы жидкость-жидкость, и были исследованы прямая клеточная цитотоксичность, трансэпителиальное электрическое сопротивление, парацеллюлярный поток, проведены иммунофлуоресцентное окрашивание, секвенирование РНК-транскриптома и прицельный протеомный анализ.
Результаты
Оказалось, что наблюдаемая токсичность моющих средств была связана с воздействием ополаскивателя, в зависимости от дозы, до разбавления 1:20 000 по объему. Нарушение эпителиального барьера, особенно из-за ополаскивателя, наблюдалось в культурах на границе раздела сред жидкость-жидкость, органоидах и «кишечнике-на-чипе», что демонстрирует снижение трансэпителиального электрического сопротивления, увеличение парацеллюлярного потока и нерегулярное и гетерогенное иммунное окрашивание плотных контактов. Когда отдельно друг от друга были исследованы разные компоненты ополаскивателя, этоксилаты спирта проявляли сильный токсический и разрушающий барьер эффект. Данные секвенирования РНК-транскриптома и протеомики выявили активацию механизмов клеточной смерти, сигнализации и коммуникации, клеточного развития, метаболизма, пролиферации, а также иммунных и воспалительных реакций эпителиальных клеток. Интересно, что даже небольшие следы моющего вещества, используемого в профессиональных посудомоечных машинах, оставались на вымытой и готовой к использованию посуде (в первую очередь, компоненты ополаскивателя, в значительной степени способных произвести цитотоксический эффект и повредить эпителиальный барьер).
Выводы авторов
Оказалось, что экспрессия генов, ответственных за выживание клеток, поддержание эпителиального барьера, сигнализацию через цитокины и метаболизм, изменилась вследствие действия ополаскивателя, используемого в концентрациях для мытья посуды в профессиональных посудомоечных машинах. Этоксилаты спирта в ополаскивателе, были идентифицированы как компонент, вызывающий воспаление эпителия и повреждение барьера.
Эпителиальный барьер кишечника формирует надежную защиту от чужеродных веществ, в то же время регулируя всасывание питательных веществ, воды и электролитов [1,2]. Такое прохождение молекул контролируется белками межклеточных плотных соединений (ПС), расположенными в апикальной части эпителиальных клеток. ПС — это мультипротеиновый комплекс, в состав которого входят трансмембранные белки (например, окклюдин [OCLN], клаудины [CLDNs], соединительная молекула адгезии и трицеллюлин), а также белки внутриклеточных бляшек (например, zonula occludens — плотный контакт [ПК], т. е. ПК-1, ПК-2 и ПК-3) [3,4].
Как предполагается, нарушение кишечного эпителиального барьера ПС является центральным патогенным фактором, приводящим к системному воспалению, что наблюдается при ожирении, воспалительных заболеваниях кишечника и других хронических неинфекционных воспалительных заболеваниях иных органов [5, 6]. «Гипотеза эпителиального барьера» связывает рост аллергических, аутоиммунных и метаболических заболеваний, который наблюдается в последние десятилетия в промышленно развитых и урбанизированных странах, с повышенным воздействием соединений, повреждающих эпителиальный барьер [5,7]. В перечень веществ, повреждающих эпителиальный барьер, входят токсичные вещества, присутствующие в стиральных порошках и бытовых моющих средствах, а также поверхностно-активные вещества, ферменты и эмульгаторы в переработанных пищевых продуктах, сигаретном дыме, твердодисперсной пыли, дизельных выхлопах, озоне, наночастицах, микропластике и зубной пасте [5, 8, 9]. Повышенная проницаемость кишечного барьера обусловливает усиленное воздействие клеток врожденного и приобретенного иммунитета на провоспалительные компоненты, расположенные под слоем эпителия, и микробиоту в просвете кишечника [10]. Такие воспалительные стимулы и провоспалительные цитокины могут непосредственно подавлять экспрессию белка ПС в кишечном барьере [11]. Переход бактерий в субэпителиальную область сопровождает это повреждение, что было выявлено при многих системных заболеваниях [12, 13, 14, 15, 16, 17, 18 , 19]. Согласно результатам недавних исследований, воздействие анионных поверхностно-активных веществ в средствах для стирки ухудшает функции эпителиального барьера в коже и бронхах человека даже при очень высоких разведениях [20, 21]. Помимо этого, остатки средств для стирки после полоскания оказались токсичными и нарушили целостность ПС барьера бронхиальных эпителиальных клеток [20].
Профессиональные посудомоечные машины приобрели популярность с 2000-х годов [8] потому, что они выполняют механическую работу по мойке посуды за человека и обеспечивают ее чистоту и дезинфекцию. Сегодня они регулярно используются, особенно в заведениях общественного питания, включая рестораны, школы и гостиницы. В профессиональной посудомоечной машине вода, объемом от 3 до 4 литров, нагревается не менее чем до 65°C, а моющее средство добавляется для максимум 60-секундного цикла мойки при давлении от 2 до 4 атмосфер. Далее следует цикл ополаскивания/сушки с добавлением 3–4 л воды и ополаскивателя, нагретого до 82°C. Следует отметить, что промывок для удаления остатков ополаскивателя не существует. Эти 2 цикла завершаются за 60–150 секунд, в зависимости от типа используемой профессиональной посудомоечной машины [22,23]. После цикла ополаскивания разведение остатков моющего средства варьируется от 1:250 до 1:667 (для посудомоечных машин), ополаскивателя — от 1:2000 до 1: 10 000. Моющие средства и ополаскиватель, используемые в профессиональных посудомоечных машинах, содержат несколько потенциально опасных веществ; однако их токсичность в отношении эпителиальных клеток желудочно-кишечного тракта полностью не исследована. Авторы предположили, что если остатки моющего средства и ополаскивателя не будут удаляться полностью, они могут остаться на поверхности посуды после высыхания. Исследователи изучили опасность воздействия данных профессиональных и бытовых средств для посудомоечных машин и их отдельных компонентов на здоровье. Клеточные культуры на границе раздела двух жидких сред, органоиды и модели «кишечника на чипе», а также транскриптомный и целевой протеомный анализ эпителиальных клеток кишечника позволили получить представление о дозах и молекулярных механизмах, с помощью которых детергенты и ополаскиватели вызывают апоптоз и воспаление, повреждающие эпителиальный барьер кишечника. Результаты могут внести вклад в общественное здравоохранение, поскольку они, возможно, укажут на старт разрушения эпителия кишечника и провоспалительных реакций — частые этапы многих хронических заболеваний.
Результаты
Профессиональный ополаскиватель для посудомоечных машин демонстрирует цитотоксичность для клеток Caco-2
Цитотоксичность моющих средств и ополаскивателей оценивали в зависимости от дозы и времени измерением количества ЛДГ вне клеток (в качестве маркера целостности клеточной мембраны). Клетки Caco-2 в монослое и дифференцированные на границе раздела жидкостных сред, в течение 24 и 72 часов соответственно подвергали обработке поэтапно разбавленным моющим средством и ополаскивателем.
После 24-часового воздействия профессионального моющего средства во всех разведениях до 1:250 на монослойные культивируемые клетки Caco-2 и клетки HT-29 (рис. 1, A; см. рис. E1 в онлайн-репозитории этой статьи на www.jacionline.org) никакого токсического эффекта не наблюдалось. Лизис клеток Caco-2 и HT-29 наблюдался при воздействии ополаскивателя, начиная с разведения 1:20000 и 1:10000 соответственно (рис. 1, А; см. рис. E1). Фазово-контрастные микроскопические изображения клеток показали отделение от слоя питательной среды и разрушение цитозольной мембраны после воздействия ополаскивателя, чего не выявлялось при обработки детергентом или необработанными клетками группы контроля (рис. 1, B; см. рис. E1). Аналогичные результаты были получены при анализе цитотоксичности с ЛДГ и изображениях фазово-контрастной микроскопии после воздействия только ополаскивателя или в сочетании с моющим средством в различных разведениях (рис. 1, А и В; см. рис. Е1). Эти данные показали, что клеточная токсичность может быть в значительной степени связана с воздействием ополаскивателя. Проточный цитометрический анализ показал, что профессиональный ополаскиватель для посудомоечных машин вызывал апоптоз монослойных клеток Caco-2 при воздействии на них разведений 1:10 000, 1:20 000 и 1:40 000 со значительным увеличением процентного содержания ранних (аннексин V+) и поздних (аннексин V+ и иодид пропидия +) апоптотических клеток (см. рис. E2 в онлайн-репозитории этой статьи на сайте www.jacionline.org).
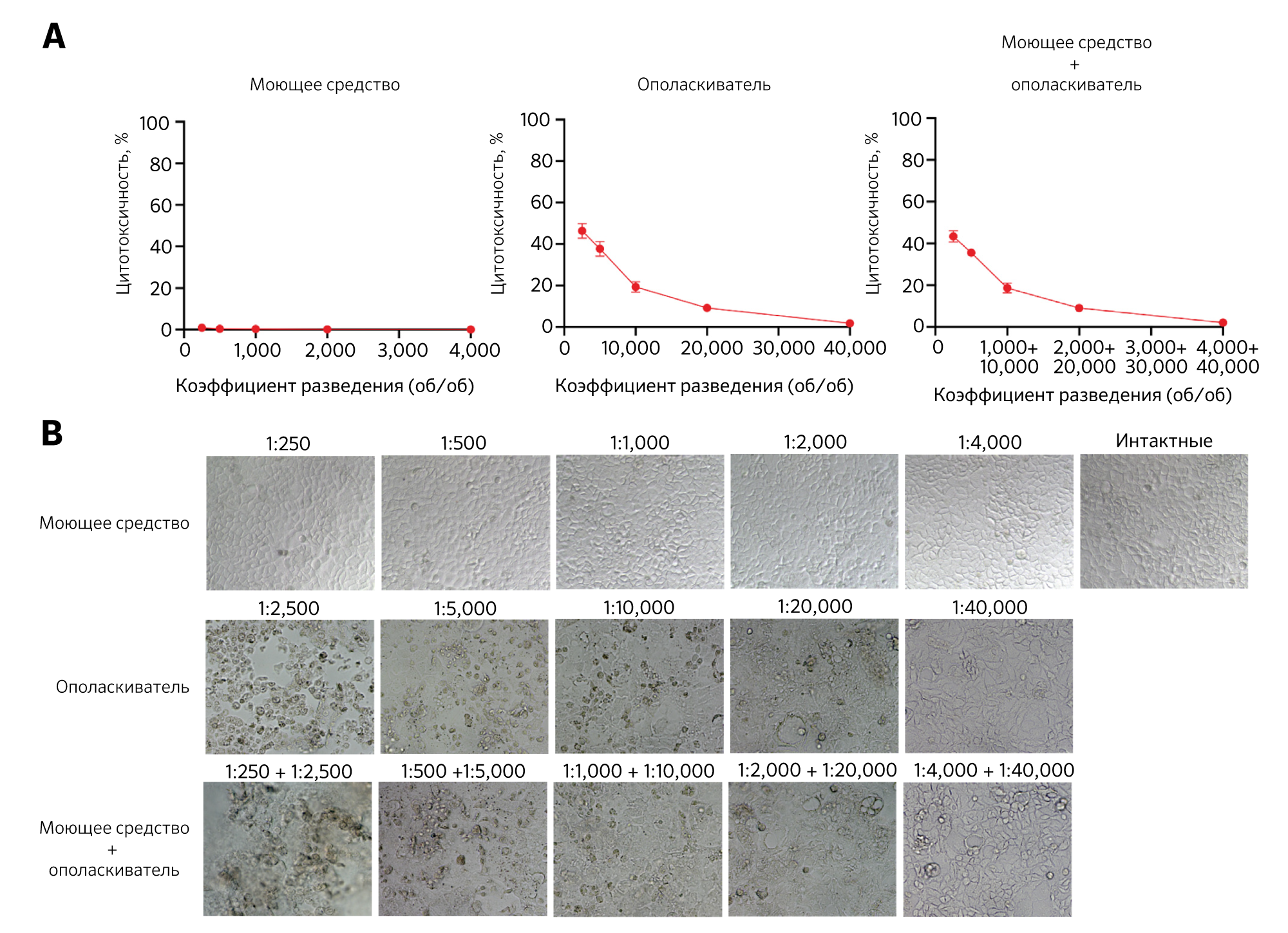
B. Репрезентативные фазово-контрастные изображения монослойных культивируемых клеток Caco-2, подвергшихся воздействию профессионального моющего средства и ополаскивателя (по отдельности или в виде смеси) в течение 24 часов. Коэффициенты разбавления указаны в верхней части изображения. Аналогичные результаты были получены при использовании 3 различных профессиональных моющих и ополаскивающих средств.
об/об — объем/объем.
Далее авторы вырастили культуры дифференцированных клеток Caco-2 на границе раздела сред жидкость-жидкость и подвергли их воздействию моющего средства и ополаскивателя по отдельности и в комбинации. Начиная с разведения 1:20000, и ополаскиватель и комбинация моющих средств и ополаскивателей, продемонстрировали лизис на клетках Caco-2. Однако обработка одним лишь моющим средством через 72 часа не привела к изменениям в жизнеспособности клеток вплоть до разведения 1:250 (см. рис. E3 в онлайн-репозитории этой статьи на сайте www.jacionline.org). Таким образом, ополаскиватель оказывает одинаковое цитотоксическое действие на культивируемые в монослое и на дифференцированные клетки Caco-2.
Цитотоксические эффекты трех широко используемых моющих средств изучали на монослойных культурах клеток Caco-2 в различных разведениях. В домашних условиях при мытье посуды обычно используется разведение 1:80 000, которое рассчитывается в зависимости от количества воды и цикла мытья. Дозозависимая цитотоксичность была обнаружена в ответ как на моющее средство A, так и на B, и в обоих случаях наблюдался лизис при воздействии детергентов в концентрациях 1:20 000. Три моющих средства для бытовых посудомоечных машин не оказывали цитотоксического действия на клетки Caco-2 при разведении 1:80 000 (см. рис. E4 в онлайн-репозитории этой статьи на сайте
Профессиональный ополаскиватель для посудомоечных машин нарушает барьерную функцию дифференцированных клеток Caco-2
Чтобы оценить, нарушают ли профессиональное моющее средство для посудомоечных машин и ополаскиватель по отдельности или в виде смеси целостность кишечного барьера, в дифференцированных клетках Caco-2 проводилось измерение TEER (трансэпителиальное электрическое сопротивление) и PF (околоклеточный поток). Было обнаружено, что детергент сам по себе не вызывает какого-либо токсического эффекта, что определено измерениями TEER и потоком FITC (флуоресцеинизотиоцианат) при всех разведениях вплоть до 1:250 в течение 72-часового периода инкубации. Ополаскиватель же, напротив, нарушал целостность барьера в зависимости от концентрации и времени, на что указывало снижение TEER. Резкое снижение TEER наблюдалось при разведении ополаскивателя 1:2500 в течение 24 часов. Неожиданно, значения TEER в значительной степени увеличились при использовании ополаскивателя в разведении 1:5000 и 1:10000 в первые 3 дня. Авторы рассматривают увеличение TEER как проявление цитотоксичности ополаскивателя в отношении эпителиальных клеток, адгезии мембран соседних клеток и эффектов фиксации. Воздействие параформальдегида на апикальную сторону клеток Caco-2, культивируемых в жидкой среде также подтверждалось повышением TEER из-за такого эффекта фиксации (см. рис. E5 в онлайн-репозитории этой статьи на сайте www.jacionline.org). Однако резкое снижение TEER наблюдалось и после 5-дневного воздействия этих разведений. Интересно, что высокие значения TEER также наблюдались после воздействия ополаскивателя в разведении 1:20 000.
Обсуждение
Распространенность аллергических заболеваний, особенно пищевой аллергии и эозинофильного эзофагита, с начала века достигла тревожных цифр [30,31]. Для объяснения беспрецедентного роста этих заболеваний недавно была предложена «гипотеза эпителиального барьера», суть которой заключается в повышенном воздействии опасных веществ, которые повреждают функцию эпителиального барьера [5,32]. Эта тенденция особенно заметна при заболеваниях, связанных с нарушением кишечного барьера и микробным дисбиозом в кишечнике. В течение последних двух десятилетий на предприятиях общественного питания в развитых странах на постоянной основе применяются профессиональные посудомоечные машины. В такой специализированной технике высокие температуры и давление достигаются в течение 1–2 минут при использовании ограниченного количества воды, так что потенциально токсичные количества этоксилатов спирта остаются и после завершения цикла мытья. В настоящем исследовании авторы демонстрируют непосредственную токсичность в отношении эпителиальных клеток, разрушение ПС и их молекулярных механизмов профессиональными ополаскивателями для посудомоечных машин в стандартных, ежедневно применяемых концентрациях (1:10 000). В ходе настоящего исследования удалось совершить открытие: с поверхности недавно вымытой посуды могут быть получены этоксилаты спирта, сохраняющие свою токсичность и ответственные за развитие указанных неблагоприятных эффектов.
Поскольку первичные клетки кишечного эпителия невозможно культивировать более нескольких дней [33], в данном исследовании эксперименты проводились на клетках Caco-2 (эта клеточная линия наиболее хорошо зарекомендовала себя в качестве выращиваемых in vitro эпителиальных клеток кишечника). Этическое разрешение для экспериментов in vivo и на мышиных моделях авторам получить не удалось, поскольку некоторые химические вещества, присутствующие в моющих средствах и ополаскивателях, являются хорошо известными токсичными соединениями. Линия клеток Caco-2 применялась во многих работах (фигурирует в более чем 20 000 публикаций), а также является текущим критерием стандарта модели кишечного барьера; клетки выращиваются на полупроницаемом фильтре на границе раздела сред жидкость-жидкость. Клетки спонтанно дифференцируются и пролиферируют подобно кишечным энтероцитам. Дифференцированные клетки Caco-2 сохраняют структуру микроворсинок щеточной каймы, образуют межклеточные ПС и продуцируют различные метаболические ферменты, расположенные в кишечном эпителии [34,35].
Исследование лактатдегидрогеназы (ЛДГ) является удобным и простым методом определения цитотоксичности или жизнеспособности клеток. В ходе анализа определяется ее количество (маркер поврежденных клеток) [36]. Однако профессиональные моющие средства не оказывают цитотоксического действия на эпителиальные клетки кишечника в разведении 1:250. Бытовые моющие средства содержат широкий спектр возможных токсичных веществ, включая лаурилсульфат натрия, этоксилаты спирта, отбеливающие вещества, ферменты, отдушки и т. д., и оказались токсичны до разведения 1:20 000. Разные компоненты и дозы и могут быть и причиной в их неодинаковой токсичности. Согласно результатам анализов, когда клетки Caco-2 подвергались воздействию ополаскивателя, даже при разведении 1:20000, ЛДГ выделялась в значительно большей концентрации. Секвенирование РНК-транскриптома и таргетная протеомика согласуются с этими результатами, демонстрируя усиление регуляции процессов клеточной гибели, реакций на поступление токсичных веществ, миграции клеток, клеточной сигнализации и коммуникации, развития и пролиферации эпителия, клеточной адгезии, а также иммунных и воспалительных реакций в ответ на действие ополаскивателя в разведении 1:10 000. Транскриптомный анализ выявил участие 1138 дифференциально экспрессируемых генов, связанных с гибелью и клеточной репарацией. Это общая клеточная и тканевая реакция на опасные вещества. В худшем случае происходит гибель клеток и воспаление; однако в некоторых клетках активируются гены выживания и восстановления. Эти результаты согласуются с более ранними сообщениями об активации сходных семейств генов в ответ на химические вещества, присутствующие в следующих детергентах:
- хлорид бензалкония, лаурилсульфат натрия и тритон X-100 активировали семейства генов в эпителиальных клетках роговицы [37];
- дезоксиниваленол — в кишечных энтероцитах [38];
- наночастицы серебра — в клетках легких человека [39];
- микотоксин (охратоксин А) — в клетках почек [40];
- канцероген бензоапирен — в клетках HepG2 [41].
Согласно исследованию ЛДГ, не удалось выявить цитотоксичность ополаскивателя при разведении 1:40 000; однако по результатам секвенирования РНК, наблюдалась активация 427 генов, связанных с реакцией на опасные химические вещества, развитием клеток эпителия, клеточной сигнализацией и коммуникацией. Согласно этим данным, длительное воздействие ополаскивателей в гораздо низких дозах, может влиять на основные внутриклеточные пути в клетках, в отличии от тех, которые способны убить эти клетки. В ряде исследований сообщается, что некоторые (одобренные FDA) пищевые эмульгаторы действуют сходно с детергентами и могут повышать проницаемость кишечника, что приводит ко множеству заболеваний, включая воспалительные поражения кишечника, колиты, метаболический синдром, ожирение и злокачественные новообразования [42, 43, 44, 45 , 46]. Танг с соавт. [47] сообщают, что диетический эмульгатор полисорбат-80 может вызывать церебральную кавернозную мальформацию у мышей из-за изменений в кишечном барьере. Согласуясь с результатами секвенирования РНК, данные прицельной протеомики указывают на активацию клеточной пролиферации, воспалительных и иммунных реакций, миграции клеток и процессы клеточной адгезии в качестве ответа на действие ополаскивателя в разведении 1:40 000.
Согласно гипотезе эпителиального барьера, факторы, повреждающие его, запускают порочный круг, который можно охарактеризовать эпителиитом, миграцией микробиоты в субэпителиальное пространство и дисбиозом. Тяжесть патологии, вызываемой этими вредными факторами, зависит от самих веществ, продолжительности их воздействия, дозы и вида пораженных тканей. В соответствии с этим многие аллергические, аутоиммунные и метаболические заболевания связаны с повреждением эпителиальных барьеров. Миграция микробиома в субэпителиальные области и колонизация условно-патогенными микроорганизмами индуцирует реакцию изгнания этих внедряющихся в ткани микробов, что рассматривается как ведущая причина реакций гиперчувствительности второго типа [5]. Это согласуется с развитием IgE-опосредованного ответа на колонизацию основным условно-патогенным возбудителем Staphylococcus aureus [7]. Кроме того, при эпителиите повышается уровень аларминов: IL-25, IL-33 и TSLP (тимусный стромальный лимфопоэтин) — хорошо известные индукторы иммунных реакций второго типа [48].
Синтез аларминов варьируется в зависимости от типа клеток и особенностей воздействия детергента. В некоторых исследованиях было продемонстрировано увеличение экспрессии TSLP и IL-33 в различных эпителиальных клетках в ответ на воздействие детергентов и протеаз [20,49,50]. В настоящем исследовании авторы зафиксировали усиленную экспрессию мРНК TSLP и IL-33 в ответ на воздействие ополаскивателя, несмотря на низкие концентрации последнего. С выводами авторов данной работы согласуются результаты работы Wang с соавт. [20], в которой также сообщается об увеличении количества мРНК TSLP и IL-33 после воздействия детергента. Обнаружение белков аларминов — IL-1α, IL-25 и IL-33 в одних и тех же супернатантах оказалось невозможным. Поскольку IL-33 является ядерным цитокином, крайне трудно определить экспрессию этого белка в культуральных супернатантах [51]. Эти результаты указывают на важность определения уровней белков аларминов во временной кинетике при воздействии разных моющих средств.
Желудочно-кишечный барьер состоит из межклеточных белков ПС, расположенных вокруг апикальной области эпителиоцитов [52]. Среди ПС основными трансмембранными белками являются OCLN (окклюдин) и CLDN (клаудины), а ZO-1 (зона окклюдинов) — белок внутриклеточных бляшек, который взаимодействует как с трансмембранными, так и с белками цитоскелета [4]. В данном исследовании определение OCLN и CLDN1 проводилось с помощью иммунофлуоресцентного окрашивания клеток, подвергшихся воздействию ополаскивателя, чтобы выяснить, является ли причиной снижения TEER изменения в локализации белка ПС. Действительно, выраженные нарушения целостности ПС были очевидны при неравномерном и стратифицированном окрашивании OCLN и CLDN1. В литературе неоднократно сообщалось о повреждении барьера ПС токсичными веществами. Хотя, насколько известно, ранее не было свидетельств об этом, применительно к профессиональным моющим средствам для посудомоечных машин. Проводится много исследований средств для стирки и их связи с развитием астмы, ринита и дерматита у работников моющих предприятий [53, 54, 55, 56, 57], а также у работников клининговых услуг [58,59]. Токсичность моющих средств объясняется наличием поверхностно-активных веществ [21], ферментов Bacillus subtilis [56,57] и других микробных протеаз [60]. Сурфактанты — главные компоненты очистки в детергентах, чья функция заключается в снижении поверхностного напряжения воды [61].
Недавние исследования авторов показали, что анионные поверхностно-активные вещества даже в следовых количествах способны повреждать целостность эпителиального барьера в коже человека и эпителиальных клеток бронхов [20,21]. Наряду со снижением TEER, наблюдаемые изменения в белках ПС связаны с ослабленной целостностью барьера и увеличением парацеллюлярной проницаемости. АС (белки адгезивного соединения — прим. перев.) — это семейство адгезивных интегральных мембранных белков, которые опосредуют межклеточную адгезию и контролируют пролиферацию клеток, полярность их расположения, форму, подвижность и выживаемость. Они играют ключевую роль для нормального морфогенеза ткани, а их нарушение приводит к развитию патологических аномалий [62]. Результаты транскриптомного анализа, проведенного авторами, показали, что токсическая доза ополаскивателя может влиять на целостность таких белков ПС, как CLDN1, OCLN, CLDN4, CLDN12 и CLDN19, и таких АС, как CDH1, который кодирует эпителиальный кадгерин, CDH6, CDH11, CTNNA1 и CTNNB1, который кодирует катенин альфа и бета 1. Результаты настоящего исследования продемонстрировали, что нарушения целостности ПС и АС, вызванные ополаскивателем, могут развиваться в результате прямого воздействия на барьерные молекулы, по причине повреждения клеток или изменения экспрессии мРНК некоторых белков ПС и AС. Также ополаскиватель вызывал активацию генов, участвующих в миграции, пролиферации и адгезии клеток. В то время как гены, связанные с метаболизмом липидов, стероидов, спиртов и кислот подавлялись, особенно при воздействии токсических концентраций.
Этоксилаты спиртов широко используются в качестве неионогенных поверхностно-активных веществ в моющих и ополаскивающих средствах [63]. Результаты работы авторов указывают на то, что остаточные этоксилаты спиртов являются компонентом, нарушающим целостность барьера. Другие компоненты, присутствующие в ополаскивателе, включая лимонную кислоту и куменсульфонат натрия, не влияли на барьерную целостность эпителиальных клеток. Человек постоянно подвергается воздействию этоксилатов спирта, поскольку они присутствуют в продуктах для дома и личной гигиены, агрохимикатах, красках, покрытиях, нефтяной промышленности и промышленных чистящих средствах. Несколько токсикологических исследований на людях и морских животных продемонстрировали опасность, связанную с воздействием этоксилатов спиртов [64, 65]. Jardak с соавт., например, сообщают, что этоксилаты спиртов могут нарушать дыхательную систему у рыб, амфибий и беспозвоночных, вызывая «раздувание» бронхиол с обильным выделением слизи [66].
NF-κB — главный регулятор врожденных иммунных реакций, участвующий в выделении многих провоспалительных цитокинов [67]. Растворы ополаскивателя в разведении 1:10 000 влияли на уровни экспрессии цитокинов, хемокинов, их рецепторов и регуляторов комплемента. Аналогичный эффект был зафиксирован при тяжелых формах COVID-19 с полиорганным поражением, токсическим гепатитом и острым поражением почек [68, 69, 70, 71, 72]. Вдобавок к изменениям транскрипционного фактора NF-κB, сигнальные пути АР-1 и МАР-киназы подверглись изменениям, как часть провоспалительной активации врожденного иммунитета. Каскад реакций MAP-киназы играет важную роль в клеточной сигнализации, а активация NF-kB и AP-1 приводит к транскрипции провоспалительных генов [73]. Результаты исследования авторов показали, что ополаскиватель регулирует активность NF-kB и транскрипционного фактора AP-1 в эпителиоцитах кишечника, а также каскада MAPK, что согласуется с предыдущими исследованиями воздействия частиц загрязненного воздуха на эпителиальные клетки дыхательных путей [74], твердых частиц на кератиноциты [75] и хлорорганических соединений на эмбриональные клетки почек человека [76]. Индукция этих сигналов приводит к к повышенной провоспалительной активности кишечного эпителия с экспрессией TH2-стимулирующего фактора TSLP и лигандов хемокинов, таких как CXCL-1, CXCL-3, CXCL-8, CXCL-10 и CSF1.
Обобщая вышесказанное, настоящее исследование дает новое представление об основных механизмах повреждения кишечного эпителиального барьера в ответ на использование профессионального ополаскивателя для посудомоечных машин. Авторы идентифицировали этоксилаты спирта как тот компонент ополаскивателя, который является «главным виновником» в нарушении целостности кишечного эпителиального барьера, а также в активации врожденного иммунного ответа и провоспалительных транскрипционных факторов. Несмотря на то, что допустимый коэффициент разведения составляет от 1: 2 000 до 1: 10 000, даже разведение 1: 40 000 оказало влияние на многие гены и белки. Постоянное воздействие моющих средств, ополаскивателей и других опасных веществ может вызывать синергетический эффект в разрушении эпителиального барьера. Хотя исследование проводилось на различных моделях, в том числе и первичных кишечных органоидах, авторам не удалось применить экспериментальные модели in vivo. Необходимы дальнейшие исследования, чтобы проверить, повреждаются ли аналогичные механизмы у людей. Учитывая, что дефект эпителиального барьера может способствовать проникновению аллергенов и вызвать воспалительную реакцию, которая может инициировать или усугубить многие хронические воспалительные заболевания, в дальнейшем необходимо оценить опасность для здоровья этоксилатов спирта в концентрациях, присутствующих в ополаскивателе, а также определить наиболее безопасные альтернативы.
Ключевые аспекты
- Профессиональный ополаскиватель для посудомоечных машин вызывает клеточную цитотоксичность в тех концентрациях, которые применяются ежедневно и напрямую повреждает барьерную целостность эпителиальных клеток кишечника, нарушая экспрессию белков ПС и АС.
- Основными механизмами нарушения эпителиального барьера при воздействии ополаскивателя оказались: гибель клеток — при разведении 1:10 000, бреши в эпителиальном барьере — при разведении 1:40 000.
- Этоксилаты спирта — ингредиент ополаскивателя, который остается на вымытой посуде и вызывает воспаление эпителия кишечника и повреждение его барьера.
