Как тахикардия вызывает тревожность. Эксперимент с оптогенетикой
В моменты беспокойства мозг влияет на сердечную деятельность, однако влияет ли само учащенное сердцебиение на головной мозг, еще больше стимулируя паттерны поведения, характерные для тревоги? Использование кардиостимулятора, работающего от энергии света, на примере мышей показало, что такое воздействие определенно имеет место. Ученым удалось точно определить задействованную в этот межорганный «диалог» область мозга.
Определенно, любому человеку хотя бы раз в жизни доводилось переживать настолько выраженную тревогу, когда сердце будто выскакивает из груди. Такая тахикардия является одним из основных симптомов тревожного расстройства и может быть настолько интенсивной, что человек может принять ее за сердечный приступ. В ходе экспериментов удалось выявить многочисленные пути, по которым от мозга к сердцу передаются сигналы. Но как в клинической психиатрии, так и в фундаментальной
нейробиологии, обратное явление — влияние частоты сердечных сокращений на эмоциональную составляющую — почти столетие остается дискуссионным вопросом. Группа исследователей Стэнфордского университета во главе с Брайаном Сюэ определили механизм, посредством которого мозг «распознает» частоту сердечных сокращений и в зависимости от этого,он осуществляет контроль над эмоциональным аспектом поведения.
Интероцепция — это непрерывное восприятие мозгом внутренних сигналов организма, поступающих, в том числе, от дыхательной, желудочно-кишечной и сердечно-сосудистой систем. У людей с тревожными расстройствами изменяется восприятие этих внутренних сигналов, особенно частоты сердечных сокращений. Благодаря исследованиям на животных была выявлена связь между изменениями сердечно-сосудистой деятельности и определенными эмоциональными состояниями, однако оставалось неясным, способствует ли напрямую увеличение частоты сердечных сокращений усилению тревожности.
До сих пор для увеличения или уменьшения частоты сердечных сокращений и оценки их влияния на эмоции использовались только неспецифически-воздействующие электрические разряды, стимуляция блуждающего нерва и фармакологические методики — однако их применение связано с развитием серьезных побочных эффектов. Исследователям не хватало методов с необходимыми временными и пространственными характеристиками, чтобы провести адекватную оценку влияния частоты сердечных сокращений на тревогу.
Первым прорывом Сюэ и его коллег стала разработка неинвазивного оптического кардиостимулятора. Его принцип работы был основан на систематическом введении мышам вирусного вектора, несущего ген, кодирующий светочувствительный белок ChRmine-опсин. При воздействии красного света сквозь этот белок проходят катионы, которые приводят к деполяризации экспрессирующих его клеток. В экспериментах клетками-мишенями были кардиомиоциты, деполяризация которых является основой мышечного сокращения.
Установив красный микродиод (микро-светодиод, micro-LED), «мигающий» с определенной частотой, на жилет, который надевали на мышей, авторы смогли воспользоваться «оптогенетической» методикой для контроля частоты сердечных сокращений (рис. 1). ChRmine-опсин ранее использовался для точного контроля функционирования определенных нейронных цепей в глубоких областях мозга без необходимости применения внутричерепной хирургии. Сюэ с соавт. расширили область применения этого молекулярного инструмента, приспособив его для контроля активности (т.е. как задается ритм сокращений) целого органа и определения любого воздействия оси «сердце-мозг» на тревожность.
Авторы воспользовались этой методикой, чтобы изучить, может ли увеличение частоты сердечных сокращений до 900 ударов в минуту (что на 36 % выше нормальных значений для мышей) способствовать изменению уровня тревожности у мышей, чье поведение ничем не ограничивалось извне. Сюэ с соавт. воспользовались двумя методами оценки тревожности — помещение животных в лабиринт или метод открытого поля. Важно отметить, что на обеих локациях были как безопасные, так и незащищенные участки. Авторы обнаружили, что в обоих случаях, при «оптически индуцированной» тахикардии животные больше избегали открытых областей, что служит отражением повышения тревожности (и соответствующего паттерна поведения). Это явная демонстрация того, что, по крайней мере, у мышей частота сердечных сокращений может влиять на выраженность тревоги и, вероятно, на другие формы поведения, обусловленного эмоциональным компонентом.
Для изучения нейробиологических основ тревоги, связанной с тахикардией, исследователи провели скрининг мозговой активности после 15-минутной оптически индуцированной тахикардии. Благодаря картированию нейронов головного мозга удалось выявить изменения экспрессии генов в ответ на тахикардию. Авторы обнаружили, что нейроны двух областей — задней островковой коры (задней островковой доли) и ствола мозга — оказались в значительной степени активированными. Электрофизиологические записи активности головного мозга живых мышей также показали увеличение частоты возбуждения нейронов в задней части островковой доли во время оптически индуцированной тахикардии.
Островковая кора участвует как в интероцептивной обработке информации и формировании поведенческих паттернов, связанных с тревогой. На этом этапе авторы обнаружили корреляцию увеличения активности задней островковой доли с повышением частоты сердечных сокращений. Однако роль этого участка в формировании тревоги, индуцированной тахикардией, еще остается определить. Для изучения этого вопроса Сюэ с соавт. использовали оптогенетическую методику, благодаря которой удалось ингибировать нейроны задней островковой доли посредством другого опсина — белка iC++, чувствительного к синему свету.
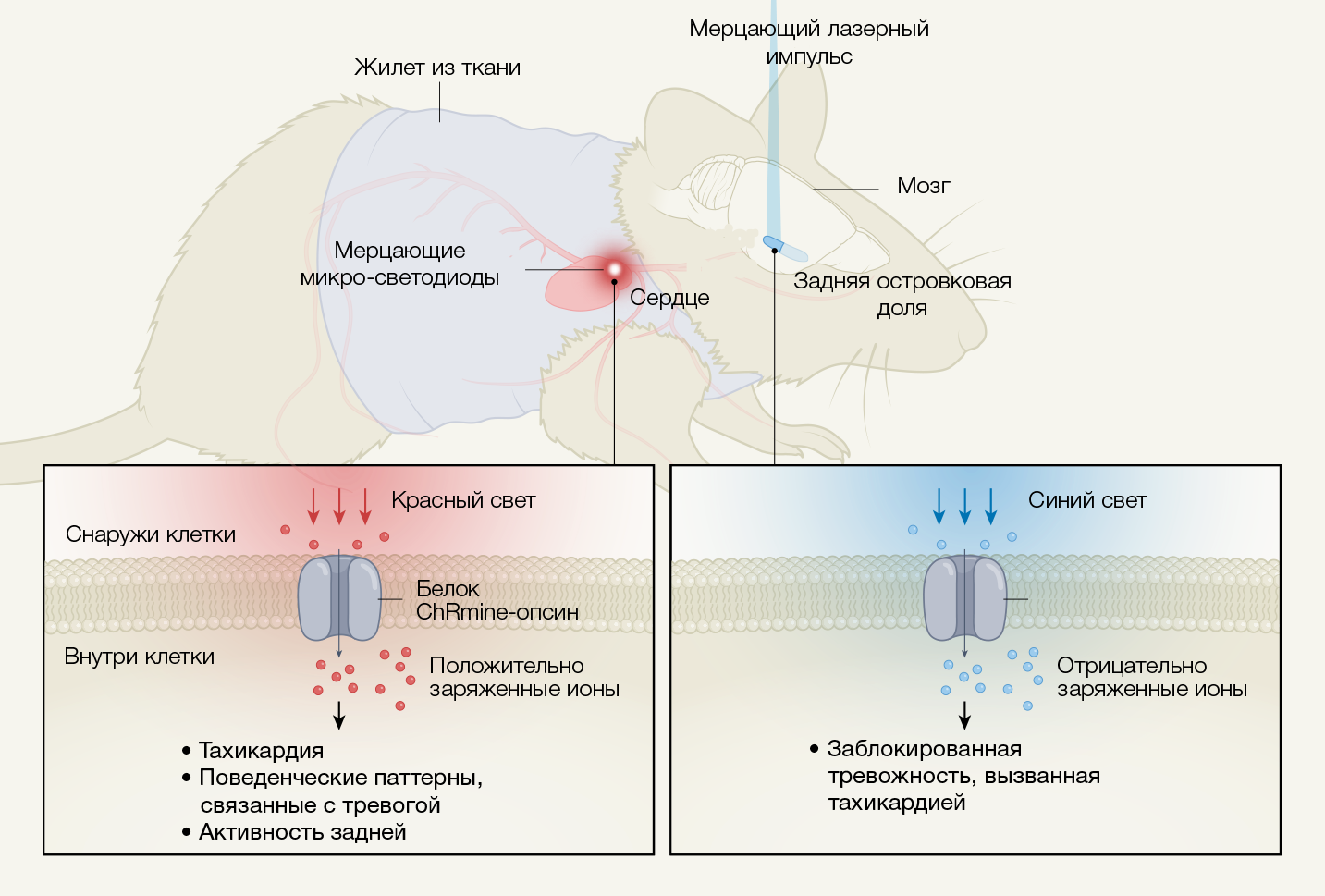
При этом авторы совершили еще одно открытие: подавление активности задней островковой доли при оптической стимуляции приводило к уменьшению тревожного поведения, вызванного тахикардией. Это указывает на то, что задняя островковая доля передает информацию о частоте сердечных сокращений, влияя, в свою очередь, на тревожность. Вышеупомянутое ослабление тревожности оказалось специфичным для задней островковой доли и не наблюдалось при оптогенетическом торможении другой области мозга — медиальной префронтальной коры.
Таким образом, повышение частоты сердечных сокращений способствует формированию паттернов поведения мышей, связанных с тревогой, и что это опосредуется активацией определенных структур мозга, например, задней островковой доли. Данное всестороннее исследование поднимает множество вопросов и открывает новые перспективы. К примеру, еще только предстоит выяснить, какие нейронные цепи и механизмы способствуют активации задней части островковой доли при тахикардии, а также какие нейронные цепи вызывают тревожное поведение.
Другим неизученным аспектом является продолжительность эффекта оптически индуцированной тахикардии: длится ли он несколько дней или недель. Данный вопрос имеет существенное клиническое значение. Это исследование закладывает основу для изучения долгосрочных изменений при хроническом повышении частоты сердечных сокращений в мозге, которые могут являться базисом развития опасных уровней тревожного расстройства. Проверить данную гипотезу затруднительно по техническим причинам, потому что жилет с микро-светодиодами (который надевали на мышей в ходе данной работы) не подходит для столь длительных периодов стимуляции и наблюдения.
Наконец, с точки зрения клинической перспективы, важно разработать дизайны исследований, в которых незначительно уменьшалась бы частота сердечных сокращений. Приведет ли это к изменениям в поведенческих паттернах, обусловленных тревогой? Работа Сюэ с соавт. стала первым шагом в направлении изучения данного вопроса.
