Первая полноценная модель эмбриона человека
На ранних этапах развития человеческие эмбрионы образуют структуру, называемую бластоцистой. Две исследовательские группы создали in vitro структуры, похожие на бластоцисты человека, предоставляющие ценную модель для эмбриологии человека.
Правильное понимание раннего развития человеческого организма имеет решающее значение в случае необходимости улучшения вспомогательных репродуктивных технологий и предотвращения выкидышей и врожденных дефектов. Однако изучение раннего развития является сложной задачей: доступно лишь малое количество человеческих эмбрионов, а исследования связаны со значительными этическими и юридическими ограничениями. Таким образом, методы, в основе которых лежит культивирование клеток in vitro для создания моделей эмбрионов млекопитающих, открывает впечатляющие возможности [1]. Две статьи в журнале «Nature» описывают ключевые достижения в этой области и свидетельствуют о том, что человеческие эмбриональные стволовые клетки [2] или клетки, перепрограммированные из тканей взрослых [2, 3], можно стимулировать для самоорганизации в чашке Петри. Эти клетки образуют структуры, напоминающие эмбрион человека на ранних этапах развития. Это первая комплексная модель человеческого эмбриона, в которой содержатся все типы клеток, относящиеся ко всем основным клеточным линиям плода и тканям его микроокружения.
Оплодотворенная яйцеклетка млекопитающих претерпевает серию клеточных делений в течение первых дней развития, что приводит к образованию структуры, называемой бластоцистой. Бластоциста содержит внешний слой клеток (трофоэктодерму), который окружает полость, содержащую кластер клеток, называемый внутренней клеточной массой (ВКМ). По мере развития бластоцисты ВКМ разделяется на две соседние популяции клеток: эпибласт и гипобласт (известный у эмбрионов мышей как примитивная энтодерма). Затем бластоциста имплантируется в ткань матки, создавая основу для события, называемого гаструляцией, при котором клетки эпибласта дают начало трем основным клеточным слоям, которые сформируют весь плод. Трофоэктодерма формирует большую часть плаценты, а гипобласт образует несколько слоев структуры, называемой желточным мешком, которая необходима для кровоснабжения плода на ранних фазах его существования.
В первых моделях in vitro, воспроизводящих образование бластоцист с помощью культур клеток (структур, известных как бластоиды), использовались стволовые клетки мышей, соответствующие стволовым клеткам, обнаруженным в эпибласте, трофобласте и примитивной энтодерме бластоцист мышей [4–6]. Однако достигнуть создания подобных бластоидов из клеток человека до сих пор не удавалось [1]. В предыдущих моделях раннего развития применялись стволовые клетки человека, развитие которых сходно с развитием постимплантационных прегаструляционных клеток эпибласта [7–9]. Таким образом, хотя эти модели и могли воспроизвести некоторые стадии постимплантационного развития человека, в них было мало клонов клеток, связанных с трофэктодермой, гипобластом или обеими этими структурами.
В настоящих работах Yu с соавт. [2] и Liu с соавт. [3] описаны человеческие бластоиды. Ключ к этим технологическим прорывам, по-видимому, заключался в двух аспектах: во-первых, в использовании клеток, представляющих клоны бластоцист человека; во-вторых, в оптимизации методик создания клеточных культур.
Yu с соавт. начали работу с человеческими эмбриональными стволовыми клетками, полученными из двух источников тканей: человеческих бластоцист или индуцированных плюрипотентных стволовых клеток, которые развиваются из взрослых клеток. Важно отметить, что оба этих типа стволовых клеток сходны по своему развитию с клетками эпибласта в бластоцисте, а также из них могут развиваться клеточные линии, связанные с трофоэктодермой и гипобластом. Напротив, Liu с соавт. перепрограммировали клетки кожи взрослых (фибробласты), в результате чего образовалась смешанная клеточная популяция, содержащая клетки с профилями экспрессии генов, аналогичными профилям клеток эпибласта, трофэктодермы и гипобласта. Как и в руководствах по созданию мышиных бластоидов [4–6], в обе методики входят: посев клеток в чашки для 3D-клеточной культуры (т. н. чашки Aggrewell) и обработка их жидкой питательной средой, содержащей химические факторы для контроля активности процессов молекулярной сигнализации, что жизненно необходимо для развития бластоцисты (рис. 1). Yu с соавт. последовательно обрабатывали клетки двумя различными типами питательной среды для усиления процесса дифференцировки клеток в клоновые линии, представляющие трофэктодерму и гипобласт.
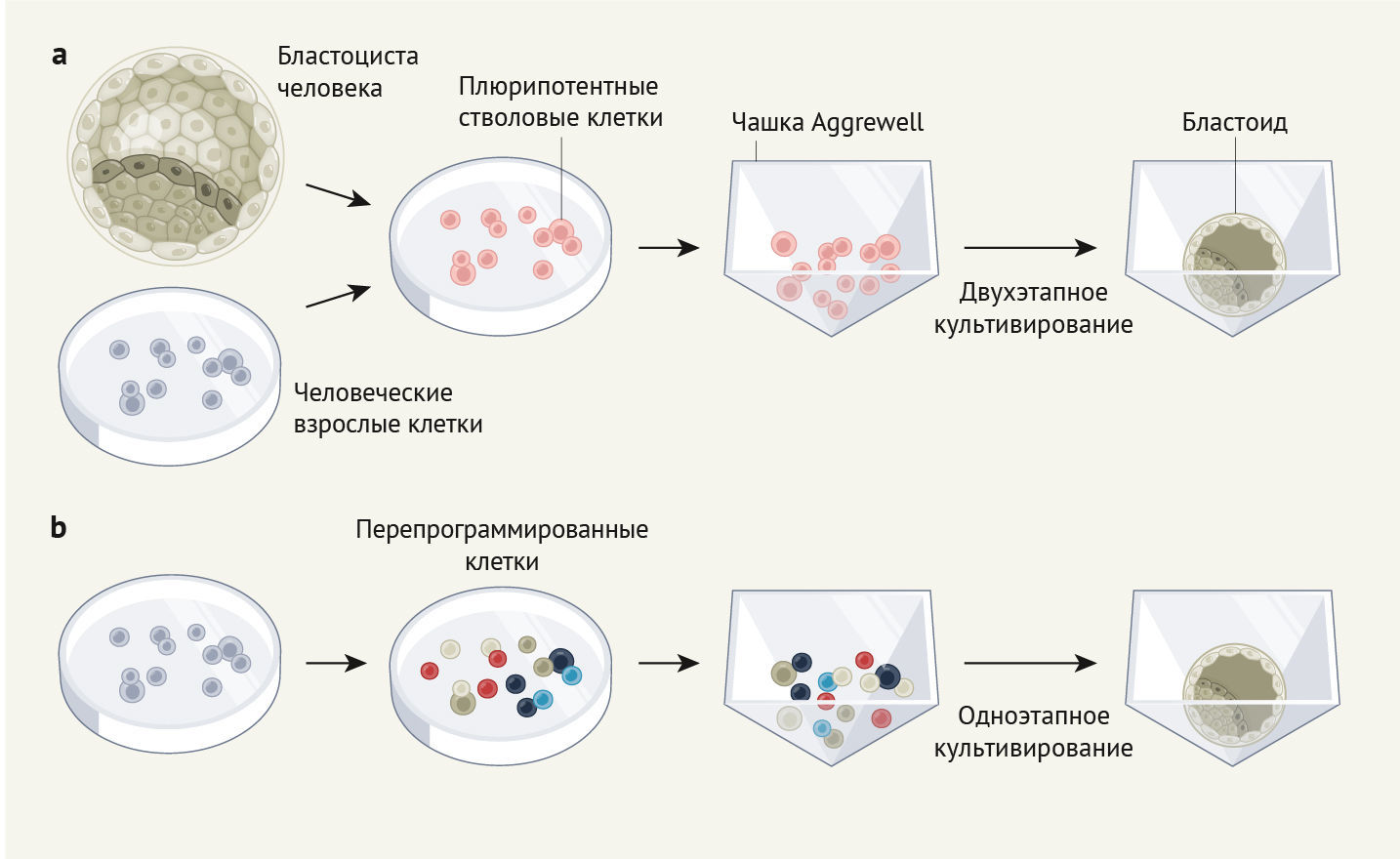
a. Yu с соавт. [2] использовали плюрипотентные стволовые клетки человека (hPSC), из которых развиваются клеточные линии, относящиеся ко всем типам клеток в бластоцисте. НPSC получали либо из бластоцист человека, либо путем перепрограммирования клеток взрослого человека. Авторы поместили hPSC в чашки для 3D-культуры (т. н. чашки Aggrewell) и использовали двухэтапный процесс культивирования для стимуляции образования человеческих бластоидов.
b. Liu с соавт. [3] перепрограммировали взрослые человеческие клетки в типы клеток, которые имели профили экспрессии генов, соответствующие трем типам клеток, обнаруженным в бластоцистах (также образовалась часть клеток неизвестного типа, обозначенных разными цветами на рисунке). Ученые использовали одноэтапный процесс создания бластоида с помощью 3D-культуры. (Обе схемы создания бластоидов учитывают наличие клеток неизвестного типа, на рисунке не показаны).
Обе группы исследователей обнаружили, что человеческие бластоиды возникали через 6–8 дней от начала культивирования с частотой образования этих структур 20 %, что сравнимо с частотой образования мышиных бластоидов [4–6]. Бластоиды человека имели такие же размер, форму, количество клеток в своем составе, как и естественные бластоцисты. Они содержали полость и кластер типа ICM.
Подробное изучение бластоидов (включая анализ геномной экспрессии и сравнение с данными об эмбрионах человека) выявило молекулярное сходство их клеточных линий с клеточными клонами бластоцист человека (до имплантации). Пространственная организация клеточных линий эпибласта, трофэктодермы и гипобласта соответствует таковой у человеческих эмбрионов до имплантации. Усилиями исследователей также удалось доказать то, что бластоидные клетки обладают ключевыми свойствами клеточных линий бластоцист: клетки, выделенные из бластоидов, пригодны для создания различных типов стволовых клеток. Yu с соавт. обнаружили, что если эти стволовые клетки трансплантировать в бластоцисты мыши, из них развиваются клетки, которые могут интегрироваться с соответствующими клеточными линиями в эмбрионе мыши.
Затем исследователи проанализировали дальнейшее развитие бластоидов, используя уже известный метод in vitro, имитирующий имплантацию в стенку матки. Как и в случае бластоцист, при проведении этой части исследования среди выращиваемых в течение 4–5 дней бластоидов некоторые прикреплялись к лабораторной посуде и продолжали развитие. У части этих прикрепленных бластоидов линия клеток, представляющая эпибласт, перестраивалась в структуру, охватывающую центральную полость, напоминающую проамниотическую полость, формирующуюся в эпибласте постимплантационных бластоцист. У некоторых бластоидов линия клеток, связанных с трофоэктодермой, распространялась и дифференцировалась в специализированные типы клеток плаценты. Yu с соавт. также наблюдали иную полость, образованную клетками, связанными с гипобластом, в некоторых бластоидах. Эта полость напоминала желточный мешок.
Все сведения, добытые исследователями, демонстрируют, что человеческие бластоиды являются перспективными моделями преимплантационного и раннего постимплантационного развития бластоцист in vitro. Однако существует ряд ограничений, которые необходимо преодолеть. Например, процент развивающихся бластоидов довольно низок и варьирует между клеточными линиями, полученными от разных доноров, а также между экспериментальными выборками. К тому же, эти три линии клеток, по-видимому, развиваются с несколько разной скоростью в отдельных бластоидах, а развитие бластоидов в одной и той же чашке не синхронизировано. Пространственная организация линии клеток, связанной с гипобластом, в бластоидах требует корректировки. Кроме того, бластоиды содержат неидентифицированные популяции клеток, не имеющие аналогов в естественных человеческих бластоцистах.
Другой вопрос заключается в том, что развитие бластоидов ограничено на постимплантационных стадиях, в отличие от бластоидов мышей [4–6]. Дальнейшая оптимизация культивирования и экспериментальных условий будет необходима для улучшения постимплантационного культивирования человеческих бластоидов in vitro в соответствии с 14 днями развития бластоцисты in vivo. Строгие этические правила не позволяют культивировать человеческие эмбрионы после этого периода, когда возникают структуры, характерные для фазы гаструляции. Трехмерные системы для культивирования бластоцист человека [10], которые эффективно поддерживают постимплантационное развитие, могут способствовать культивированию бластоидов до описанного выше предела. Это поддерживало бы нормальную трехмерную архитектуру ткани и пространственные отношения между различными клеточными линиями в бластоидах.
Человеческие бластоиды — это первые модели человеческих эмбрионов, полученные из клеток, культивируемых in vitro, которые имеют все основные клеточные линии плода и питающих его тканей. При совершенствовании процедур создания бластоидов они будут более точно имитировать бластоцисты человека. Это неизбежно приведет к разногласиям на почве биоэтики. Каким должен быть этический статус человеческих бластоидов и как он должен регулироваться? Применимо ли правило 14 дней в этой ситуации? Прежде чем приступить к исследованиям бластоидов человека с должной внимательностью необходимо получить ответы на эти вопросы. Для многих изучение человеческих бластоидов окажется менее спорным с этической точки зрения, чем изучение естественных человеческих бластоцист, однако другие люди могут расценивать исследования бластоидов человека как способ создания человеческих эмбрионов. Таким образом, непрерывное развитие моделей человеческого эмбриона, включая такую форму его, как бластоиды человека, требует общественного диалога по вопросам научной значимости, социальных и этических сторон таких исследований.
