Как возбудители менингита снижают резистентность организма к инфекции
Ученые обнаружили, что бактерия-возбудитель менингита способна стимулировать нервные волокна в оболочках головного мозга выделять нейропептиды, которые подавляют иммунный клеточный ответ и облегчают инвазию в центральную нервную систему.
Менингит — это заболевание, которое развивается при попадании возбудителя в оболочки мозга и запуске мощного воспалительного ответа организма. Заболевание представляет высокую опасность для организма и при отсутствии надлежащего лечения с большой степенью вероятности приводит к смертельному исходу, а выжившие пациенты зачастую долго страдают от неврологических осложнений [1]. Хотя накоплено уже довольно много сведений о самом патологическом процессе при развитии менингита, все еще остаются пробелы в понимании того, как иммунокомпетентные клетки борются с бактериальной инвазией и защищают ткани мозга от повреждений. В своей статье в Nature Пино-Риберо с соавт. [2] показали взаимоотношения между чувствительными нейронами и иммунными клетками в мозговых оболочках, которые облегчают бактериальную инвазию и развитие менингита у мышей. Авторы демонстрируют, что бактерии могут усиливать собственное распространение по центральной нервной системе (ЦНС) путем стимуляции чувствительных нейронов оболочек мозга для выделения последними молекул нейропептида, которые ослабляют активность иммунных клеток, выполняющих роль «стражников».
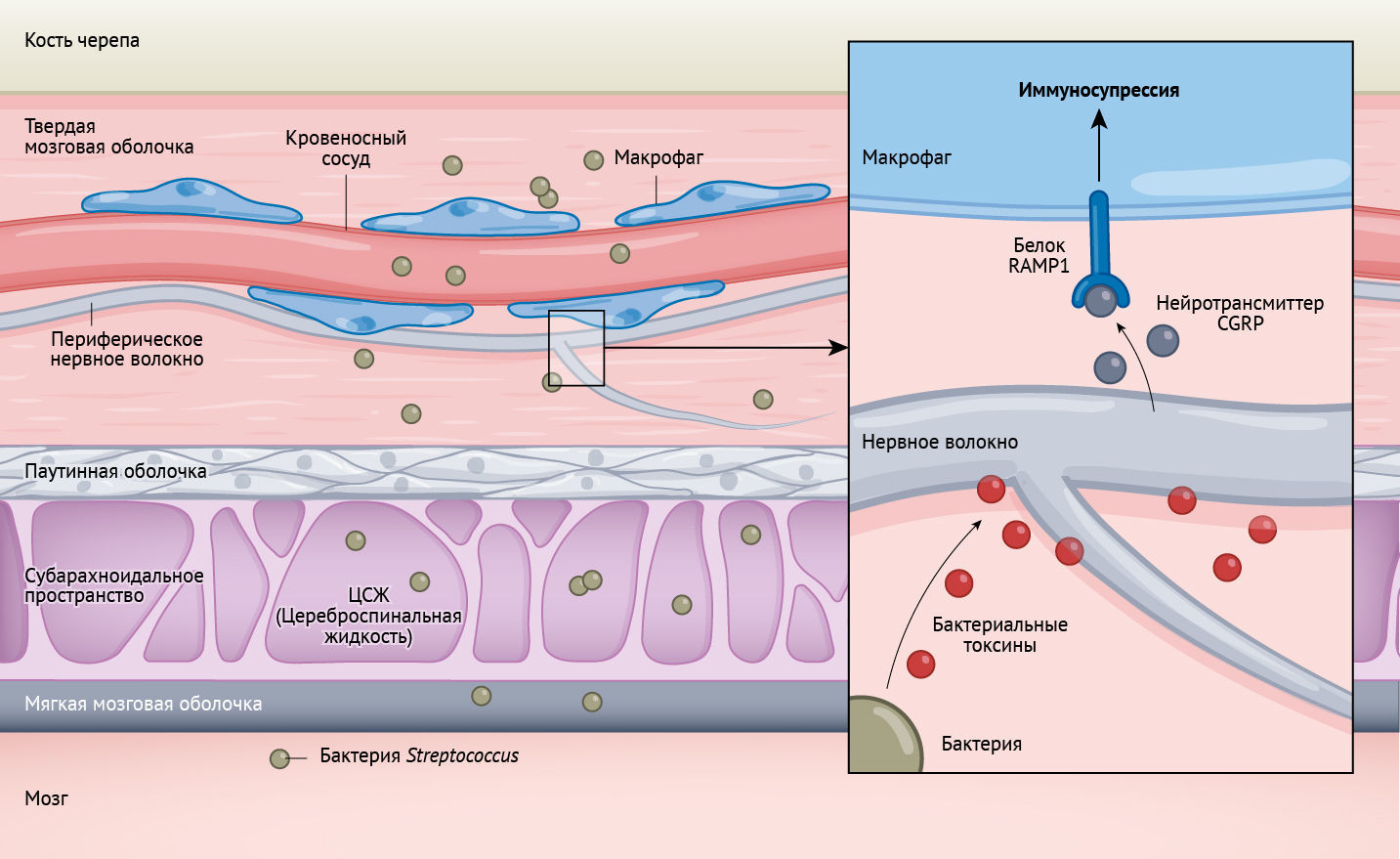
Мозговые оболочки — это набор из трех наслаивающихся друг на друга мембран, называемых твердой (dura mater), паутинной (arachnoid mater) и мягкой оболочками (pia mater) (см. рис. 1), которые окружают ЦНС и выполняют роль ключевого барьера для защиты от различных микроорганизмов [3]. Внешний слой — это твердая мозговая оболочка; являет собой толстую мембрану, которая находится прямо под костями черепа. Под твердой мозговой оболочкой находятся паутинная и мягкая мозговые оболочки, для обозначения которых существует особый термин — лептоменинкс.
Кровеносные сосуды в лептоменинксе и головном мозге надежно закупорены в т.н. плотные соединения. Они формируют барьер, ограничивающий попадание микробов из кровотока в ЦНС. Кровеносные сосуды в твердой мозговой оболочке лишены этих плотных соединений и той антимикробной защиты, которую последние обеспечивают. Таким образом, твердая мозговая оболочка напоминает ткани, находящиеся вне головного мозга и относится к периферическим. По причине такой восприимчивости к проникновению микробов, мозговые оболочки защищены набором из разнообразных иммунных клеток, которые быстро реагируют на проникновение инфекционного агента.
Другой примечательной особенностью мозговых оболочек является их иннервация периферическими чувствительными нейронами — ноцицепторами, которые способны распознавать тепловые, механические и химические раздражители. Эти нейроны также могут реагировать на антигены, что выражается в ощущении боли. Согласно предыдущим исследованиям, ноцицепторы взаимодействуют с иммунными клетками в периферических тканях, например, в коже и кишечнике, обеспечивая регуляцию противоинфекционного иммунитета [4]. Давно известно, что твердая мозговая оболочка получает мощную иннервацию множеством периферических нервных волокон, которые отходят от скоплений нейронов — ганглий [5]. Существуют различные типы нервных волокон: адренергические, холинергические и пептидергические. Они классифицируются по выделяемым ими веществам-мессенджерам.
При активации пептидергические нервные волокна могут выделять нейропептид, называемый CGRP (пептид, связанный с геном кальцитонина), который играет ключевую роль в развитии головной боли и мигрени [6,7]. Активация менингеальных нейронов может вызывать головные боли, однако мало информации о том, как они регулируют иммунные реакции в мозговых оболочках. Интересно, что сильная головная боль является ранним симптомом бактериального менингита [1]. Это позволяет предположить, что активация менингеальных ноцицепторов происходит довольно скоро после инфицирования человека.
Пино-Рибейро с соавт. исследовали иммунологию менингеального барьера, подвергая мышей воздействию двух видов бактерий, которые наиболее часто вызывают менингит у людей: Streptococcus pneumoniae и Streptococcus agalactiae. После введения бактерий в кровоток животных авторы определили, как происходит инфицирование различных менингеальных слоев. Согласно их результатам, вначале бактерии инфицируют твердую мозговую оболочку, а затем перемещаются в нижележащий лептоменинкс и головной мозг. В твердой мозговой оболочке бактерии обнаруживались рядом с ноцицепторами, а согласно исследованиям клеточных культур, токсины, выделяемые бактериями, активируют эти нервные волокна и способствуют высвобождению CGRP.
Чтобы оценить роль ноцицепторов в патогенезе менингита, авторы применили комбинацию фармакологических и генетических методик для торможения передачи сигналов по нервным волокнам [8]. Важно отметить, что местное или системное уменьшение количества ноцицепторов снижало концентрацию бактерий в оболочках мозга и головном мозге после заражения. Оказалось, что такое снижение связано с увеличением количества иммунных клеток, называемых макрофагами и нейтрофилами, в твердой мозговой оболочке. Это позволяет предположить, что ноцицепторы задействованы в подавлении локального антибактериального иммунного ответа.
Учитывая, что токсины S. pneumoniae и S. agalactiae стимулировали выработку CGRP ноцицепторами, авторы определили, какова роль этого сигнального пути в развитии менингеального иммунного ответа на бактериальную инвазию. CGRP индуцирует сигнализацию посредством белка-рецептора RAMP1 (ссылка 9), а фармакологическая блокада или генетическая делеция этого рецептора снижает содержание бактерий в мозговых оболочках и усиливает иммунный ответ. Кроме того, введение ингибитора RAMP1 мышам (с терапевтической целью) через шесть часов после заражения S. pneumoniae тормозило развитие симптомов, хотя и не предотвращало гибель животных.
Затем Пино-Рибейро с соавт. попытались изучить, как на менингеальные иммунные клетки, которые обеспечивают раннюю защиту от вторжения бактерий, влияет сигнализация посредством CGRP. Авторы провели секвенирование одноклеточной РНК менингеальных иммунных клеток неинфицированных мышей и обнаружили, что у различных иммунокомпетентных клеток (моноцитов, макрофагов, нейтрофилов) наблюдается высокая степень экспрессии гена, кодирующего белок RAMP1 (эти же клетки также выделяют фермент лизоцим М — LyzM).
Благодаря этому открытию авторам удалось вывести линию мышей с удаленным геном, кодирующим RAMP1, в иммунных клетках, выделяющих LyzM. У этих мышей по сравнению с контрольной группой количество бактерий в мозговых оболочках и головном мозге оказалось меньше, что сопоставимо с таковым у грызунов с минимальным количеством менингеальных ноцицепторов. Эти результаты позволяют предположить, что сигнализация посредством RAMP1 в иммунных клетках, выделяющих лизоцим, ответственна за подавление антибактериального иммунного ответа в мозговых оболочках.
Гистиофагоциты (клетки-мусорщики, в число которых входят и макрофаги) играют решающую роль в защите от бактериальных инфекций и являются наиболее распространенными иммунными клетками в мозговых оболочках. Пино-Рибейро с соавт. обнаружили, что заражение S. pneumoniae ассоциировалось с увеличением количества менингеальных макрофагов в течение дня после инфицирования, и что на клеточном уровне наблюдалось повышение экспрессии различных иммунных сигнальных молекул (хемокинов) этими макрофагами. На основании этих данных авторы предполагают, что резидуальные макрофаги защищают мозговые оболочки от инфекции, выделяя хемокины, которые вовлекают в каскад иммунных реакций клетки с периферии, и что эту функцию подавляет сигнализация посредством RAMP1.
Данная теория подтверждается несколькими направлениями в исследованиях. Уменьшение количества менингеальных макрофагов приводило к снижению численности вовлеченных в иммунный процесс моноцитов и нейтрофилов в мозговых оболочках и, следовательно, усилению бактериальной инвазии. Напротив, делеция гена белка RAMP1 у менингеальных макрофагов снижает бактериальную инвазию мозговых оболочек до значений, сопоставимых с таковыми у мышей с низким количеством ноцицепторов. В экспериментах с клеточными культурами авторам также удалось продемонстрировать, что S. pneumoniae способствует выработке хемокинов макрофагами, что может подавляться воздействием CGRP.
Все эти данные подтверждают существование механизма, с помощью которого бактериальная инвазия в твердую мозговую оболочку стимулирует выделение CGRP ноцицепторами, что подавляет экспрессию хемокинов в менингеальных макрофагах. Это, в свою очередь, ослабляет вовлечение в иммунный процесс моноцитов и нейтрофилов и усиливает бактериальную инвазию. Выделение менингеального CGRP после бактериальной инфекции играет роль в развитии болевого синдрома (включая и головную боль). Также, по всей видимости, этот нейропептид тормозит активность резидуальных макрофагов, давая бактериям небольшое преимущество.
Поэтому будет разумным изучить вопрос о том, может ли блокада RAMP1-сигнализации в макрофагах способствовать улучшению клинического течения в случае бактериального менингита. Однако стоит подчеркнуть, что существуют механизмы, которые подавляют иммунный ответ: обычно они защищают организм от чрезмерной активности иммунной системы. ЦНС относительно плохо «переносит» заболевания, в ходе развития которых активно протекают иммунные реакции, а мобилизация моноцитов и нейтрофилов может вызвать обширное повреждение кровеносных сосудов и отек головного мозга, особенно после инфекции [10].
Способность ноцицепторов воспринимать присутствие бактерий предоставляет мозговым оболочкам потенциальный механизм для «определения» масштабов инфекции и соответствующей настройки реакций резидуальных макрофагов посредством высвобождения CGRP. Однако этот механизм — поистине «хождение по лезвию ножа»: он сопряжен с риском усиления бактериальной инвазии мозга и его оболочек.
