Новый взгляд на концепцию критического заболевания

Аннотация
Исследования и клиническая практика в реаниматологии долгое время определялись синдромами, которые, несмотря на то, что представляют собой клинически распознаваемые сущности, фактически являются смесью гетерогенных состояний, способных по-разному отвечать на терапию. Накапливающиеся трансляционные данные, подкрепленные исследованиями дыхательной недостаточности вследствие инфицирования коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2), дают основание предполагать, что нынешняя концепция критического состояния, основанная на синдромах, должна быть пересмотрена. В настоящей статье авторы обсуждают новые данные фундаментальных и клинических исследований в области интенсивной терапии и изучают, как они могут стать основой новой концептуальной модели критического заболевания. Авторы переносят акцент с синдромов на вызывающие их биологические изменения, которые лежат в основе критических состояний и которые можно было бы лечить. Авторы строят гипотезу, согласно которой такой подход ускорит исследования в области реаниматологии, что приведет к более глубокому пониманию патобиологии критического заболевания и ключевых факторов, определяющих результаты лечения пациентов. Это, в свою очередь, поможет в разработке более эффективных клинических испытаний и в усовершенствовании клинической практики.
Главное
В отделение реанимации и интенсивной терапии (ОРИТ) поступила 66-летняя женщина с лихорадкой, кашлем и одышкой. У нее диагностировали пневмонию, после чего пациентке провели интубацию и подключили к аппарату искусственной вентиляции легких. На следующий день рентген грудной клетки выявил двустороннюю инфильтрацию, а анализ содержания газов в артериальной крови показал тяжелую гипоксемию. Лечащие врачи размышляли, что делать дальше.
Если бы эта пациентка поступила в 2019 г., то медицинская помощь для нее создавала бы больше вопросов, чем ответов. У нее был и сепсис, и синдром опасной для жизни функциональной недостаточности органов, и острый респираторный дистресс-синдром (ОРДС) — синдром дыхательной недостаточности, связанный с повреждением легких и нарушением газообмена. Оба эти синдрома были предметом многих эпидемиологических и интервенционных исследований, однако полученные в результате данные клинически малозначимы. Помимо противомикробных препаратов, не существует специфического способа лечения сепсиса [1], а искусственную вентиляцию легких, применяемую для терапии ОРДС, можно оправданно использовать для любого пациента в ОРИТ [2].
Если бы она поступила сегодня, — в зависимости от географического положения и времени года — ее состояние могло бы быть результатом тяжелой формы коронавирусной инфекции (COVID-19). Она по-прежнему отвечала бы критериям как для сепсиса, так и для ОРДС, и предположительно столкнулась бы с той же степенью врачебной неуверенности. Однако в последние несколько лет многие крупные рандомизированные исследования предоставили кладезь данных, позволяющих предположить, что для пациентки в таком состоянии будут полезны кортикостероиды [3] и антагонисты рецептора интерлейкина 6 [4, 5], и что подходы для лечения более легкой формы заболевания, такие как применение ремдесивира [6] и системной антикоагуляции [7] окажут существенный эффект с малой вероятностью. К огромному облегчению многих, прежде сухой ландшафт клинических данных в реаниматологии начал давать ростки.
Ниже авторы статьи рассматривают, как достижения в трансляционной интенсивной терапии привели к переломному моменту и каким образом эти достижения фундаментально изменяют способ концептуализации и классификации критических состояний.
Новая эра в исследованиях в области трансляционной интенсивной терапии
Область медицины критических состояний можно описать тремя этапами развития (рисунок 1). На первом этапе («Основы», ок. 1955–1980 гг.) в реаниматологию были введены механическая вентиляция легких и постоянный мониторинг физиологических параметров, а также более высокое соотношение числа медработников и пациентов, стандартизованные практики; начинало появляться понимание интенсивной терапии как отдельной медицинской специальности. Эти технологические достижения дали фундамент для основанного на физиологии понимания реакции организма на повреждение и спасли жизни пациентов, которые в противном случае могли бы умереть. Критическое заболевание определялось как патофизиологический процесс на уровне органов (например, шок и дыхательная недостаточность), и медицинская помощь в рамках интенсивной терапии была сосредоточена на поддержании гомеостаза на органном уровне (например, вспомогательная вентиляция легких и вспомогательное кровообращение).
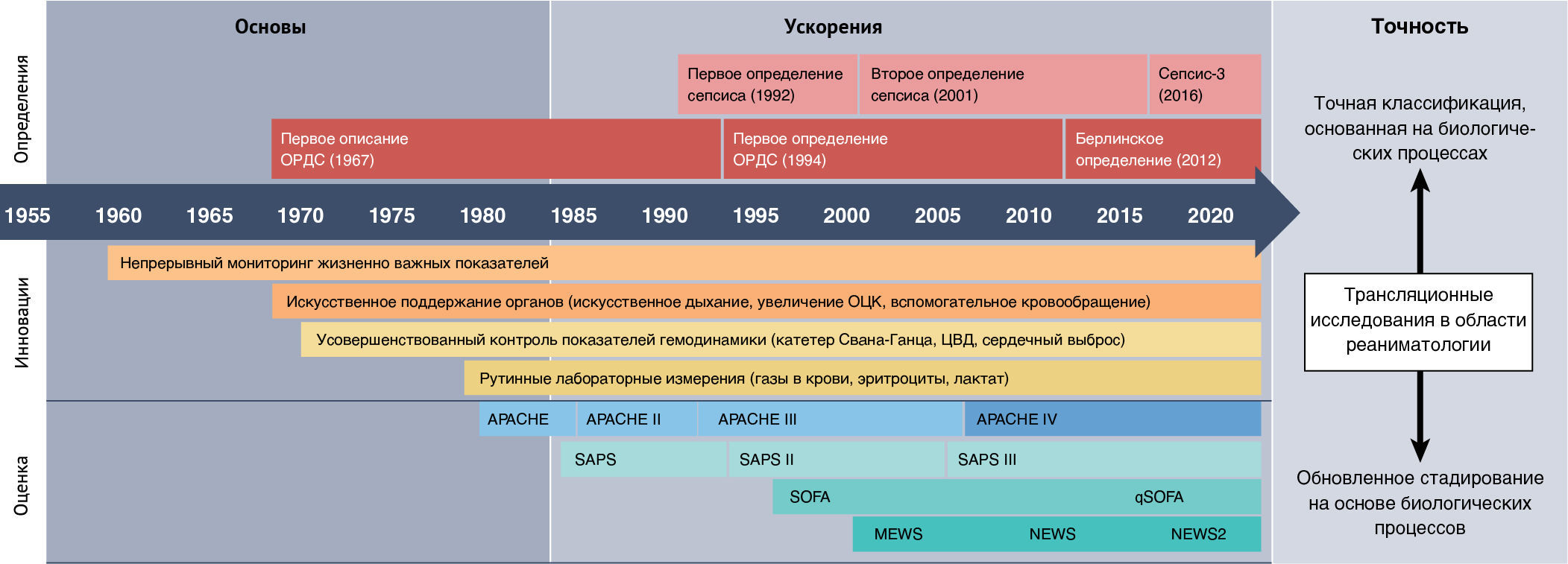
ЦВД — центральное венозное давление.
Вторая стадия развития в области интенсивной терапии («Ускорение», ок. 1980–2020 гг.) наступила вместе с достижениями в трансляционных исследованиях, которые предложили улучшенное понимание патофизиологии реакций организма. В эту эпоху сфера интенсивной терапии приобрела структуру благодаря появлению систем количественных оценок и стандартизованного определения синдромов. К ним относятся шкала APACHE [8], а также определения для синдрома системного воспалительного ответа (ССВО), сепсиса [9] и ОРДС [10]. Все это создало основу для скрупулезных клинических и трансляционных исследований, которые в комбинации с улучшенной организацией и междисциплинарным сотрудничеством привели к огромному прогрессу в клинических исходах у пациентов, находящихся в критическом состоянии.
Появляющиеся в последние годы данные позволяют предположить, что, несмотря на изначальную пользу для исследований и практики, существующие концепции заболеваний не всегда достаточно охватывают всю сложность критического состояния [11, 12]. Достижения омиксных наук, анализа и обработки данных и машинного обучения свидетельствуют о гетерогенности типичных синдромов ОРИТ. Данные об экспрессии генов из крови как детей, так и взрослых пациентов с сепсисом были исследованы с применением алгоритмов иерархической кластеризации для выявления и подтверждения различных подгрупп пациентов с общими транскриптомными ответами на тяжелую инфекцию [13–19]. Сходным образом, анализ латентных классов (другой статистический метод определения подгрупп в популяции) был использован совместно с клиническими и биомаркерными данными пациентов с ОРДС для выделения гиповоспалительного и гипервоспалительного подтипов [20–22]. Эти результаты прекрасно соответствуют повседневному опыту врачей, лечащих пациентов в критическом состоянии, которые, несмотря на наличие общих диагнозов, тем не менее демонстрируют значительные вариации в клиническом течении и исходе болезни [19–25]. Существует все более непреодолимая потребность пересмотреть превалирующий подход к классификации критического заболевания [26–28].
Медицина интенсивной терапии сейчас находится на пороге кардинальных перемен — третьей фазы развития («Точность»; рис. 1), которая определяется достижениями трансляционной науки. Этот этап будет более революционным, чем предыдущие, и потребует полной перестройки существующих рамок классификации.
Синдромы критического состояния
Большинство заболеваний, которые лечат в ОРИТ, являются критическими. Такие состояния, как сепсис, ОРДС, острая почечная недостаточность, бред и даже хроническое критическое заболевание характеризуются не какими-либо определенными признаками биопсии, генетической мутацией, микробной культурой или серологическим тестом, но набором характеристик и симптомов, которые в совокупности создают картину клинически распознаваемой сущности. В результате синдромы критического состояния гетерогенны по своей природе. Например, сепсис может возникать в результате множества инфекций, вызываемых многими различными патогенами и приводящих к различным паттернам повреждения органов. ОРДС может развиваться как от легочных (таких как пневмония или аспирация), так и от нелегочных триггеров (таких как травма или панкреатит), а бред может проявляться как в виде возбуждения, так и в виде сонливости. Существует также временная гетерогенность; пациент, отвечающий диагностическим критериям для одного синдрома в определенное время, может проходить через различные — часто коренным образом различные — фазы. Следует также добавить огромную гетерогенность ответа организма на повреждение среди разных индивидуумов.
Несмотря на ограничения, синдромы позволяют с объективностью и воспроизводимостью объединять пациентов в когорты и, таким образом, полезны для исследований и повышения качества оказания медицинской помощи. Синдромы также могут быть «прогностическими», что означает возможность использования их для оценки вероятности того или иного исхода. Например, современные клинические критерии для септического шока связаны с риском смерти, превышающим 40 % [29]. Эти критерии, тем не менее, не позволяют определять, какие пациенты будут отвечать на специфическое лечение. Классификаторы, выполняющие такую функцию, часто называют «предсказательными». Например, при коагулопатии вследствие тромбоцитопении часто помогает переливание тромбоцитов, в то время как если коагулопатия наступает в результате дисфибриногенемии, этот подход неэффективен. Это неотъемлемое ограничение классификации критических состояний, основанной на синдромах, возникает из-за того, что текущие критерии в большей степени базируются на результатах клинических исследований, нежели на биологических процессах, которые их порождают. Важным вопросом, таким образом, будет — целесообразна ли нынешняя схема классификации на основе синдромов и есть ли необходимость в создании нового подхода?
Трансляционная классификация критических состояний
Классификации заболеваний предлагались и пересматривались с античных времен, но по большей части существенные компоненты изменялись очень слабо. Современные схемы, такие как система Международной классификации болезней (МКБ), поразительно схожи с ранней таксономией, разработанной Линнеем в XVIII в., в то время как отдельные заболевания специфицируются на основе признаков и симптомов, и отношения между ними часто описываются иерархией вложений.
Тем не менее, появились важные концептуальные достижения (блoк 1). В онкологии система классификации стадий онкологических заболеваний «опухоль — узлы — метастазы» (TNM) полезна в плане рассмотрения злокачественной опухоли не как единичного заболевания, а как собрания взаимосвязанных состояний, оптимальная терапия которых зависит от степени их прогрессии. При адаптации этой концепции для ОРИТ была предложена модель ППОД (англ. PIRO) (предрасположенность — повреждение — ответ — дисфункция органа), призванная подчеркнуть, что на ответ на терапию влияет гораздо больше факторов, чем те, что отвечают определенным критериям синдромов; на клинический исход у пациента также сильно воздействует его базовая физиология, природа провоцирующего повреждения и способ, которым реагируют различные системы органов [30].
Модель ППОД была важным начальным шагом к признанию гетерогенности критических заболеваний. Но трансляционные и клинические данные, полученные в последние десятилетия, углубили понимание сложности критического состояния и его биологических детерминант, побуждая пересмотреть нозологию интенсивной терапии. Чтобы извлечь максимум из этих открытий, новая концепция должна учитывать сложность и неоднородность, а также устанавливать более тесное соответствие между диагностикой и лечением. Другими словами, классификация критических состояний должна быть не только прогностической — какими являются синдромы — но и предсказательной, позволяя исследователям и клиницистам сфокусироваться на мерах, необходимых для улучшения клинического исхода.
Новая система классификации должна концептуально охватывать событие, запускающее болезнь, возникающие физиологические нарушения и способы лечения, которые бы вернули поврежденную систему (или системы) в здоровое состояние. В настоящей статье авторы предлагают новую концепцию, начиная с повреждений — событий, которые вызывают острый сдвиг гомеостаза с некоторого базового положения с потенциальной возможностью привести к критическому состоянию. Повреждения многочисленны и разнообразны. Инфекция, травма, инсульт, кровотечение/кровоизлияние, передозировка и обширная хирургическая операция — все они представляют собой резкое изменение в базовой физиологии и все являются распространенными причинами поступления в ОРИТ. Повреждения приводят к нарушениям в системах тела, которые, в свою очередь, приводят к болезненным состояниям, нарушению функции органов и клинически явной морбидности.
В основе этой модели — более прямое соответствие между повреждениями и патофизиологическими состояниями, которые они вызывают. Это достигается помещением повреждения, вместе с его физиологическими последствиями и возможными методами лечения, в систему причинно-следственных связей. Здесь причинность служит ключевой характеристикой и важным отличием от современных синдромных классификаций. Например, хотя известно, что жидкости в целом полезны при септическом шоке, а низкое рабочее давление при искусственной вентиляции легких помогает при ОРДС, гетерогенность этих состояний ограничивает возможность сделать выводы на основе причинно-следственных связей, препятствуя таким образом практическому применению этих принципов при лечении любого индивидуального пациента.
Чтобы повысить точность диагностики в интенсивной терапии, авторы прибегают к концепции «излечимой черты» — специфического физиологического нарушения, характеризуемого биомаркерами, которые предсказывают ответ на определенную терапию [31]. Хотя обычно считается, что биомаркеры связаны со специфическими лабораторными тестами — обычно анализами крови или тканей — применение этого термина здесь толкуется гораздо шире. В контексте излечимой черты под термином «биомаркер» авторы понимают любую наблюдаемую черту, которая соответствует биологической аномалии в области интереса и которая лежит в основе прогноза того, как пациент будет отвечать на лечение. В силу этого биомаркеры могут включать транскриптомные характеристики, полученные при секвенировании РНК, факторы вирулентности, выявляемые при помощи геномики патогенов, признаки, заметные в исследованиях с применением передовых методов визуализации или даже нарушения баланса в автономной нервной системе, определяемые по миллисекундным вариациям сердечного ритма. Они также могут включать простые и рутинно измеряемые клинические переменные, такие как кислородная сатурация, уровни гемоглобина и концентрации глюкозы, которые в настоящее время служат приемлемыми маркерами, позволяя предсказывать эффекты подбора дозы кислорода, переливания крови и инсулиновой терапии, соответственно. Какая конкретно применяется процедура, не столь важно; первостепенно то, что характеристику можно измерить, что она соответствует повреждению или физиологическому процессу, наносящему вред, и что ее можно связать с ответом на лечение.
Данные дают основание полагать, что различные повреждения становиться началом общих молекулярных паттернов поражений. В значимой работе программы «Воспаление и ответ организма на повреждение» (NCT00257231) воспроизводили клинические наблюдения за патофизиологическими сходствами синдромов клинического состояния путем демонстрации того, что молекулярные признаки травмы и ожогового поражения включают активацию сходных путей, связанных с инфекцией и воспалением [32]. Недавно эта работа была расширена и выявила молекулярные сходства между бактериальным сепсисом и вирусным сепсисом, вызванным COVID-19 [33], а также между ОРДС и панкреатитом [34]. На основании этих наблюдений можно предположить, что некоторые сигналы могут генерализовываться при различных формах критического заболевания, вызванного весьма различными повреждениями.
Такие открытия указывают на не охарактеризованное ранее обилие биологических детерминант критического состояния. Это в гораздо большей степени взаимодействие одной из них с многими или даже многих с многими, нежели взаимодействие единичной с единичной. Поскольку традиционные иерархические модели классификации не позволяют легко изобразить такую систему, авторы предлагают круговую модель, показанную на рис. 2; она показывает точные биологические процессы, которые характеризуют механизм течения болезни при различных патологических состояниях вне зависимости от повреждения, вследствие которого они возникают. Такая конфигурация лучше отражает сложность критического заболевания, учитывая, что определенные состояния могут достигаться через разные причинно-следственные пути; это, несмотря на важность повреждения самого по себе, представляет собой результирующее физиологическое состояние, которое может лучше характеризовать текущий статус пациента.
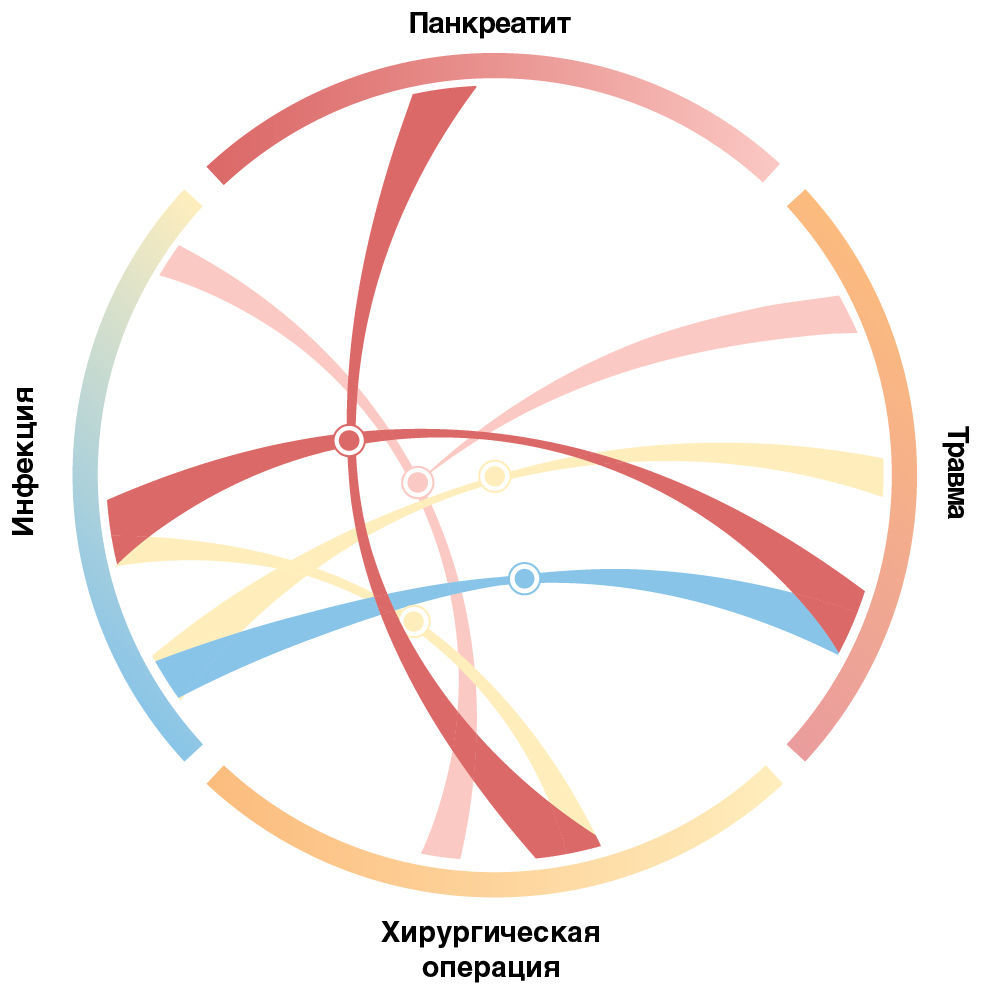
Для иллюстрации потенциальной пользы модели, построенной таким образом, рассмотрим роль сигнального пути Toll-подобного рецептора (TLR) при критическом заболевании. Пути TLR участвуют в воспалительных реакциях и, как известно, активируются различными триггерами: как экзогенными (например, бактериальным эндотоксином), так и эндогенными (например, гемом и гиалуроновой кислотой) [35]. Действительно, активация путей TLR обнаруживается при построении генных профилей в условиях как травмы [32], так и сепсиса [36]. Так или иначе, с учетом гетерогенности этих клинических синдромов, а также различий генетических детерминант иммунного ответа на активацию TLR [37], степень опосредованного TLR воспаления, по-видимому, варьирует у разных пациентов. Такая биологическая гетерогенность может частично объяснить, почему ингибирование TLR-опосредованного воспаления не представляется эффективным методом лечения для когорт, выделенных на основе диагностических критериев тяжелого сепсиса [38]. Однако авторы предполагают, что этот подход будет полезен для подгруппы пациентов с сепсисом и более выраженным нарушением регуляции TLR-сигналинга. Более того, они также выдвигают гипотезу, согласно которой для подгруппы пациентов с травмами, у которых выражена дезадаптивная регуляция путей TLR, такой подход также будет полезен, даже если их заболевания имеют различную причину. Ответ на этот вопрос потребует проведения клинического испытания, для которого пациенты перспективно отбираются на основе излечимой черты, — в данном случае, активации TLR, — а не клинического синдрома, такого как сепсис или травма.
Сигнальный путь TLR также может играть важную роль в реакции организма на инфицирование коронавирусом 2 (SARS-CoV-2) острого респираторного синдрома. Быстрое полногеномное секвенирование пробандов с COVID-19 выявило делеции в гене TLR7, которые были связаны с фенотипом критического заболевания крайней степени [39]. Хотя здесь также участвует TLR-сигналинг, природа нарушения иная; у вариантов с потерей функции повреждается опосредованный интерфероном ответ на вирус, и как следствие, развивается критическая форма COVID-19. Авторы резонно предполагают, что в этих случаях будет эффективен агонист TLR (такой как имиквимод), а не антагонист. Это могло бы быть отдельной излечимой чертой, которая также может встречаться при других состояниях, включая злокачественные новообразования кожи [40].
Концептуальную модель для интенсивной терапии, предложенную здесь, еще предстоит проверить в проспективных клинических испытаниях; для этого потребуются исследования, в которых пациенты отбираются на основе излечимых черт, а не синдромных критериев. Тем не менее, накапливаются первые данные о применимости и эффективности такого подхода. Например, в платформе I-SPY в онкологии применяется молекулярное профилирование опухолей молочной железы для определения специфических подтипов, которые с наибольшей вероятностью будут отвечать на определенную терапию, такую как действие тирозинкиназного ингибитора нератиниба [41]. Такая методика, часто называемая прогностическим обогащением, используется для оценки многих подтипов рака молочной железы, выделяемых на основе данных об экспрессии генов, часто совместно с адаптивной рандомизацией — типом стратегии распределения лечения, которая корректирует коэффициенты рандомизации в соответствии с промежуточными результатами. Объединение I-SPY недавно расширилось для запуска платформы для клинических испытаний II фазы I-SPY COVID, разработанной для применения адаптивной рандомизации с целью быстрой оценки целесообразности новых методов терапии COVID-19 и дальнейшим продвижением потенциально перспективных к более крупным окончательным испытаниям [42].
В рандомизированных исследованиях в реаниматологии начали изучать применение прогностического обогащения для снижения гетерогенности терапевтического эффекта, которое наблюдается, если отбор пациентов идет по синдромным критериям. Один из примеров — исследование EUPHRATES, в котором тестировали использование гемоперфузии полимиксина B у пациентов с септическим шоком [43]. Эта терапия разработана для устранения из кровотока бактериального эндотоксина и поэтому вместо набора всех пациентов, отвечающих синдромным критериям для септического шока, исследовали рандомизировали только тех пациентов, у которых был высокий базальный уровень циркулирующего эндотоксина. Опыт EUPHRATES демонстрирует целесообразность использования биомаркера для быстрого выделения специфической подгруппы пациентов, для которых ожидается наилучший ответ на лечение. Он также иллюстрирует трудности определения излечимых черт. При отсутствии различий в смертности между группами лечения и плацебо это исследование подчеркивает важность определения соответствующих подгрупп, поиска прогностических биомаркеров и разработки реалистичных показателей ответа на лечение.
Недавние клинические испытания, посвященные COVID-19, во многих отношениях также показали потенциальную целесообразность применения концепции излечимой черты для устранения неоднозначности синдромов клинического заболевания и повышения количества практически значимых данных. Роль кортикостероидов в лечении ОРДС остается неопределенной, но многие пациенты с ОРДС в качестве последствия COVID-19 положительно реагируют на это лечение [3]. Здесь положительный тест на вирус SARS-CoV-2 с использованием полимеразной цепной реакции (ПЦР) можно рассматривать как биомаркер для подтипа ОРДС с повышенной вероятностью ответа на терапию кортикостероидами. Дополнительным нюансом является прогностическая важность динамических факторов пациента, таких как время относительно изначального повреждающего воздействия и тяжесть возникшего в результате заболевания. В случае COVID-19 кортикостероиды представляются наиболее эффективными для тяжелобольных пациентов и при их применении на поздних стадиях заболевания. Благодаря успеху испытаний RECOVERY [3] и REMAP-CAP [4], изучение COVID-19 также расширило наше знакомство с адаптивной рандомизацией.
Предлагая такую модернизированную модель критического заболевания, авторы спешат добавить ряд потенциальных ограничений и нюансов. Во-первых, хотя модель напрямую применима к лечению, прогноз остается практически неизменным. Например, возраст может не быть излечимой чертой, но при многих состояниях он является прогностическим фактором. Тем не менее, в интенсивной терапии нет недостатка в прогностических моделях, которые хорошо выполняют эту функцию — как для общих, так и для конкретных заболеваний.
Во-вторых, хотя авторы делают акцент на некоторых ключевых молекулярных данных, продемонстрировавших многообещающие результаты в области интенсивной терапии, предложенная здесь концепция критического состояния абсолютно не требует того, чтобы излечимая черта была молекулярным или геномным признаком. Вопреки растущему вниманию к молекулярным методам в трансляционных исследованиях в области интенсивной терапии, нет никаких гарантий, что повышение детализации приведет к ощутимым результатам. Этой функции может служить любой признак, отличающий конкретный патофизиологический процесс, причинно связанный с лечебными эффектами.
В-третьих, обсуждение новой концептуальной модели критического заболевания поднимает ряд вопросов о судьбе синдромов критического состояния, которые на протяжении десятилетий способствовали значительному прогрессу в этой области. Это основополагающие концепции современной реаниматологии, и они глубоко укоренились в наших системах прогнозирования, ведения документации, эпиднадзора, эпидемиологии, управления, улучшения качества и исследований. Предстоит понять, готова ли интенсивная терапия к полному отказу от синдромов, или они все же в каком-то качестве будут сохранены.
Наконец, предложенная здесь модель — лишь один из многих возможных путей движения вперед. Хотя авторы полагают, что изложенные выше принципы решают многие проблемы, с которыми сталкивается интенсивная терапия, главная цель состоит в том, чтобы выявить эти проблемы и предложить способы добиться прогресса в их решении.
Новая фаза в медицине критических состояний
После поступления в ОРИТ у вышеупомянутой пациетки оказался ПЦР-положительный мазок из носоглотки на вирус SARS-CoV-2, прогрессирующая гипоксемия, снижение диуреза и спутанность сознания. Эхокардиограмма выявила легкую дисфункцию правого желудочка, также у нее был заметно повышен уровень D-димера (маркер свертывания крови). По текущим стандартам можно было бы диагностировать несколько синдромов — ОРДС, сепсис, острая почечная недостаточность, делирий и диссеминированное внутрисосудистое свертывание, — каждый из которых можно лечить с помощью различных видов поддерживающей терапии. Эти методы лечения могут противоречить друг другу, а недостаток точности в постановке диагнозов затрудняет прогнозирование ее терапевтического ответа.
Новая концептуальная модель, разработанная на основе вышеописанных принципов, должна поддерживать более эффективный подход, при котором акцент переносится от синдромных признаков к более точным биологическим характеристикам. Геномное секвенирование может показать, что у пациентки присутствует вариант аллеля, который создает гораздо более высокий риск тяжелого воспаления легких по сравнению с другими пациентами того же пола и возраста с такими же клиническими проявлениями [44, 45]. Транскриптомное профилирование может выявить, что дисфункция органов в большой мере служит результатом воспаления, опосредованного TNF/IL-1 [46] с небольшим вкладом тромбоза микрососудов. Анализ вариабельности сердечного ритма может показать изменения вегетативной регуляции, которые могут предвещать делирий [47]. Более того, эти патофизиологические черты могут не ограничиваться одним лишь COVID-19 и встречаться при критических состояниях, которые возникают в результате совершенно различных повреждений. Эти характеристики будут рассматриваться как излечимые черты, для которых необходим определенный терапевтический курс. На генетический полиморфизм можно направленно воздействовать известным фармакологическим агентом, для пациентки может быть более вероятна эффективность ингибирования определенных воспалительных путей, а симпатолитические препараты могут лучше, нежели антипсихотики, предотвращать и устранять возбудимость.
Как мы к этому пришли?
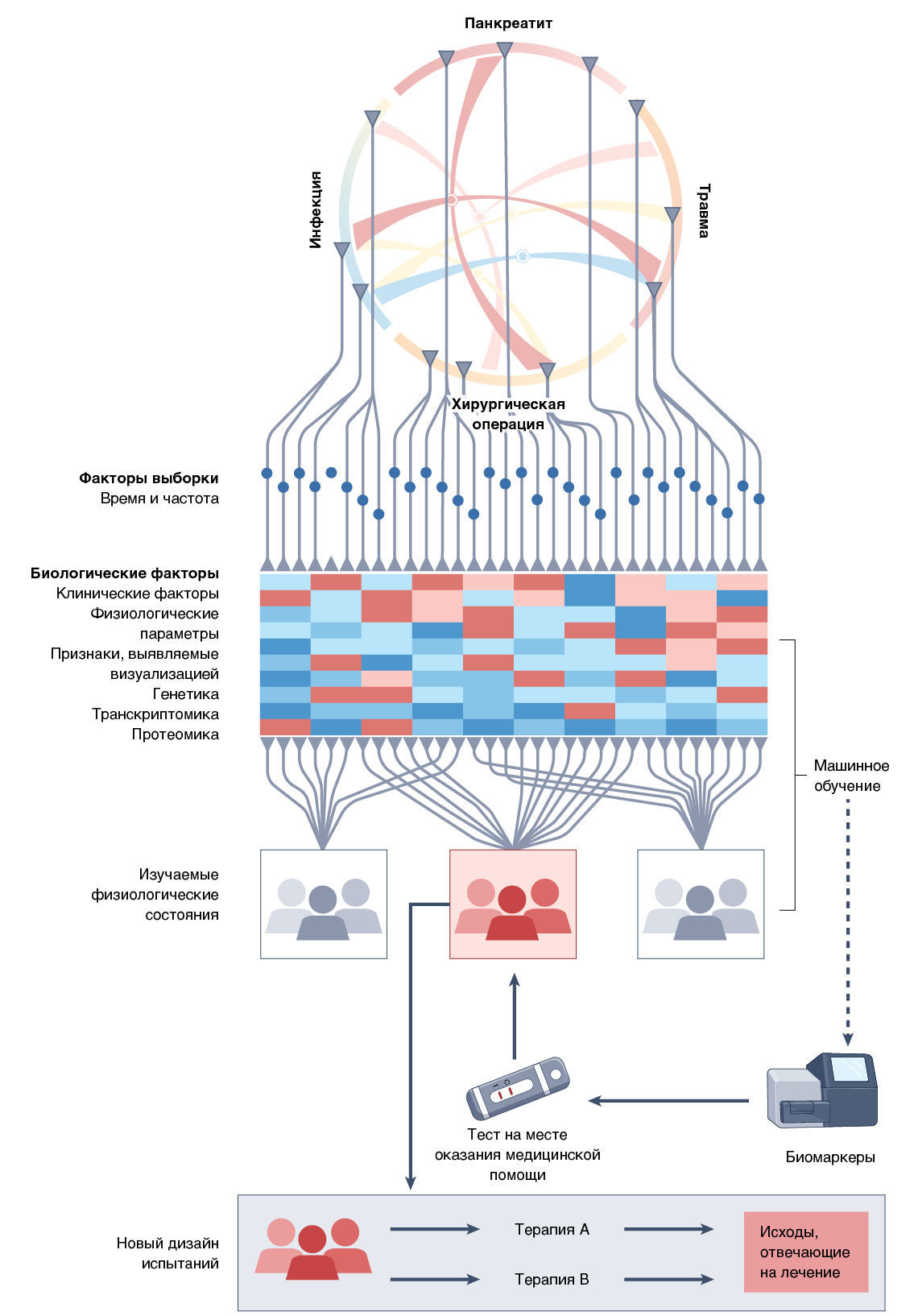
Между стремлением и достижением лежит широкая пропасть. Многие разделяют убеждение, что нужно двигаться за пределы синдромной характеристики критических состояний и разрабатывать модели заболеваний, основанные на общей биологии [48–51]. В разработке и уточнении ключевых концепций могут быть полезны консенсусные конференции ученых. Но значительный прогресс также требует согласованных усилий, направленных на решение технических вопросов. Общий подход к решению проблемы показан на рис. 3; он должен фокусироваться на теоретических и практических соображениях в рамках целого ряда ключевых областей знаний.
Фундаментальная наука
Концепция «излечимой черты» в целом подразумевает, что понятен лежащий в ее основе механизм и что он учитывается при лечении. Следовательно, детальную доклиническую работу, нацеленную на понимание механизмов предполагаемых излечимых черт, следует воспринимать всерьез.
Разработка биомаркеров
Применение концепции излечимой черты на практическом уровне в некоторых случаях приведет к необходимости разработки новых биомаркеров, которые можно будет использовать в условиях ОРИТ. Потребуется тесное сотрудничество с клиническими химиками и лабораторными экспертами для создания утвержденных анализов, которые можно проводить в клинической лаборатории с учетом как многоцентрового характера интенсивной терапии, так и коротких сроков, необходимых для принятия продуманных решений. Анализы легкодоступных образцов, таких как кровь, моча, выдыхаемые газы или даже физиологические сигналы, будут применяться с большей вероятностью, нежели более инвазивные тесты, такие как биопсия тканей. Сходным образом, тесты на основании более быстрых методов, такие как ПЦР или платформы для получения молекулярных штрих-кодов, получат большее распространение, чем более громоздкие технологии секвенирования. Разработка целесообразных анализов биомаркеров потребует устранения многих препятствий, включая определение физиологически значимых болезненных состояний, описание соответствующей клинической интерпретации результатов тестов и удовлетворения нормативных требований. Несомненно, что абсолютно новые технологии будут изучаться для решения проблемы поиска биомаркеров и излечимых черт в ОРИТ.
Оценка клинического исхода
Необходимо разработать систему оценки клинического исхода, по которой можно было бы оперативно определить, было ли эффективно лечение на основе выявленных биомаркеров. Применяемые в настоящее время способы определения исходов, такие как количество летальных исходов, число дней без искусственной поддержки органов и грубая оценка функции почек, могут не иметь необходимой специфичности для того, чтобы установить, насколько успешна полученная терапия. Например, пациент с COVID-19 может положительно реагировать на кортикостероиды, но позже умереть от легочной эмболии или бактериальной инфекции. Следует учитывать относительную важность промежуточных клинических исходов, а также тех исходов, которые по текущим стандартам не считаются ориентированными на нужды пациента [52].
Интеграция данных
Шум, который возникает из-за большого числа переменных, эффекты смешения различных подходов к лечению и оказанию медицинской помощи и уменьшение реалистического размера индивидуальных эффектов говорят о необходимости интеграции данных в большом масштабе и в течение длительного периода времени. Данные из электронных медицинских карт, секвенирования нового поколения и мультиомиксной биологии создают основу, а наука об анализе и обработке данных и усовершенствованная статистика и машинное обучение предоставляют методы. Опыт Фрамингемского исследования сердца [53], проект «Геном человека» или открытия в области физики элементарных частиц, полученные на Большом адронном коллайдере — это примеры силы создания, обработки и обмена большим количеством данных.
Новые схемы исследований
Заключениям на основе причинно-следственных связей препятствует влияние вмешивающихся факторов. Его можно снизить с помощью рандомизации и таким образом установить причинность. Следовательно, крупные рандомизированные клинические испытания предоставляют мощные, но используемые в неполной мере возможности для установления причинно-следственных связей, в то время как новые методы, такие как менделевская рандомизация [55], позволяют сделать более надежные выводы о причинно-следственной связи на основе случайной биологической изменчивости. Использование платформенных испытаний, включающих в себя адаптивные планы, которые оценивают множество методов лечения, показало перспективность взвешивания эффективности многих различных видов терапии и может учитывать неоднородность изучаемой популяции [56]. Это подтверждается успехом исследований RECOVERY и REMAP-CAP [3, 7].
Национальное и международное сотрудничество консорциумов под руководством исследователей
Крупномасштабные международные и межинститутские сотрудничества, такие как CERN, LIGO и проект «Геном человека», становятся все более распространенными. Движение в сторону открытой науки и создания общих хранилищ данных усиливает желание работать и предоставляет платформы для коллаборации. Сотрудничество между национальными клиническими исследовательскими группами расширяется в таких областях, как новые инфекционные заболевания, онкология, инсульт и тромбоз. В сфере интенсивной терапии Международный форум специалистов по неотложной помощи (InFACT) создал форум для ранней дискуссии о стратификации пациентов на стадии клинического заболевания. Сотрудничество в том масштабе, который необходим для решения проблемы, становится возможным.
Заключение
Ведение пациентов со злокачественными заболеваниями изменилось в 1933 при создании Международного союза по борьбе с раком и разработке системы стадирования TNM, которая впервые была предложена Пьером Денуа в 1940-х гг. [57, 58]. Лечение сердечно-сосудистых заболеваний оформилось в результате Фрамингемского исследования сердца с его всеобъемлющей характеристикой естественного течения болезни во времени [53]. Сходный подход потребуется и для пересмотра концепции критического состояния. В силу быстро происходящих изменений и мультиорганного проявления критического состояния оно, вероятно, будет более сложным и потребует больше усилий, чем прецеденты в онкологии и кардиологии. Этого можно достичь, но потребуется сотрудничество общемирового масштаба — для достижения согласия в терминологии и подходах к классификации, для создания общих хранилищ данных для проверки и принятия моделей и применения моделей в рандомизированных испытаниях для оценки влияния причинно-следственных связей. COVID-19, несмотря на все вызванные им потрясения, показал, что такое стремление к глобальному сотрудничеству в исследованиях не только желательно, но и осуществимо.
