Физиологическое влияние гипотермии: Хороший, Плохой, Злой

Вступление
Гипотермия – пониженная температура тела человека, при которой физиологические процессы замедляются, а организм адаптируется к новому холодовому состоянию. Такой процесс может вызывать сбои и нарушения в работоспособности органов и тканей, или, наоборот, помогать им преодолевать критические моменты жизни человека.
При помощи гипотермии в экспериментах на животных удается останавливать кровообращение на 1-2 часа без серьезных последствий, в то время как выживаемость при нормальной температуре организма составляет от 4-х до 5-ти минут. Это поразительное различие во временном промежутке привлекает медицинских исследователей в область гипотермии и криотехнологий для поиска решений важных задач: эффективной протекции органов при трансплантации, защиты нейронов в неонатальный период, помощи при проведении кардиохирургических манипуляций и других медицинских процедур.
Использование терапевтической гипотермии, которая, в отличие от случайного переохлаждения, контролируется со стороны медицинского работника и корректируется в соответствии с состоянием пациента стала важным шагом в развитии клинической медицины. Тем не менее остается немало вопросов и трудностей применения контролируемого холодового воздействия. К наиболее важным из них относятся осложнения, ограничивающее безопасное согревание пациентов после гипотермии: аритмии, неконтролируемые кровотечения и «шок от согревания».
В статье раскрываются особенности применения гипотермии в практической медицине, а охлаждение рассматривается в своих трех конкурирующих ролях: “хороший”, “плохой” и “злой”.
Введение
Люди – гомойотермные организмы, то есть активно регулируют температуру своего тела в ответ на воздействие окружающей среды. На протяжении всей истории человек выживал в условиях меняющегося климата, и умение переносить разные температуры окружающей среды выступало важным эволюционным фактором.
Несмотря на то, что в наши дни человечество обеспокоено проблемой глобального потепления, с древних времен именно низкие температуры окружающей среды приводили к потере огромного количества жизней. Яркий пример массового переохлаждения людей – холод и голод во время войн: переход армии Ганнибала через Альпы более 2200 лет назад, поход Наполеона на Москву в 1812 году, отступление Гитлера из Сталинграда в 1944-45 годах и многие другие.
Несмотря на свое давнее прошлое, диагноз – гипотермия появился далеко не сразу. Определение точной температуры стало возможным только в 1714 году, когда Фаренгейт изобрел ртутный термометр, и в 1866 градусник впервые стали использовать в качестве клинического инструмента (1).
Сперва гипотермию диагностировали только в экстремальных ситуациях, таких как погружение в воду с достижением очень низких температур тела, в то время как в менее тяжелых случаях она не признавалась до 1960-х годов (2).
Гипотермия, определение
Физиологические изменения при охлаждении зависят от глубины и продолжительности гипотермии. Гипотермия у людей определяется как преднамеренное (терапевтическое) или случайное понижение температуры тела ниже 35°C. Гипотермия изначально подразделялась на легкую (35-32 °C), умеренную (32-22 °C), тяжёлую (22-8 °C) или глубокую (<8 °C) (3). В 1994 году была установлена новая классификация: легкая (35-32 °C), умеренная (32-28°C), сильная (28-20 °C) и глубокая (<20 °C) (4), и данная классификация используется в этом тексте. Также в 2009 году Полдерман и Герольд (5) предложили более упрощенную шкалу с разделением на легкую (35-34 °C), умеренную (34-30 °C) и сильную (<30 °C) гипотермию, которая в настоящее время используется Американской кардиологической ассоциацией. Дополнительно переохлаждение можно разделить по длительности на острое (несколько часов), пролонгированное (несколько часов) и хроническое (дни или недели).
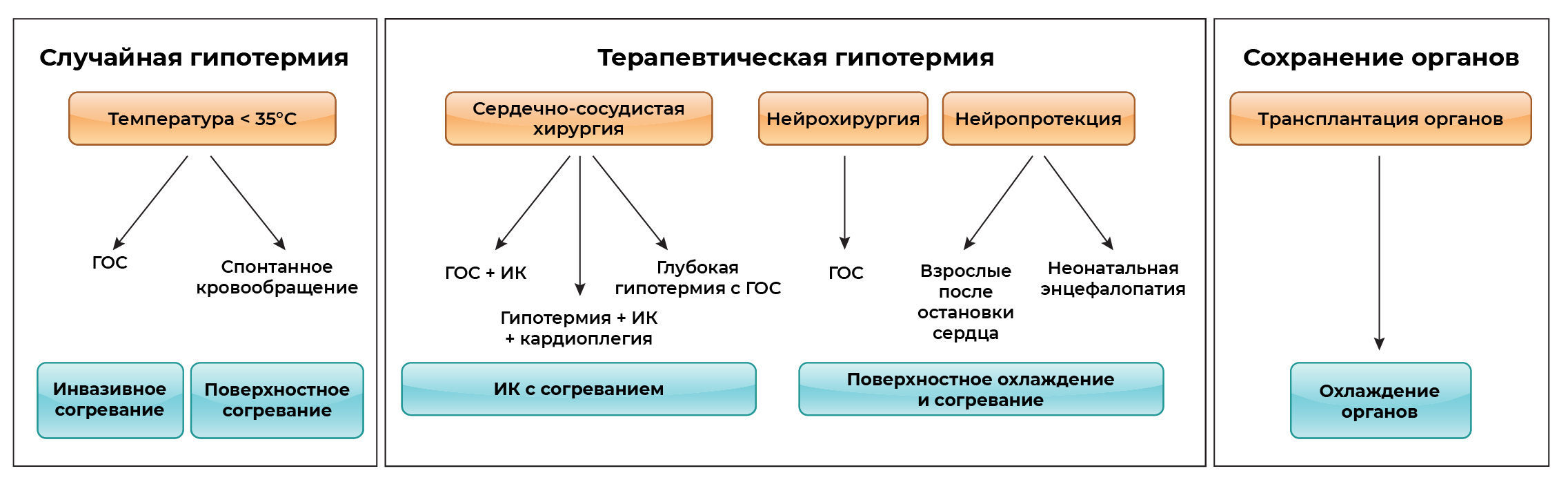
Рисунок 1. Гипотермия может быть случайной, целенаправленной и терапевтической. ГОС – гипотермическая остановка сердца; ИК – искусственное кровообращение.
Q10 температурный коэффициент
Температурный коэффициент Q10 является мерой температурной чувствительности химических реакций и биологических процессов (ферментативных и биохимических), в которых повышение или понижение температуры на 10 °C вызывает определенное изменение их скорости. Среднее значение коэффициента Q10 в головном мозге млекопитающих составляет 2,2 (6) и принимает значение около 2,0 всего организма при терапевтической гипотермии во время анестезии (7). Защитная роль гипотермии обусловлена снижением метаболической активности и, следовательно, снижением скорости потребления O2 (VO2) и скорости синтеза CO2 (VCO2). Соответственно, при умеренной гипотермии (снижение температуры тела на 10 °C) VO2 и VCO2 составляют примерно 50% от нормотермических значений. В условиях глубокой гипотермии (снижение температуры тела до 30 °C) снижение показателей потребности и синтеза VO2 и VCO2 более значительно. Таким образом, замедление показателей VO2 и VCO2 при охлаждении содействует защитному терапевтическому эффекту.
Терапевтические преимущества гипотермии в клинической медицине: «Хороший»
Переохлаждение опасно, но при этом при снижении температуры организм становится устойчивее к повреждающему воздействию факторов внешней или внутренней среды. Это фундаментальное свойство терапевтической гипотермии в эксперименте позволяет останавливать кровообращение охлажденных животных на 1-2 часа без последующих пагубных последствий. Эта удивительная разница между 4-5 минутами при нормотермии и 2-мя часами при глубокой гипотермии стала основным фактором, привлекшим в эту область множество врачей и ученых. Потенциальные лечебные и защитные свойства гипотермии послужили базисом для ее внедрения в практическую медицину.
Терапевтическая гипотермия
В клиническую практику терапевтическая гипотермия впервые была введена в начале 20-го века в новаторской работе Темпл Фея (1895-1963), где он использовал гипотермию для лечения пациентов на поздней стадии онкологии. Пациентов охлаждали до температуры примерно 32 °C на протяжении 18-ти часов, после чего согревали обратно. Однако, несмотря на широкие усилия по внедрению гипотермии в качестве нового метода лечения онкологического заболевания, работа Фея не получила должного признания (8).
Терапевтическая гипотермия для защиты миокарда во время операций на остановленном сердце
В 1950-е годы кардиохирурги были заняты поиском метода, который позволил бы проводить хирургические вмешательства на остановленном сердце. Решением стала терапевтическая гипотермия: при понижении VO2 и VCO2 во всем организме во время охлаждения до 27 °C происходила гипотермическая остановка сердца (ГОС), которая мгновенно приводила к снижению VO2 до 80% в мышечной ткани сердца (9). Таким образом, терапевтическая гипотермия позволила кардиохирургам завершать операцию на неподвижном, и при этом метаболически защищенном сердце. Метод был впервые введен в качестве иммерсионной гипотермии у пациентов под наркозом. Методика позволила хирургу за 6-8 минут остановки кровообращения устранить простые дефекты сердца, балансируя между продолжительностью оперативного вмешательства и потребностью мозга в VO2. Впоследствии были внедрены малопоточные помповые оксигенаторы, предшественники современного аппарата искусственного кровообращения (АИК). С ними ГОС достигалась охлаждением крови до 10-20 °C (10), что увеличивало допустимый период остановки кровообращения до 30-60 минут. Быстрая химическая остановка сердца перед развитием распространенной ишемии миокарда с применением более 200 ммоль калия (кардиоплегический раствор) была введена в практику Мелроузом с соавт. (11) в 1955 году. Она позволила восстанавливать работу сердца после эпизода ишемии эффективнее, чем простое пережатие аорты. В первые годы развития кардиохирургии считалось, что защита миокарда достигается с помощью гипотермии как дополнения к одному из многочисленных вариантов кардиоплегических растворов, направленных на остановку сердца в фазе диастолы. Впоследствии кардиоплегические растворы претерпели значительные изменения, направленные на усиление защиты миокарда во время ишемии сердца, реперфузии и согревания (12). Защита миокарда долгое время считалась ключевым фактором успешного выздоровления пациентов, перенесших остановку сердца с искусственным кровообращением. За последние несколько десятилетий различные кардиоплегические техники были дополнены другими компонентами: кардиоплегией крови, изменением температуры (согреванием, охлаждением), ретроградной кардиоплегией, комплексной кардиоплегией, а также пред- и посткондиционированием миокарда (13). Впервые открытая Мелроузом и соавт. (11) кардиоплегия крови оставалась в тени, пока не была позже введена в практику заново (14, 15) и не продемонстрировала экспериментально и клинически мощные защитные эффекты против повреждения миокарда во время ишемии и реперфузии (16).
Преимуществами кардиоплегии крови стали:
- большая способность снабжать организм кислородом (больший аэробным метаболизм);
- быстрая остановка сердца в насыщенной кислородом среде;
- возможность периодической повторной оксигенации с подачей раствора для кардиоплегии;
- цельная кровь содержит онкотические компоненты и не требует добавления белков плазмы, маннитола или декстрана;
- большая способность поддерживать кислотно-щелочной баланс;
При этом кардиоплегический раствор в холодной крови имеет и недостатки:
- повышенная вязкость нарушает коронарную микроциркуляцию;
- сдвиг кривой диссоциации кислорода влево приводит к снижению доставки кислорода в периферические ткани;
- требуется более частая повторная инфузия для поддержания асистолии, по сравнению с кристаллоидной кардиоплегией при температуре 4°C;
- отсроченное постишемическое восстановление сердечной функции вследствие вызванного гипотермией угнетения сердечного метаболизма.
В конечном итоге была разработана непрерывная нормотермическая кардиоплегия крови как средство предотвращения ишемии в период пережатия аорты. В 1991 году Лихтенштейн и соавт. (17) провели «операцию на теплом сердце», показав безопасность и эффективность непрерывной нормотермической кардиоплегии крови. С момента внедрения нормотермической кардиоплегии крови многие исследования (18-20) показали ее превосходную способность в защите миокарда в сравнении с обычной холодовой кардиоплегией. Однако при непрерывной нормотермической кардиоплегии кровью критические коронарные стенозы могут ограничить доставку O2 в ишемизированные участки сердца. Кроме того, по техническим причинам постоянную инфузию кардиоплегического раствора необходимо прерывать во время операции. Такие перерывы в инфузии или неадекватное распределение тока крови могут искусственно создавать анаэробный метаболизм и тепловое ишемическое повреждение. В то же время Клафиоре с соавт. (21) сообщили об отсутствии различий в кардиопротекторном эффекте между группами пациентов, перенесших коронарное шунтирование с прерывистой теплой или прерывистой холодной инфузиями. Таким образом, авторы пришли к выводу, что прерывистая антеградная доставка нормотермической крови для кардиоплегии является безопасным, надежным и эффективным методом защиты миокарда (13). Кроме того, в 1994 году Хаясида и соавт. (22, 23) изобрели новую концепцию – кардиоплегию прохладной (29 °C) кровью в качестве безопасного и эффективного метода защиты миокарда. За счет снижения температуры сердца с 37 °C до 29 °C создается запасной буфер для ишемического повреждения, в том случае, если доставка крови в процессе остановки сердца нарушится или прервется.
Однако более поздние оценки различных кардиоплегических растворов показали, что, помимо генерируемой электрохимической остановки, добавление растворов для кардиоплегии с высоким содержанием калия обеспечивает лишь незначительную защиту миокарда или не обеспечивают ее вовсе (24).
Терапевтическая гипотермия, недописанная картина: «Плохой»*
*Определение “плохой” авторы считают условным, т.к. в указанных далее по тексту эффектах гипотермии присутствуют как положительные, так и неуточненные данные по показаниям к применению терапевтической гипотермии. Основная тема данного раздела – потребность в подборе групп пациентов и дополнительном изучении показаний для эффективного лечения охлаждением (прим. переводчика)
Эффекты защиты миокарда
Долгое время считалось, что гипотермия создает свой защитный эффект за счет снижения скорости метаболизма и следующего за этим снижением VO2 и VCO2 в остановленном сердце. В то время фраза «чем холоднее, тем лучше» считалась аксиомой (25). Однако более поздние фундаментальные исследования физиологии показали, что в остановленном сердце при охлаждении тела ниже 27 °C основной метаболизм снижается не так сильно, как предполагалось вначале. При температуре тела около 27 °C происходит самопроизвольная остановка сердца даже без добавления кардиоплегического раствора, и дальнейшее охлаждение дает низкий кардиопротекторный эффект. Следовательно, искусственное кровообращение с холодом при традиционном коронарном шунтировании может применяться при температуре тела >30 °C. Существуют новые хирургические операции на коронарных сосудах, которые, в отличие от традиционных методов с гипотермической кардиоплегией и искусственным кровообращением, выполняются у пациентов в нормотермическом состоянии. Они известны под названиями «аортокоронарное шунтирование без искусственного кровообращения» или «операция на работающем сердце». И несмотря на то, что традиционная коронарная хирургия считается стандартизованной процедурой, исследование 2017 года выявило значительные различия в работе хирургических стационаров по всему миру. В разных учреждениях температура тела пациентов во время операции шунтирования варьировалась от 37,0 до 33,4 °C.
При реконструктивных операциях на сердце, например, при операции на проксимальном отделе аорты, глубокая (<20 °C) гипотермия и ГОС сочетаются с антеградной или ретроградной перфузией головного мозга с целью защиты нейронов. Эти операции были разработаны на основе обширных исследовательских работ (26-29). В современной клинической практике ГОС проводится при температуре от 18 до 19 °C, но доказательства эффективности таких температур противоречивы (30, 31). В некоторых медицинских учреждениях в настоящее время существует консенсус в пользу меньшей степени гипотермии (32, 33), а ряд авторитетных медицинских организаций предостерегает от использования глубокой гипотермии (32, 34). Таким образом, на сегодняшний день отсутствует единое мнение относительно оптимальной стратегии регулирования температуры во время ИК для операций на проксимальной аорте и реконструктивной сердечно-сосудистой хирургии. Стратегии регулирования температуры во время ИК зависят в большей мере от врачебных или внутрибольничных предпочтений, а не от научных данных (35).
Нейропротективные эффекты
Головной мозг – это орган, наиболее чувствительный к гипоксии и ишемии. Способность гипотермии защищать нервную ткань обнаружили, когда анализировали случаи выживания без неврологических осложнений после пребывания в воде в зимнее время. Нейропротективные эффекты терапевтической гипотермии объясняются снижением скорости метаболизма и потребности в О2 при сохранении тканевого рН и АТФ, что способствует клеточному гомеостазу (36-38). Клинические и экспериментальные результаты демонстрируют защитные эффекты гипотермии во время и после ишемии нервной ткани (39) путем ингибирования биосинтеза, экскреции и поглощения ряда катехоламинов и других эксайтотоксичных нейромедиаторов (40-42), особенно глутамата и дофамина, что предотвращает перегрузку кальцием и потенциальное повреждение нейронов (43, 44). Другие положительные эффекты гипотермии включают: сохранение гематоэнцефалического барьера (45, 46), восстановление постишемической церебральной микроциркуляции (47) и, вероятно, снижение внутричерепного давления (48, 49). В дополнение к снижению скорости метаболизма и потребления O2 тканями, нейропротективные эффекты терапевтической гипотермии во время и после ишемии/реперфузии объясняются снижением выработки активных форм кислорода (АФК), снижением синтеза медиаторов воспаления и ингибированием апоптоза во время локальной и общей реперфузии головного мозга (50). Рандомизированные контролируемые исследования в начале 2000-х годов показали, что применение терапевтической гипотермии было связано со снижением смертности и неврологических осложнений (51, 52). Однако, несмотря на то, что нейропротективные механизмы гипотермии при различных заболеваниях отличаются и полностью не изучены, роль гипотермии в защите нейронов была точно установлена в экспериментах на животных и у выживших пациентов после следующих критических ситуаций: остановки сердца (53, 54), гипоксически-ишемической энцефалопатии (55), черепно-мозговой травмы (56) и других заболеваний (57).
Несмотря на большой список научных работ, оптимальная стратегия регулирования рН для наилучшего неврологического исхода после сердечно-сосудистых операций с использованием гипотермического ИК остается неизвестной. Две основные клинические стратегии – альфа-stat и рН-stat – различаются своими подходами к кислотно-щелочным изменениям, которые происходят при гипотермии. Растворимость CO2 и O2 в воде, крови и тканях увеличивается при охлаждении. При охлаждении парциальное давление CO2 уменьшается с постоянным коэффициентом 4,5% на 1 °C в крови и тканях и не зависит от уровня PCO2 или HCO3. Согласно эффекту Розенталя, при понижении температуры рН повышается на 0,0147 рН единиц/ °C (58). При использовании альфа-stat, возникающий алкалоз остается постоянным в процессе охлаждения, в то время как при использовании pH-stat следует добавлять углекислый газ в систему газов крови, чтобы поддерживать pH на физиологическом уровне во время нормотермии. Клинические испытания подтверждают положительное влияние стратегии pH-stat на церебральный исход после гипотермической остановки кровообращения у детей (59). Положительные клинические эффекты в этой возрастной группе были обусловлены усилением вазодилатации (60) и улучшением саморегуляции сосудов головного мозга после хирургической операции (61) при применении стратегии pH-stat. У взрослого населения различия в результатах при сравнении этих двух стратегий еще не задокументированы, и, как в клинической, так и в экспериментальной областях не существует четкого консенсуса.
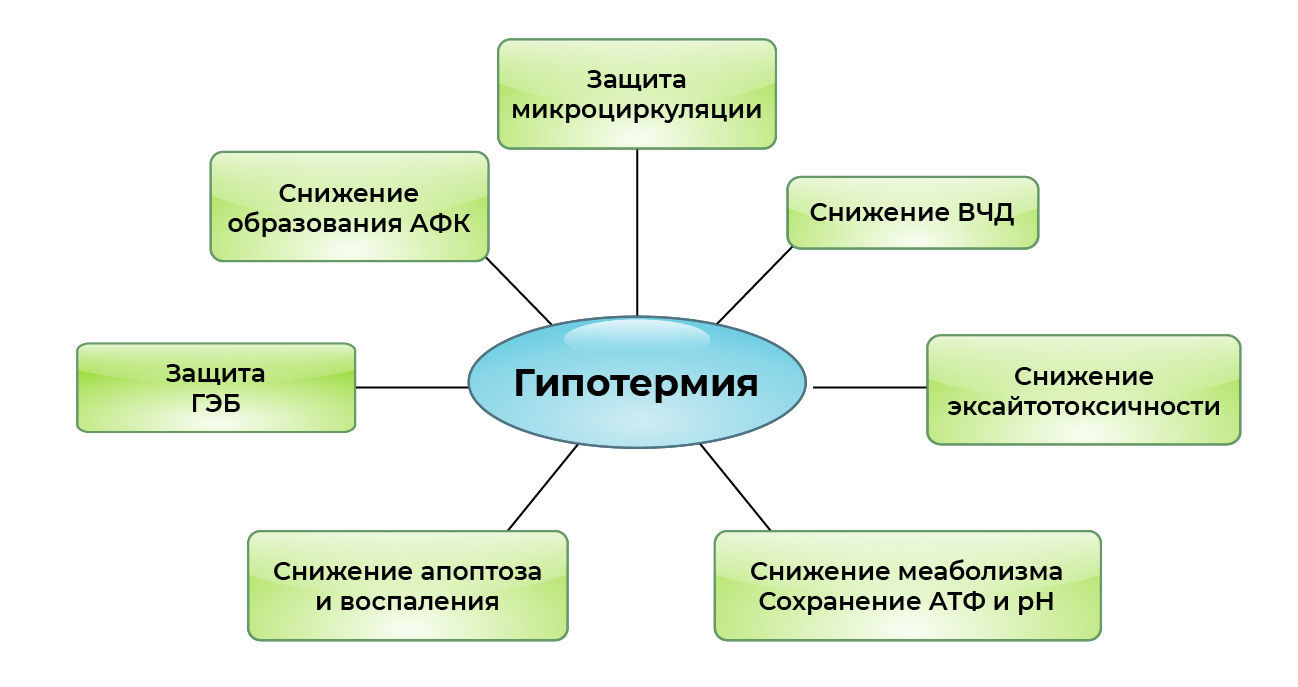
Рисунок 2. Нейропротективные эффекты индуцированной гипотермии: АФК – активные формы кислорода; ВЧД – внутричерепное давление.
Нейрохирургия
Несмотря на долгую историю, которая показывает потенциальную пользу гипотермии для сохранения головного и спинного мозга после травм или заболеваний, клинические испытания последних 50 лет не смогли продемонстрировать убедительную пользу гипотермии по сравнению с контролируемой нормотермией. Сохраняющийся с тех пор интерес нейрохирургов к гипотермии отражает продолжающуюся борьбу за использование нейропротекторных преимуществ охлаждения при минимизации системных побочных эффектов (62). Для передовых операций на головном мозге до недавнего времени чаще применялось охлаждение с ИК до глубокой (<20 °C) терапевтической гипотермии в сочетании с остановкой кровообращения во время операции. Однако новые методы лечения способствуют использованию церебральных шунтов с низким давлением или притоком крови, требующих меньшего охлаждения организма.
Травматическое повреждение головного мозга
Черепно-мозговую травму следует разделять на первичную и вторичную. Первичная травма возникает вследствие механического повреждения тканей, например: перелома костей черепа, ушиба головного мозга, эпидуральной/субдуральной гематомы и травматического субарахноидального кровоизлияния (63). Последующее вторичное повреждение головного мозга формируется из-за оксидативного стресса, гипоксического/ишемического повреждения, воспаления и отека ткани – факторов, которые продлевают и усугубляют неврологическое повреждение (36).
Тактика лечения черепно-мозговой травмы состоит из борьбы с основной патологией и снижения рисков развития вторичного черепно-мозгового повреждения. Нейрохирургические операции, являющиеся основным методом лечения в этой ситуации, направлены на поддержание внутричерепного давления в пределах физиологической нормы с целью обеспечения достаточной оксигенации мозга и физиологичного мозгового кровотока (36, 63). Альтернативой нейрохирургическим вмешательствам для нормализации внутримозгового давления стало использование медикаментозной (барбитуратовой) комы, которая дополнительно снижает метаболизм и потребление кислорода тканями мозга. Также отмечается уменьшение мозгового кровотока и нейроэксайтотоксичности* за счет уменьшения высвобождения глутамата и аспартата в тканях головного мозга (51, 63, 64). На протяжении многих лет эксперименты на животных демонстрировали многообещающие результаты использования индуцированной гипотермии для предотвращения вторичного повреждения головного мозга путем снижения метаболических потребностей мозга, воспаления, эксайтотоксичности, перекисного окисления липидов и гибели клеток (65-67). Однако, в отличие от благоприятных эффектов индуцированной гипотермии в доклинических экспериментах, три крупных рандомизированных контролируемых многоцентровых исследования на людях не продемонстрировали положительного влияние гипотермии (33 °C) на предотвращение вторичного повреждения головного мозга (63, 68, 69). В исследованиях было показано, что у детей искусственная гипотермия ухудшила состояние и увеличила смертность (70). У взрослых данные по применению терапевтической гипотермии в настоящее время противоречивы, и такая технология не рекомендуется для профилактического или постоянного применения при черепно-мозговой травме (64).
*Нейроэксайтотоксичность – пусковой механизм нетипичного апоптоза, некроза и аутофагии нейронов при ряде неврологических нарушений, таких как: ишемия головного мозга, рассеянный склероз, острые и хронические нейродегенеративные заболевания (прим. переводчика)
Управляемая терапевтическая гипотермия при внебольничной остановке сердца
За последние 20 лет терапевтическая гипотермия практически рутинно использовалась у реанимированных пациентов в состоянии комы после остановки сердца (50). Два международных исследования, опубликованных в 2002 году (51, 52), показали значительное увеличение выживаемости после 24-х часового лечения индуцированной гипотермией (32-34 °C), по сравнению с нормотермией. Охлаждение предотвращает развитие энцефалопатии у выживших пациентов после догоспитальной остановки сердца в состоянии комы. Как следствие, рекомендации Американской кардиологической ассоциации 2010 года советовали использовать гипотермию (от 32 °C до 34 °C) как часть лечения после остановки сердца у реанимированных пациентов (71). В дальнейшем были изучены нейропротективные эффекты терапевтической гипотермии у выживших пациентов. В 2013 году в исследовании целевого управления температурой (ЦУТ) сравнивалось влияние температуры 33 °C и 36 °C с последующим результатом в виде отсутствия различий (72). Тогда руководство Американской кардиологической ассоциации/Международного комитета связи по реанимации 2015 года изменило свои рекомендации и повысило показатель температуры тела с 32°C до 36°C (73-75). У пациентов с остановкой сердца и нерегулируемым ритмом исследование HYPERION (ЦУТ для остановки сердца и нерегулярного ритма) показало снижение неврологических осложнений у пациентов, которым была назначена терапевтическая гипотермия, по сравнению с нормотермией (76). В обновленном мета-анализе, проведенном в 2020 году, сравнивалась эффективность терапевтической гипотермии у пациентов с постреанимационной болезнью. Анализ включал исследование HYPERION и пришел к выводу, что терапевтическая гипотермия связана со снижением неврологических осложнений у всех пациентов, перенесших остановку сердца, дополнительно снижалась смертность у пациентов с изначально нерегулярным ритмом сердца (50). Несмотря на многообещающие результаты, группа CARES (Cardiac Arrest Registry to Enhance Survival surveillance group) сообщила о тенденции к снижению в 2013-2016 годах использования терапевтической гипотермии для данной группы пациентов (73). В недавней публикации от 2021 года (77) не было сообщений о различиях в выживаемости после остановки сердца в группе пациентов, получавшей индуцированную гипотермию (33 °C) и группы с нормотермией. До сих пор остаются пробелы в знаниях относительно нейропротективных эффектов терапевтической гипотермии после остановки сердца. Чтобы уточнить эффективность и безопасность этого метода лечения, необходимо ответить на ряд дополнительных вопросов.
Гипоксическая ишемическая энцефалопатия
Ранее неонатологи мало что могли предложить новорожденным с гипоксической ишемической энцефалопатией помимо системной поддерживающей терапии. Однако нейропротективные эффекты умеренной терапевтической гипотермии, применявшейся в течение последнего десятилетия для противодействия гипоксической ишемической энцефалопатии у доношенных детей, показали, что охлаждение снижает смертность и не увеличивает инвалидизацию выживших. Гипотермия снижает риск смерти и инвалидности у младенцев с гипоксической ишемической энцефалопатией средней и тяжелой степени (78-81). Доношенным и недоношенным детям I степени с гипоксической ишемической энцефалопатией средней и тяжелой степени следует назначать лечение с использованием умеренной гипотермии (33,5 – 35,0 °C). Клинические данные коррелируют с результатом раннего (180-360 мин) начала этой терапии (73). Систематический Кохрейновский обзор 2013 года (80), оценивающий 11 рандомизированных контролируемых исследований, включавших 1505 младенцев, привел к выводу, что терапевтическая гипотермия полезна доношенным и недоношенным детям I степени с гипоксической ишемической энцефалопатией. Текущие исследования направлены на определение подходящих методов охлаждения, включая уточнение отбора пациентов, продолжительность и способ охлаждения этой группы младенцев. Патофизиология гипоксической ишемической энцефалопатии в настоящее время более понятна, и применение охлаждения стало частью основы терапии (82).
Гипотермия для сохранения органов
С момента появления трансплантационной медицины в 1960-х годах терапевтическая гипотермия (0-10 °C) стала стандартной процедурой защиты донорских органов от вредного воздействия ишемии/гипоксии после их извлечения. Однако ранее было отмечено, что простого охлаждения недостаточно для обеспечения хорошей сохранности органов. Первые попытки использовать растворы на основе крови, даже гемодилютированных растворов со сниженной вязкостью, считались тщетными. Было обнаружено, что гипотермия связана с увеличением вязкости крови, способствующей окклюзии эритроцитами микроциркуляторного русла (“слипанию”) и пагубной коагулопатии (83-87). Следовательно, сладж эритроцитов имеет серьезные последствия для микроциркуляции в органах во время проведения гипотермии, а также во время реперфузии у реципиента. Эксперименты на животных показали хорошую выживаемость при применении глубокой гипотермии в условиях ИК в сочетании с заменой крови бесклеточными растворами, а также успешное согревание с помощью аутотрансфузии после длительного охлаждения (88). В результате основным направлением развития технологии гипотермического хранения органов стала разработка специализированных технологий для консервации.
Центральным элементом является тщательный контроль внеклеточного содержимого тканей, который достигается путем очищения сосудов или перфузии жидкостей для противодействия губительному воздействию холода. Преобладающим объяснением набухания клеток, вызванного холодом (внутриклеточного отека), является зависящее от температуры снижение активности Na+-K+-АТФазного насоса (89), приводящее к увеличению концентрации Na+ в цитозоле ([Na+]cyt) (90, 91) и последующую задержку воды внутри клетки. Кроме того, повышенный уровень внутриклеточного [Na+] замедляет выход Ca2+ из-за изменения системы обмена Na+/Ca2+, что может способствовать перегрузки цитозоля Ca2+, особенно в клетках сердца.
Вызывают интерес новые и альтернативные теории, объясняющие набухание клеток в донорских органах из-за хранения в холодильной камере (92). Масштабные исследования (93) выявили увеличение внутриклеточных хелатируемых ионов железа (92, 94-99) в течение первых часов холодной инкубации, приводящие к образованию высокоактивных форм кислорода (94, 100-102). Установлено, что повреждение холодом в первую очередь воздействует на митохондрии и изменяет проницаемость их мембран (99, 103), что в конечном итоге приводит к апоптозу и набуханию клеток. Последнее указанное изменение может преобладать при согревании (104-106). Добавление комплексонов железа эффективно ингибирует процесс повреждения митохондрий, и, вероятно, может проложить путь к лучшей сохранности органов во время гипотермии в будущем. В совокупности указанные открытия о холодовом повреждении ранее приписывались реперфузионному повреждению (107, 108).
Что сделало успешным применение терапевтической гипотермии в сердечно-сосудистой хирургии?
Для сравнения, за одинаковый период времени подавляющее большинство успешных операций на сердце, проведенных с использованием терапевтической гипотермии, намного превышает число операций у пациентов любых других категорий. Сокращение использования терапевтической гипотермии у кардиохирургических пациентов за последние 20 лет не было связано с явными побочными эффектами гипотермии, хотя они подробно описаны. Вероятнее всего, использование гипотермии в кардиохирургических операциях дало понимание и опыт для разработки новых хирургических методов, более простых, менее затратных и в равной степени безопасных по сравнению с гипотермией. С физиологической точки зрения безопасное использование охлаждения в кардиохирургии, по-видимому, является следствием по крайней мере двух существенных эффектов ГОС: индуцированного температурой снижения метаболизма в миокарде и временного «отключения» работы сердца. В совокупности эти физиологические изменения приводят к существенному снижению потребления O2 (около 80%) во время кардиохирургических вмешательств. Дополнительное применение кардиоплегического раствора, которое временно прекращает работу сердца за счет химической диастолической остановки сердца, обладает определенными защитными свойствами по сравнению с существовавшим ранее изолированным охлаждением для создания ГОС. Тогда остановке сердца часто предшествовали аритмии, связанные с нарушенным потреблением O2. Последнее, но не менее важное: кардиоплегическое средство поддерживает остановку сердца в течение всего периода гипотермии и предотвращает возникновение фибрилляции желудочков, которая может возникать при использовании обычной ГОС. Ни один другой орган тела не будет испытывать подобного уровня физиологического сдвига в VO2 в ответ на снижение температуры. Функция органов тела снижается в ответ на охлаждение, однако, в отличие от сердца, их работа будет практически прекращена только при очень низких температурах тела, ниже которых происходит ГОС, в результате чего самопроизвольное кровообращение прекращается, и возникает ишемия и гипоксия. Напротив, во время кардиохирургических операций с остановкой сердца кровоток в органах и поддержка O2 обеспечивается ИК. За исключением индуцированной гипотермии, применяемой перед плановой операцией на головном мозге, в других рассмотренных выше случаях гипотермия применяется уже после повреждение органа, и мы ожидаем, что организм получит пользу от подобных защитных эффектов, если применить их в начале процесса лечения и реперфузии.
Состояние сердца при ГОС во время операции имеет сходство с тем, что происходит при консервации любого органа, подготовленного к трансплантации. Такие органы, как печень, поджелудочная железа, почки и легкие пропитываются консервирующими растворами и поддерживаются в состоянии глубокой гипотермии. Все они отключены от общего кровообращения, в результате чего их функция еще больше снижается. Также органы лишены какого-либо гормонального влияния или каскадных воспалительных реакций в течение относительно короткого (60 минут) периода гипоксии/ишемии. Здесь следует оставить заметку для дальнейшего сравнения с консервированием органов для трансплантации, где решающее значение имеет использование бесклеточного консервирующего раствора: во время кардиохирургии используется бесклеточный холодный кардиоплегический раствор, который может оказывать положительный эффект сохранения микроциркуляции во время последующей реперфузии/согревания сердца. Тот же аргумент можно применить и в поддержку использования кардиоплегии с тёплой кровью.
Что известно на данный момент?
Использование терапевтической гипотермии стало краеугольным камнем в развитии современной кардиохирургии. При достижении ГОС потребность охлажденного сердца в кислороде немедленно снижается примерно на 90 %. Тем временем ИК обеспечивает циркуляцию холодной, насыщенной кислородом крови по всем другим органам тела, что позволяет хирургу завершать операцию на сердце в безопасные сроки.
Терапевтическая гипотермия широко применяется у пациентов с черепно-мозговыми травмами для нейропротекции в рамках лечения в отделении реанимации и интенсивной терапии (ОРИТ). Кроме возможного снижения или предотвращения развития повышенного внутричерепного давления у пациентов ОРИТ, защитное действие терапевтической гипотермии на выживаемость мозговой ткани остается неясным. Касательно потенциальных нейропротекторных эффектов терапевтической гипотермии после остановки сердца – важно поддержание температуры тела в физиологических пределах для предотвращения лихорадки после согревания. Этот факт позволил сделать вывод о том, что терапевтическая гипотермия не оказывает лечебного воздействия на пациентов с черепно-мозговой травмой.
С момента появления трансплантационной медицины хранение в холоде (0-10 °C) стало стандартной процедурой для защиты донорских органов. Гипотермия, усовершенствованная изобретенными растворами для консервирования, составляет основу современных стандартов, и технологии замораживания, разработанные Висконсинским университетом, остаются золотым стандартом протекции и предотвращения отека клеток в извлеченных органах.
Однако, несмотря на полученные сведения о лечебном воздействии индуцированной гипотермии на многочисленные патологические процессы, клинические испытания последних 50 лет не продемонстрировали каких-либо преимуществ терапевтической индуцированной гипотермии в сравнении с поддержанием нормотермии в большинстве критических состояний (62).
Что остается неизвестным и какие пробелы в знаниях существуют?
Оптимальная температура для защиты миокарда до сих пор не определена. Тактика «чем холоднее, тем лучше» оспаривается, ей противопоставляются операции на теплом сердце. Прежняя универсальная оценка защитного действия кардиоплегических растворов миокарда была поставлена под сомнение. Также остается без ответа вопрос об оптимальной температуре для достижения наилучшей защиты органов при гипотермической остановке сердца с использованием реконструктивных сердечно-сосудистых операций.
Обнаружение ранее неизвестных патофизиологических холодовых механизмов повреждения тканей указывает на то, что улучшение сохранности органов может следовать за изменением технологий сбережения донорских органов. Масштабные экспериментальные исследования выявили высокую продукцию активных форм кислорода и повреждения митохондрий в донорских органах при воздействии холода, что способствует апоптозу во время последующей реимплантации и согреванию внутри реципиентов. Эти новые знания открывают пути к совершенствованию растворов и методов хранения донорских органов в холоде.
Случайное переохлаждение/согревание: «Злой»
Случайное переохлаждение
В отличие от терапевтической гипотермии у пациентов, находящихся под наркозом во время кардиохирургических операций, охлаждение у людей в сознании, пострадавших от случайной гипотермии, создает состояние физиологического стресса неизвестной продолжительности и интенсивности. Эта физиологическая реакция направлена на поддержание температурного гомеостаза, при котором все органы тела могут испытывать почти максимальную физиологическую активность.
У людей мозговая активность постепенно снижается при уменьшении температуры тела ниже 35 °C, и, по некоторым сведениям, при охлаждении ниже 33 °C наступает потеря сознания. После потери сознания психологический стресс снимается, и за этим следует заметное снижение потребления кислорода. При дальнейшем снижении температуры тела снижение потребления кислорода происходит по линейной схеме, определяемой эффектом Q10. Все органы тела имеют одинаковый показатель Q10, который для всего тела равен 2,0, а для тканей мозга – 2,2. В отличие от сердца, которое останавливается при охлаждении, другие органы будут испытывать постепенное снижение функционирования и последующего потребления O2. Во время охлаждения сердце попадает в ГОС, что приводит к ишемии и гипоксии всех остальных органов. При последующем согревании и реперфузии восстановление функции органа зависит от времени ожидания помощи, качества догоспитальных вмешательств и способов согревания.
Одно из наиболее известных сообщений об успешном согревании относится к 1999 году (109), когда опытная молодая лыжница каталась вне трассы и упала в овраг с водопадом, оказавшись в ловушке и повиснув вниз головой на своих лыжах. Ее голова высовывалась из воды, но ее тело постоянно поливало ледяной водой. После эвакуации она находилась без сознания, ей проводилась сердечно-легочная реанимация. По прибытии в больницу температура ее тела составляла всего лишь 13,7 °C, и после 9-ти часового периода помощи, который включал эвакуацию, транспортировку и стабилизацию состояния, при согревании на АИК ее сердце восстановило синусовый ритм. Через 5 месяцев наблюдения ментальные функции девушки были неизменными и она возвратилась к работе (109).
Терапевтические проблемы, связанные со случайным переохлаждением и повторным согреванием
В учебниках по неотложной медицине указывают три терапевтические проблемы восстановления после случайного переохлаждения:
- Аритмия;
- Кровотечения;
- Шок во время согревания (110).
Возникновение аритмий хорошо документированный и наиболее опасный симптом, возникающий у пациентов со случайным переохлаждением. Несмотря на то, что это частое осложнение спонтанной гипотермии, клинических данных об эффектах применения антиаритмических препаратов мало. Некоторые сообщения свидетельствуют о благоприятном действии на нормализацию проводимости антиаритмических средств III класса, например, бретилия тозилата. Дополнительное доклиническое исследование задокументировало потенциальный положительный эффект этой группы лекарств для предотвращения повторных аритмий (111). Недавно опубликовали данные, что во время охлаждения от 34 до 30 °C, а также последующего согревания сердце подвергается проаритмическому периоду из-за вызванной сниженной температурой продленной реполяризацией (112). Удлинение реполяризации при гипотермии делает этот температурный промежуток аритмогенным. Удлиненная реполяризация купируется либо последующим согреванием, либо дальнейшим охлаждением. В ходе изучения литературы мы подтвердили отсутствие клинических данных об использовании фармакологических антиаритмических препаратов при гипотермии, но новая экспериментальная работа документирует антиаритмический потенциал бретилия, при этом следует избегать препаратов, удлиняющих интервал QT (113).
Кровотечение – еще одно опасное осложнение, которое возникает вследствие нарушения в системе сосудисто-тромбоцитарного и коагуляционного гемостаза при охлаждении. Причина такого нарушения заключается в том, ферментная система работает только при определенных температурах. Как следствие, снижение температуры тела у пациентов с множественными травмами представляет серьезную угрозу, а смертность из-за бесконтрольного кровотечения равна почти 100%.
Шок при согревании (“шок от согревания”) – расплывчатое понятие, которое связано с внезапным и неожиданным снижением самопроизвольного кровообращения во время согревания. В молниеносной форме шок возникает сразу или вскоре после начала согревания и напрямую не связан с возникновением аритмий. Шок при согревании хорошо описан в клинических случаях и в некоторых учебниках, но сам термин нечасто используется в литературе. В большинстве случаев у пациентов, согретых с помощью перфузионного ритма вентиляции легких, сердечный выброс и артериальное давление самостоятельно увеличиваются по мере повышения температуры тела. Однако первым клиническим признаком последующего циркуляторного шока являются снижение или отсутствие прироста сердечного выброса во время согревания или вскоре после него, не связанные с какой-либо очевидной или легко излечимой причиной (114-118). Более поздний шок от согревания проявляется быстрым падением артериального давления, вызванным снижением общего периферического сопротивления, когда компенсаторное увеличение сердечного выброса не происходит (119). Эта опасная гемодинамическая ситуация без лечения приводит к летальному исходу. В то же время она может быть устранена вмешательствами, направленными на повышение периферического сопротивления. В учебнике Маклина и Эмсли-Смита «Случайная гипотермия» (116), опубликованном в 1977 году, утверждается, что истинные причины "согревающего шока" пока неизвестны. Даже если снижение сердечного выброса обнаруживается, методов лечения существует немного. Фармакологические вмешательства в основном ограничиваются применением средств для поддержки сердечно-сосудистой функции и внутривенной инфузионной терапией. Они часто оказываются недостаточно эффективными для противостояния молниеносному сосудистому коллапсу (116).
При анализе результатов исследования 2001 года у пациентов с тяжелым случайным переохлаждением, получавших лечение в отделении интенсивной терапии, было обнаружено, что циркуляторный шок, требующий лечения вазоактивными препаратами, является независимым фактором риска >60% летальных исходов (120). Этот эпидемиологический анализ подтверждает как само существование, так и тяжесть шока согревания, который может иметь место у пациентов со случайным переохлаждением, как описано в многочисленных сообщениях о клинических случаях. Как ранее упомянуто, наше текущее понимание патофизиологических механизмов согревающего шока недостаточно. Существует предположение, что шок связан с возникновением острой сердечной недостаточности, возникающей при воздействии гипотермии (3, 115, 121, 122).
Шок во время согревания: новые данные о гипотермии и последующем согревании в экспериментах на животных
Несмотря на защитную роль гипотермии в выживании тканей, глубокое и длительное охлаждение в конечном итоге приводит к нарушению кровообращения во время гипотермии. Это, вероятно, является основным фактором, ограничивающим безопасное выживание охлажденных организмов с сохраненной самостоятельной циркуляцией крови. Ранее ученые (121, 123) обнаружили, что время выживания тесно связано со степенью снижения температуры тела и продолжительностью гипотермии. Было замечено, что животные, охлажденные до 15 °C, могут выживать при такой температуре в течение 9-10 часов, но безопасное согревание последует только в том случае, когда оно было начато в течение первых 5-ти часов. Если попытка согревания предпринималась через 5 часов, животные погибали, как только температура тела достигала 25-28 °C. Выдвигались предположения, что шок во время согревания, приведший к смерти, был вызван повышением периферического сопротивления, выраженным сгущением крови, нарушением капиллярной перфузии, снижением венозного возврата и острой сердечной недостаточностью.
Чтобы доказать «безопасность использования гипотермии в кардиохирургии», в 1950-х годах были проведены масштабные исследования физиологии гипотермии (96, 119, 124). Взаимосвязь между глубиной гипотермии и её продолжительностью была исследована до начала применения АИК (125). В частности, была проведена серия последовательных лабораторных и клинических работ, сфокусированных на компромиссах между временем, необходимым для восстановления работы сердца, и потребностью мозга в кислороде (126). Важным вкладом стала новаторская работа Бигелоу с соавт. (96, 119, 125, 127) в 1950 году. На модели погружного охлаждения до 18-20 °C на собаках с последующим немедленным иммерсионным согреванием исследователям удалось получить данные о значительном снижении сердечного выброса после согревания (96, 119, 125, 127). Это открытие подтвердилось последующими экспериментами, которые показали снижение сердечного выброса вследствие постгипотермической сердечной дисфункции («шока от согревания»), которая возникала в здоровом бьющемся сердце животного (128-134).
С изобретением АИК постгипотермическая сердечная дисфункция («шок от согревания») была устранена. Таким образом, любая патофизиология послеоперационной сердечной дисфункции теперь связывается с предшествующим периодом ишемии и реперфузии во время операции на сердце, а не с воздействием холода (135). Поэтому постгипотермическая сердечная дисфункция считается клинической проблемой только при согревании пациентов со случайным переохлаждением. Определение патофизиологических механизмов в основе сердечной недостаточности при гипотермии будет иметь решающее значение для комплексного лечения в клинических условиях. Основываясь на этих данных, наша исследовательская группа с начала 1990-х годов проводила экспериментальные исследования с целью дальнейшего изучения сердечно-сосудистой функции во время гипотермии/согревания в эксперименте. Первоначально эти исследования проводились на здоровых животных (136-138). В исследованиях на собаке (133, 139, 140) мы обнаружили, что согревание после умеренной гипотермии вызывало угнетение сердечно-сосудистой функции параллельно с заметным снижением кровотока в миокарде, несмотря на неповрежденный коронарный эндотелий (139). Опубликованные результаты указывают на прямое влияние гипотермии/согревания на сократительную функцию миокарда. Эти исследования были вдохновлены оригинальной работой Бигелоу с соавт. (96, 119, 125, 127), и наши результаты согласуются с их выводами о снижении функционирования миокарда после согревания. Аналогичные результаты были получены при работе с моделью здоровой крысы (134, 141), в которой мы показали ухудшение механической функции миокарда и сдвиг в энергетическом метаболизме. Таким образом, вполне вероятно, что сердце является важной мишенью гипотермии и согревания in vivo, при этом сердечная дисфункция способствует развитию циркуляторного шока после согревания. При использовании современных инвазивных методов мониторинга гемодинамики на моделях здоровых собак, крыс, мышей и свиней (142-144) результаты показывают, что охлаждение и согревание оказывают прямые эффекты на связь возбуждения и сокращения миокарда и актин-миозиновое взаимодействие (140, 143, 145). Эти эффекты, предположительно, объясняют снижение сократительной функции левого желудочка после согревания, что лежит в основе снижения сердечного выброса и падения артериального давления (146). Эти модели также использовались для скрининга потенциальных полезных эффектов различных фармакологических вмешательств для снижения сердечной дисфункции, вызванной гипотермией и согреванием, in vivo (142, 147-153).
Чтобы определить основные патофизиологические механизмы нарушения работы сердца, связанного с гипотермией и согреванием, исследования были сосредоточены на связи возбуждения и сокращения и возникновения мышечной силы в кардиомиоцитах. Ослабление механизма регуляции внутриклеточного [Ca2+] является ключевым фактором в патофизиологии сердечной недостаточности при нормотермии (154), и, вероятно, при гипотермии. В норме базальный уровень внутриклеточного [Ca2+] поддерживается на низком уровне и повышается лишь временно в ответ на электрическую стимуляцию. Амплитуда и продолжительность вызванных переходных процессов цитозольного [Ca2+] преобразуются в сократительные реакции через регуляцию тонких нитей на основе тропонина, в частности, за счет связывания внутриклеточного [Ca2+] с сердечным тропонином C (cTnC) и устранения преграды в виде стереохимической конфигурации тропонина I (cTnI) (155). Гипотермия, по-видимому, нарушает механизмы, лежащие в основе высвобождения и обратного захвата Са2+ саркоплазматическим ретикулумом (СР). Таким образом увеличивается амплитуда и продолжительность вызванного цитозольным [Ca2+] ответа на электрическую стимуляцию. С их увеличением также усиливается сократительная реакция сердечных миоцитов во время охлаждения. Эти, казалось бы, противоречивые функциональные изменения в кардиомиоцитах наблюдаются при снижении температуры тела уже с 36 °C до 30 °C (156). Повышение амплитуды и увеличение продолжительности созданного перехода внутриклеточного [Ca2+] со временем нарушается и приводит к перегрузке Ca2+ (154, 157). Вызванные гипотермией нарушения в обмене внутриклеточным [Ca2+] также могут быть объяснены изменениями в других клеточных компонентах ионного баланса сердечных миоцитов. Например, гипотермия влияет на Na+-K+-АТФазный насос (158, 159), обменник Na+/Ca2+ (91) и АТФазный насос саркоплазматического эндоплазматического ретикулума (SERCA2) (160). Двухфазное изменение сердечной функции в ответ на повышенный уровень внутриклеточного [Ca2+] было зафиксировано в экспериментах с использованием изолированных гипотермических сердец (91, 95, 102, 159, 161-170), а также у здоровых животных (171, 172) и в изолированных культурах кардиомиоцитов (173, 174).
Возникающая перегрузка внутриклеточным [Ca2+] во время гипотермии может негативно влиять на отложенную сократительную реакцию посредством ряда эффектов (154). Повышенный уровень [Ca2+] в цитозоле увеличивает потребность в энергии за счет активации АТФ-зависимого электромеханического сопряжения перекрестных мостиков и АТФ-зависимых насосов Ca2+ в саркоплазматическом ретикулуме и сарколемме (94). Увеличение потребления АТФ в конечном итоге приводит к деполяризации митохондрий, прекращению окислительного фосфорилирования, образованию АФК, нарушению синтеза энергии, набуханию митохондрий и гибели клеток (94, 134, 140, 175-186). С помощью электронной микроскопии и морфометрии мы смогли количественно оценить и классифицировать повреждение митохондрий миокарда после согревания вслед за 4-х часовым периодом охлаждения до температуры 15-13 °C с возобновлением кровообращения (137). Измененные митохондрии с электронно-плотными включениями составляли 20% от общего числа митохондрий. Это открытие соответствует результатам исследования измененных функционирующих митохондрий со значительной потерей высокоэнергетических фосфатов в нашей сопоставимой экспериментальной работе (134). В изолированных клетках, демонстрирующих нарушение связи возбуждения и сокращения миокарда, мы обнаружили, что уменьшение избыточного образования АФК путем антиоксидантной терапии во время охлаждения снижало нарушения в работе миокарда (187).
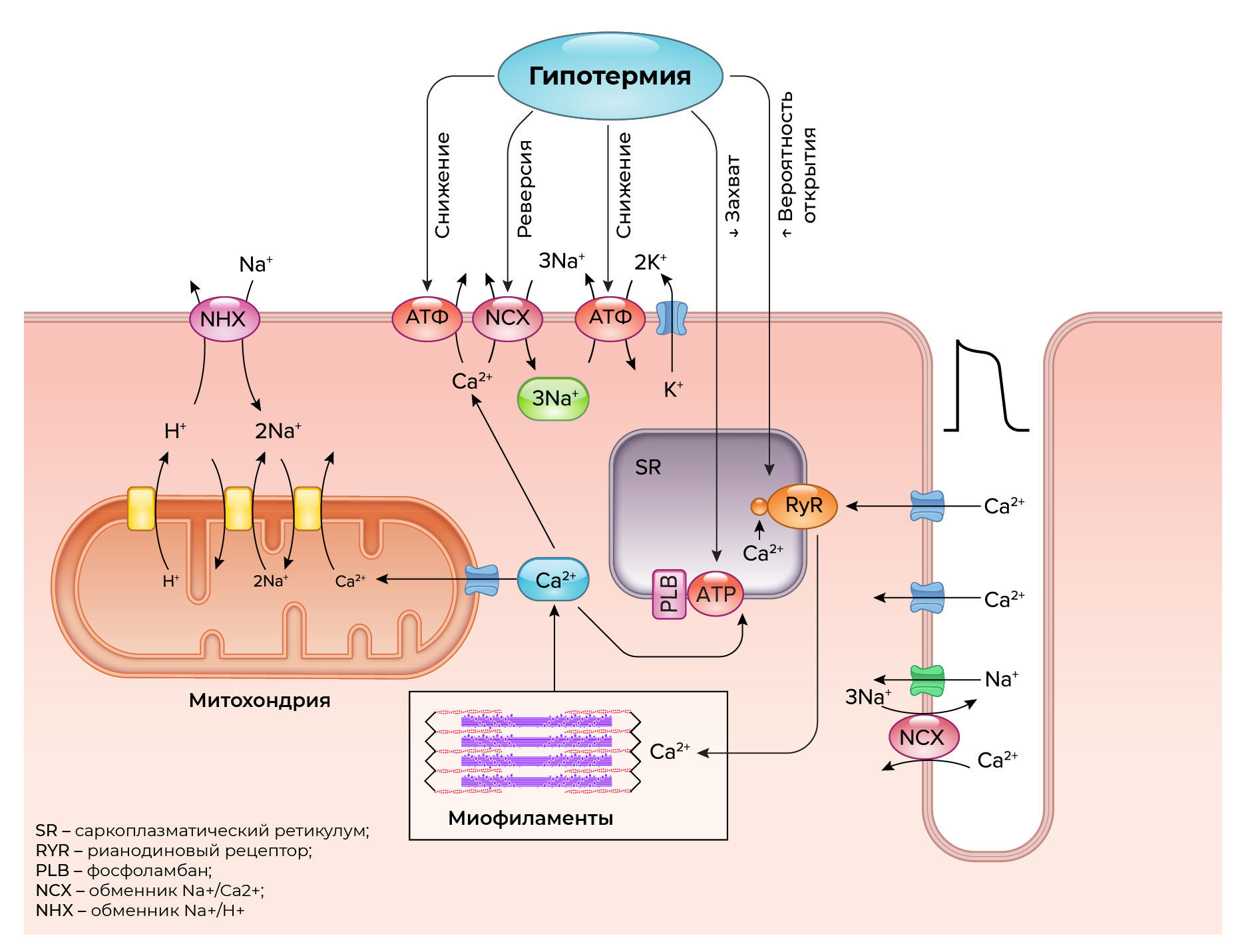
Рисунок 3. Классические теории, объясняющие индуцированный гипотермией отек клеток и перегрузку клетки кальцием. СР - саркоплазматический ретикулум; РиР - рианодиновый рецептор; ФЛМ - фосфоламбан; НКО - обменник Na+/Ca2+; NHX – обменник Na+/H+.
При согревании амплитуда и продолжительность вызванного переходного процесса внутриклеточного [Ca2+] возвращается к исходным показателям. Таким образом, снижение сократительной способности сердечных миоцитов (сердечная недостаточность) при “шоке от согревания” не может объясняться только нарушением регуляции высвобождения и обратного захвата внутриклеточного [Ca2+]. Напротив, сократительная чувствительность сердечных миоцитов к внутриклеточному [Ca2+] (чувствительность к Ca2+) снижается во время “шока от согревания” (188). Другим механизмом, лежащим в основе снижения генерации энергии независимо от уровней внутриклеточного [Ca2+], является повышение фосфорилирования сТнI, снижающее сократительную реакцию в ответ на ионы Са2+ (189). Фосфорилирование аминокислоты серина, опосредованное протеинкиназой A (ПКА) с участием сТнI по участкам 23 и 24, изменяет молекулярную конформацию сТнI и служит для ускорения расслабления и электромеханического сопряжения перекрестных мостиков (190). Участок ser-23 подвергается обязательному фосфорилированию. Фосфорилирование ser-24 также имеет большое функциональное значение (191). Важно отметить, что взаимодействие между миозином и актином с образованием перекрестных мостиков более вероятно, когда ser-24 сТнI не фосфорилируется (192), одноврменно фосфорилирование сТнI снижает способность ТнC к связыванию Ca2+.
На модели случайной гипотермии и согревания на здоровых крысах мы показали, что сенсибилизатор Ca2+ - левосимендан - воздействует на сТнC. Он ограничивает снижение сердечного выброса до 60% после согревания (147). Сравнивая мышей дикого типа с трансгенными мышами, экспрессирующими медленный скелетный ТнI (мсТнI), у которых отсутствуют участки фосфорилирования ser23/24, мы показали, что вызванная гипотермией сердечная дисфункция была снижена в процессе фосфорилирования сТнI в ser23/24 у трансгенных мышей (193). Кроме того, в сосочковой мышце крысы, которую непрерывно стимулировали в течение 1,5-часового периода гипотермии (15 °C) для имитации биения сердца при случайном переохлаждении, сократительная реакция сердца после согревания снизилась, несмотря на нормальные обмены внутриклеточного [Ca2+]. Это показывает снижение чувствительности к Ca2+ (194). Важно отметить, что в данной модели согревающего шока ПКА-зависимое фосфорилирование сТнI в ser23/24 увеличивалось. Аналогичные результаты были получены при использовании препарированных сердечных миоцитов крысы после аналогичного периода гипотермии (15 °C) (174). В этом случае измеряли сократительные ответы (укорочение длины саркомера), вызванные внутриклеточным [Са2+]. Снижение чувствительности к Са2+ было продемонстрировано сдвигом вправо на графиках фазовых циклов внутриклеточного [Са2+] и циклов сократительного ответов. В кардиомиоцитах сниженная чувствительность к Са2+ была связана с фосфорилированием сТнI в ser23/24 и активацией ПКА. Мы также подтвердили факт того, что во время гипотермии амплитуда вызванных переходных процессов внутриклеточного [Ca2+] увеличивалась, а время удлинялось. Также наблюдалось повышение базального цитозольного [Ca2+]. Предположительно, это и является основой перегрузки клетки Ca2+ при гипотермии. Однако сразу после согревания созданный переход цитозольного [Ca2+] возвращался к уровням нормотермии. Важно отметить, что, если изолированные сердечные миоциты не подвергались стимуляции во время гипотермии, снижение чувствительности к Са2+ и фосфорилирования сТнI было меньше (173). Эти результаты соприкасаются с кардиохирургией, где сердце останавливается во время гипотермии. Можно утверждать, что благодаря ГОС, как дополнению к потенциальным защитным эффектам химической кардиоплегии, во время кардиохирургической операции сердце защищается от повышения уровня внутриклеточного [Ca2+], изменения чувствительности к Ca2+ и фосфорилирования сТнI и, в конечном счете, от постгипотермической сердечной дисфункции.
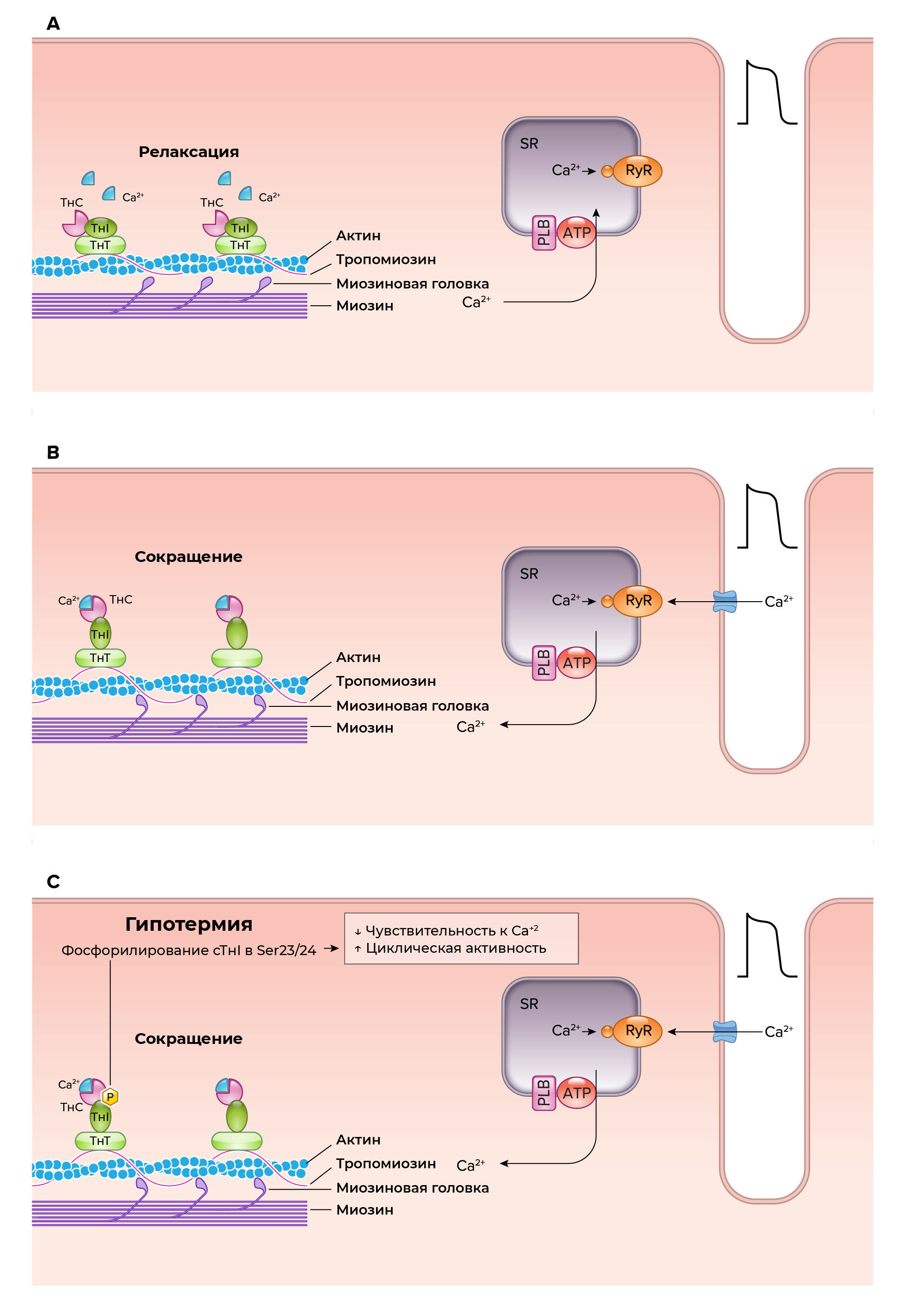
Рисунок 4. Механизм электромеханического сопряжения клеток сердца
А и В: Электромеханическое сопряжение клеток сердца в ответ на деполяризацию мембраны сарколеммы, выброс кальция саркоплазматическим ретикулумом (СР), вызванные Ca2+ изменения в актин-миозин-тропомиозиновом комплексе и цитоплазматическое Ca2+- индуцированное изменение конформации сердечного тропонина C (сТнС) и сердечным тропонином I (сТнI).
C: Вызванное гипотермией увеличение фосфорилирования сТнI с участием протеинкиназы A (ПКА), в Ser23/24 приводит к снижению чувствительности сТнC к Са2+ и увеличению циклической активности поперечных мостиков миозина. РиР – рианодиновый рецептор; ФЛМ – фосфоламбан.
В случаях случайного переохлаждения у пациентов с остановкой сердца сообщалось о полном восстановлении неврологических функций спустя 6 часов после догоспитальной реанимации и согревания в условиях стационара (109, 195-198). Эти данные о благоприятных исходах, по-видимому, связаны с качеством оказываемой неотложной медицинской помощи в стационаре, состоящей из раннего начала и дальнейшего применения сердечно-легочной реанимации в соответствии с последними международными рекомендациями (199, 200). В попытке задокументировать влияние сердечно-легочной реанимации на сердечный выброс, артериальное давление, транспорт и потребление O2, а также регионарный кровоток, нами была создана модель экспериментальной гипотермии на свинье (144). Прототип был оснащен автоматическим устройством для компрессии грудной клетки с функцией выполнения сердечно-легочной реанимации после гипотермической остановки сердца. Мы обнаружили, что, по сравнению с самостоятельным кровообращением при нормотермии, 3 часа непрерывной реанимации при температуре 27 °C обеспечивают частичную, но достаточную доставку O2 для поддержания аэробного метаболизма в жизненно важных органах (201). На основании многообещающих клинических случаев (202-204) было рекомендовано использовать экстракорпоральную мембранную оксигенацию для согревания после случайной гипотермии. Поэтому мы добавили в нашу модель согревание с использованием экстракорпоральной мембранной оксигенации после 3-х часовой непрерывной сердечно-легочной реанимации. Результаты показали устойчивое снижение сердечного выброса и артериального давления, устойчивость аэробного метаболизма, восстановление притока крови к сердцу и головному мозгу. Этот метод согревания создавал «шоковый» ритм сердца (222). Из-за нарушений функции сердца у наших животных после согревания, экстракорпоральное кровообращение для кардио- и респираторной поддержки при необходимости продолжалось до нескольких дней. Оно проводилось по типу помощи пациентам со случайным переохлаждением, которых согревали данной методикой (203, 204) для восстановления ритма перфузии.
Согревание после гипотермической остановки сердца и реперфузия после нормотермической ишемии или гипоксии используют одну и ту же стратегию лечения - восстановить кровоток в макрососудистом русле и попытаться оптимизировать кровоток на микрососудистом уровне, чтобы свести к минимуму дисфункцию органов. Однако все реперфузированные органы подвержены сложным патофизиологическим процессам, вызывающим неравномерные изменения в их функционировании. В совокупности указанное выше называется постреанимационной болезнью (205). Это заболевание может также включать системные воспалительные реакции и иметь перекрестные связи с воспалением и реакциями коагуляции/фибринолиза. Считается, что гипоксический/ишемический инсульт является основной причиной послеоперационной гибели нейронов. Потеря нервных клеток в дальнейшем приводит к длительному неврологическому дефициту. Концепция ишемии и реперфузии при нормотермических состояниях широко освещалась в других научных работах (206). В то же время, многочисленные экспериментальные и клинические исследования фиксировали, что гипотермия, как случайная, так и терапевтическая вместе с согреванием могут вызывать клеточные стресс-реакции (207-216), которые становятся центральными в патофизиологии гипотермии-согревания и потенциально доступны для последующих терапевтических вмешательств. На модели крысы мы продемонстрировали, что реанимация после тяжелой гипотермии связана с реакцией клеток миокарда на стресс. Она включает активацию передачи сигналов ядерного фактора каппа В и аутофагии. Кроме того, было обнаружено, что большинство изменений в экспрессии генов индуцируется во время согревания. Это позволяет предположить происхождение ключевых событий патогенеза “согревающего шока”, что делает перечисленные факторы мишенями для терапевтических вмешательств (171, 172, 217-219).
Что известно на данный момент?
Благодаря улучшению догоспитальной диагностики и лечения, выживаемость пациентов со случайной гипотермией с перфузионным ритмом увеличилась с выживания 20-48% 20 лет назад, до 68-72% на сегодняшний день. Смертность связана с возникновением аритмий, кровотечений и острой сердечной недостаточности (“шока при согревании”) во время восстановления температуры. Напротив, смертность пациентов со случайной гипотермией при остановке сердца достигает 70% и остается примерно неизменной за тот же период времени. Однако последние данные о пациентах указывают на увеличение выживаемости в последней группе пациентов после использования современных инвазивных методов согревания.
Что неизвестно и какие пробелы в знаниях существуют?
Отсутствуют детальные представления о механизмах дисфункции органов, возникающей во время переохлаждения. Более глубокое понимание этих патофизиологических механизмов необходимо для совершенствования методов согревания. Аналогичным образом, углубление знаний является необходимым условием для раннего распознавания симптомов и начала своевременных вмешательств в угрожающих жизни ситуациях на фоне острой органной недостаточности после гипотермией в процессе согревания.
