Микробиота кишечника при ожирении и контроле веса: микробы — друзья или враги?

Аннотация
Ожирение вызывается долговременной разницей между потреблением и расходом энергии — дисбалансом, который, как кажется на первый взгляд, легко восстанавливается путем увеличения физических упражнений и снижения потребления калорий. Однако, каким бы простым ни представлялось это решение, многим людям трудно добиться потери лишнего веса и еще труднее поддерживать результат. Причина этой проблемы кроется в том, что потребление и расход энергии и, соответственно, масса тела регулируются сложными гормональными, нервными и метаболическими механизмами, которые находятся под влиянием многих факторов окружающей среды и внутренних реакций. В дополнение к этой сложности на пищеварение, всасывание и метаболизм пищи прямое влияние оказывают микроорганизмы (микробы), образующие микробиоту кишечника. Более того, кишечная микробиота оказывает множество защитных, структурных и метаболических воздействий как на кишечную среду, так и на периферические ткани, тем самым влияя на массу тела, модулируя метаболизм, аппетит, обмен желчных кислот, а также гормональную и иммунную системы. В настоящем обзоре авторы описывают исторические и недавние достижения в понимании того, как микробиота кишечника участвует в регуляции гомеостаза массы тела. Они также обсуждают возможности, ограничения и проблемы использования подходов, связанных с кишечной микробиотой, в качестве средства для достижения и поддержания здоровой массы тела.
Основные положения
- Два десятилетия назад пионерские исследования показали, что вызванные пребиотиками изменения микробиоты кишечника влияют на массу жировой ткани у крыс.
- Многочисленные пищевые факторы, такие как жиры, белки и пищевые волокна, формируют микробиоту кишечника и в конечном итоге способствуют регуляции энергетического метаболизма хозяина с помощью специфических микробных метаболитов.
- На сегодняшний день нет никаких доказательств того, что одна конкретная бактерия или группа бактерий могут предсказать начало ожирения или потерю массы тела у людей.
- Регуляция энергетического метаболизма хозяина находится под влиянием многих метаболитов, продуцируемых и/или модифицируемых микробиотой кишечника, и некоторые из этих молекул могут стать потенциальными лекарственными препаратами.
- Демонстрация пользы или вреда определенного состава микробиоты для контроля массы тела остается сложной задачей и требует будущих исследований для разработки подходов персонализированной таргетной модуляции микробиоты.
Введение
Одно из первых указаний на то, что изменение состава кишечной микробиоты может положительно влиять на прогрессирование ряда заболеваний, таких как ожирение и сахарный диабет второго типа (СД2), было получено в исследованиях на грызунах с ожирением с использованием растворимых волокон. Эти соединения были названы пребиотиками, так как они действуют как удобрения, стимулирующие рост определенных полезных для здоровья бактерий [1, 2]. Впоследствии было показано, что у мышей с отсутствием кишечной микробиоты (безмикробных) развивается меньшая жировая масса, они менее склонны к ожирению по сравнению с обычными мышами (то есть мышами с кишечной микробиотой) [3, 4]. Последующие исследования на людях продемонстрировали изменение микробного состава у людей с ожирением и в качестве объяснения такого фенотипа предложили соотношение между двумя доминирующими типами, Firmicutes и Bacteroidetes (или Bacillota и Bacterioidota, согласно новой номенклатуре) [5, 6]. Начались поиски «хороших» и «плохих» бактерий. Сегодня достижения в этой области ясно показали, что такие упрощенные взгляды не работают и что при рассмотрении роли кишечной микробиоты в метаболическом здоровье необходимо учитывать множество других факторов и взаимодействий.
Авторы настоящего обзора реконструируют достигнутый в этой области прогресс, обобщая его историю и затем обращаясь к более поздней литературе, в которой обсуждается, как состав микробиоты влияет на ожирение. Также рассматриваются несколько механизмов, с помощью которых присутствие определенных бактерий и/или метаболитов, продуцируемых кишечной микробиотой, может быть ответственным за дифференциальную реакцию на управление весом. Далее авторы изучают роль конкретных диетических режимов и то, как они, воздействуя на микробиоту кишечника, могут влиять на контроль массы тела. Наконец, авторы обсуждают остающиеся проблемы и ограничения в этой области.
Пионерские исследования
Непосредственная роль кишечных микроорганизмов (микробов) в регуляции энергетического метаболизма хозяина была всесторонне изучена с использованием безмикробных мышей. Разработка безмикробных животных началась в 1940-х годах [7], а к 1964 году исследования на безмикробных и обычных крысах и цыплятах показали, что кишечная микробиота препятствует абсорбции жиров [8, 9]. Работа с самой ранней демонстрацией специфических изменений в контролирующих аппетит кишечных пептидах, связанных с кишечными микробами, была опубликована в 1989 году. Goodlad et al обнаружили, что у безмикробных крыс уровень циркулирующего энтероглюкагона и пептида тирозин-тирозин (PYY) был выше, чем у обычных крыс [10].
В 2000 году Daubioul et al обнаружили, что изменение состава микробиоты кишечника у тучных крыс fa/fa Zucker с помощью растворимых волокон, таких как пребиотики инулин или олигофруктоза (то есть фруктанов инулинового типа), было связано со снижением жировой массы, стеатозом печени и гликемией [11]. В 2002 году при первой попытке выявить механизмы, связывающие микробиоту и высокую ферментацию фруктанов инулинового типа по сравнению с плохо ферментирующимися волокнами, такими как целлюлоза, та же группа обнаружила, что фруктаны инулинового типа увеличивают содержание пропионата в слепой кишке и его концентрацию в воротной вене [12]. Вскоре после этого, в 2003 году, было показано, что пропионат является одной из ключевых короткоцепочечных жирных кислот (КЦЖК), способных связывать и активировать рецепторы свободных жирных кислот FFAR2 и FFAR3 [13]. Активация этих рецепторов, связанных с G-белком (GPCR), зависит от длины цепей КЦЖК. У человека на FFAR2 сильнее всего в равной степени действуют ацетат (C2) и пропионат (C3), за ними следуют бутират (C4), валерьянат (C5) и формиат (C1), в то время как FFAR3 обладает большим сродством к длинным КЦЖК (C4 = C3 = C5 > C2 = C1) [13–15].
В настоящее время общепризнано, что КЦЖК, вырабатываемые микробиотой кишечника, способствуют секреции кишечных пептидов, таких как глюкагоноподобный пептид 1 (GLP1) и PYY [16]. Эти гормоны продуцируются энтероэндокринными L-клетками, наиболее часто встречающимися в подвздошной и толстой кишке, где в больших количествах присутствует большинство кишечных микробов, способных ферментировать пищевые волокна, такие как фруктаны инулинового типа [17]. Поразительно, что в 1998 году Kok et al [18] обнаружили, что в слепой кишке у крыс, которых кормили фруктанами инулинового типа, наблюдалось статистически значимо более высокое содержание GLP1 по сравнению с крысами, не получавшими эти волокна. GLP1 представляет собой кишечный пептид, который снижает потребление пищи, уменьшает гликемию и повышает чувствительность к инсулину. В 2004 году Cani et al в экспериментах на крысах показали, что ферментация растворимых волокон (например, фруктанов инулинового типа) связана с меньшим потреблением пищи, снижением массы тела и прироста жировой массы по сравнению с крысами, потребляющими обычную диету, содержащую волокна, но не обогащенную фруктанами инулинового типа. Этот фенотип был напрямую связан со специфическими изменениями выработки кишечных пептидов, участвующих в регуляции аппетита, такими как статистически значимое увеличение продукции анорексигенных пептидов GLP1 и PYY и снижение выработки орексигенного пептида грелина, что подтверждает связь между кишечной микробиотой, ожирением хозяина и потреблением пищи [11, 19–22] (рис. 1).
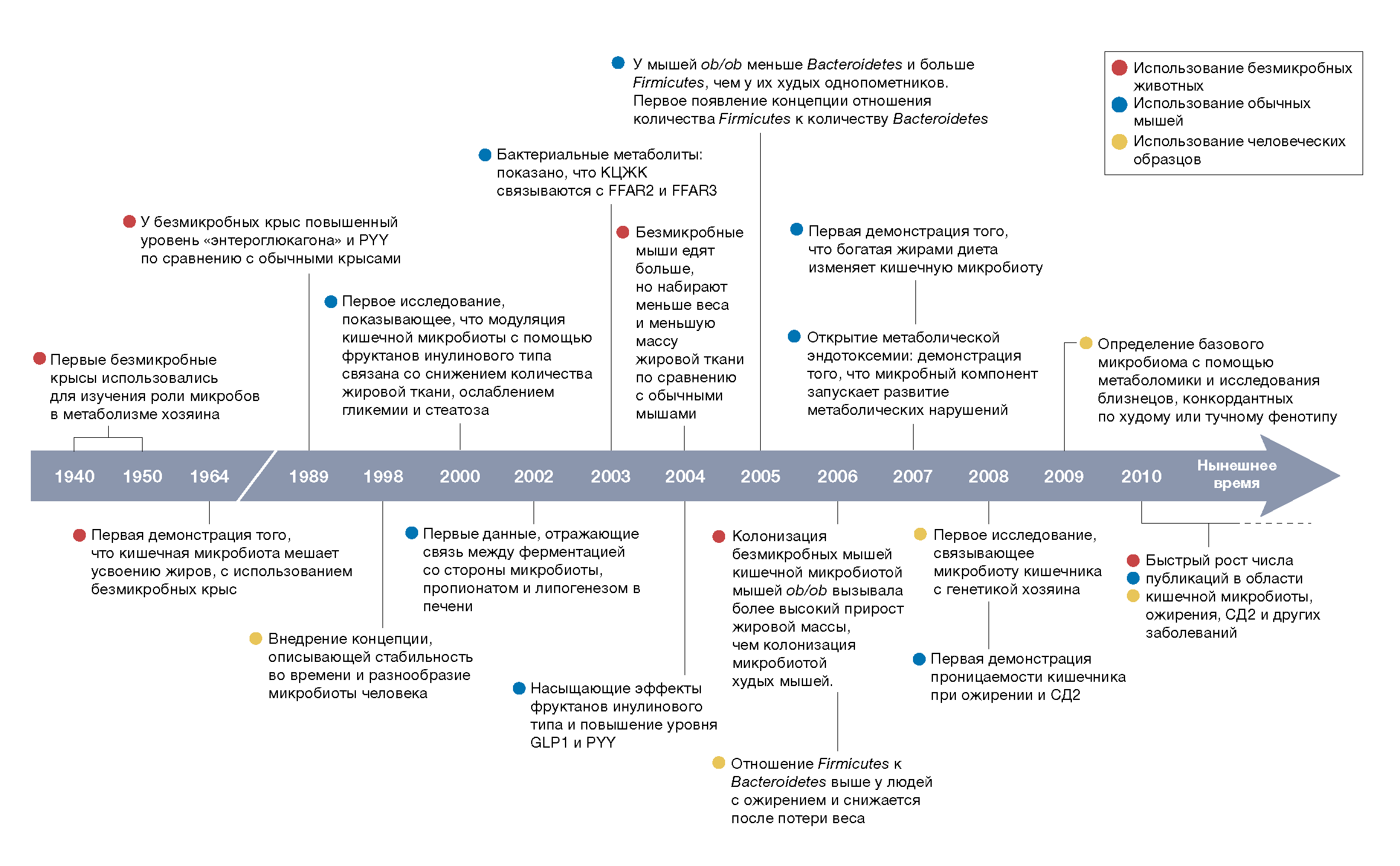
В тот же период, в 2004 году, Bäckhed et al в выдающемся исследовании однозначно показали, что кишечные микробы принимают непосредственное участие в энергетическом метаболизме хозяина. Авторы обнаружили, что безмикробные мыши набирали статистически значимо меньшую массу тела и жировую массу, чем обычные мыши [3] (рис. 1). И наоборот, оказалось, что колонизация безмикробных мышей кишечными микроорганизмами повышала уровень глюкозы, инсулина и лептина в их крови, стимулировала накопление липидов в жировой ткани и способствовала синтезу триглицеридов в печени [3].
Влияние кишечных микробов на ожирение также было продемонстрировано на мышах ob/ob с генетически обусловленным ожирением. В 2005 году Ley et al [5] первыми предположили, что ожирение может характеризоваться изменением состава микробиоты. По сравнению с худыми мышами у мышей ob/ob было на 50% снижено количество Bacteroidetes (теперь переименованных в Bacterioidota) и пропорционально увеличено количество Firmicutes (теперь Bacillota), что позволяет ввести концепцию увеличения отношения количества Firmicutes к количеству Bacteroidetes (отношение F:B), в связи с ожирением. Ley et al также предположили, что у мышей ob/ob ожирение влияет на разнообразие кишечной микробиоты [5]. В 2006 году Turnbaugh et al [6] показали, что микробиота кишечника мышей ob/ob обогащена генами, участвующими во всасывании и превращении неперевариваемых полисахаридов в доступные для хозяина субстраты, что приводит к повышению биодоступности энергии. Они продемонстрировали, что колонизация безмикробных мышей кишечной микробиотой мышей ob/ob вызывала более высокий прирост жировой массы, чем колонизация кишечной микробиотой худых мышей, и этот эффект не зависел от приема пищи [6] (рис. 1).
Ley et al также сравнили микробиоту кишечника худых людей и лиц с ожирением, и обнаружили, что у людей с ожирением было меньше Bacteroidetes и больше Firmicutes, чем у худых контрольных лиц, что подтвердило их наблюдения на мышах [23]. Они обнаружили, что у людей с ожирением отношение F:B может быть частично восстановлено после 52 недель диетического снижения веса с помощью низкокалорийной диеты с ограничением жиров или углеводов [23]. Однако относительное изменение содержания конкретных бактериальных штаммов или их связь с массой тела не изучались. Вскоре после публикации концепция отношения F:B как предполагаемой характеристики ожирения была подвергнута сомнению: возможно, она не является универсальной. В 2008 году Duncan et al в аналогичном исследовании не смогли подтвердить гипотезу об отношении F:B, поскольку они не обнаружили различий в пропорциональном содержании Bacteroidetes и Firmicutes в образцах фекалий худых людей и лиц с ожирением даже после снижения веса [24].
В 2008 г. Khachatryan et al опубликовали первое исследование, связывающее микробиоту кишечника с генетикой хозяина путем сравнения 19 человек с семейной средиземноморской лихорадкой (распространенное моногенное рецессивно наследуемое аутовоспалительное заболевание) с восемью здоровыми людьми и предоставило убедительные данные о том, что разнообразие кишечных бактерий значительно отличалось и зависело от аллельного статуса хозяина. Представление о том, что на микробиоту влияет генетика, позже было подтверждено другими исследованиями с участием близнецов. Более того, было показано, что генетика хозяина влияет на состав микробиома кишечника человека таким образом, что это затрагивает метаболизм хозяина [26]. В 2009 г. Turnbaugh et al исследовали микробиоту кишечника в общей сложности 154 пар монозиготных или дизиготных близнецов, которые были конкордантны по фенотипу худобы или ожирения, с помощью метагеномного анализа, что позволило изучить как таксономические, так и функциональные изменения [27] (рис. 1). Эта работа стала первым исследованием того, как генотип хозяина, а также воздействие окружающей среды и ожирение могут быть связаны как с составом, так и с активностью микробиоты кишечника. Помимо выявления общих характеристик микробиоты среди членов семьи, они также обнаружили, что каждый человек имеет свою собственную сигнатуру микробного сообщества, но с эквивалентной степенью ковариации между парами. Это исследование было пионерным, показавшим, что люди имеют общие микробные гены; это привело к предположению о существовании «основного микробиома» на генном, а не на таксономическом уровне [27]. В совокупности эти данные подтверждают гипотезу о том, что в развитии ожирения участвуют небольшие изменения или более специфическая модуляция сообщества кишечной микробиоты, а не просто широкое изменение на уровне типа. Еще одним важным достижением в этой области, которое является следствием описанного исследования, стало то, что ожирение у человека связано с определенной представленностью бактериальных генов и ключевых метаболических путей [27] (рис. 1). Результаты исследования также позволяют предположить, что разнообразие (по составу и функциям) может быть связано с различными физиологическими состояниями (ожирение или худоба).
Следует отметить, что концепцию микробного разнообразия в кишечнике была введена в 1998 году Zoetendal et al. Они использовали гель-электрофорез в температурном градиенте — особый метод, который в то время позволил авторам предположить, что микробиота отдельного человека очень стабильна во времени (по крайней мере, шесть месяцев) [28] (рис. 1). В настоящее время концепция сниженного микробного разнообразия, за некоторыми исключениями, широко применяется во многих патологических ситуациях. Одним из таких исключений служит низкое разнообразие микробиоты у младенцев, в которой преобладает один вид, встречающийся в изобилии (Bifidobacterium spp.), но это не является указанием на патологию.
Данные, подтверждающие роль кишечной микробиоты в этиологии ожирения, также получены из нескольких исследований, в которых мышей в раннем возрасте подвергали воздействию субтерапевтических доз антибиотиков, что приводило к умеренному увеличению массы тела и жировой массы [29]. Кроме того, эффекты были более выраженными, когда антибиотики вводили мышам с рождения [30]. Субтерапевтические дозы антибиотиков также имели тенденцию усиливать влияние диеты с высоким содержанием жиров (ДВСЖ) на ожирение у мышей [30]. Кроме того, перенос микробиоты кишечника от мышей, получавших субтерапевтическую дозу антибиотика, к безмикробным мышам вызывал аналогичные влияния на массу тела и жировую массу [30], что еще раз подтверждает причинно-следственную связь между микробиотой и ожирением. Использование безмикробных мышей остается важным для научного сообщества; тем не менее, исследование, проведенное в 2022 году, четко показало, что условия их содержания (в вивариях без конкретных патогенов или же вовсе без микробов) могут иметь значение в контексте ожирения и в конечном итоге — привести к противоречивым результатам в литературе [31, 32].
Пищевые факторы, влияющие на микробиоту
На кишечную микробиоту могут воздействовать многие факторы, включая образ жизни, возраст, генетику хозяина, способ рождения и состояние здоровья [33]. Однако основным фактором, влияющим на состав кишечной микробиоты, служат пищевые привычки хозяина. Современный малоподвижный образ жизни и западная диета, которые в течение последних нескольких десятилетий активно внедрились в жизни людей, несомненно, способствуют росту количества проблем со здоровьем. Из-за сложности этих взаимосвязей последствия влияний различных пищевых компонентов (например, макроэлементов и микроэлементов, соли и пищевых добавок) на модуляцию кишечной микробиоты до сих пор в значительной степени неизвестны. Однако, начиная с 2015 года, сосредоточенные на этой проблеме исследования помогают распутать этот сложный вопрос (рис. 2).
Пищевые жиры
Крупнейшее в своем роде диетическое исследование на мышах показало, что именно пищевой жир (а не белки или углеводы) регулирует потребление энергии и вызывает накопление жировой ткани [34]. В этой работе микробиота кишечника не изучалась; однако менее крупное и более глубокое исследование, проведенное в 2022 году, подтвердило, что именно пищевой жир, а не сахар, является основным фактором, определяющим накопление жировой ткани у мышей, а также продемонстрировало, что рационы с разным содержанием сахара и жира вызывают специфические изменения в количестве определенных бактериальных таксонов [35]. В более раннем исследовании, проведенном в 2007 году [36], уже показано, что кормление мышей ДВСЖ вызывает у них специфические изменения в составе микробиоты кишечника. Эти изменения включали снижение численности Bacteroides-подобных кишечных бактерий мышей, близкородственных группе Bacteroides–Prevotella — бактериям группы, содержащей Eubacterium rectal, Clostridium coccoides и Bifidobacterium spp. по сравнению с мышами, получавшими контрольный рацион. В серии последующих исследований удалось подтвердить, что ДВСЖ, содержащая в основном насыщенные и омега-6 полиненасыщенные жирные кислоты, вызывает специфические изменения в микробиоте кишечника [37–40]. Прямая связь между вызванными ДВСЖ изменениями микробиоты кишечника и ожирением была подтверждена работой, показывающей, что мыши, получавшие антибиотики широкого спектра действия и ДВСЖ, были частично устойчивы к ожирению, воспалению и резистентности к инсулину [40, 41]. Кроме того, безмикробные мыши также были частично устойчивы к метаболическим нарушениям, вызванным ДВСЖ, что убедительно свидетельствует о взаимодействии между пищевыми жирными кислотами и предрасположенностью к развитию ожирения и связанных с ним заболеваний [4, 42, 43].
Хотя насыщенные жирные кислоты связывают с возникновением метаболических нарушений, мыши, получавшие изокалорийную ДВСЖ с омега-3 жирными кислотами (то есть рыбий жир), были защищены от слабовыраженного воспаления, метаболической эндотоксемии, инсулинорезистентности и ожирения по сравнению с мышами, чей рацион был столь же калорийным, но содержал жирные кислоты из сала [44] (рис. 2). Было также показано, что тип пищевого жира является основным фактором структуры микробного сообщества, влияя как на состав, так и на разнообразие кишечной микробиоты [44]. Кроме того, кишечная микробиота мышей, получавших рыбий жир, при переносе путем трансплантации фекальной микробиоты (ТФМ) обеспечивает защиту от ожирения и воспаления, вызванных жирной диетой. Среди предполагаемых бактерий, связанных с положительным эффектом употребления омега-3, было выявлено повышенное содержание Bifidobacterium spp., Lactobacillus spp. и Akkermansia muciniphila 44]. Эти три таксона бактерий также были связаны с благотворным действием пребиотиков, таких как фруктаны инулинового типа, при ожирении [37, 45–47] (рис. 2 и 3). В частности, A. muciniphila связана с положительными эффектами при ожирении [48].
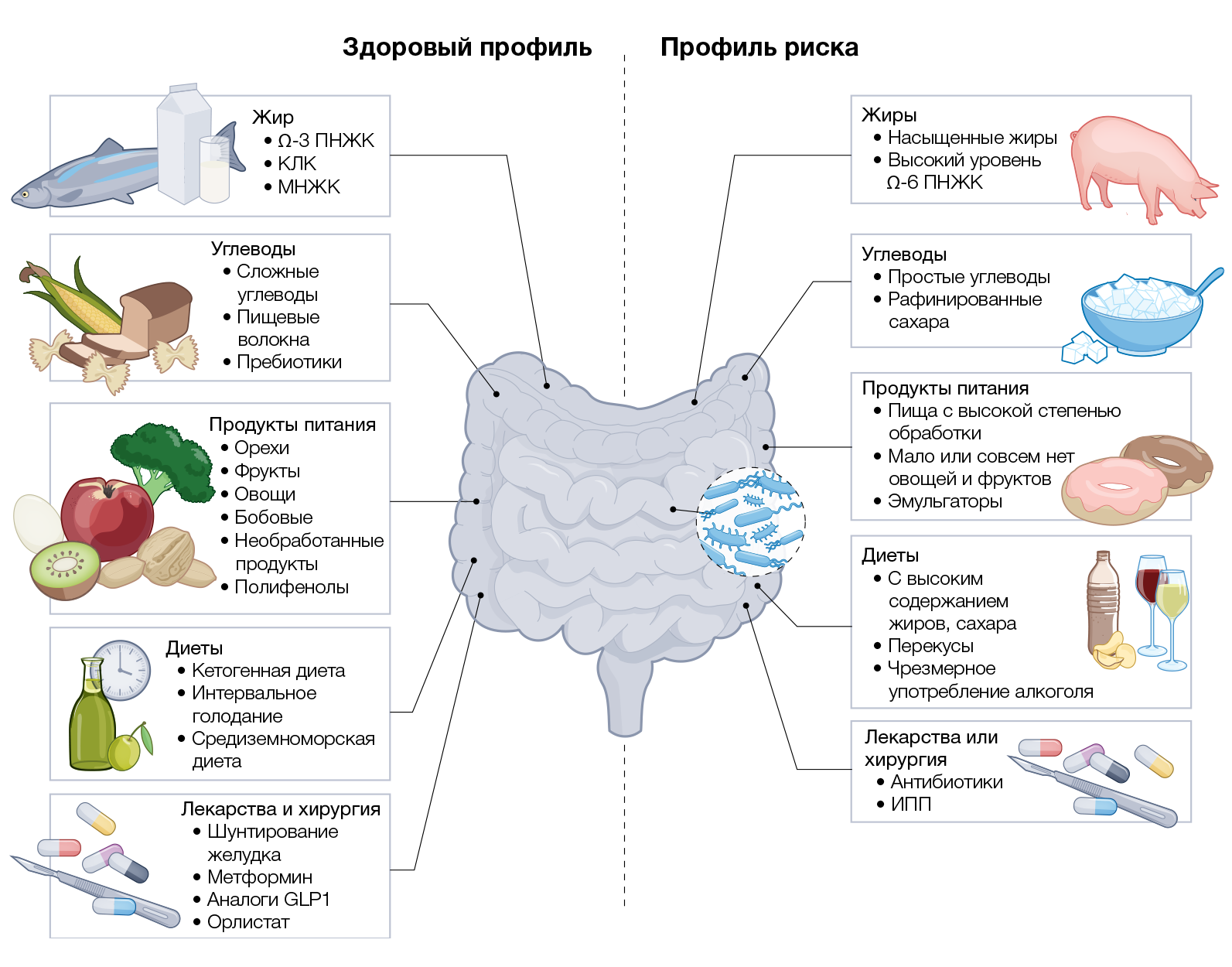
Предметом дальнейших исследований стало влияние количества и качества пищевых жирных кислот на состав микробиоты кишечника и его метаболические последствия. Интересный систематический обзор 2019 года дал поразительные результаты [20]. Так, анализ шести интервенционных испытаний не показал сильного влияния количества или качества пищевого жира на состав кишечной микробиоты или здоровье участников исследования. Напротив, все обсервационные исследования показали, что различия в количестве и качестве пищевых жиров связаны с изменениями в микробиоте и здоровье. Кроме того, потребление большого количества жира в целом или насыщенных жирных кислот негативно влияло на богатство и разнообразие микробиоты, а диеты с повышенным содержанием мононенасыщенных жирных кислот были связаны со снижением общего числа бактерий. Удивительно, но диетические полиненасыщенные жирные кислоты не влияли на микробное богатство или разнообразие [49].
Пищевой белок
Пищевые белки также участвуют в модуляции состава и активности кишечной микробиоты [50]. Хотя большая часть пищевых белков всасывается в тонкой кишке (> 90%), часть из них избегает переваривания и достигает толстой кишки, где служит субстратом для микробного метаболизма. Богатые белком диеты часто рекомендуются для снижения веса; однако общее понимание того, как увеличение количества белков, достигающих толстой кишки, влияет на состав и функцию микробиоты, ограничено [51]. Даже хорошо продуманные исследования на людях показали противоречивые результаты в отношении состава микробиоты при повышенном потреблении пищевого белка, что связано с различными факторами [50]. Помимо количества, следует учитывать и качество белков. Например, рацион со сложным составом пищевого белка, потребляемый людьми в западных странах, непосредственно способствовал увеличению веса и развитию резистентности к инсулину у мышей. Пагубное воздействие белковой смеси было связано с выработкой микробами жирных кислот с разветвленной цепью, а также с повышенным уровнем ацилкарнитинов в плазме и печени, что свидетельствует об аберрантном окислении жирных кислот в митохондриях [52].
Так или иначе, было высказано предположение, что на формирование общего микробного сообщества влияет относительная доступность азота в среде кишечника. Эта гипотеза подразумевает, что потребление белка с пищей следует рассматривать как один из многих факторов, влияющих на динамику взаимодействий между хозяином и микробиомом. Изучение взаимосвязи между различными белковыми, углеводными и липидными профилями будет главной задачей при разработке конкретных диетических стратегий для снижения веса [53].
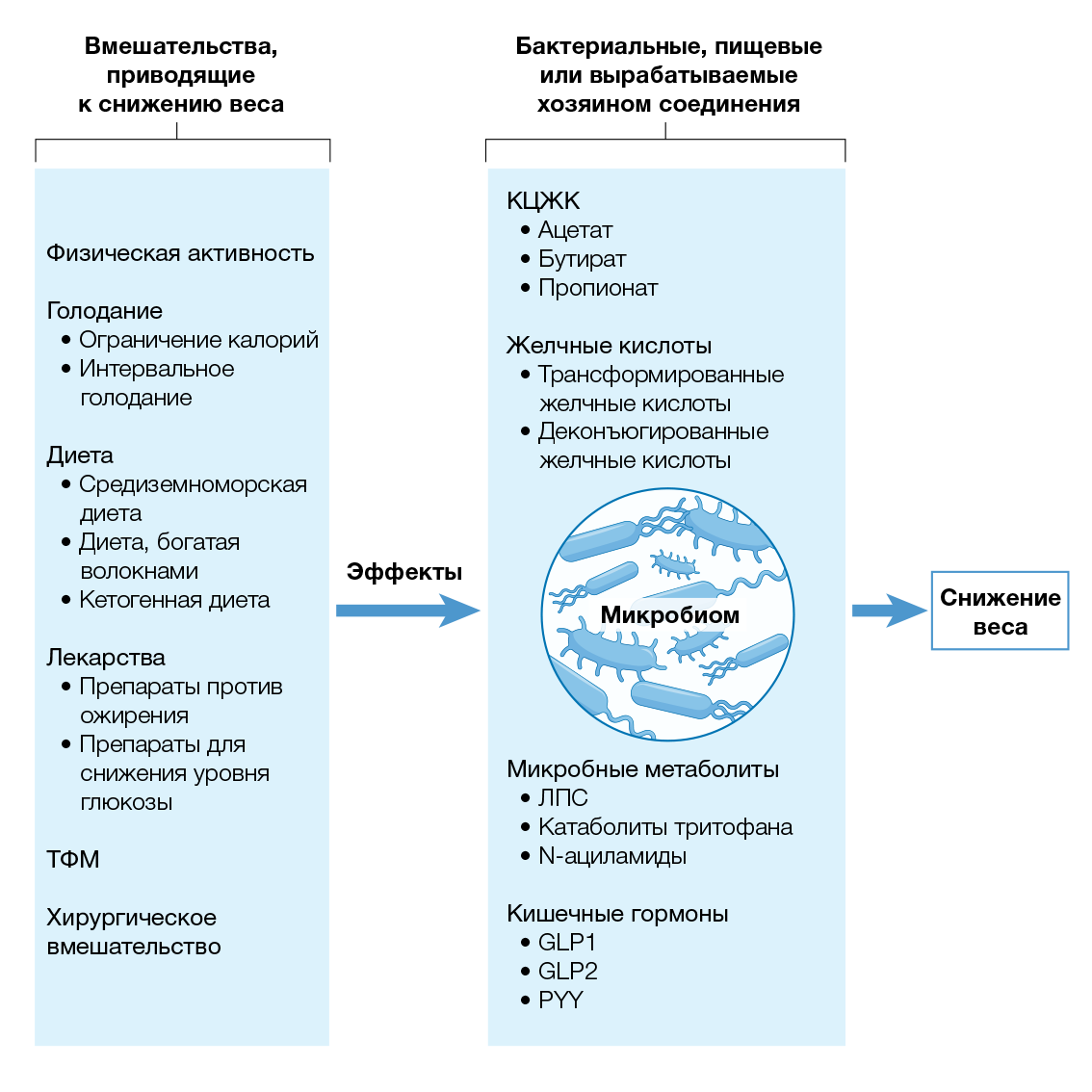
Влияние микробиоты на массу тела
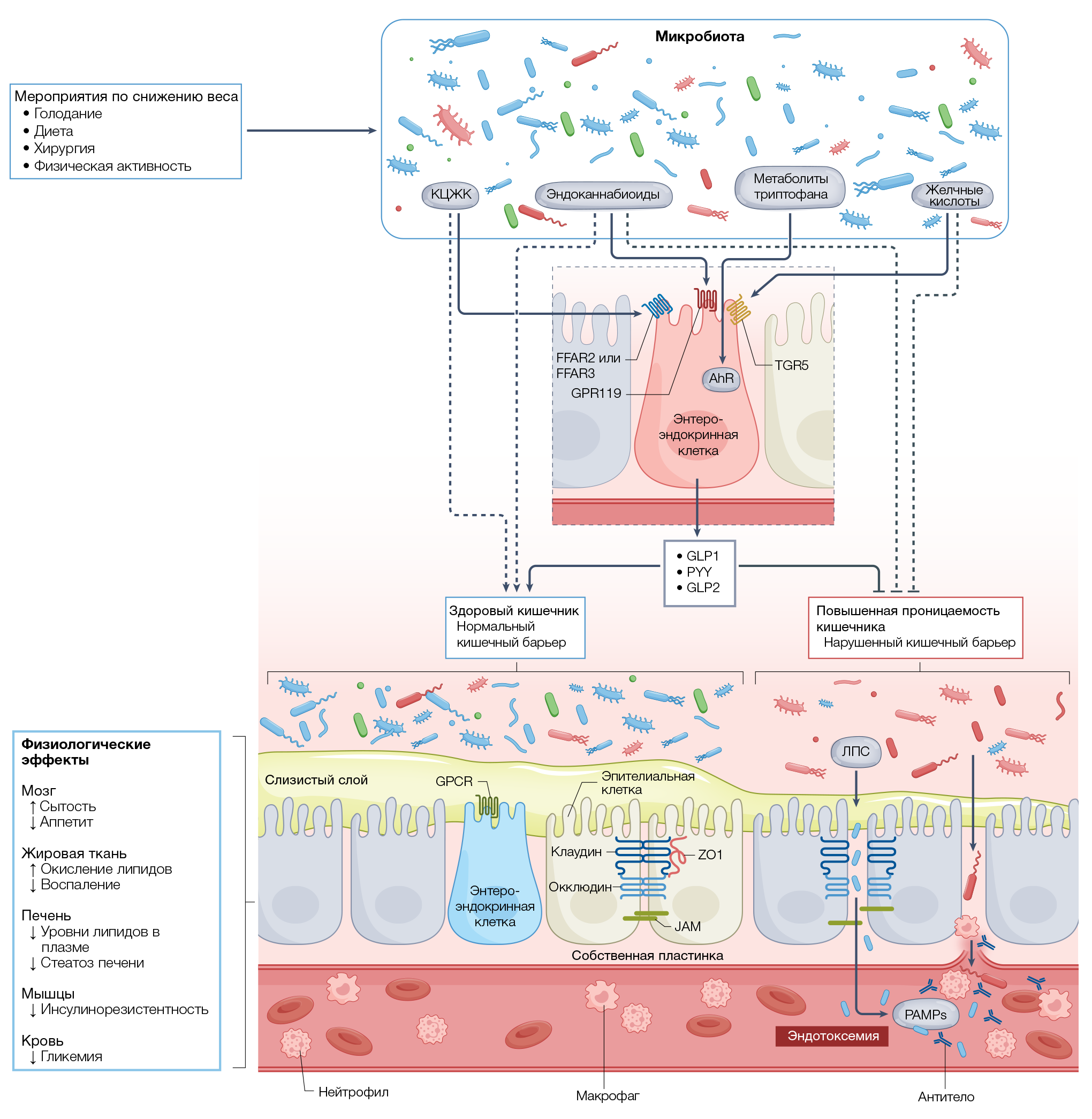
Хотя многое остается неизвестным, за последнее десятилетие было получено важное понимание механизмов того, как микробиота кишечника модулирует метаболизм хозяина и массу его тела. Эти исследования выявили как прямое действие (микробиота изменяет количество калорий, доступных для поглощения), так и косвенные механизмы (микробиота вырабатывает или модулирует бактериальные, пищевые или произведенные хозяином соединения, которые влияют на метаболические пути хозяина). Хотя исчерпывающий список микробных метаболитов выходит за рамки этого обзора [16], здесь обобщены данные о некоторых важных участниках в контексте метаболизма хозяина. Предполагается и другой прямой путь влияния бактерий на физиологию хозяина, а именно — транслокация бактерий в различные ткани и органы (включая жировую ткань человека) из-за повышенной проницаемости кишечника [54–57]. Тем не менее, как присутствие бактерий и бактериальной ДНК в периферических тканях влияет на метаболизм хозяина, остается неясным.
Короткоцепочечные жирные кислоты
КЦЖК производятся некоторыми кишечными бактериями в результате ферментации углеводов. Основными КЦЖК-продуктами являются ацетат, пропионат и бутират, которые производятся в приблизительном молярном соотношении 60:20:20. Эти КЦЖК регулируют pH просвета кишечника и выработку слизи, служат топливом для эпителиальных клеток и модулируют иммунную функцию слизистой оболочки. Кроме того, они могут попадать в системный кровоток и непосредственно влиять на метаболизм или функцию периферических тканей [17, 58, 59]. Хотя КЦЖК представляют собой прямой источник дополнительных калорий, считается, что повышенное образование КЦЖК благотворно влияет на системную регуляцию энергии за счет снижения продукции глюкозы и липидов в печени [60]. Как упоминалось ранее, КЦЖК стимулируют секрецию анорексигенных гормонов PYY и GLP1 в толстой кишке, тем самым облегчая передачу сигналов по оси кишечник — мозг путем активации FFAR2 и FFAR3 для регуляции иммунитета, времени кишечного переноса, воспаления и метаболизма [16, 17, 58, 59] (рис. 4).
В настоящее время литература, посвященная КЦЖК у людей, сосредоточена в основном на добавках пищевых волокон и эндогенной продукции КЦЖК. Получению новых данных препятствуют трудность измерения продукции КЦЖК, различия в способе введения и/или месте выработки, различия в протестированных пищевых волокнах, в составе рациона и в метаболическом фенотипе отдельных людей [59, 61]. Хотя исследования острого и хронического введения КЦЖК на грызунах показывают благотворное влияние на потерю веса и предотвращение или замедление набора веса [59], данные, касающиеся человека, все еще очень ограничены [61]. Тем не менее, в серии исследований было показано, что увеличение количества пропионата в толстой кишке предотвращает набор веса и/или регулирует аппетит у взрослых с избыточной массой тела; это позволяет предположить, что усиление выработки КЦЖК может быть ценной стратегией предотвращения ожирения [62–64].
Желчные кислоты
Первичные желчные кислоты, такие как холевая кислота и хенодезоксихолевая кислота, при приеме пищи выделяются в тонкую кишку, где они способствуют всасыванию пищевых жиров и жирорастворимых витаминов. Кроме того, желчные кислоты служат сигнальными молекулами и все чаще считаются ключевыми регуляторами системного метаболизма. Взаимодействия с ядерными рецепторами гормонов (такими как фарнезоидный X-рецептор [65], рецептор витамина D [66], прегнановый X-рецептор [67] и конститутивный андростановый рецептор [68]) и мембранными рецепторами (например, рецептором Takeda 5, связанным с G-белком) [69] могут регулировать секрецию PYY, GLP1 и фактора роста фибробластов 19 (FGF19, FG15 у мышей), метаболизм холестерина и системный расход энергии [70] (рис. 4). На желчные кислоты сильно влияет бариатрическая хирургия, что, возможно, способствует метаболическим эффектам операции [71].
В просвете кишечника желчные кислоты служат субстратами для биотрансформации кишечными микробами. Модификации включают деконъюгацию (удаление аминокислотных остатков) за счет активности гидролазы желчных солей (BSH/ГДС) и дальнейшую метаболизацию за счет удаления гидроксильных групп (дегидроксилирование), окисления (дегидрирование) или эпимеризации [72, 73]. Модифицированные желчные кислоты называются вторичными желчными кислотами и включают дезоксихолевую кислоту, литохолевую кислоту и урсодеоксихолевую кислоту (вторичная желчная кислота у человека, но первичная желчная кислота у грызунов). ДВСЖ увеличивает содержание фекальных и циркулирующих вторичных желчных кислот [74–76]. Метаболизм бактерий изменяет биодоступность и биоактивность желчных кислот и, следовательно, их влияние на метаболические реакции, в которые они вовлечены [77]. Интересно, что взаимодействия между микробиотой и желчными кислотами, как предполагается, вносят свой вклад в повторное увеличение веса после ограничения калорий [78]. Кроме того, было показано, что у людей с ожирением и резистентностью к инсулину потеря веса, вызванная очень низкокалорийной диетой, увеличивает постпрандиальный уровень дезоксихолевой кислоты и снижает расход энергии в покое [79].
Эндоканнабиноидоподобные соединения
Эндоканнабиноидная система состоит из различных биоактивных липидов, экспрессирующихся практически во всех клетках и органах. Они выполняют многочисленные регуляторные функции, в том числе участвуя в контроле энергии, метаболизма глюкозы и липидов, а также в иммунитете и воспалении посредством активации различных рецепторов [80, 81]. В 2010 году впервые было показано, что эндоканнабиноидная система и другие родственные биоактивные липиды и рецепторы регулируются кишечной микробиотой, тем самым представляя еще один механизм, с помощью которого микробы осуществляют контроль над кишечным барьером [82] (рис. 4). Кроме того, было показано, что безмикробные мыши или обычные мыши, как худые, так и с моделью ожирения и СД2, имеют специфическое состояние микробиоты и эндоканнабиноидной системы [83–85]. В свою очередь, эндоканнабиноидная система хозяина может также регулировать состав и активность микробиоты и способствовать регуляции образования бурой жировой ткани, расходу энергии и влиять на прием пищи через ось кишечник — мозг [86–88]. Таким образом, эти находки демонстрируют важные и сложные взаимодействия в этой системе.
В 2017 году элегантное исследование показало, что среди комменсальных бактерий может быть распространена химическая мимикрия эукариотических сигнальных молекул, о чем говорит тот факт, что желудочно-кишечные бактерии обогащены генами N-ациламидсинтазы, а липиды, которые они кодируют, взаимодействуют с GPCR [89]. Например, комменсальные агонисты регулируют гомеостаз глюкозы, а также опорожнение желудка и аппетит посредством GPR119-зависимого выделения гормона из энтероэндокринных клеток и, как полагают, делают это столь же эффективно, как и человеческие лиганды [89]. Проведенные недавно многочисленные исследования указали на роль и специфические взаимодействия между эндоканнабиноидомом (включая эндоканнабиноиды и родственные молекулы, а также их ферменты и мишени) и метаболизмом хозяина (рис. 4).
Метаболиты триптофана и лиганды AhR
Катаболиты триптофана микробного происхождения в нескольких моделях были связаны с регуляцией аппетита [90–92] (рис. 4). Триптофан — незаменимая аминокислота, используемая для синтеза белка. Кроме того, триптофан играет ключевую роль в воздействии микробиома на массу тела и метаболизм [93]: полученные данные говорят о том, что триптофан и связанные с ним метаболиты способны передавать сигналы как локально (в слизистой оболочке кишечника), так и к отдаленным органам, включая мозг [94]. Некоторые микробные катаболиты триптофана, такие как триптамин, индол-3-уксусная кислота и 3-индолпропионовая кислота, представляют собой естественные лиганды арилуглеводородного рецептора (AhR) [95] — сенсора средовых и физиологических сигналов и мощного модулятора целостности кишечного барьера, иммунитет и обмена веществ [96, 97]. В образцах фекалий людей с метаболическим синдромом выявляются низкие уровни метаболитов триптофана, и этот фенотип связан со сниженной активностью AhR [95]. Снижение способности микробиоты вырабатывать лиганды AhR приводит к нарушению целостности слизистого барьера, ослаблению секреции GLP1 (рис. 4) и, в конечном итоге, может способствовать развитию метаболического синдрома, СД2, возрастанию ИМТ и кровяного давления [95].
Липополисахариды
В 2007 году в контексте ожирения специфические бактериальные компоненты (такие как липополисахариды [ЛПС]) были определены как циркулирующие воспалительные факторы, производимые кишечной микробиотой. Способность ЛПС вызывать слабовыраженное воспаление и резистентность к инсулину, индуцированные кормлением мышей ДВСЖ [36], привела к концепции метаболической эндотоксемии. Важно отметить, что метаболическая эндотоксемия в настоящее время считается патологическим признаком ряда хронических состояний, включая ожирение, СД2, неалкогольную жировую болезнь печени, хроническую болезнь почек и атеросклероз (рис. 3 и 4). Впоследствии было обнаружено, что ЛПС некоторых бактерий способствуют метаболически благоприятному состоянию эндотоксемии, выступая в роли антагонистов Toll-подобных рецепторов, которые, в свою очередь, могут противодействовать метаболически неблагоприятной эндотоксемии [98]. ЛПС разных видов бактерий могут взаимодействовать, и эти взаимодействия следует учитывать при оценке влияний на метаболизм хозяина.
Модуляция микробиоты для снижения веса
В нынешний рост показателей ожирения, безусловно, внесли основной вклад доступность недорогих, высококалорийных продуктов и снижение физической активности в повседневной жизни. Изменения образа жизни с сочетанием гипоэнергетической диеты и регулярных физических упражнений в настоящее время служат основным подходом к снижению веса и уменьшению метаболического риска (рис. 2). Однако для многих людей с избыточным весом или ожирением соблюдение мер по снижению веса является проблематичным. Успех похудения варьируется от человека к человеку и зависит от сложного взаимодействия между средовыми, генетическими, нервными и эндокринными факторами. Индивидуальная вариабельность реакции на снижение массы тела может частично зависеть от базового состава микробиоты кишечника. Исследования с участием людей показали, что состав микробиоты человека может предсказать, как масса тела будет отвечать на диету [99]. В этом разделе обсуждаются некоторые из подходов к управлению весом, которые используются или рассматриваются в настоящее время, и их связь с микробиотой кишечника (рис. 2). Хотя акцент в этом обзоре делается на контроле и снижении веса, людям с избыточной массой тела или ожирением может быть полезно изменение образа жизни, влияющее на состав микробиоты, устраняющее факторы метаболического риска, улучшающее физические функции и качество жизни независимо от влияния на массу тела.
Диета
Кетогенная диета. Кетогенная диета — это режим питания с низким содержанием углеводов и высоким содержанием жиров. Как правило, такие диеты состоят примерно из 10% углеводов, 70% жиров и 20% белков. Этот баланс достигается путем замены зерновых, фруктов, крахмалистых овощей, бобовых и сладостей безуглеводными продуктами или продуктами с очень низким содержанием углеводов, такими как некрахмалистые овощи, сыр, авокадо, орехи и семена, яйца, мясо, морепродукты и использованием оливкового или кокосового масла для приготовления пищи и заправки готовых продуктов. Эта диета заставляет организм изменить свой обмен веществ, чтобы в качестве основного источника энергии использовать жирные кислоты, а не углеводы, производя в качестве молекулярного побочного продукта кетоновые тела и приводя к состоянию кетоза. Однако на результат будут влиять выбранные типы жира; поэтому не все кетогенные диеты одинаковы.
Кетоновые тела привлекли общественный интерес из-за их предполагаемых полезных эффектов для улучшения метаболизма, содействия снижению веса, уменьшения воспаления и ослабления нервно-психических расстройств, таких как (эпилептическая) судорожная активность и депрессия [100–102]. Хотя за прошедшие годы многие исследования с участием людей продемонстрировали эффективность кетогенной диеты в снижении веса, основные механизмы до сих пор полностью не изучены [103]. Дополнительные исследования на мышах показали, что кетоновые тела напрямую влияют на микробиоту кишечника [104, 105].
В стационарном перекрестном исследовании, опубликованном в 2020 году [105], в течение двух месяцев наблюдали за взрослыми мужчинами с избыточным весом или ожирением (без сахарного диабета) в метаболическом отделении, где контролировали их диету и уровень физической активности. В течение первых четырех недель исследования участникам давали либо стандартную диету, состоящую из 50% углеводов, 15% белков и 35% жиров, либо кетогенную диету, состоящую из 5% углеводов, 15% белков и 80% жиров, приводившую к повышению уровня циркулирующих в плазме крови кетоновых тел. Через четыре недели две группы поменялись диетами. Переход от стандартной к кетогенной диете резко изменил количество бактерий из типов Actinobacteria, Bacteroidetes и Firmicutes, и между группами различалось содержание 19 родов. При кетогенной диете сильнее всего уменьшилось количество Bifidobacteria, в частности — Bifidobacterium adolescentis [105]. Интересно, что эти изменения, вероятно, были вызваны ограничением углеводов, а не высоким потреблением жиров, поскольку они отличались от изменений, наблюдаемых у мышей, получавших диету с высоким содержанием жиров и углеводов, которая, как известно, способствует развитию метаболических заболеваний у этих животных [47, 106, 107].
Последующие диетические эксперименты на мышах показали, что добавки кетоновых тел были достаточными для воспроизведения многих специфических микробных изменений, наблюдаемых при кетогенной диете, даже у мышей, получавших диету, содержащую углеводы и, следовательно, не являющуюся кетогенной. Эти результаты показывают, что диета вызывает изменения в микробиоте, которые влияют на метаболизм хозяина, и что эти изменения оказывают нижележащее обратное влияние на микробиоту [105, 108]. Следует отметить, что как моноколонизация безмикробных мышей B. adolescentis, так и ТФМ человека безмикробным мышам показали, что уменьшение количества Bifidobacterium было связано с ослаблением воспаления, о чем говорит заметное снижение уровня Тh17-клеток — провоспалительного маркера — как в кишечнике, так и в висцеральной жировой ткани [105].
Одним из ограничений кетогенной диеты является отсутствие полезных пищевых волокон и полифенолов, поступающих из фруктов и злаков. Более того, данные, полученные на животных, также указывают на то, что кетогенная диета может быть связана с долгосрочными метаболическими побочными эффектами, такими как непереносимость глюкозы, дислипидемия и признаки стеатоза печени [109]. Кроме того, предполагается, что у людей, которые придерживаются кетогенной диеты, повышается потребность в биотине [110]. Авторы элегантного исследования, выполненного в 2022 году, провели метагеномный анализ более 1500 человек и связали тяжелое ожирение с заметным дефицитом микробов, вырабатывающих биотин и его переносчики. Было обнаружено, что содержание этих микробов и биотина коррелирует с многочисленными метаболическими параметрами хозяина, связанными с массой тела и жировой ткани (такими как ИМТ, масса жировой ткани, обхват талии и количество висцерального жира), а также с обменом глюкозы (глюкозным голоданием, HbA1c, триглицеридами и маркерами резистентности к инсулину) и воспалением. В экспериментах с использованием безмикробных мышей или животных, получавших антибиотики, и мышей, получавших ДВСЖ, отсутствие или истощение кишечной микробиоты изменяло уровень биотина в кровотоке. Потеря веса после бариатрической хирургии была связана с увеличением количества бактерий, производящих биотин и повышением уровня системного биотина хозяина в случае как людей, так и мышей. Наконец, пероральное добавление биотина и пребиотика мышам, получавшим ДВСЖ, улучшает массу тела и метаболизм глюкозы, а также увеличивает микробное разнообразие и потенциал производства биотина бактериями [111].
Средиземноморская диета. Благотворное влияние средиземноморской диеты (MedDiet) было научно описано более 50 лет назад [112]. MedDiet характеризуется небольшим количеством мяса и рафинированных зерновых продуктов, умеренным количеством рыбы и молочных продуктов и большим количеством фруктов, овощей, бобовых, цельного зерна и орехов (рис. 2 и 3) и связана со снижением сердечно-сосудистой заболеваемости и смертности [113]. В настоящее время считается, что MedDiet ассоциирована с более низкой смертностью и меньшим риском ожирения, СД2, слабовыраженного воспаления, рака и многих других заболеваний, чем в общей популяции [114–116].
Взаимодействие между диетой и микробиотой кишечника, а также потенциальное благотворное влияние MedDiet на метаболические нарушения, связанные с ожирением, рассмотрены в обзоре [117]. В одном важном рандомизированном контролируемом исследовании изучались здоровые люди с избыточным весом или ожирением, которые вели малоподвижный образ жизни и обычно потребляли небольшое количество фруктов и овощей. В ходе восьминедельного наблюдения 43 человека были включены в группу MedDiet и получали индивидуальную диету, соответствующую их обычному потреблению энергии, а 39 человек находились на обычной диете [118]. MedDiet привела к удвоению количества потребляемых пищевых волокон, снижению соотношения животного белка и овощей, снижению уровня насыщенных жирных кислот в кровотоке и повышению уровня полиненасыщенных жирных кислот. Метаболический анализ показал изменения в метаболоме фекалий, крови и мочи после соблюдения MedDiet в этой популяции. Помимо этого, состав кишечной микробиоты после MedDiet по сравнению с контрольной группой характеризовался большим количеством Faecalibacterium prausnitzii и Roseburia и меньшим — Ruminococcus gnavus и Ruminococcus torques. Следует отметить, что у лиц, у которых MedDiet способствовала снижению резистентности к инсулину, был повышен базальный уровень Bacteroides uniformis и Bacteroides vulgatus и понижен — Prevotella copri [118]. Поразительно, что все эти эффекты наблюдались независимо от потребления энергии, тем самым сильно подчеркивая важность типа питательных веществ, а не их калорийности. Хотя точные механизмы еще полностью не выяснены, имеющиеся данные указывают на четкую связь между кишечными микробами, их метаболитами и эффективностью MedDiet [119].
Диеты, обогащенные волокнами. Пищевые волокна состоят из группы сложных углеводов, содержащихся в основном в овощах, фруктах и бобовых, которые в изобилии присутствуют в MedDiet, вегетарианской и веганской диетах. Связь между потреблением волокон и здоровьем в настоящее время хорошо известна, и положительное влияние (в основном растворимых) пищевых волокон подтверждают данные, полученные за десятилетия исследований. К ним относятся прямое влияние на функции кишечника и пищеварение, а также косвенное — на контроль уровня глюкозы в крови, сердечно-сосудистые функции, сахарный диабет и ожирение [120]. Несмотря на многочисленные положительные влияния волокон на здоровье, среднее потребление ее населением остается намного ниже рекомендуемого.
Причинно-следственная связь между потреблением волокон, изменениями микробиоты кишечника и регуляцией метаболизма остается неясной из-за разнородности доступных исследований. Эффекты в основном могут быть связаны с увеличением количества продуцентов КЦЖК и специфическими изменениями в микробиоте кишечника [121–124]. Действительно, эффект волокон напрямую зависит от их типа и может быть или не быть напрямую связан с изменениями функций кишечника и пищеварения, такими как прохождение содержимого через кишечник или дефекация, которые ограничивают переваривание других компонентов [125–127].
Интервальное голодание. Интервальное голодание — это общий термин для набирающей популярность диетической стратегии, которая заключается в чередовании установленных периодов голодания (от 12 часов до нескольких дней) и периодами, когда прием пищи разрешен (рис. 3).
Интересные сведения о голодании были получены при изучении мусульман во время священного месяца Рамадан, когда люди постятся от рассвета до заката, в том числе избегая воды. После Рамадана повышался уровень полезных кишечных бактерий, таких как A. muciniphila, F. prausnitzii и Roseburia [128–131]. Голодание увеличило микробное богатство и разнообразие, а также повысило уровень полезной КЦЖК, бутирата. Обзор 27 исследований, проведенных в 2020 году, показал, что интервальное голодание в популяции людей с избыточным весом или ожирением снижает вес на 0,8–13% в течение периода от двух недель до одного года без побочных эффектов [132]. Теме не менее, рандомизированное клиническое исследование, проведенное в том же году, показало, что ограниченное по времени питание не приводит к снижению веса или кардиометаболическим улучшениям [133].
Хотя этот метод является многообещающим для лечения ожирения, до сих пор исследования были небольшими и непродолжительными. Таким образом, чтобы понять устойчивую роль, которую интервальное голодание может играть в потере веса, и опосредуются ли эти эффекты механизмами, зависящими от микробиоты, необходимы более продолжительные исследования.
Индивидуальные диеты. Хотя рекомендации, направленные на предоставление населению стандартного плана правильного питания, имеют свои достоинства, некоторые исследования, такие как крупномасштабное исследование питания PREDICT, показывают, что такой универсальный подход может быть пригоден не для всех. Разные люди, даже однояйцевые близнецы, могут по-разному реагировать на одни и те же продукты. Таким образом, лица, характеризующиеся высоким соотношением Prevotella и Bacteroides (P:B), теряют больше веса на диетах, богатых пищевыми волокнами, чем лица с низким содержанием Prevotella (низкое соотношение P:B) [134]. Разницу в потере веса между группами с высоким и низким соотношением P:B объясняют взаимодействием между фактически потребляемым рационом и эффективностью выработки энергии микробиотой, поскольку в экспериментах микробиота мышей с ожирением была богата генами, кодирующими ферменты, которые расщепляют неперевариваемые иначе полисахариды до КЦЖК. Таким образом, бактерии мышей с ожирением, по-видимому, помогали своему хозяину извлекать дополнительные калории из проглоченной пищи, которые затем можно было использовать в качестве энергии [6]. Следует отметить, что, помимо КЦЖК, микробиотой продуцируются многие другие метаболиты, и они, вероятно, могут подвергаться воздействию микробной активности. Эти метаболиты (например, 3-индолпропионовая кислота или имидазолпропионат) в конечном счете могут быть связаны с различными метаболическими реакциями, наблюдаемыми в исследовании PREDICT, но еще не изученными [135]. Хотя связь между концентрацией КЦЖК в кишечнике и ожирением все еще служит предметом дискуссий [136, 137], этот пример показывает, что у разных людей эффективность разных диет будет неравномерной и что персонализированное питание обещает более эффективные стратегии борьбы с ожирением.
В другом важном исследовании изучалась роль микробиоты в гликемическом ответе (не обязательно связанном с массой тела). В течение недели в когорте примерно из 800 человек, репрезентативной для взрослого западного населения без сахарного диабета (54% с избыточной массой тела и 22% с ожирением), постоянно отслеживался уровень глюкозы в крови [138]. У добровольцев было оценено влияние ~ 47 000 приемов пищи на глюкозный ответ, и результаты были объединены со многими другими параметрами, включая микробиоту кишечника, антропометрические показатели, параметры крови, пищевые привычки и физическую активность. С помощью машинного обучения удалось показать, что микробиота кишечника может точно предсказать персонализированные постпрандиальные гликемические реакции на реальные приемы пищи в когорте, и это было подтверждено в другой независимой когорте из 100 человек. Это исследование также показало, что профиль кишечных микроорганизмов можно использовать для помощи в разработке персонализированных и диетических подходов для изменения уровня постпрандиальной глюкозы и связанных с ним метаболических изменений [138].
Фармакологический подход
Потери веса нелегко достичь, и еще труднее ее поддерживать. Хотя стратегии снижения веса, основанные на изменении образе жизни, включая диету, физические упражнения и изменение поведения, могут изначально быть эффективными, скорость основного обмена постепенно снижается примерно через шесть месяцев в попытке компенсировать потерю энергии. Это снижение сопровождается постепенным набором веса в течение следующих месяцев [139]. Неудивительно, что так много усилий прилагается для поиска фармакологических решений, помогающих достичь адекватного снижения веса и поддерживать его.
Чтобы классифицироваться как лекарство от ожирения, продукт должен привести к средней потере веса не менее 5% у > 35% пациентов после года лечения. К лекарствам против ожирения, одобренным в настоящее время FDA и EMA для длительного применения, относятся орлистат, налтрексон-бупропион пролонгированного действия, лираглутид и семаглутид. Кроме того, FDA также одобрило фентермин-топирамат с контролируемым высвобождением. Интересным новым препаратом, который ожидает одобрения, является тирзепатид — новый двойной глюкозозависимый инсулинотропный пептид и агонист рецептора GLP1 для приема один раз в неделю и первый экспериментальный препарат, обеспечивающий потерю веса в среднем более, чем на 20% в фазе III клинических испытаний. Интересно, что этот препарат действует на одну из ключевых мишеней микробиоты кишечника, то есть на GLP1; это позволяет предположить, что следует также учесть возможность воздействия на эндогенную выработку GLP1 в кишечнике. Обзор механизмов действия, долгосрочной эффективности и безопасности этих современных препаратов против ожирения можно найти по ссылке [140].
Было показано, что некоторые лекарственные препараты, влияющие на массу тела, могут потенциальное воздействовать на микробиоту кишечника. Например, исследования как на мышах, так и с участием людей показали, что прием метформина (противодиабетического препарата, который был связан с потерей веса, но не считается средством для снижения веса как таковым) оказывает прямое влияние на кишечную микробиоту [141, 142]. Кроме того, лечение орлистатом увеличивало содержание таксонов бактерий, которые коррелировали с эндокринным, глюкозным и липидным метаболизмом и путями воспаления как в исследованиях на мышах, так и с участием людей [143–145]. В дополнение можно упомянуть, что лираглутид способствует микробному фенотипу, характерному для худых мышей и людей [146, 147].
Хотя данные ограничены, а причинно-следственные связи еще предстоит изучить, эти исследования показывают, что модуляция кишечной микробиоты является потенциально важным компонентом механизма действия препаратов против ожирения.
Бариатрическая хирургия
Бариатрическая хирургия является наиболее эффективным и длительным доступным вмешательством для достижения существенной и устойчивой потери веса, а также улучшения обмена веществ и общего состояния здоровья. В качестве основных механизмов потери веса обычно выдвигаются механическое ограничение и мальабсорбция калорий; однако были предложены и другие механизмы, такие как повышение уровня в крови гормонов кишечника, участвующих в насыщении, изменение микробиоты кишечника, изменения метаболизма желчных кислот и/или изменения расхода энергии [148, 149] (рис. 3). Кроме того, бариатрическая хирургия вызывает глубокие изменения в составе микробиоты кишечника, которые, как полагают, способствуют снижению веса и улучшению обмена веществ. Исследование, проведенное в 2022 году, в ходе которого мышей колонизировали образцами фекалий пациентов до и после бариатрической операции, показало, что такая подгруппа кишечных микроорганизмов может улучшать толерантность к глюкозе независимо от изменений жировой массы, опосредуя абсорбцию глюкозы в кишечнике [150]. Также было высказано предположение, что предоперационная микробиота кишечника влияет на результаты бариатрической хирургии, что объясняет некоторые различия в реакции у разных людей и предполагает возможность микробиоты выступать в роли предиктора исхода [151, 152]. Интересно отметить, что после бариатрической хирургии наблюдается увеличение общего содержания желчных кислот в сыворотке крови.
На уровне таксонов постоянно наблюдалось увеличение количества Bacteroidetes, Proteobacteria (включая Escherichia coli) и Verrucomicrobia (A. muciniphila) и уменьшение количества представителей типа Firmicutes (включая Lactobacillus, Clostridium, Faecalibacterium и Roseburia) после шунтирования желудочно-кишечного тракта по сравнению с теми же пациентами до операции или пациентами с ожирением, которым не была проведена бариатрическая хирургия [153]. Однако на уровне родов данные гораздо более противоречивы и иногда не связаны с улучшением фенотипа или же влияют на состав микробиоты противоположным образом [154–157].
Трансплантация фекальный микробиоты
Учитывая данные о возможной причинно-следственной связи между кишечной микробиотой и ожирением, ТФМ часто рассматривается как потенциальная будущая терапевтическая стратегия для лечения ожирения и метаболического синдрома (рис. 3). Идея состоит в том, чтобы полностью заменить кишечную микробиоту пациентов с ожирением микробиотой худых и здоровых доноров. Ретроспективный обзор карт пациентов, перенесших ТФМ при лечении рецидивирующей инфекции Clostridium difficile, проведенный в 2016 году, показал, что ИМТ доноров кала существенно не влиял на ИМТ реципиентов [158]. В 2019 году метаанализ трех рандомизированных плацебо-контролируемых исследований, изучающих влияние ТФМ от худых доноров к лицам с ожирением на улучшение метаболических параметров, дал неоднозначные результаты [159]. В то время как в двух исследованиях сообщалось об улучшении периферической чувствительности к инсулину, а в одном исследовании у пациентов с ожирением, получавших донорскую микробиоту, наблюдались более низкие уровни HbA1c по сравнению с пациентами, получавшими плацебо-контроль, не было обнаружено различий в уровне глюкозы в плазме натощак, чувствительности печени к инсулину, ИМТ или уровне холестерина [159]. Метаанализ, проведенный в 2020 году с включением трех дополнительных исследований (всего 154 пациента с ожирением), смог только подтвердить, что через шесть недель после ТФМ уровни HbA1c были значительно снижены. Через 6 и 12 недель после процедуры различий в антропометрических параметрах, характеризующих ожирение, обнаружено не было [160]. В целом, ТФМ от худых доноров к донорам с ожирением значительно увеличила численность таких видов, как Roseburia intestinalis, A. muciniphila и Clostridium spp. [159]. Еженедельное введение ТФМ-капсул в двойном слепом рандомизированном плацебо-контролируемом исследовании у взрослых с ожирением приводило к приживлению кишечной микробиоты у большинства реципиентов в течение как минимум 12 недель [161].
На сегодняшний день четких доказательств клинических преимуществ использования ТФМ у пациентов с ожирением и метаболическим синдромом все еще мало. Тем не менее, проведенное в 2020 году исследование с участием 24 человек с метаболическим синдромом, ранее не получавших лечения, показало, что ТФМ от доноров после шунтирования желудка с анастомозом по Ру увеличивает экспрессию транспортера дофамина (DAT) в мозге, тогда как пероральный прием бутирата снижает связывание DAT. Однако никакого влияния на массу тела и чувствительность к инсулину не наблюдалось. Авторы обнаружили положительную корреляцию между уровнями связывания B. uniformis и DAT, тогда как увеличение количества Prevotella spp. показала обратную связь [162].
Предполагается, что реакция на ТФМ может зависеть от исходного микробного состава реципиентов или доноров и от их диетических привычек после процедуры [163–165]. Например, в двойном слепом рандомизированном исследовании, проведенном в 2021 году с участием пациентов с тяжелым ожирением и метаболическим синдромом, сочетали как ТФМ, так и ежедневные добавки пищевых волокон, чтобы попытаться модулировать кардиометаболический исход. Через шесть недель у пациентов, получавших ежедневно добавки низкоферментируемых волокон (микрокристаллическая целлюлоза), наблюдалось значительное улучшение чувствительности к инсулину, связанное с увеличением бактериального богатства и усилением приживления донорских микробов. Интересно, что у пациентов, получавших пищевые добавки с высокоферментируемыми волокнами (равная смесь растворимой кукурузной клетчатки, резистентного пшеничного крахмала типа 4 и камеди акации), таких улучшений не было [166].
Исследование, проведенное в 2016 году с применением мышиных моделей потери веса и рецидивирующего ожирения, выявило изменения кишечного микробиома после кормления ДВСЖ, которые сохраняются в течение длительных периодов времени и увеличивают скорость восстановления веса после диеты [167]. Эксперименты с ТФМ подтвердили, что фенотип ускоренного набора веса может передаваться безмикробным мышам и что величину набора веса можно предсказать по составу микробиома [167]. У людей, подвергающихся процедурам по снижению веса, аутологичная фекальная микробиота, собранная во время фазы потери веса и введенная в фазе восстановления, может помочь сохранить сниженный вес и гликемический контроль, как показано в рандомизированном контролируемом исследовании, проведенном в 2021 году, включающем 90 участников с абдоминальным ожирением или дислипидемией (исследование DIRECT PLUS) [168].
Остающиеся проблемы и ограничения
Миллионы лет совместной эволюции человека и микробов неизбежно привели к взаимозависимости. Влияние микробиоты на своего хозяина в настоящее время признано критическим фактором как в патогенезе заболеваний, так и в укреплении здоровья. Динамичные и сложные взаимодействия между хозяином и микроорганизмами, а также микроорганизмов между собой очень затрудняют определение того, какие бактерии или комбинации бактерий полезны, а какие — нет. В то время как литература переполнена описаниями связей между микробиотой и здоровьем, исследований, позволяющих перейти от статистических ассоциаций к причинно-следственным связям с болезнями и здоровьем, по-прежнему мало. Кроме того, по-прежнему трудно отличить оппортунистов от настоящих патогенов или полезных бактерий от тех, что никак не влияют на здоровье.
По мнению авторов, эти простые классификации нельзя применять в контексте ожирения. Многочисленные исследования сообщают об изменениях относительной численности бактерий на уровне типов или семейств, но этот подход имеет серьезные ограничения: могут быть затронуты многие роды и виды, и необходимы более глубокие анализы, чтобы лучше отразить реальность метаболической активности микробов. Необходима также более полная характеристика состава микробиоты. Выявление функциональных групп микробов и метаболитов, вероятно, является минимальным требованием для согласующихся результатов исследований и получения (частичных) заключений. Действительно, определение функциональных групп вместо простого использования таксонов, связанных с различными последствиями для здоровья, могло бы помочь объяснить некоторые противоречивые сообщения в текущей литературе и избежать их в будущих анализах. Это достаточно новая тема, и она заслуживает дальнейшего специального обсуждения. Учитывая сложность этой области исследований, невозможно ограничить участие одного типа микроорганизмов ролью «друга» или «врага». Всегда следует учитывать другие основные искажающие факторы и взаимодействия между микробами или микробными сообществами, которые влияют на то, почему некоторые люди лучше реагируют (или не реагируют) на процедуры по снижению веса. Многие исследования сходятся в том, какие бактерии или типы связаны с ожирением; тем не менее, количество (учтенных и неучтенных) искажающих факторов, описанных ранее, требует определенной осторожности, когда дело доходит до заявлений о причинно-следственных связях.
Хотя этой области, несомненно, посвящено многих полезных исследований и подходов, в том числе описанных в этом обзоре, также можно утверждать, что в литературе существует столько же подходов и процедур, сколько существует конкретных реакций микробиоты кишечника. Действительно, тройная классификация микробов как патогенных, комменсальных или полезных в данном контексте неприменима. Более того, патогенность данного микроорганизма сильно зависит от множества переменных, связанных не только с самими бактериями, но и с хозяином. Это замечание не ограничивается контекстом ожирения, поскольку экологические принципы микробиоты применимы и к другим неинфекционным заболеваниям. При этом были выявлены специфические кишечные микробы, для которых достаточно часто демонстрировались причинно-следственные связи и следствия, так что теперь их можно считать полезными для здоровья хозяина. Одним из наиболее ярких примеров является A. muciniphila [48], но F. prausnitzii также все чаще рассматривается как потенциально полезный для здоровья вид бактерий. У некоторых бактерий, таких как A. muciniphila, благоприятные эффекты обнаруживаются при различных патологиях. Напротив, другие считаются потенциально полезными перспективными бактериями только в определенных условиях. Среди них — Eubacterium hallii (переименованная в Anaerobutyricum soehngenii), которая связана с улучшением здоровья только у мышей с ожирением и СД2 или у людей с метаболическим синдромом по сравнению с с плацебо [169, 170]. Эта бактерия в большем количестве присутствовала у лиц, отвечающих на ТФМ ослаблением инсулинорезистентности [171]. Кроме этих нескольких примеров, были предложены многие другие кандидаты в потенциально полезные бактерии, такие как Odoribacter laneus [172], Holdemanella biformis [173, 174] и B. uniformis [176] которые, безусловно, заслуживают места в более специализированном обзоре.
Один из основных вопросов, касающихся будущего применения полезных бактерий, заключается в том, следует ли предлагать направленный подход с использованием одной бактерии или коктейля. Хотя может показаться, что больше бактерий лучше, чем меньше, комбинация бактерий (то есть коктейль) потенциально может иметь антагонистический эффект in vivo и влиять на активность отдельных типов или ставить под угрозу их потенциальные эффекты. Здесь, опять же, не следует упускать из виду более широкую картину и не стоит рассматривать потерю веса как единственную конечную цель. Управление весом должно быть частью более крупного общего интегративного плана, направленного на понимание и лечение сложного кластера потенциальных изменений или метаболических нарушений, которые могут возникнуть при ожирении. Такой подход должен учитывать индивидуальные обстоятельства, историю лечения и, возможно, состав и активность микробиоты кишечника. В завершение настоящего обзора авторы не могут не упомянуть важность других микроорганизмов, которые также нужно изучить на предмет их потенциальной роли в ожирении, метаболическом здоровье и здоровье в целом. Понятие микробиоты кишечника, хоть и используется чаще всего как синоним «кишечных бактерий», гораздо более разнообразно и включает археи, грибы, вирусы и протистов, которые играют важную роль наряду с бактериями [177–180].
Заключение
До сих пор нет доказательств того, что определенный микроорганизм является виновником возникновения ожирения и неспособности справиться с избыточным весом. Однако, не умаляя роли наследственности и факторов окружающей среды, можно утверждать, что микробиота кишечника явно вносит важный вклад в развитие метаболических нарушений и ожирения. Поддержание гомеостаза и нормального обмена веществ невозможно без восстановления разнообразия и нормальных функций микробиоты кишечника. Достижению этой цели могут способствовать диеты, пребиотики, пробиотики и лекарственные препараты. Тем не менее, для разработки полезных рекомендаций о том, как эффективно модулировать микробиоту кишечника на индивидуальной основе, необходимы дальнейшие исследования.
