Клеточное восстановление после длительной теплой ишемии всего организма

После остановки кровотока или сходных ишемических воздействий в клетках млекопитающих начинаются разрушительные молекулярные каскады, которые в конечном итоге ведут к их гибели [1 ,2]. Однако с помощью направленных вмешательств эти процессы можно ослабить или остановить даже спустя минуты или часы после смерти, что, как сообщается, удалось показать на изолированном мозге свиньи с применением технологии BrainEx [3]. На сегодняшний день переход от работы с отдельными органами к целому интактному организму затруднен из-за сложностей с кровообращением и мультисистемных физико-математических проблем. В настоящей статье авторы описывают OrganEx — адаптацию BrainEx, представляющую собой экстракорпоральную систему импульсной перфузии и цитопротекторного перфузата для работы с целым телом свиньи. После одного часа теплой ишемии применение OrganEx сохранило целостность тканей, уменьшило клеточную гибель и восстановило отдельные молекулярные и клеточные процессы во многих жизненно важных органах. В соответствии с этим транскриптомный анализ отдельных ядер выявил специфичные для органов или определенных типов клеток паттерны генной экспрессии, которые отражают специфические молекулярные и клеточные восстановительные процессы. Проведенный авторами анализ включает в себя описание специфических для разных типов клеток изменений в течение определенных периодов ишемии и перфузионных воздействий, охватывающих множество органов; он демонстрирует неоценимый потенциал для клеточного восстановления после длительной теплой ишемии всего тела крупного млекопитающего.
Для поддержания жизнеспособности клеток и тканей млекопитающих необходим кислород [4]. Уже спустя минуты после ишемии развивается внутриклеточный ацидоз, клетки набухают, и запускается вторичное повреждение мембран и органелл, часто приводящее к клеточной гибели [1]. На уровне всего организма происходит системное выделение гормонов и цитокинов, за которым следует активация автономной нервной, иммунной системы и системы свертывания крови, что ведет к циркуляторно-ишемическому поражению органов, завершающемуся системным метаболическим ацидозом и гиперкалиемией [2, 5, 6].
Однако недавние исследования ставят под вопрос неизбежность гибели клеток даже спустя часы после нарушения кровообращения. После длительной ишемии из многих органов можно выделить жизнеспособные клетки и поддерживать в культуре in vitro [7]. Сходным образом, клеточному восстановлению можно способствовать путем перфузии изолированных целых органов ex vivo, включая сердце, печень, почки и легкие [8–11]. Основанная на перфузии технология BrainEx, созданная авторами статьи, также продемонстрировала восстановление кровообращения и клеточной активности в изолированном мозге свиньи — органе, который наиболее наиболее уязвим для ишемии [2, 6].
Тем не менее, перенос решений, касающихся молекулярного и клеточного восстановления, от моделей изолированных органов к целому организму после продолжительной ишемии до сих пор сталкивается с существенными проблемами. Реперфузия всего организма аутологичной кровью затрудняется рядом препятствий, в том числе коагуляцией, нарушением функции сосудов микроциркуляторного русла, воспалением и дисфункцией форменных элементов крови [2, 5]. У крупных млекопитающих это ограничивает реперфузию всего тела и время восстановления до 20 минут [12], хотя у человека катастрофические/летальные последствия широко распространяются уже через несколько минут [13]. Новый подход может восстановить системное кровообращение, в то же время реализуя направленные стратегии молекулярного и клеточного восстановления для определенных органов в системе целостного организма. Таким образом, достижение восстановления после одного часа теплой ишемии может способствовать расширению возможностей в разнообразных клинических дисциплинах.
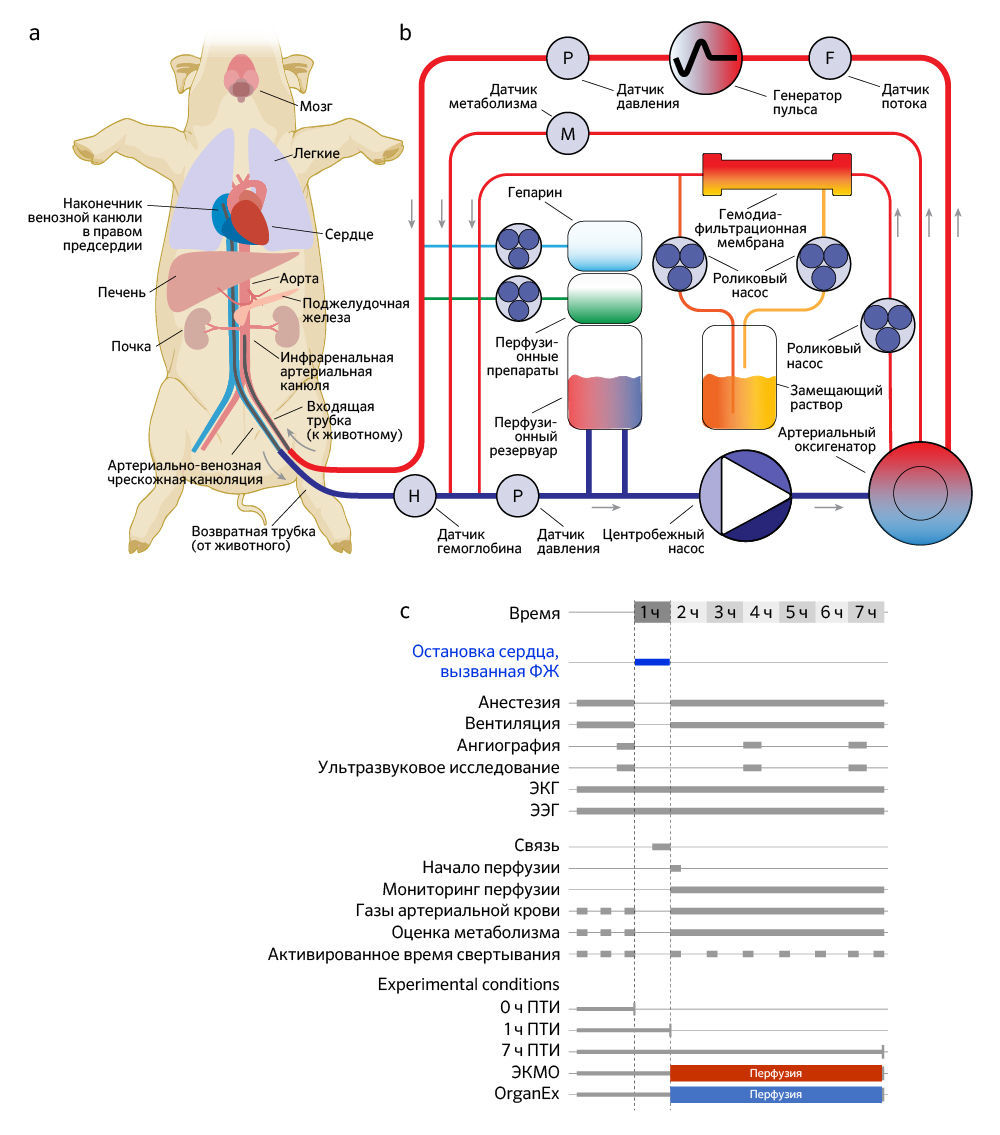
б. Упрощенная схема перфузионного устройства OrganEx. Система оснащена центробежным насосом, генератором пульса, гемодиафильтрацией, газовой инфузией, системами доставки лекарств и датчиками для измерения метаболических параметров и параметров кровообращения.
c. Схема экспериментального рабочего процесса и условий. ФЖ — фибрилляция желудочков.
На пути к этим целям авторы использовали принципы технологии BrainEx [3] для создания OrganEx — системы перфузии и синтетической бесклеточной цитопротекторной перфузионной жидкости, чтобы применять ее для работы с целым организмом крупного млекопитающего. Авторы оценивали OrganEx посредством проведения перфузии тела самки свиньи (Sus scrofa domesticus, 30–35 кг) в течение 6 ч после 1 ч теплой ишемии, вызванной остановкой кровообращения вследствие фибрилляции желудочков сердца. Протокол перфузии без выживания был реализован по согласованию с Институционным комитетом Йельского университета по уходу и использованию животных и внешними консультативными и этическими комитетами и содержал в своей основе предопределенные базовые принципы обеспечения гуманного обращения (см. «Методы»).
Настоящее исследование демонстрирует, что направленные вмешательства могут выявить неожиданные возможности молекулярного и клеточного восстановления в жизненно важных органах тела крупного млекопитающего после длительной теплой ишемии. Полученные результаты проливают новый свет на специфические для разных типов клеток и тканей реакции на периоды теплой ишемии и перфузионных процедур в масштабе целого организма.
Обзор технологии OrganEx
Технология OrganEx включает в себя перфузионную систему и синтетический перфузат (рис. 1b и «Meтоды»). В схеме перфузионной системы имеется изготовленный по индивидуальному проекту генератор пульса, который присоединен к центробежному насосу и воспроизводит физиологические колебания давления. Контур заполняется раствором, специально разработанным для противодействия нарушениям электролитного и метаболического баланса после длительной ишемии, в то время как автоматические системы гемодиафильтрации и доставки препаратов подают перфузионную жидкость (см. дополнительные таблицы 1–3). Она представляет собой модификацию созданного авторами бесклеточного несвертываемого цитопротекторного перфузата BrainEx на основе гемоглобина [3], который оптимизирован так, чтобы он был совместим с целым организмом. Наконец, сенсоры, работающие в реальном времени, позволяют отслеживать важные показатели кровообращения и метаболиты.
Чтобы протестировать технологию OrganEx на крупных млекопитающих, авторы исследования использовали модель общей теплой ишемии у свиней, вызванной остановкой сердца вследствие фибрилляции желудочков у анестезированных и гепаринизированных животных. После остановки сердца и прекращения системного кровообращения теплое ишемическое состояние сохраняли в течение 1 ч, поддерживая температуру тела на уровне 36–37 °C. Затем для восстановления системного кровообращения животных подключали к одной или двум перфузионным системам (см. ниже) через бедренную артерию/вену; при этом ток жидкости через камеры сердца и альвеолы легких не требовался (рис. 1а). Исследование включало пять групп: три неперфузируемые контрольные группы, соответствующие различным экспериментальным временным точкам и периодам теплой ишемии (ПТИ): (1) контрольная группа с минимальным/0 ч ПТИ; (2) 1 ч ПТИ для изучения накапливающиеся молекулярных/клеточных повреждений до перфузионного вмешательства; (3) 7 ч ПТИ для анализа повреждений в полной степени без какого-либо вмешательства. Кроме того, в двух группах перфузионного вмешательства после 1 ч теплой ишемии авторы проводили перфузию в течение 6 ч в условиях гипотермии (28 °C) как (4) со стандартным клиническим аппаратом для заместительной перфузии сердца и легких — экстракорпоральной системой мембранной оксигенации (ЭКMO) [14]; так (5) и с применением собственной перфузионной технологии (OrganEx) (рис. 1c). Группу ЭКМО перфузировали аутологичной кровью. В группе OrganEx перед началом протокола перфузии аутологичную кровь вводили в систему OrganEx и смешивали с перфузатом в эффективном соотношении 1:1, после чего применяли для перфузии.
Параметры системного кровообращения
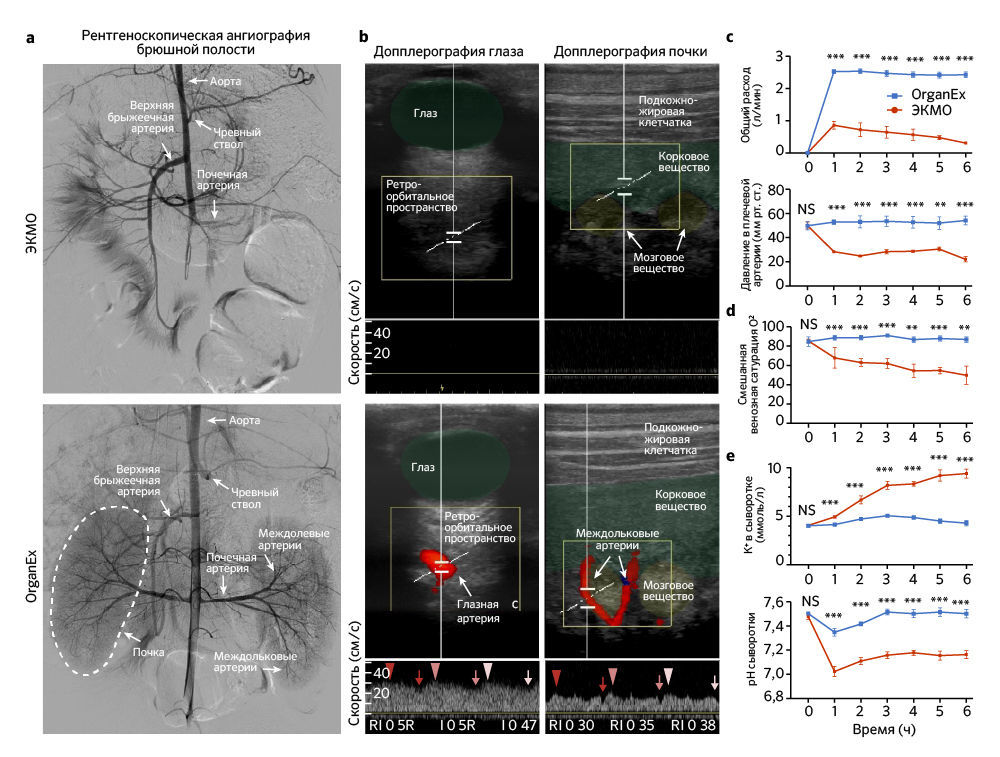
Первым делом авторы проверили, может ли кровообращение в целом организме быть восстановлено с помощью внешней перфузии спустя 1 ч теплой ишемии. Результатом перфузии системой ЭКМО неизменно были состояния со слабым током жидкости или его отсутствием. С помощью флюороскопичной ангиографии было показано, что при перфузии ЭКМО заполнение основных артерий и органов, таких как почки, печень и головной мозг, ограничено (рис. 2a и «Расширенные данные», рис. 1а). Применение ЭКМО также приводило к неадекватной перфузии органов, на что указывают данные цветной ультразвуковой допплерографии (рис. 2b). Кроме того, параметры системной перфузии выявили коллапс кровообращения, о чем свидетельствует отрицательное венозное перфузионное давление и низкое артериальное давление (рис. 2с и «Расширенные данные», рис. 1с).
B группе OrganEx, напротив, авторы исследования наблюдали устойчивую перфузию всего тела, на которую указывает контрастное усиление основных артерий и органов, а цветная допплерография демонстрирует пульсирующий ток жидкости по всему организму (рис. 2a, b и «Расширенные данные», рис. 1а). В частности, при анализе, проведенном на третьем часу протоколов перфузии, в группе присутствовал кровоток в глазной артерии — косвенный показатель перфузии головного мозга; в группе ЭКМО он не наблюдался (рис. 2b). Сходные паттерны обнаруживались во внутридольковых артериях почки (рис. 2b); при этом в сонных артериях животных из группы ЭКМО кровоток присутствовал, но был снижен по сравнению с таковым в группе OrganEx («Расширенные данные», рис. 1b). Эти результаты затем были дополнительно подтверждены датчиками системы, которые показали восстановление физиологических скоростей кровотока и артериального давления (рис. 2c).
После успешного восстановления кровообращения авторы оценили способность OrganEx нормализовать связанные с ним метаболические параметры. Измеряя кислородную ситуацию венозной крови, они подтвердили, что технология OrganEx способна в ходе перфузии обеспечивать достаточный уровень кислорода во всем теле (рис. 2d). Это оказалось сопряжено со стабилизацией тканевых метаболических расходов («Расширенные данные», рис. 1d) и коррекцией физиологического дисбаланса, который возникает в ходе длительной ишемии гиперкалиемии и метаболического ацидоза (рис.2e). Более того, посмертное окоченение и трупные пятна, которые наблюдались в группе ЭКМО, отсутствовали после перфузии OrganEx («Расширенные данные», рис. 1e). В совокупности эти наблюдения указывают, что спустя 1 ч теплой ишемии OrganEx может восстановить кровообращение и нормализовать наблюдаемые физиологические и метаболические параметры в масштабах всего организма.
Гистологический анализ
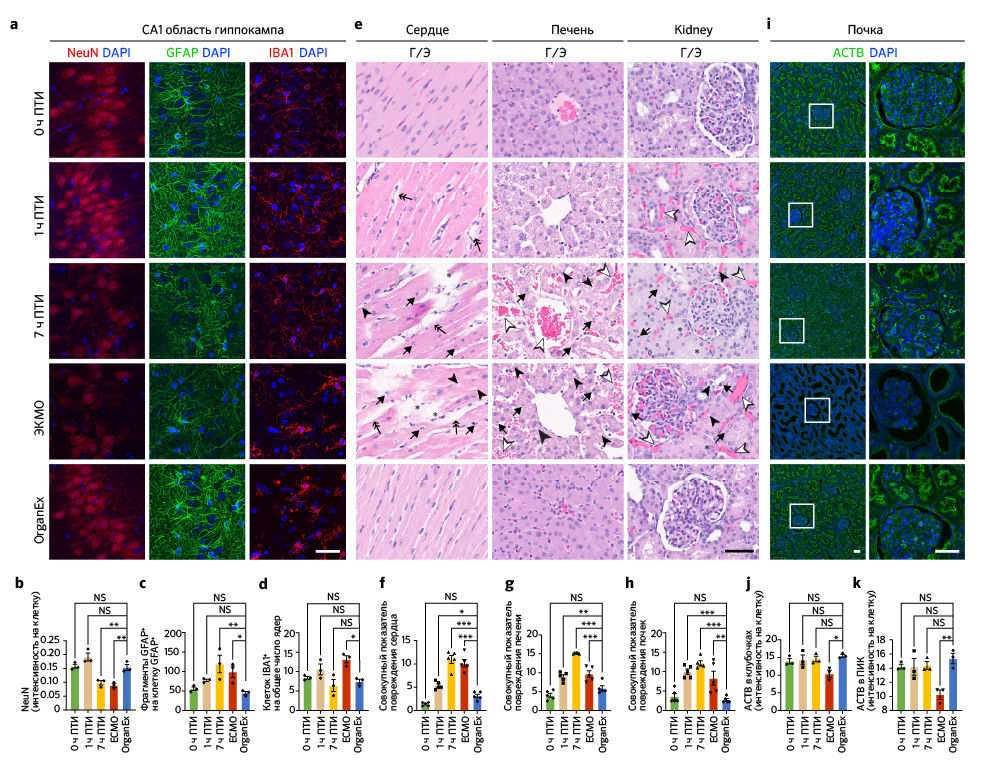
После восстановления системного кровообращения и определенных ключевых метаболических параметров при использовании перфузии OrganEx авторы исследовали изменения цитоархитектоники ряда органов с помощью несмещенной выборки и гистологического анализа. Цитоархитектонику головного мозга изучали методом окрашивания по Нисслю участка CA1 гиппокампа и префронтальной коры (ПФК) — тех областей мозга, которые особенно чувствительны к ишемии [15, 16]. Число клеток как в CA1, так и в ПФК снижалось при увеличении продолжительности периода ишемии; уровень опустошения был сравним в группах 7 ч и ЭКМО. Однако после применения OrganEx число клеток восстанавливалось приблизительно до величины, соответствующей 0 ч в группе ПТИ («Расширенные данные», рис. 2a, b, d). В качестве индикатора раннего цитотоксического набухания клеток при ишемическом стрессе рассматривали их эллипсоидную морфологию; количество клеток с такой морфологией возрастало в ПФК с увеличением ПТИ, но достигало эффекта насыщения в CA1 во всех временных точках. Морфологические проявления более глубокого повреждения, с меньшим числом эллипсоидных клеток, преобладали в группе ЭКМО, но в группе OrganEx в обеих областях количество клеток приближалось к таковому для 0 ч ПТИ («Расширенные данные», рис. 2а, с, е).
Далее авторы исследования изучили три основных типа клеток мозга: нейроны, астроциты и микроглию. В обоих областях мозга интенсивность иммуномечения паннейрального маркера NeuN (также известного как RBFOX3), для которого ранее было показано снижение при гипоксии [17], была ниже в группах ЭКМО и 7 ч ПТИ по сравнению с группой OrganEx (рис. 3a, b и «Расширенные данные», рис.2h, i). Хотя в СА1 иммуномечение NeuN в группах OrganEx, 0 ч и 1ч ПТИ не различалось, в ПФК его уровни были снижены в группах 1 ч ПТИ и OrganEx по сравнению с контролем 0 ч ПТИ («Расширенные данные», рис. 2h, i). Сходным образом, количество астроцитов с иммуномечением GFAP (ГФКБ) было сравнимо между группами OrganEx и 0 ч ПТИ, но в других группах оказалось снижено как в ПФК, так и в CA1 («Расширенные данные», рис .2f, g, h, k). Внутри области CA1 в группах 7 ч ПТИ и ЭКМО анализ иммуномечения GFAP выявил усиление его фрагментации, что дает основания предполагать нарушение целостности астроцитов, при этом в группах OrganEx, 1 ч и 0 ч ПТИ уровень фрагментации GFAP был низким и примерно одинаковым (рис. 3a, c). В ПФК уровень фрагментации GFAP также повышался в группах 7 ч ПТИ и ЭКМО, но более высокая дисперсия означала, что некоторые различия не были значительными («Расширенные данные», рис. 2h, j). Сходным образом, популяции микроглиальных клеток с иммуномечением IBA1 давали похожую картину в CA1 и ПФК в группах OrganEx, 1 ч и 0 ч ПТИ, в то время как в группе ЭКМО обнаруживалось значительное увеличение в CA1 (рис. 3a, d) и снижение в ПФК («Расширенные данные», рис. 2h, l). В совокупности эти результаты указывают на то, что в исследованных областях головного мозга и проанализированных типах клеток сохранялась клеточная и тканевая целостность при оценке сразу после перфузии OrganEx, что согласуется с предыдущим исследованием авторов на изолированном мозге свиньи [3].
После исследования выбранных областей мозга, восприимчивых к гипоксии, авторы проанализировали влияние OrganEx на тканевую и клеточную целостность в основных периферических органах, включая сердце, легкие, печень, почки и поджелудочную железу. Они оценили характер кровоизлияния, отека тканей, пикноза ядер, вакуолизации клеток, а также клеточной морфологии с помощью окрашивания гематоксилином и эозином (Г/Э) и объединили эти данные в суммарную оценку повреждений в соответствии со стандартными патологическими критериями [18]. Примечательно, что группа OrganEx показала снижение величины повреждения в соответствии с оценкой Г/Э по сравнению с группами 7 ч ПТИ и ЭКМО (рис. 3e–h и «Расширенные данные», рис. 3a–c). Более того, органы после перфузии OrganEx демонстрировали меньше признаков кровоизлияния и отека тканей по сравнению с группой 1 ч ПТИ. Эти результаты указывают на отсутствие усиления повреждений и нарушения цитоархитектоники по сравнению с ЭКМО и, что не менее важно, снижения показателей повреждений на основе окрашивания Г/Э, что приближается к состоянию 0 ч ПТИ после перфузии OrganEx.
Чтобы исследовать признаки восстановления цитоархитектоники в группе OrganEx и очевидную прогрессию повреждений в группе ЭКМО, авторы проанализировали критерии, относящиеся к клеткам почек. Эти критерии хорошо определены для выделения уровней повреждения; среди них — окрашивание Шиффом / перйодной кислотой (ШИК-реакция), иммуногистохимическое выявление β-aктина цитоскелета (ACTB), белка KIM-1 (kidney injury molecule-1, также известного как HAVCR1) [19] и маркера пролиферации Ki-67 (MKI67) [20]. Комбинированная оценка повреждения с помощью ШИК-реакции, оценки расширения почечных канальцев и пространства Боуменовой капсулы, мочевых цилиндров и нарушений щеточной каемки, указывает на более сильное повреждение в группе ЭКМО по сравнению с группой OrganEx («Расширенные данные», рис. 3d, e). Эти результаты подтверждаются снижением иммуномечения ACTB в группе ЭКМО по сравнению с таковым в группе OrganEx (рис. 3i–k). Сходным образом, процент почечных канальцев, окрашивающихся антителами к HAVCR1, был сравним в группах 0 ч ПТИ, 1 ч ПТИ и OrganEx. Напротив, в группах 7 ч ПТИ и ЭКМО иммуномечение HAVCR1 было снижено по сравнению с группой OrganEx; это согласуется с характером окрашивания других органов, что, возможно, указывает на деградацию белков («Расширенные данные», рис. 3f, g). Сходным образом, число ядер, окрашивающихся антителами к Ki-67, было сравнимо между группами 0 ч ПТИ, 1 ч ПТИ и OrganEx, но значительно снижено в группах 7 ч ПТИ и ЭКМО. Это указывает на сохранение пролиферативного ответа в клетках эпителия почечных канальцев в группе OrganEx («Расширенные данные», рис. 3h–j).
Анализ процессов клеточной гибели
Поскольку перфузат OrganEx содержит фармакологические ингибиторы клеточной гибели, и авторы наблюдали ее снижение по данным гистопатологического анализа в группе OrganEx (рис. 3e–h и «Расширенные данные», рис. 3), далее они с помощью иммуногистохимического анализа исследовали ключевые пути гибели клеток [18]. Для оценки апоптоза авторы измеряли интенсивность иммуномечения активной каспазы 3 (aктCASP3) и проводили окрашивание методом TUNEL. В группе ЭКМО они обнаружили усиление окрашивания в периферических органах, таких как сердце, печень, почки и поджелудочная железа, по сравнению с группой OrganEx. Кроме того, относительная интенсивность aктCASP3 и TUNEL в группе OrganEx была сравнима с таковой в группе 0 ч ПТИ, у которой не было ишемического повреждения, что указывает на то, что перфузия OrganEx уменьшает активацию каспазы 3 и снижает уровень апоптоза («Расширенные данные», 4a–j).
Анализ CA1 и ПФК показал, что интенсивность иммуномечения aктCASP3 в группе OrganEx была ниже, чем в группах 0 ч и 1 ч ПТИ («Расширенные данные», рис. 4k–m). Но в то же время, интенсивность окрашивания методом TUNEL имела более низкую тенденцию в группе OrganEx по сравнению с группами 7 ч ПТИ и ЭКМО («Расширенные данные», рис. 4n–p). Таким образом, можно предположить, что слабое иммунное окрашивание актCASP3 в мозге свиней из группы OrganEx связано в большей степени с активным ингибированием aктCAPS3 фармакологическими компонентами перфузионной жидкости, как сообщалось ранее [3], чем с разрушением клеток или белков, что также подтверждают другие исследования авторов статьи (рис. 3a–d и 5a and и «Расширенные данные», рис. 2, 6h–k и 9f, g).
Затем, чтобы исследовать пироплазмоз — способ клеточной гибели, запускаемый провоспалительными сигналами, — авторы провели иммуногистохимический анализ интерлейкина-1β (IL-1B). Во всех изученных периферических органах, таких как сердце, печень и почки, интенсивность иммунного окрашивания IL-1B была сходной в группе 0 ч ПТИ и увеличена в группе ЭКМО по сравнению с таковой в группе OrganEx. В мозге интенсивность иммуномечения была снижена в группе ЭКМО по сравнению с группой OrganEx («Расширенные данные», рис. 5a–e). Тенденции в обоих периферических органах и мозге были сходны с наблюдаемыми результатами окрашивания aктCASP3 («Расширенные данные», рис. 4).
Наконец, авторы исследовали некроптоз и ферроптоз — два различных пути клеточной гибели — с помощью иммуногистохимического анализа ключевых белков этих путей: взаимодействующей с рецептором серин/треониновой киназы 3 (RIPK3) и глутатионпероксидазы 4 (GPX4), соответственно. Результаты оказались сопоставимыми между двумя типами клеточной гибели и всеми исследованными органами — мозгом, сердцем, печенью и почками. По сравнению с группой OrganEx интенсивность иммуномечения была сходной в группе 0 ч ПТИ и существенно снижена в группах 7 ч ПТИ и ЭКМО («Расширенные данные», рис. 5f–o).
Метаболический и функциональный анализ органов
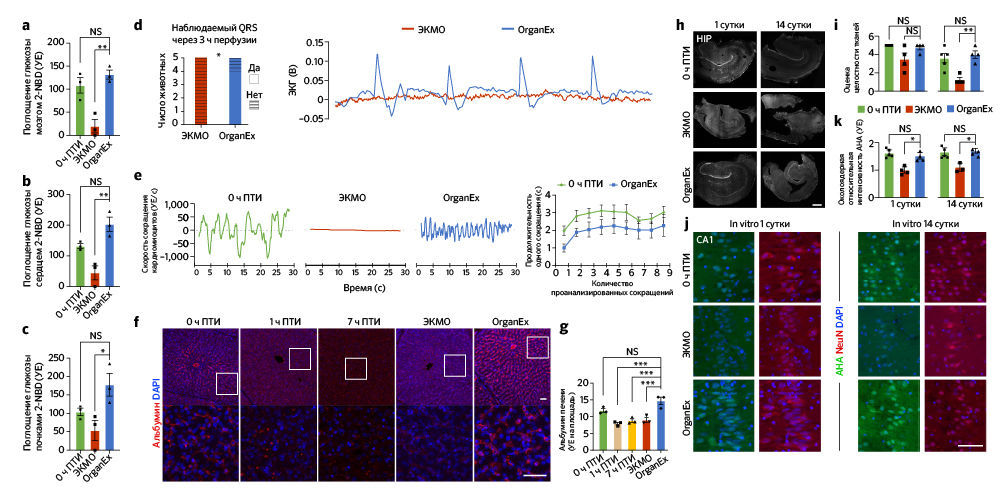
После наблюдения улучшения метаболических функций, цитоархитектоники и снижения клеточной гибели при применении OrganEx авторы детально исследовали энергетический баланс клеток. Они измерили потребление глюкозы в органах с высоким уровнем обмена веществ (головной мозг, сердце, почки) с помощью флуоресцентного аналога глюкозы 2-NBDG21. Во всех изученных органах были показаны сходные уровни потребления глюкозы в группах OrganEx и 0 ч ПТИ; в группе ЭКМО захват глюкозы клетками был снижен, что может указывать на нарушение утилизации глюкозы или ее утечку из клетки (рис. 4а–c). Такие результаты подразумевают, что восстановление клеточного метаболизма может быть взаимосвязано с восстановлением системных метаболических параметров (рис. 2d, e и «Расширенные данные», рис. 1d).
Авторы далее продолжили изучать индикаторы восстановления на клеточном и тканевом уровнях в соответствующих органах. Исследование сердца методом электрокардиографии показало спонтанное возобновление комплексов QRS во время перфузии OrganEx, что указывает на деполяризацию желудочков (рис. 4d). При этом в группе ЭКМО появления QRS не было. Чтобы провести дальнейшую оценку активности желудочков, авторы исследовали сократимость кардиомиоцитов с помощью светлопольной микроскопии срезов ткани левого желудочка, полученных в конечной точке эксперимента. Они наблюдали сокращения в образцах OrganEx и 0 ч ПТИ и полное его отсутствие в группе ЭКМО (рис. 4e). Наконец, авторы статьи исследовали биомаркеры кардиомиоцитов, иммуномечение которых снижается при ишемии [22]. Иммуногистохимическое окрашивание левого желудочка на биомаркеры тропонина I выявило снижение иммуномечения при длительной ишемии, причем интенсивность окрашивания в группе ЭКМО была значительно ниже по сравнению с таковой в группе OrganEx («Расширенные данные», рис. 6l, m).
Восстановление клеток печени оценивали с помощью иммуногистохимического выявления альбумина и фактора V, которые представляют собой неструктурные синтезируемые в печени белки в высокой концентрации и с коротким временем полужизни, соответственно. По сравнению с группой OrganEx интенсивность окрашивания была близкой в группе 0 ч ПТИ и значительно снижена в группах 7 ч ПТИ и ЭКМО (рис. 4f, g и «Расширенные данные», рис. 6n, o).
О почках: несмотря на то, что многие характеристики клеток сходным образом сохранялись в группах 0 ч ПТИ и OrganEx — включая целостность тканей (рис. 3h и «Расширенные данные», рис. 3d, e), уровень клеточной гибели («Расширенные данные», рис. 4 и 5), молекулярные и пролиферативные реакции на повреждение («Расширенные данные», рис. 3f–j) и индикаторы клеточного метаболизма (рис. 4c), основной функциональный показатель почки — диурез — был минимальным. Тем не менее, известно, что гипертермическая перфузия замедляет функцию почек у пациентов со здоровыми органами [23, 24], а контуры экстракорпоральной перфузии могут нарушать действие эндокринных, гуморальных и нервных факторов, которые регулируют почечную фильтрацию даже в условиях адекватной перфузии почек и здоровых клеток [25]. Более длительное время восстановления также может потребоваться в силу того, что за восстановлением после шока часто следует сниженный диурез.
Затем авторы провели непрерывный электроэнцефалографический (ЭЭГ) анализ головного мозга в группах OrganEx и ЭКMO, и никаких признаков глобальной сетевой активности обнаружено не было («Расширенные данные, рис. 6a–e). Они предполагают, что в группе OrganEx это может быть связано с неадекватным восстановлением мозга в целом, потребностью в более длительном времени восстановления, присутствием антагонистов нейронной активности в перфузионной жидкости, анестезией, эффектами гипотермической перфузии [3, 23] или любой комбинацией этих факторов. Интересно, что при введении контраста в каротидную артерию для рентгеноскопии сосудов головного мозга животные, получавшие перфузию OrganEx, демонстрировали сложные, нецеленаправленные, нестереотипные движения головы, шеи и туловища в результате скоординированных действий агонистов/антагонистов в нескольких суставах и мышечных единицах. Этого не наблюдалось при визуализации живых животных под седацией или животных, подключенных к ЭКМО («Расширенные данные», рис. 6f). Рисунки ЭЭГ при этих движениях не поддаются интерпретации вследствие вызванных движениями артефактов, но они были плоскими сразу перед движениями и после них («Расширенные данные», рис. 6g). Трудно определить, были ли эти движения вызваны преимущественным прерыванием церебрального нисходящего торможения двигательных паттернов или положительным действием на субкортикальном уровне, уровне спинного мозга, периферических нервов или нейромоторных единиц. Тем не менее, способность тел свиней выполнять такие движения говорит о сохранении эфферентной моторной функции по крайней мере на уровне шейного отдела спинного мозга или его корешков.
Затем авторы постарались изучить долгосрочное действие перфузии OrganEx на жизнеспособность клеток. Однако, в силу нормативных ограничений и невозможности продлить протокол перфузии за пределы 6 ч, исследователи использовали органотипические культуры срезов гиппокампа головного мозга (BSC) для мониторинга характеристик тканей, которые ранее подвергались различным перфузионным процедурам. BSC были приготовлены в начале экспериментов (0 ч ПТИ), по окончании перфузии ЭКМО и OrganEx и из соответствующих контролей 7 ч ПТИ; культуру вели в течение 14 дней, оценивая целостность тканей и синтез белка с помощью методики Click-iT [27]. На BSC из группы 7 ч ПТИ такие измерения провести не удалось из-за глубокой степени деградации тканей. На основе визуального осмотра и окрашивания DAPI авторы заключили, что BSC из группы ЭКМО были менее стойкими по сравнению с образцами из группы OrganEx, и большинство из них распались к 14-му дню (рис. 4h, i). Целостность тканей BSC сохранялась до 14-го дня как в группе OrganEx, так и в группе 0 ч ПТИ, несмотря на одно дополнительное ишемическое воздействие (одно — в ходе 1 ч теплой ишемии и одно — при выделении мозга, 5–10). Сходным образом, синтез белка был сравним до 14-го дня в группах OrganEx и 0 ч ПТИ и снижен в группе ЭКМО в различных регионах гиппокампа (рис. 4j, k и «Расширенные данные», рис. 6h–k).
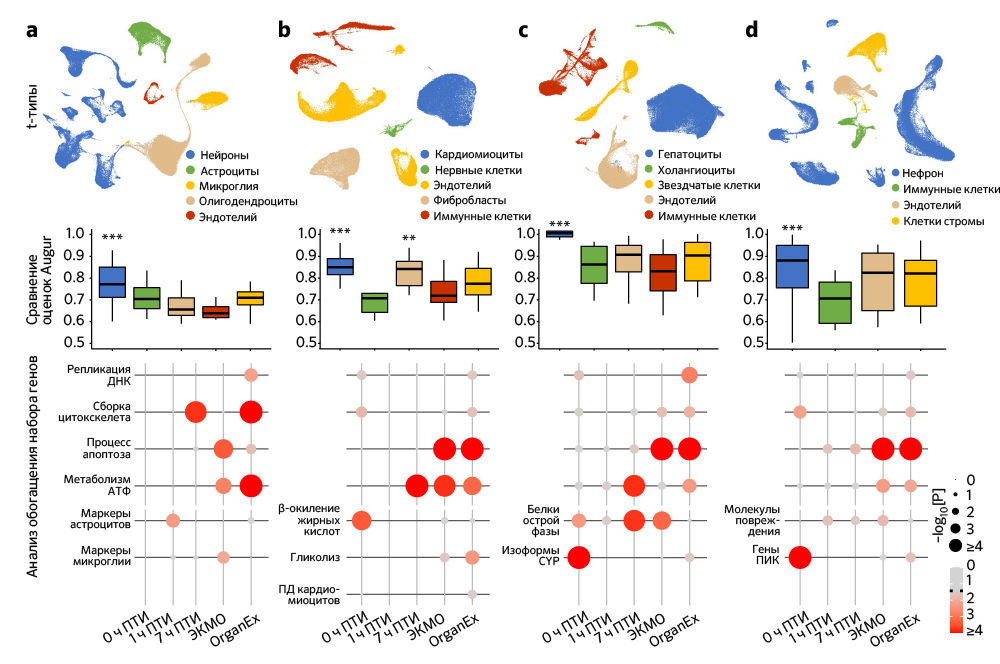
Специфичные для клеток изменения транскриптома
Чтобы исследовать транскриптомные реакции на различные ишемические воздействия и эффекты OrganEx, авторы провели секвенирование РНК единичных ядер (snRNA-seq; «Meтоды»). Обработка данных snRNA-seq показала наличие крупных транскриптомных клеточных типов (t-типов), которые сопоставимы с общедоступными наборами данных по единичным клеткам мыши и человека («Расширенные данные», рис. 7). Однако авторы также обнаружили выраженные транскриптомные различия между одними и теми же t-типами во всех экспериментальных группах («Расширенные данные», рис. 9–12c). Этот масштабный клеточный таксономический ресурс расширяет данные предыдущих исследований [28–33] и позволяет систематически изучать транскриптомные изменения в различных органах и типах клеток свиней, подвергшихся воздействию различных ПТИ и условий реперфузии («Расширенные данные», рис. 8, 9–12a, b; http://resources.sestanlab.org/OrganEx).
Чтобы на основе транскриптомных изменений в экспериментальных группах сравнить способность клеток реагировать на ишемию, авторы провели приоритизацию Augur [34] и выделили t-типы с наибольшей дивергенцией транскриптомов. Таким способом были обнаружены значительные изменения в нейронах, кардиомиоцитах, гепатоцитах и клетках проксимальных извитых канальцев (ПИК), что согласуется с t-типами, выявленными в более ранних исследованиях, и требует детального анализа (рис. 5a–d). Сначала авторы работы оценили, отражают ли паттерны транскриптомных изменений в группе OrganEx относительно прочих групп изменения на молекулярном и клеточном уровне, обнаруженные в предыдущих исследованиях при изучении транскриптомного обогащения соответствующих наборов генов («Meтоды»). Сравнение группы OrganEx с другими группами показало обогащение наборов генов, усиливающих сборку цитоскелета, репарацию ДНК, метаболизм АТФ и ингибирование апоптоза и других основных типов клеточной гибели во всех типах клеток исследованных органов (рис. 5a–d и «Расширенные данные», рис. 9–12f–g). Эти данные подтверждают более ранние результаты, демонстрируя, что OrganEx как подавляет прогрессию клеточных повреждений (например, нарушение цитоархитектоники, клеточную гибель и фрагментацию ДНК), так и способствует восстановлению путем модуляции клеточных путей на транскриптомном уровне. Сходным образом, в группе OrganEx, в отличие от ЭКМО, гены, которые кодируют белки, участвующие в клеточной гибели, окислительном повреждении и воспалительных сигнальных путях (дополнительная таблица 4) обширно регулируются в сторону выживания клеток во всех исследованных органах. Это коррелирует с выбором фармакологических компонентов в перфузате OrganEx, которые вводились с использованием основанного на гипотезе подхода рациональной политерапии для модуляции этих путей («Расширенные данные», рис. 9–12d).
Дальнейшее изучение влияния OrganEx на глиальные воспалительные реакции, лежащие в основе прогрессирования мозговых повреждений после ишемии, показало, что в группе OrganEx не было усиления транскрипции провоспалительных факторов в клетках глии гиппокампа. Напротив, в группах ЭКМО и 1 ч ПТИ, соответственно, микроглиальные воспалительные и астроцитарные панреактивные транскриптомные сигнатуры были усилены [35, 36] (рис. 5а). Вместе с иммунофлуоресцентным анализом GFAP в астроцитах и IBA1мв астроцитах (рис. 3а–d и «Расширенные данные», рис. 2f–l), эти результаты демонстрируют, что применение OrganEx модулирует глиальный воспалительный ответ.
Затем авторы оценили транскриптомные сигнатуры функционирования клеток и тканей в образцах сердца, печени и почек. В кардиомиоцитах в группе OrganEx было показано обогащение генами, обеспечивающими формирование потенциала действия и хорошо описанный сдвиг [37] в сторону гликолитического обмена после ишемии, что подтверждает жизнеспособность кардиомиоцитов (рис. 5b). В печени и почках свиней группы OrganEx, в отличие от других групп, гепатоциты и клетки ПИК были соответственно обогащены генами цитохрома P450 и транспоптеров ПИК, однако без достижения контрольного уровня группы 0 ч ПТИ, что позволяет предположить сохранение органоспецифических функций (рис. 5c, d). Экспрессия генов белка острой фазы печени и маркеров повреждения почек также были заметно ниже после реперфузии OrganEx по сравнению с ЭКМО или группой 7 ч ПТИ (рис. 5c, d). Эти данные подтверждают более ранние выводы о целостности тканей и клеточной активности (рис. 3e–h и 4b–g и «Расширенные данные», рис. 3d–j и 6l–o).
Для более систематического выявления транскриптомных паттернов в экспериментальных группах и определения функциональных генных модулей авторы провели анализ коэкспрессии дифференциально экспрессируемых генов [38]. Собственные гены каждого модуля обозначали ключевые тенденции экспрессии генов, а последующий анализ Gene Ontology (GO) выделял соответствующие биологические пути («Расширенные данные», рис. 9–12e и дополнительная таблица 5). Здесь у OrganEx и ЭКMO были разные тенденции по разным модулям. Модули генов с увеличением собственного гена в группе OrganEx содержали термины GO, связанные с поддержанием клеток и специфическими для органа функциями. Напротив, модулям с повышенным количеством собственных генов в группе ЭКМО соответствовали термины GO, связанные с гибелью клеток (печень и почки).
Наконец, анализ пар «лиганд — рецептор» [39] t-типов показал уменьшение взаимодействий, связанных с воспалительными путями (например, IL-1, IL-6, ICAM, VCAM), в группе OrganEx по сравнению с группами ЭКМО («Расширенные данные», рис. 9–12h, i). Это согласуется с результатами более ранних исследований, в которых было обнаружено, что реперфузия OrganEx после ишемии снижает уровень маркеров воспаления, ассоциированный с уменьшением клеточного повреждения и улучшением процессов восстановления/защиты по сравнению с ЭКМО («Расширенные данные», рис. 5а–e и 9–12d).
Таким образом, snRNA-seq-анализ подтверждает результаты, полученные на клеточном и тканевом уровнях и показывающие снижение клеточного повреждения и запуск определенных молекулярных и клеточных процессов восстановления после применения OrganEx.
Обсуждение
В настоящей статье описывается технология OrganEx и ее потенциал в деле поддержания восстановления ключевых молекулярных и клеточных процессов в различных органах свиньи после длительной глобальной теплой ишемии. Это также демонстрирует недооцененную способность организма крупного млекопитающего восстанавливать гемодинамические и метаболические параметры после остановки кровообращения или другого тяжелого ишемического стресса. Кроме того, эти данные подкрепляют предыдущие результаты авторов, полученные при исследовании посмертно изолированного свиного мозга [3] и указывающие на то, что разрушение клеток является более длительным процессом, не привязанным к узко определенным временным рамкам. Применение технологии OrganEx демонстрирует, что клеточную гибель можно остановить, а состояние организма можно сдвинуть в сторону восстановления на молекулярном и клеточном уровнях даже после длительной тепловой ишемии. Кроме того, авторы провели детальный транскриптомный анализ единичных клеток различных органов свиньи, предоставив уникальный ресурс для будущих исследований типов клеток и воздействия ишемии и реперфузии.
Хотя жизнеспособность клеток может в некоторой степени восстанавливаться после длительной ишемии в тканевых культурах [7] или изолированных органах [3, 8–11], клинические сценарии обычно включают менее продолжительную ишемию в условиях остановки сердца [40, 41] или регионарную перфузию при трансплантации органов [42, 43]. Используя рациональный политерапевтический подход, основанный на оптимизированной динамике перфузии и усовершенствовании бесклеточного синтетического перфузата, технология OrganEx смогла восполнить прежние пробелы в коммуникации между экспериментальной и клинической медициной, восстановив кровообращение и метаболический гомеостаз во всем организме. Это ослабляет процессы распада, вызванные нарушениями в клеточном окружении и недостатком кислорода и служит отличительной чертой этой технологии, а также делает возможным контроль множества неспецифических механизмов повреждения, влияющих на восстановление эффекторных органов и общий прогноз после глобальной ишемии. Существует множество потенциальных применений технологии OrganEx; она может открыть новые пути для развития изучения ишемии и смежных клинических дисциплин. OrganEx может расширить пределы допустимого времени тепловой ишемии за счет регионарной абдоминальной/торакальной реперфузии [44], тем самым увеличивая доступность органов для трансплантации. Этот подход потребует обязательного предварительного пережатия аорты/сонных артерий для предотвращения восстановления кровообращения в мозге донора органов. И наоборот, если бы какие-либо будущие усовершенствованные технологии могли быть направлены на восстановление функции мозга после травмы, кровоснабжение мозга осталось бы нетронутым. С этой точки зрения, технология OrganEx может улучшить результаты экстракорпоральной сердечно-легочной реанимации [45] с необходимой поддержкой кровообращения, а перфузат OrganEx может помочь в выздоровлении, когда сердечная функция сохранена, но мозг поврежден, как это наблюдается при инсульте. Таким образом, перед возможным использованием технологии OrganEx необходимо провести четкое различие в отношении включения мозгового кровообращения.
Хотя описанные в статье исследования демонстрируют цитопротекторные и восстановительные процессы в жизненно важных органах в значимых временных точках, остаются вопросы, касающиеся восстановления органов в более широких временных рамках. Поскольку в соответствии с текущими нормативными ограничениями повторение всех экспериментов в течение дополнительных, увеличенных периодов времени для включения в полное лонгитюдное исследование было невозможно, авторы для изучения выживаемости клеток после перфузии в наиболее чувствительных к ишемии клетках использовали долгоживущие органотипические препараты культуры из срезов гиппокампа. Благодаря этому было показано, что OrganEx обеспечивает устойчивые эффекты клеточного восстановления после переноса в условия, способствующие длительному выживанию. Тем не менее, неизвестно, соответствует ли такое восстановление in vitro ситуации длительной перфузии всего организма с помощью OrganEx.
В целом, для полного понимания эффектов разработанной авторами технологии по отношению к ишемизированным тканям и их восстановлению необходима дальнейшая ее оптимизация и расширение. Хотя результаты in vivo здесь и обещают заполнить пробелы между фундаментальными исследованиями в области ишемии и трансплантационной медицины или клинической реанимации, понимание восстановления функции мозга требует тщательного рассмотрения. В частности, необходимо вдумчивое исследование, чтобы выяснить, почему только в группе OrganEx происходили движения головы и шеи после инъекции контраста. При строгом этическом надзоре со стороны исследователей, биоэтиков и институционных советов характеристика этих движений в будущем может обеспечить лучшее понимание нейромоторной биологии и патофизиологии ишемии после остановки сердца или инсульта.
Онлайн-ресурсы: любые методы, дополнительные ссылки, сводки отчетов Nature Research, данные источников, расширенные данные, дополнительная информация, благодарности, информация о рецензировании, вклад авторов и конфликт интересов, а также состояние доступности данных и кодов можно найти по ссылке https://doi.org/10.1038/s41586....
Методы
Обзор перфузионной системы OrganEx и перфузата
Обзор перфузионной системы OrganEx
Перфузионная система состоит из основного замкнутого контура, непосредственно подключенного к животному, и включает центробежный насос (Medtronic Bio-Console 560, Medtronic), который пропускает смесь аутологичной крови и перфузата OrganEx через оксигенатор (Affinity Fusion, Medtronic) и изготовленный по индивидуальному проекту импульсный генератор и далее — в артериальную систему животного. Оксигенатор соединен с охлаждающей ванной (Polystat, Cole-Parmer) для контроля температуры и газовым смесителем (Sechrist Industries) для контроля растворенных газов и инфузии анестезии. Перфузионная система имеет резервуар для жидкости, в котором она хранится и используется для заполнения системы. Автоматизированная система гемодиафильтрации и резервуар подключаются параллельно к основному контуру (рис. 1б). Автоматизированная система гемодиафильтрации применяется для замены фракции плазмы на специально изготовленный диализный обменный раствор. Система гемодиафильтрации состоит из роликового насоса (Cobe Shiley, Stockert), диализатора (Diacap Pro 13H, Braun) и двух перистальтических насосов (Masterflex L/S, Cole-Parmer), интегрированных с датчиком уровня (eTape, Milone Technologies) и специально разработанным логическим контроллером. Два инфузионных насоса (Sigma Spectrum, Baxter Healthcare) соединены с артериальной частью главного контура и поставляют гепарин и фармакологические компоненты перфузата. Система мониторинга параметров крови CDI и датчик гематокрита/насыщения кислородом (Terumo Cardiovascular Systems) подключены к артериальной и венозной стороне, соответственно, вместе с датчиками давления (PendoTECH) и датчиками потока (Bio-Probe TX50, Medtronic). Для автоматизированного управления и сбора данных компоненты перфузионной системы OrganEx, логические контроллеры и датчики подключаются к компьютеру. Подробные схемы доступны по запросу.
Приготовление и применение перфузата OrganEx
Перфузат OrganEx представляет собой конечную смесь специально разработанного раствора для заливки (дополнительная таблица 2), Hemopure (HbO2 Therapeutics), специального раствора для замены диализа (дополнительная таблица 3) и раствора фармакологических соединений (дополнительная таблица 1). Перед подключением животного в перфузионную систему OrganEx заливают 2200 мл раствора для первичного заполнения (5000 мл), а затем в систему вводят 1000 мл Hemopure. Эти растворы оставляют в перфузионной системе для перемешивания и установления равновесия, после чего 600 мл из нее подвергают диализу для достижения желаемых концентраций электролитов и онкотических агентов в перфузионной системе и ее подготовки к введению аутологичной крови. Перед началом протокола перфузии бедренные сосуды животных канюлируют и подключают к основному контуру. Через 30 минут ПТИ в систему вводят 5000 единиц гепарина (Sigma-Aldrich), а затем приблизительно 1000 мл венозной крови от мертвого животного, которая дренируется в перфузионную систему. В этот момент объем кровообращения в перфузионной системе OrganEx составляет приблизительно 3600 мл, из которых 2600 мл приходится на перфузат, а 1000 мл — на аутологическую кровь. Затем смесь перфузата и аутологичной крови оставляют для достижения равновесия и подвергают встречному диализу против остаточного затравочного раствора в течение 30 мин, чтобы обеспечить коррекцию метаболических нарушений в дренированной венозной крови. Параллельно приблизительно 1600 мл жидкости отфильтровывается из перфузионной системы в течение 30 минут, в то время как остаточная жидкость охлаждается до 28 °С, в результате чего конечный объем в перфузионной системе OrganEx составляет 2000 мл. Далее, через 1 ч ПТИ животному вливают 1000 мл смеси перфузата и аутологичной крови, обеспечивая наполнение системы кровообращения после венозного оттока, и начинают протокол перфузии. Оставшиеся 1000 мл смеси хранятся в резервуаре и при необходимости используются для восполнения жидкости. После инфузии смеси перфузата и аутологичной крови фармакологические соединения и диализирующий обменный раствор, содержащие аминокислоты, витамины и неорганические соли, непрерывно вводят в основной перфузионный контур с помощью инфузионного насоса и системы гемодиафильтрации, соответственно. В перфузионной системе OrganEx используется автоматизированный контур гемодиафильтрации, который корректирует и поддерживает определенные метаболические и электролитные параметры путем обмена 1 : 1 (объем : объем) растворенных веществ и частиц размером менее 40 кДа на специальный диализный обменный раствор (20 000 мл), сохраняя при этом нормоволемию. Поток гемодиафильтрации поддерживали на уровне 30–35 мл/кг/ч в течение шестичасовой перфузии.
Обзор перфузионной системы ЭКМО
Перфузионная система ЭКМО была собрана в соответствии с клиническим стандартом [14]. Она имеет основной замкнутый контур, непосредственно связанный с животным, и состоит из центробежного насоса (Bio-Console 560, Medtronic), который направляет аутологическую кровь через оксигенатор (Affinity Fusion, Medtronic) в артериальную систему животного. Оксигенатор соединен с охлаждающей ванной (Polystat, Cole-Parmer) для контроля температуры и газовым смесителем (Sechrist Industries) для контроля растворенных газов и инфузии анестезии. Перфузионная система имеет жидкостный резервуар, который используется для заполнения системы и хранения дополнительной жидкости. Кроме того, перфузионная система ЭКМО содержит модуль параметров крови CDI и датчик гематокрита/насыщения кислородом (Terumo Cardiovassal Systems), подсоединенные, соответственно, к артериальной и венозной сторонам вместе с датчиками давления (PendoTECH) и датчиками потока (Bio-Probe TX50), Medtronic). Все зонды и датчики перфузионной системы ЭКМО подключены к компьютеру для сбора данных. Подробные схемы доступны по запросу.
Установленные существенные принципы использования животных
Настоящий исследовательский проект был одобрен и контролировался Институциональным комитетом Йельского университета по уходу за животными и их использованию, а руководство осуществлял внешний консультативный и этический комитет. Для разработки дизайна исследования и экспериментов перед их началом учитывались интересы животных, данные предыдущих исследований и цели текущих экспериментов. В результате были установлены три существенных принципа, которым следовали авторы при проведении научной работы, описанной в настоящей статье.
Во-первых, авторы стремились свести к минимуму количество животных и любой потенциальный дискомфорт и страдания. Во-вторых, поскольку полной уверенности в результатах эксперимента и эффективности технологии OrganEx не было, до перехода к исследованию возможного выживания авторы сфокусировались на контролируемой изнутри экспериментальной проверке концепции, которая могла продемонстрировать в первую очередь жизнеспособность на молекулярном и клеточном уровнях. Наконец, время перфузии было выбрано на основе как выполненного авторами предыдущего исследования изолированного мозга свиньи, показывающего, что шесть часов перфузии с использованием технологии BrainEx было достаточно для инициации процессов, связанных с молекулярным и клеточным восстановлением, так и ожидаемых клинических временных рамок для начала и распространения гипоперфузионного повреждения органов-мишеней.
Анестезия животных и хирургический протокол
Экспериментальные животные — самки домашних свиней Sus scrofa domesticus, возраст 10–12 недель (~30–35 кг) — были закуплены у заводчиков местной фермы. Все животные были размещены в помещениях отделения ухода за животными Йельской школы медицины как минимум за три дня до эксперимента.
Перед началом экспериментального протокола все животные получали пластырь с фентанилом, 50 мкг/ч (Duragesic, Henry Schein) для седации. Для индукции анестезии вводили 6 мг/кг телазола (Henry Schein) и 2,2 мг/кг ксилазина (Henry Schein). Далее животных интубировали и подключали к аппарату ИВЛ с FiO2 40 % и FiN2 60 % при стандартных параметрах дыхательного объема 10–15 мл/кг и частоте 14–16 вдохов в минуту, с 1–2 % изофлюраном (Henry Schein). После фибрилляции желудочков и индукции остановки сердца вентиляция прекращалась на 1 ч. После начала перфузионного протокола в группах ЭКМО и OrganEx вентиляция была продолжена с дыхательным объемом 3–4 мл/кг, частотой 5 вдохов в минуту, положительным давлением в конце выдоха (ПДКВ) 10 см H2O, низким давлением выдыхаемого воздуха, FiO2 50 % и FiN2 50 %. В течение шестичасового протокола перфузии через испаритель, соединенный с газовым смесителем, вводили 0,5 % изофлурана.
Остановку сердца и последующее прекращение кровообращения вызывали фибрилляцией желудочков через загрудинное окно путем прикладывания к стенке миокарда батареи 9 В. Перед фибрилляцией желудочков животные получали 7000 единиц гепарина (Sigma-Aldrich). Для подключения кровеносной системы животного к перфузионной системе ЭКМО или OrganEx делали разрез в правой паховой области, обнажая бедренную артерию и вену (рис. 1а). Артериальную и венозную канюли вводили в бедренную артерию и вену, соответственно. Для артерии использовали канюлю 14 Fr, а для вены – канюлю 19 Fr (Edwards Lifesciences). Кончик венозной канюли помещали в отверстие нижней полой вены правого предсердия, а артериальную канюлю располагали ниже почечных артерий.
Протокол перфузии и мониторинг физиологических и метаболических параметров
В начале протокола перфузии в группе OrganEx смесь перфузата и аутологичной крови медленно вливали в течение пяти минут, в результате чего средняя скорость потока в конце инфузии составляла 600 мл/мин. По завершении этого шага скорость потока постепенно увеличивали в течение следующих 20 минут до целевого значения 80–100 мл/кг/мин или до максимально возможной скорости потока, не вызывающей чрезмерного вращения центробежного насоса. На протяжении всего процесса наращивания потока пульсация устанавливалась так, чтобы колебаться вокруг средней скорости потока примерно на ± 10 % от заданной общей скорости расхода. Оставшуюся смесь синтетического перфузата и аутологичной крови, хранившуюся в резервуаре, использовали для инфузионной терапии из расчета 1–2 мл/кг/ч-1. Целевое артериальное давление устанавливали на уровне 40–70 мм рт. ст., при необходимости контролировали фенилэфрином, но не более 2 мг/ч. Сходным образом, в группе ЭКМО скорость потока постепенно увеличивали в течение 25 минут, ориентируясь на скорость потока и артериальное давление в группе OrganEx. В качестве дополнительной жидкости применяли лактат Рингера (Baxter Healthcare) в количестве 3–4 мл/кг/ч. Как в группе ЭКМО, так и в группе OrganEx протокол гипотермической перфузии при 28 °C использовался на протяжении всех шести часов протокола перфузии.
В течение первого часа перфузии животные как в группе ЭКМО, так и в группе OrganEx получали 50 мл 8,4 % бикарбоната натрия (Henry Schein). Глюкоза подавалась в соответствии с ее уровнем в крови с целью поддержания нормогликемии. Протамин (25 мг) вводили сразу же после начала протокола перфузии для контроля времени активированного свертывания крови, которое при введении титрованного гепарина поддерживалось между 180 и 220 с. В обеих перфузионных группах парциальное давление CO2 и O2 в артериальной крови через газовый смеситель было установлено на уровне 35 и 250 мм рт. ст., соответственно.
Оценку электрокардиограммы (ЭКГ) проводили с четырьмя отведениями, расположенными в каждом углу туловища. Мониторинг артериального и центрального венозного давления в режиме реального времени осуществлялся путем венесекции плечевой артерии и яремной вены, соответственно. Диурез измеряли через катетер Фолея. Температуру тела животного непрерывно контролировали с помощью ректального зонда. Мониторинг ЭКГ, давления и температуры проводили с помощью Philips IntelliVue MP50. Во время предоперационной процедуры температуру поддерживали на уровне 37 °С с помощью грелки, которую отключали после фибрилляции желудочков. ЭЭГ контролировали с помощью системы долгосрочного мониторинга (LTM) Natus и коммутационного бокса EMU40 (Natus Medical). В начале седации шесть электродов были размещены подкожно вдоль скальпа (расширенные данные, рис. 6а). Мониторинг ЭЭГ проводился на протяжении всего шестичасового перфузионного протокола.
Базовые и почасовые образцы артериальной и венозной крови для анализа собирали из артериальных и венозных канюль, соответственно. 60 мкл каждого образца немедленно анализировали с использованием системы клинического анализатора крови GEM4000 (лаборатория приборов). Непрерывный мониторинг электролитов крови, концентрации и насыщения гемоглобина проводили с помощью системы CDI-500 (Terumo Cardiovassal Systems).
Рентгенологическое и ультразвуковое исследование кровообращения
Флюороскопия. Визуализацию сосудов брюшной полости и головы выполняли с помощью системы Philips Allura Xper FD20. У выбранных для флюороскопии животных перед индукцией фибрилляции желудочков выполняли фоновую физиологическую визуализацию как в экспериментальных протоколах ЭКMO, так и в OrganEx. Катетер для введения контраста помещали в разрез бедренной артерии и устанавливали в супраренальную аорту для визуализации почек и в общую сонную артерию для визуализации головного мозга. Для получения изображения головного мозга и почек с помощью инъектора Medrad Power (Bayer Vital) вводили контраст Omnipaque в количестве 350 мг/мл (General Electric), 24 мл и 45 мл, соответственно. После базовой визуализации всем животным была проведена дополнительная рентгеноскопия через 3 и 6 ч перфузии. В группах ЭКМО и OrganEx визуализацию абдоминальных кровеносных сосудов модифицировали путем помещения катетера для введения контраста в инфраренальную аорту из-за изменения направления артериального потока, что является следствием перфузии бедренной артерии/вены в обеих группах ЭКМО и OrganEx. Реконструированные изображения были сохранены в формате DICOM и дополнительно обработаны с помощью программного обеспечения RadiAnt DICOM Viewer (Medixant).
Ультразвуковое исследование. Динамику перфузии контролировали с помощью ультразвукового триплекса (спектральный допплер, цветовой допплер и В-режим) с использованием портативной ультразвуковой системы LOGIQe (General Electric) и линейного датчика 8L-RS (General Electric). У всех оцениваемых животных для профилирования динамики перфузии использовали левую глазную артерию, общую сонную артерию и внутрипочечные артерии. Анализ формы сигнала мощности был выполнен с использованием частоты 4,4 МГц, Gn 17, SV 2 и DR 40.
Выделение клеточных ядер
После соответствующего экспериментального рабочего процесса области интереса были извлечены из каждого органа и заморожены при температуре –80 °C. Чтобы обеспечить соответствие между образцами, все вскрытия проводились одним и тем же человеком. Выделение клеточных ядер из каждого органа (мозг, сердце, печень, почки) проводили одинаково в соответствии с уже установленным протоколом [46, 47] с некоторыми изменениями, чтобы учесть специфические структурные особенности каждого органа и иметь идентичные буферы для возможности сравнения органов одного и того же экспериментального животного. Чтобы избежать влияния субъективных факторов в эксперимента, выделение ядер выполнял один и тот же человек, не знавший об условиях эксперимента. Кроме того, чтобы случайным образом и полностью представить полный срез ткани, каждую ткань измельчали до состояния мелкого порошка в жидком азоте с помощью ступки и пестика (Coorstek). Все реагенты для молекулярно-генетического применения получены от Sigma-Aldrich, если не указано иное. Затем небольшое количество измельченной ткани (5–10 мг) добавляли в 1 мл охлажденного льдом буфера для лизиса (буфер А представляет собой 250 мМ сахарозы, 25 мМ KCl, 5 мМ MgCl2, 10 мМ NaCl, 10 мМ Трис-HCl (pH 7,4) с ингибиторами протеазы без ЭДТА (Roche), ингибитором РНКазы (80 ед/мл) (Roche), 1 мМ DTT, 1 % BSA (масс : об) (Gemini Bio-Products), 0,1 % NP-40 (об : об), 0,1 % Tween-20 (об : об) (Bio-Rad), 0,01 % дигитонином (масс : об) (Thermo Fisher Scientific). Для лизиса сердца добавляли 0,1 % Triton X-100 (об : об). DTT, RNase Protector, ингибиторы протеаз и все детергенты добавляли непосредственно перед использованием. Суспензию переносили в гомогенизатор тканей Dounce объемом 2 мл и лизировали при постоянном давлении и без введения воздуха пестиком А (30×) и пестиком B (30×). Гомогенат процеживали через предварительно смоченный 40-мкм пробирочный клеточный фильтр (Thermo Fisher Scientific). Все последующие центрифугирования проводили в охлаждаемой настольной центрифуге с поворотным ротором (Eppendorf). Лизат сердца центрифугировали при 100g в течение 5 мин при 4 °С, осадок миофибрилл и недиссоциированной соединительной ткани удаляли, а надосадочную жидкость сохраняли. Все лизаты (мозга, печени, почек) и надосадочную жидкость сердца (после центрифугирования при 100g) центрифугировали при 1000g в течение 10 мин при 4 °C, осадки сохраняли и ресуспендировали в 0,4 мл ресуспендирующего буфера (буфер B представляет собой буфер A без детергентов). Полученные 0,4 мл раствора смешивали с 0,4 мл (1 : 1) раствора Optiprep (буфер C — йодиксанол 50 % [об : об], 25 мМ KCl, 5 мМ MgCl2, 10 мМ NaCl, 10 мМ Тris-HCl [рН 7,4], ингибиторы протеазы без ЭДТА, ингибитор РНКазы [80 ед/мл], 1 мМ ДТТ, 1 % BSA [масс : об]). Суспензию (конечное содержание йодиксанола 25 %) смешивали 10 раз, не смешивая слои, и наносили на 0,6 мл 29 % йодиксаноловой подушки (соответствующая смесь буфера В и буфера С). Затем пробирки центрифугировали при 3000g в течение 30 минут при 4 °C. После центрифугирования супернатант удаляли и добавляли в пробирки суммарный объем 1 мл промывочного буфера (буфер D: 25 мМ KCl, 5 мМ MgCl2, 10 мМ NaCl, 10 мМ Тris-HCl [pH 7,4], ингибитор РНКазы [80 ед/мл], 1 мМ ДТТ, 1 % BSA [масс : об], 0,1 % Тween-20 [об : об] в DPBS [без Ca2+ и Mg2+] [Gibco]) суммарным объемом 1 мл и центрифугировали при 1000g в течение 10 мин при 4 °С. Затем супернатанты полностью удаляли, осадки осторожно растворяли, добавляя 100 мкл буфера для ресуспендирования (буфер E представляет собой буфер D без детергента) и пипетируя 30 раз наконечником пипетки объемом 1 мл, собирали и фильтровали через клеточный фильтр 20 мкм. Наконец, ядра подсчитывали на гемоцитометре и разбавляли до 1 млн/мл.
Микрожидкостный захват единичных ядер и синтез кДНК
Извлеченные образцы ядер помещали на лед и обрабатывали в лаборатории в течение 15 минут для секвенирования мяРНК с целевым восстановлением 10 000 ядер на микрожидкостной системе Chromium (10x Genomics) в соответствии с протоколом от производителя (CG000315_ChromiumNextGEMSingleCell3'_GeneExpression_v3.1(DualIndex)_RevA) с использованием Chromium Single Cell 3ʹ GEM, Library & Gel Bead Kit v3.1 (PN-1000268, 10x Genomics) и Chromium Single Cell G Chip Kit (PN-1000120, 10x Genomics), набора Dual Index Kit TT Set A (PN-1000215, 10x Genomics) на контроллере Chromium (10x Genomics). Поскольку исходным материалом были ядра, кДНК амплифицировали в течение 14 циклов.
Создание библиотеки snRNA-seq и секвенирование
После амплификации кДНК очистку и построение библиотек с индексами образцов и их амплификацию проводили в соответствии с инструкциями производителя (CG000315_ChromiumNextGEMSingleCell3’_GeneExpression_v3.1(DualIndex)_RevA), при этом этап амплификации напрямую зависел от количества вводимой кДНК. Чтобы достичь глубины секвенирования в 20 000 необработанных ридов на ядро, библиотеки единичных ядер запускали с использованием парного секвенирования с одинарной индексацией в системе NovaSeq 6000 S4 (Illumina) в соответствии с инструкциями производителя (Illumina; 10x Genomics). Чтобы избежать систематической ошибки, несколько образцов с уникальным индексом были смешаны и распределены по нескольким дорожкам.
Транскриптомный анализ единичных ядер
Контроль качества и анализ данных транскриптома единичных ядер. Риды секвенирования были сопоставлены с эталонным геномом свиньи (susScr11) с аннотациями комбинированных экзон-интронных генов из NCBI RefSeq с использованием CellRanger v.5.0.1. pipe48, который также выполнял подсчет UMI, подсчет штрих-кодов и выделение истинных ячеек из фона. Отфильтрованные матрицы подсчета затем систематизировались по размеру библиотеки с помощью функции NormalizeData в Seurat [49]. Чтобы сравнить клеточные и транскриптомные изменения в разных условиях, для каждой партии сначала выполняли отбор признаков, и признаки из одинаковых условий суммировали с помощью функции SelectIntegrationFeatures. Объединение генов с высокой изменчивостью в разных условиях затем передавалось в конвейер интеграции данных в Seurat для создания скорректированной по партиям матрицы экспрессии. Чтобы выявить клеточное разнообразие, авторы масштабировали интегрированные данные, а затем выполнили уменьшение размерности с использованием анализа основных компонентов (PCA), выбрав основные компоненты с применением метода «локтя». Затем авторы определили кластеры ячеек в графе k-ближайших соседей и визуализировали результаты кластеризации с помощью UMAP [50]. Первоначальный кластерный анализ выявил несколько низкокачественных кластеров с небольшим количеством уникальных молекулярных идентификаторов и обычно высоким процентом митохондрий без значимых кластерных маркеров, которые были удалены для последующего анализа. Чтобы аннотировать идентичность клеточных кластеров, авторы далее объединили данные свиней с опубликованными данными человека из того же органа [51–54,] применяя конвейер интеграции данных, описанный выше. Затем с помощью функции FindMarkers они рассчитали кластерные маркеры и вручную удалили дублетные кластеры, демонстрирующие высокую экспрессию маркеров двух разных типов клеток. Чтобы получить более точные аннотации ячеек и более четкую визуализацию UMAP, те же конвейеры интеграции данных, уменьшения размеров и кластеризации ячеек были повторно применены к отфильтрованным данным.
Глобальные транскриптомные сравнения с общедоступными наборами данных. Чтобы подтвердить кластерную аннотацию данных, авторы провели глобальное транскриптомное сравнение с общедоступными эталонными наборами данных для четырех органов [51–54]. Для каждого органа рассчитали логарифмически преобразованную среднюю экспрессию для каждого кластера клеток, а затем выполнили парную корреляцию Пирсона между кластерами в полученном авторами наборе данных и соответствующем ему общедоступном наборе данных с использованием высоковариабельных генов. Полученные коэффициенты корреляции визуализировались на градиентных тепловых картах («Расширенные данные», рис. 7c–f).
Аннотации клеточных типов. Классификация типов клеток для данных по гиппокампу («Расширенные данные», рис. 7c) была основана на генных маркерах, полученных из недавних данных по гиппокампу и энторинальной коре взрослого человека [53]. Первоначально клетки разделили на несколько основных групп на основе экспрессии маркерного гена: возбуждающие нейроны (SLC17A7+), тормозные нейроны (GAD1+), клетки-предшественники олигодендроцитов (PDGFRA+), олигодендроциты (PLP1+), астроциты (AQP4+), микроглия (PTPRC+) и клетки сосудов (COL1A1+). Из-за высокой гетерогенности, присутствующей в популяциях возбуждающих и тормозных нейронов, авторы дополнительно разделили эти две популяции на подгруппы. Возбуждающие нейроны были разделены на зрелые гранулярные клетки (PROX1+), мшистые клетки (ADCYAP1+), возбуждающие нейроны СА2–4 (FREM1+GALNT3+), возбуждающие нейроны СА1 и основания гиппокампа (SATB2+BCL11B+TLE-) и энторинальные возбуждающие нейроны верхнего слоя коры (CUX2+) и глубокого слоя (TLE4+). Тормозные нейроны были классифицированы на основе их источников развития на происходящие либо из медиального ганглиозного возвышения (MGE, LHX6+), либо из каудального ганглиозного возвышения (CGE, ARADB2+). Небольшая группа клеток, соединяющих клетки-зерна на UMAP, которые лишены всех этих маркеров, но характеризуются экспрессией DCX и CALB2, была аннотирована как нейробласты — промежуточные клеточные популяции в нейрогенезе взрослых свиней.
Данные по сердцу («Расширенные данные», рис. 7d) были аннотированы на основе генных маркеров, полученных из недавних данных по сердцу взрослого человека [52]. Клетки классифицировали на основе экспрессии маркеров: кардиомиоциты (MYH7+FHL2+), иммунные клетки (PTPRC+), перициты (RGS5+ABCC9+), гладкомышечные клетки (MYH11+ACTA2+), эндотелиальные клетки (CDH5+PECAM1+), фибробластоподобные клетки (DCN+GSN+) и нейральные клетки (NRXN1+XKR4+). Эндотелиальные клетки содержат две подгруппы, которые имеют дифференциальную экспрессию VWF и TBX1. Иммунные клетки далее делили на миелоидные (BANK1+C1QA+) и лимфоидные клетки (SKAP1+CD8A+).
Данные по почкам («Расширенные данные», рис. 7e) были аннотированы на основе генных маркеров, полученных из недавних данных по почкам взрослого человека [51]. Клетки классифицировали на основе экспрессии маркеров: клетки проксимальных канальцев (CUBN+LRP2+), клетки соединительных трубочек и главные клетки (SAMD5+LINGO2+), клетки петли Генле (NHSL2+UMOD2+), вставочные клетки (HEPACAM2+SLC26A7+), подоциты (PTPRQ +PTPRO+), иммунные клетки (PTPRC+), эндотелиальные клетки (CHRM3+PTPRB+) и фибробласты (PRKG1+FBLN5+). Иммунные клетки были дополнительно разделены на миелоидные (BANK1+MARCH1+) и лимфоидные клетки (SKAP1+THSD7B+).
Данные по печени («Расширенные данные», рис. 7f) были аннотированы на основе генных маркеров, полученных из недавних данных по печени взрослого человека [54]. Клетки классифицировали на основе экспрессии маркеров: гепатоциты (APOB+PCK1+), звездчатые клетки (RELN+ACTA2+), холангиоциты (CFTR+PKHD1+), иммунные клетки (PTPRC+) и эндотелиальные клетки (FLT1+PECAM1+). Далее авторы разделили иммунные клетки на несколько подгрупп: В-клетки (MS4A1+), плазматические клетки (JCHAIN+MZB1+), естественные киллеры и Т-клетки (SKAP1+), миелоидные клетки (CD163+EMR4+, преимущественно клетки Купфера).
Гетерогенность клеток. Для определения маркерных генов для кластеров высокого разрешения использовалась функция FindMarkers от Seurat [55]. Корректировка значения P проводилась с применением поправки Бонферрони с отсечкой, установленной на уровне 0,05. Лучшие 10 генов для каждого кластера были ранжированы по кратности изменений и визуализированы на тепловой карте с использованием функции DoHeatmap в Seurat. Авторы отобрали полученные ими наборы данных случайным образом, чтобы иметь 1000 клеток на условие для каждого t-типа перед анализом дифференциальной экспрессии.
Приоритизация клеточных типов с помощью Augur. Чтобы найти клеточные популяции, которые демонстрируют высокую степень транскриптомных изменений, авторы использовали Augur [34] для приоритизации типов клеток между каждой парой условий. Поскольку на одно условие приходится три образца, анализ Augur выполняли для всех девяти пар образцов в каждой паре условий, используя кластеры клеток с высоким разрешением, определенные с помощью Seurat. Медиану рассчитанных показателей AUC для каждого кластера затем визуализировали на макете UMAP. Сравнение показателей AUC для каждого конкретного типа клеток и данной пары состояний выполняли путем сравнения показателя AUC интересующего конкретного типа клеток и показателей AUC всех других типов клеток в данной паре состояний с применением одностороннего рангового критерия Вилкоксона.
Анализ дифференциальной экспрессии и G-анализ. Сначала авторы рассчитали дифференциально экспрессируемые гены (ДЭГ) между OrganEx и другими состояниями (0 ч ПТИ, 1 ч ПТИ, 7 ч ПТИ,
ЭКMO) в нейронах гиппокампа, кардиомиоцитах в сердце, гепатоцитах в печени и клетках проксимальных извитых канальцев в почках (основные t-типы для каждого органа). Кроме того, были определены ДЭГ между 0 ч ПТИ и 1 ч ПТИ, а также между 0 ч ПТИ и 7 ч ПТИ. ДЭГ рассчитывали с использованием функции Seurat FindMarkers [55] и определяли по критерию отсечки: они должны экспрессироваться не менее чем в 10 % клеток в любой популяции и иметь коэффициент экспрессии более 0,1, среднее значение log2[FC] больше или меньше 0,1. Корректировка множественного тестирования для отсечки частоты ложных открытий (FDR) была установлена на уровне 0,05. Первые 15 ДЭГ, ранжированные по абсолютным значениям log2[FC], были визуализированы с помощью пакета EnhancedVolcano [56]. Кроме того, авторы провели анализ обогащения GO в условиях ишемии (сравнивая 0 ч ПТИ с 1 ч ПТИ и 0 ч ПТИ с 7 ч ПТИ) в основных t-типах всех органов. Чтобы поддерживать сопоставимое количество ДЭГ, авторы сохранили 800 лучших ДЭГ в обоих направлениях, ранжированных по кратности изменений. Анализ обогащения биологических путей был выполнен с использованием функции richGO из clusterProfiler [57], которая для расчета значимости использует односторонний точный критерий Фишера. В случае многократного тестирования значения P были скорректированы для FDR с отсечкой, установленной на 0,05, и qvalueCutoff = 0,2. 10 лучших биологических процессов, ранжированных по значению P, были визуализированы с помощью гистограммы с применением пользовательского скрипта ggplot2.
Анализ обогащения набора генов. Чтобы оценить, активируются ли наборы генов интереса в определенных условиях (например, 0 ч ПТИ, 1 ч ПТИ, 7 ч ПТИ, ЭКМО и OrganEx), авторы провели анализ обогащения набора генов в нейронах гиппокампа, астроцитах и клетках микроглии, кардиомиоцитах в сердце, гепатоцитах в печени и клетках проксимальных извитых канальцев в почках. Этот метод обычно используется в анализе обогащения с помощью GO и широко применялся во многих опубликованных исследованиях [46, 47, 53]. В частности, авторы установили все экспрессированные (хотя бы в одной клетке) гены как генное множество и рассмотрели каждый набор обогащенных условиями генов как выборку из этого множества. Обогащение набора генов, выполняемое с помощью гипергеометрических тестов (также называемых односторонним точным тестом Фишера), служит оценкой того, перепредставлены ли гены из данного набора в обогащенных условиями генах по сравнению со случайным извлечением из генного множества. Чтобы идентифицировать обогащенные условиями гены в вышеупомянутых t-типах, авторы провели анализ дифференциальной экспрессии с использованием функции Seurat FindMarkers [55]. Другими словами, они взяли одну группу условий и сравнили ее профили экспрессии с остальными условиями, используя критерий суммы рангов Уилкоксона. Для любого данного сравнения гены с FDR менее 0,01 считались статистически значимыми и сохранялись. Поскольку критерий суммы рангов Уилкоксона может быть смещен из-за различий в количестве клеток, — т. е. чем больше клеток, тем больше ДЭГ, — авторы случайным образом отобрали полученные ими наборы данных, чтобы перед дифференциальной экспрессией иметь 1000 клеток на условие в каждом t-типе. Располагая обогащенными состоянием генами и некоторыми выбранными наборами генов, загруженными из Gene Ontology (http://geneontology.org/), они смогли оценить значимость обогащения набора генов в данных условиях. Значимыми считались значения Р менее 0,05. Значимость обогащения отображали на точечном графике, на котором размер и цвет точки показывают значимость как –log10[P]. Как видно на рис. 5a–d, авторы тестировали обогащение на положительную регуляцию репарации ДНК (GO:0045739), отрицательную регуляцию процесса апоптоза (GO:0043066), положительную регуляцию организации цитоскелета (GO :0051495) и процесс метаболизма АТФ (GO:0046034) во всех условиях для всех органов. Такой же подход использовался при оценке анализа функционального обогащения для каждого органа. Таким образом, в гиппокампе авторы протестировали обогащение клеток микроглии провоспалительными маркерами [35] и астроциты — панреактивными маркерами [36], как показано на рис. 5а. Кардиомиоциты сердца тестировали на потенциал действия клеток сердечной мышцы (GO:0086001), β-окисление жирных кислот (GO:0006635) и гликолиз (GO:0006096), как показано на рис. 5b. В печени авторы тестировали гепатоциты на обогащение белками острой фазы [58] и всеми экспрессируемыми изоформами CYP (рис. 5с); и, наконец, клетки проксимальных канальцев в почках тестировали на гены молекул повреждения [33] и гены транспортеров PCT [59] (рис. 5d).
Анализ обогащения экспрессии набора генов. Авторы также оценили динамику экспрессии выбранного набора генов, связанных с клеточной гибелью, в различных условиях [60–63]. Сначала с использованием функции Seurat DotPlot [55] были созданы точечные графики («Расширенные данные», рис. 9–12f). Затем для каждого гена из данного набора проверили обогащение его экспрессии при каждом условии, сравнив его экспрессию в данном состоянии с экспрессией в других условиях. Сходным образом, авторы использовали критерий суммы рангов Уилкоксона для измерения значимости. Полученные логарифмически преобразованные значения P (–log10[P]) для различных условий представили в виде гистограммы («Расширенные данные», рис. 9–12g).
Иерархическая кластеризация для основных ДЭГ. Чтобы выявить динамические изменения в транскриптоме для каждой ткани при различных условиях и временных точках, авторы определили основные ДЭГ для всех парных состояний: 0 ч и 1 ч, 0 ч и 7 ч, 0 ч и ЭКМО, 0 ч и OrganEx, 1 ч и 7 ч, 1 ч и ЭКМО, 1 ч и OrganEx, 7 ч и ЭКМО, 7 ч и OrganEx, ЭКМО и OrganEx с использованием функции FindMarkers() в Seurat [49]. Для гиппокампа были выбраны значимые ДЭГ со средним значением log2[FC] больше 0,5 или меньше –0,5. Авторы объединили 50 генов с повышенной экспрессией и 50 ДЭГ с пониженной экспрессией (всего 100 генов) из каждого парного состояния для последующего анализа. Чтобы выявить паттерны экспрессии генов, рассчитывали среднюю экспрессию объединенных ДЭГ по t-типам и экспериментальным группам и определяли коэффициенты корреляции, вычтенные из 1, как расстояния между генами, которые были переданы в иерархическую кластеризацию с применением функции hclust в R с алгоритмом D2. Чтобы определить генные модули (кластеры), гены разделили на группы с помощью функции cutreeDynamic из пакета R WGCNA [38] с настройками minClusterSize = 45, чувствительность = 2. Затем авторы нанесли на график масштабированные собственные гены — первый главный компонент матрицы экспрессии модуля, чтобы показать тенденцию экспрессии генов в каждом модуле. С помощью TopGO [64] авторы провели GO-анализ для генов в каждом модуле и использовали точный критерий Фишера для расчета значений P. Для выбора генов в тканях сердца, почек и печени применяли те же методы, что и для данных по гиппокампу. Чтобы число выбранных генов было сопоставимо с образцами гиппокампа, авторы сохранили значимые ДЭГ со средним log2[FC] больше 0,75 или меньше -0,75 в данных сердца, значимые DEG со средним log2[FC] больше 1,00 или меньше, чем -1,00 в данных о почках, и выбраны значимые ДЭГ со средним значением log2[FC] больше 1,75 или меньше –1,75 в данных по печени. Затем те же настройки использовали для построения сети экспрессии генов с помощью иерархической кластеризации [38]. Авторы нанесли на график масштабированные собственные гены каждого модуля и использовали тот же метод (TopGO) для GO-анализа.
Оценка эффектов компонентов перфузионной жидкости. Чтобы оценить влияние компонентов перфузата на OrganEx, авторы сравнили обогащение экспрессии значимых путей (гибель клеток, воспаление и окислительный ответ) в условиях OrganEx и ЭКMO (дополнительная таблица 4). В частности, с помощью пакета AUCell [65] были рассчитаны показатели AUC, а также применен односторонний критерий суммы рангов Уилкоксона для оценки значимости обогащения пути.
Анализ траектории. Для проведения псевдовременного анализа гиппокампа, сердца, печени и почек использовали monocle2 [66] и пользовательские R-скрипты. Авторы следовали рекомендуемому протоколу анализа, за исключением функции FindMarkers из пакета Seurat для выполнения попарных сравнений в различных условиях, чтобы найти гены со статистически значимым повышением или снижением экспрессии. Чтобы уменьшить число ложноположительных результатов, некоторые параметры были настроены на основе вычислительной перестановки. Например, требовалось, чтобы минимальный процент клеток с экспрессией каждого гена в любом состоянии был выше 0,1, а кратность изменения превышала 1,25. Максимальное количество ячеек в любом состоянии было уменьшено до 1000, чтобы сбалансировать сравнение. Следовательно, ДЭГ, выявленные Seurat, были использованы в качестве информативных генов для упорядочения ячеек с помощью функции setOrderingFilter из monocle2, а для выполнения уменьшения размерности данных был выбран расширенный алгоритм нелинейной реконструкции, называемый DDRTree.
Анализ коммуникации между клетками. Межклеточные взаимодействия, основанные на экспрессии известных пар «лиганд — рецептор» в различных t-типах, были определены с использованием CellChat (v.1.1.3) [39]. Авторы следовали официальному рабочему процессу CellChat для анализа нескольких наборов данных (0 ч ПТИ, 1 ч ПТИ, 7 ч ПТИ, ЭКMO и OrganEx). Сначала выборку каждого набора данных случайным образом уменьшили до 1000 ячеек на t-тип, чтобы сбалансировать сравнение. Затем нормализованные подсчеты загрузили в CellChat. Далее для анализа межклеточных коммуникаций выбрали базу данных человека CellChatDB, после чего применили функции предварительной обработки identifyOverExpressedGenes и identifyOverExpressedInteractions со стандартным набором параметров. Затем была вычислена вероятность связи между взаимодействующими группами ячеек с усеченным средним значением, равным 0,1. Впоследствии авторы использовали filterCommunication, calculateCommunProbPathway иaggregationNet со стандартными параметрами. Для определения консервативных и специфичных сигнальных путей авторы применили функцию rankNet к слоту данных netP, которая показала общий информационный поток каждого сигнального пути в виде столбчатой гистограммы. Чтобы определить силу реакций и t-типы, участвующие в каждом сигнальном пути, задействовали netAnalysis_signalingRole_heatmap и визуализировали сигналинг в целом, объединив вместе исходящие и входящие сигнальные пути.
Подготовка тканей и гистология
Подготовка тканей. По завершении каждого экспериментального протокола были взяты образцы головного мозга, сердца, легких, почек, печени и поджелудочной железы. Образцы зафиксировали путем погружения в раствор, содержащий 10 % (масс : об) нейтрального формалина в буфере, при осторожном встряхивании. Отбор проб производил один и тот же человек в каждой временной точке эксперимента случайным образом из одной и той же области каждого органа. После фиксации каждый кусочек ткани обрабатывали и заливали в парафиновый блок с помощью тканевого процессора Excelsior (Thermo Fisher Scientific). Эти парафиновые блоки обрезали на микротоме Shandon Finesse 325 (Thermo Fisher Scientific) до срезов толщиной 5 мкм. Срезы помещали на адгезивные предметные стекла TruBond 380 и оставляли сушиться в течение ночи при комнатной температуре. Далее проводили депарафинизацию и регидратацию срезов, как описано ранее [3]. Cрезы депарафинизировали в двух сменах Histo-Clear II (64111-04, Electronic Microscopy Sciences) по 10 мин каждая. Затем предметные стекла переносили в 100 % спирт с двумя сменами по 10 мин каждая, а затем —— по одному разу в 95 %, 70 % и 50 % спирт на 5 мин. После этого предметные стекла промывали водой и промывочным буфером (0,05 % Tween-20 в 1× PBS) в течение 10 мин.
Окрашивание тканей гематоксилином и эозином, крезиловым фиолетовым (по Нисслю), методом TUNEL и ШИК. Все срезы сердца, легких, печени, почек и поджелудочной железы окрашивали одновременно Г/Э с помощью автоматического прибора для окрашивания препаратов Shandon Linistain (Thermo Fisher Scientific).
Окрашивание срезов головного мозга (гиппокампа и ПФК) по Нисслю проводили 0, 1% раствором крезилового фиолетового (Abcam, ab246816) в течение 5 мин и быстро промывали одной сменой дистиллированной воды. Затем эти срезы быстро обезвоживали в абсолютном спирте, очищали в Histo-Clear II и, наконец, заключали в среду aProlong Gold Antifade Mountant (Thermo Fisher Scientific, P36934).
Все срезы для окрашивания методом TUNEL (Millipore, S7101, 3542625) подготавливали одновременно. Их депарафинизировали, регидратировали и инкубировали в присутствии протеинкиназы K (20 мкг/мл в PBS) в течение 30 мин при 37 °C. Стекла со срезами промывали PBS и инкубировали с 3 % H2O2 в PBS в течение 10 мин при комнатной температуре для того, чтобы блокировать активность эндогенных пероксидаз. Далее следовала промывка PBS и инкубация в 0,1 % Triton X-100 в 0,1 % растворе цитрата натрия в течение 2 мин на льду (4 °C). Стекла со срезами помещали в смесь раствора TdT и меченого флуоресцеинизотиоцианатом dUTP во влажной камере при 37 °C на 60 мин. После этого следовала промывка в PBS и инкубация в присутствии Fab-фрагментов антител к флуоресцеину, меченых пероксидазой хрена, во влажной камере при 37 °C в течение 30 мин. После промывания PBS ядра докрашивали метиловым зеленым.
Все стекла со срезами подготавливали к проведению ШИК-реакции одновременно. Сначала их депарафинизировали и регидратировали, после чего 10 мин инкубировали в 0,5 % растворе йодной кислоты. Затем срезы промывали тремя сменами дистиллированной воды и помещали в реактив Шиффа на 15 мин. После инкубации их промывали дистиллированной водой в течение 10 мин и в течение 1 мин докрашивали гематоксилином с уксусной кислотой. Затем срезы снова промывали дистиллированной водой, дифференцировали в кислом спирте (одно погружение) и промывали перед добавлением подсиняющего раствора (два погружения). Наконец, срезы обезвоживали 95 % и абсолютным спиртом и очищали ксиленом перед заключением в смолу.
Иммуногистохимия. Все срезы для специфического гистохимического окрашивания подготавливали одновременно. Стекла с зафиксированными формалином и залитыми в парафин гистологическими срезами сначала депарафинизировали в двух сменах Histo-Clear II (64111-04, Electron Microscopy Sciences) в течение 10 мин каждая. Затем стекла переносили в две смены 100 % спирта по 10 мин каждая, а после этого — в 95 %, 70 % и 50 % спирты, по 5 мин в каждом. После этого срезы промывали в воде и промывочном буфере (0,05 % Tween-20 в 1× PBS) на протяжении 10 мин. После этого их помещали в камеру, заполненную буфером, для извлечения антигена (10× R-Buffer A, разбавленный до 1× водой, pH 6, 62706-10, Electron Microscopy Sciences) и подвергали термическому извлечению антигена в системе Unique Retriever (Electron Microscopy Sciences). После извлечения антигена срезы помещали в промывочный буфер и блокировали в течение 1 ч в 10 % нормальной козьей сыворотке на промывочном буфере при комнатной температуре. Затем предметные стекла инкубировали с первичными антителами при 4 °C в течение ночи в следующих разведениях: кроличьи анти-NeuN (1/1000, Abcam, ab177487, GR3275112-10), мышиные анти-GFAP (1/1000, Sigma-Aldrich, G3893). -100UL, 0000082460), анти-Iba1 кролика (1/500, Wako, 019-19741, PTR2404), мышиные антитела к альбумину (1/500, Abcam, 4A1C11, GR3215248-15), мышиные антитела к β-актину (1/500, Abcam, 4A1C11, GR3215248-15), 500, Invitrogen, AC-15, 01003256), кроличьи антитела к процессированной каспазе 3 (1/50, R&D Systems, MAB835, KHK0821021), кроличьи анти-RIPK3 (1:200, Aviva Systems Biology, ARP31513_T100), кроличьи анти-IL-1B (1:200, Thermo Fisher Scientific, ASC0912), кроличьи анти-GPX4 (1:200, Abcam, ab125066), кроличьи антитела к сердечному тропонину I (1:100, Abcam, ab47003), кроличьи антитела к фактору V (1:100, Abcam, ab234849), мышиные антитела к цитокератинам 8+18+19 (1:500, Abcam, ab41825), кроличьи анти-ki-67 (1:200, Abcam, ab15580) и кроличьи анти-TIM1 (1: 200, Abcam, ab78494). На следующий день предметные стекла со срезами отмывали от первичных антител, а затем инкубировали с флуоресцентно мечеными вторичными антителами против кролика (Cell Signaling Technology, 8889S, 12) и против мыши (Abcam, ab150113, GR3370569-1) в разведении 1/500 на 1 ч при комнатной температуре. После окрашивания вторичными антителами предметные стекла промывали и инкубировали в DAPI (1/1000 в течение 5 мин) при комнатной температуре. Наконец, предметные стекла промывали и на них помещали покровные стекла со средой для заключения Prolong Gold Antifade Mountant (P36934, Thermo Fisher Scientific). Набор TSA (Superboost, Thermo Fisher Scientific, B40915). Для усиления сигнала использовали набор TSA (Superboost, Thermo Fisher Scientific, B40915).
Микроскопия и обработка изображений
Изображения срезов тканей были получены с помощью конфокального микроскопа LSM880 (Zeiss), оснащенного моторизованным столиком с объективами 10× (0,3 NA) или 20× (0,8 NA) с одинаковыми настройками для всех экспериментальных условий. Использовались следующие лазеры: аргоновые 458, 488 и 514; диод 405 и ДПСС 561-10. При просмотре контрольных образцов перфузата интенсивность лазера DPSS 561-10 была увеличена, чтобы оценить внутрисосудистую флуоресценцию гемоглобина для получения фонового сигнала, который был бы сопоставим с другими группами. Изображения были получены с разрешением 1024 × 1024 или 2048 × 2048 пикселей. Они представляют собой репрезентативные конфокальные мозаичные сканы, проекции z-стеков с максимальной интенсивностью с большим увеличением (стеки примерно 7–9 мкм; ~ 1 мкм на z-шаг) или конфокальные изображения с большим увеличением. При этом гистологические изображения были получены с помощью Aperio CS2 Pathology Slide Scanner (Leica), как описано выше. Настройки изображения в Zeiss Zen применялись одинаково ко всем экспериментальным условиям. Оцифрованные изображения были собраны в Zeiss Zen, ImageScope и Adobe Illustrator.
Анализ гистологических данных и количественная оценка
Оценка повреждений при окрашивании Г/Э. Все окрашенные Г/Э срезы были отсканированы. Из каждого среза и из соответствующих областей были случайным образом выбраны четыре изображения. Наблюдатели оценивали каждое изображение слепым методом. Критериями для сердца были повреждение ядер, вакуолизация кардиомиоцитов, увеличение промежутков между миофибриллами и набухание. Критериями для легких были повреждение ядер, вакуолизация пневмоцитов и кровоизлияние. Критериями для почек были повреждение ядер, вакуолизация канальцев, кровоизлияние и повреждение канальцев. Критериями для печени были повреждение ядер, вакуолизация тканей, вакуолизация гепатоцитов и гиперемия. Критериями для поджелудочной железы были повреждение ядер, вакуолизация клеток, кровоизлияние и набухание.
Оценка повреждений при окрашивании крезиловым фиолетовым (по Нисслю). Было получено два изображения для каждой интересующей области (область CA1 гиппокампа или ПФК); они оценивались слепым методом с использованием функции счетчика клеток в ImageJ в соответствии с ранее установленными критериями [3].
Оценка повреждений по результатам проведения ШИК-реакции. Все срезы, окрашенные методом ШИК, слепым методом проанализировал нефропатолог. Баллы (0–3) присваивались в зависимости от тяжести повреждения, которое включало: расширение пространства Боумена, расширение канальцев, вакуолизацию канальцев, нарушение щеточной каемки и присутствие цилиндров.
Иммунофлуоресцентный анализ клеток головного мозга и их количественная оценка. Все изображения были с помощью ImageJ нормализованы по интересующим областям (гиппокамп CA1, CA3 и DG) и рандомизированы. Количество меченых астроцитов (клетки GFAP+) и микроглии (клетки IBA1+) определяли вручную слепым методом с помощью плагина счетчика клеток и усредняли на основе полученного отношения площади к числу клеток. Гранулометрический анализ астроцитов был выполнен с помощью пользовательского конвейера в программном обеспечении с открытым исходным кодом CellProfiler [67], в котором был установлен единый порог на GFAP для определения объектов цитоскелета GFAP+. Затем количество фрагментов GFAP+ в каждой области автоматически подсчитывали и усредняли в соответствии с количеством астроцитов. Средняя интенсивность NeuN на нейрон количественно определялась с помощью пользовательского конвейера, в котором нейроны определялись на основе сегментированных объектов, окрашенных DAPI и экспрессирующих NeuN. Данные были проанализированы и нанесены на график в GraphPad Prism9. Все данные представлены как среднее значение ± стандартная ошибка среднего. Значения n относятся к числу биологических повторов.
Иммунофлуоресцентный анализ почек, печени и сердца. В почках случайным образом были получены три изображения коркового вещества. Все изображения были рандомизированы и проанализированы слепым методом. Клубочки и проксимальные извитые канальцы были выбраны вручную в качестве областей интереса в четырех кругах одинакового размера в соответствующих зонах на изображениях. Средняя интенсивность мечения ACTB и TIM1 была рассчитана с использованием ImageJ. Количество клеток Ki-67+ подсчитывали вручную.
В печени количественное определение иммунноокрашивания было выполнено таким же образом для альбумина и фактора V. Из одной и той же области печени были случайным образом взяты три изображения. Средняя интенсивность альбумина и фактора V автоматически определялась количественно с помощью ImageJ по всему предметному стеклу.
В сердце были случайным образом получены три изображения из левого желудочка чуть ниже эпикарда. Все изображения были рандомизированы, после чего слепым методом ткань сердечной мышцы была выбрана в качестве области интереса. Затем с помощью функции средней интенсивности в ImageJ количественно определяли содержание цитоплазматического тропонина I.
Количественная оценка и анализ типов клеточной гибели (актCASP3, IL-1B, RIPK3 и GPX4). Для почек, печени, сердца и поджелудочной железы было случайным образом получено по три изображения с каждого среза и из соответствующих областей каждого органа. Интенсивность мечения клеток антителами к aктCASP3+ определяли вручную слепым методом с помощью ImageJ. Среднюю интенсивность иммуномаркировки IL-1B, RIPK3 и GPX4 в почках, печени и сердце количественно определяли в программе ImageJ с функциями вычитания фона и измерения. В головном мозге количество клеток актCASP3+ и RIPK3+ подсчитывали вручную в области CA1 гиппокампа и префронтальной коре. Экспрессию IL-1B и GPX4 в CA1 гиппокампа измеряли в клетках, которые были отобраны вручную в зернистом слое с использованием функции измерения в программе ImageJ.
Количественная оценка и анализ при окрашивании методом TUNEL. Все изображения были сделаны с использованием светлопольного микроскопа, после чего получены случайные снимки слайдов одинакового размера. Рандомизированные изображения проанализировали слепым методом с помощью программы Fiji для разделения каналов окрашивания ядер (гематоксилином) и фрагментов ДНК (DAB). Общее содержание фрагментов ДНК количественно определяли на основе общей интенсивности DAB с использованием CellProfiler [67].
Функциональная оценка органов
Измерения сократимости сердца. Небольшой кусочек апикальной части левого желудочка сердца вырезали и помещали в карбонизированный раствор Тироде (140 мМ NaCl, 6 мМ KCl, 10 мМ глюкозы, 10 мМ HEPES, 1 мМ MgCl2, 1,8 мМ CaCl2, pH 7,4). Затем ткань разрезали на кубики объемом 1–2 см3 и помещали на держатель эпикардом вниз, чтобы направление среза совпадало с ориентацией сердечных миофибрилл. С помощью вибратома при 4 °C приготавливали срезы сердца толщиной 150 мкм. После получения срезов спонтанная частота и ритм сердечных сокращений были охарактеризованы и зарегистрированы с помощью микроскопа для срезов с температурным контролем, установленным на 37 °C (Scientifica SliceScope). Частоту биений определяли количественно в течение 30 с.
Оценка содержания глюкозы. По окончании перфузии из каждого органа (почки, сердца и коры головного мозга) с помощью 3 мм биопсийного перфоратора (Miltex, Integra) были получены два идентичных образца ткани длиной 5 мм и помещены в холодный раствор PBS (свежий) и раствор ПФА (фиксация на ночь), соответственно. Свежие ткани и фиксированные контроли инкубировали в рабочем растворе 2-NBDG (Cayman, 11046, 100 мкМ) в течение 30 мин при 37 °C с последующей 15-минутной промывкой в PBS. Сразу же с помощью широкопольного микроскопа (Zeiss) под объективом ×2,5 (поглощение: 465–495 нм, испускание: 520–560 нм) со временем экспозиции 295 мс (почки и сердце) и 50 мс (кора головного мозга) были получены изображения. Они далее были проанализированы в программе ImageJ для количественной оценки средней интенсивности области интереса с нормализацией на основе фиксированных контролей.
Органотипическая культура гиппокампа и оценка текущего синтеза белка. Гиппокамп выделяли в конце соответствующего экспериментального протокола и делали срезы с помощью вибратома толщиной 250 мкм в карбонизированном растворе NMDG-HEPES aCSF (92 мМ NMDG, 2,5 мМ KCl, 1,25 мМ NaH2PO4, 30 мМ NaHCO3, 20 мМ HEPES, 25 мМ глюкозы, 2 мМ тиомочевины, 5 мМ аскорбата натрия, 3 мМ пирувата натрия, 0,5 мМ CaCl2·2H2O и 10 мМ MgSO4·7H2O, pH 7,3). Затем срезы гиппокампа собирали и переносили на культуральные мембраны (культуральная вставка Falcon, 0,4 мкм) и культивировали в шестилуночной культуральной чашке с 1,5 мл среды (48 % DMEM/F-12 (Gibco), 48 % Neurobasal (Gibco), 1×N-2 (Gibco), 1×B-27 (Gibco), 1×Glutamax (Gibco), 1×NEAA (Gibco), 1×пенициллин-стрептомицин (Gibco)). Планшеты выдерживали в инкубаторе при 37 °C с 5 % CO2 до 2 недель. Аналог аминокислоты метионина — азидогомоаланин (Thermo Fisher Scientific) — добавляли к срезу гиппокампа в конечной концентрации 50 мкМ в HEPES-буферном растворе (HBS) с последующей инкубацией в течение 6 ч при 37 °C. Срезы промывали PBS и немедленно фиксировали в 4 % параформальдегиде при 4°C на ночь. Детекцию текущего синтеза белка проводили с использованием модифицированного набора Click-iT l-azidohomoalanine Alexa Fluor 488 Protein Synthesis HCS Assay (Thermo Fisher Scientific). Для одновременной визуализации нейронов срезы затем блокировали 5 % NDS на 1 ч при комнатной температуре и инкубировали с кроличьими антителами против NeuN (abcam, 1:1000) в течение ночи при 4 °C с последующей инкубацией с антителами против кролика AlexaFluor 647 (1:500) в течение 1 ч при комнатной температуре. Затем срезы докрашивали DAPI для визуализации ядер. Изображения были получены с использованием конфокального микроскопа Zeiss LSM800 с объективом ×20. Комбинированные изображения z-стеков каналов DAPI, AlexaFluor 488 и AlexaFluor 647 были получены с оптической толщиной среза около 20 мкм; показаны изображения с максимальной проекцией. Белки, обнаруженные вокруг ядра (перинуклеарные), являются наиболее распространенными вновь синтезированными белками в клетках [27]; их количественно определяли с применением функции измерения интенсивности в программе ImageJ.
Визуализация изображений
Изображение свиньи на рис. 1а и головы свиньи на рис. 6а с расширенными данными были адаптированы из BioRender с постобработкой в Adobe Illus-trator и Adobe Photoshop.
Статистический анализ и воспроизводимость
Все данные представлены как среднее значение ± стандартная ошибка среднего. При этом анализ данных проводился с помощью однофакторного дисперсионного анализа (ANOVA) с апостериорной корректировкой множественных сравнений Даннетта по отношению к группе перфузии OrganEx или непарных t-тестов для сравнений между двумя группами. Для сравнения появления комплексов QRS в группах OrganEx и EКMO во время протокола перфузии применяли точный тест Фишера. Подробная информация о количестве повторов в каждой экспериментальной группе вместе с соответствующей статистической обработкой показаны ниже. Значимость была установлена на уровне P < 0,05. Весь статистический анализ и построение графиков выполняли в GraphPad 9 (GraphPad) или Python. Все рисунки были созданы с помощью Adobe Illustrator (Adobe Systems).
Дальнейшая информация. Из-за нехватки места в подписях к рисункам ниже приводится дополнительная информация о статистических значениях и воспроизводимости результатов.
На рис. 2c–e показаны результаты на исходном уровне (где это применимо) и далее через каждый час на протяжении всего эксперимента по перфузии в группах ЭКМО и OrganEx. Каждая группа состояла из n = 6 биологических повторностей. На рис. 2c приведен общий поток: значения P для часов 1–6, 1 ч: < 0,0001, 2 ч: < 0,0001, 3 ч: < 0,0001, 4 ч: < 0,0001, 5 ч: < 0,0001, 6 ч: < 0,0001; значения t для часов 1–6, 1 ч: 12,34, 2 ч: 8,120, 3 ч: 8,869, 4 ч: 9,683, 5 ч: 17,64, 6 ч: 22,96. Давление в плечевой артерии: значения P для часов 0–6, 0 ч: 0,9704, 1 ч: < 0,0001, 2 ч: 0,0002, 3 ч: 0,0003, 4 ч: 0,0006, 5 ч: 0,0027, 6 ч: < 0,0001; значения t для часов 0–6, 0 ч: 0,03807, 1 ч: 12,24, 2 ч: 5,645, 3 ч: 5,480, 4 ч: 4,890, 5 ч: 3,953, 6 ч: 7,590. На рис. 2d насыщение O2 смешанной венозной крови: значения P для часов 0–6, 0 ч: 0,8996, 1 ч: 0,0837, 2 ч: 0,0002, 3 ч: 0,0003, 4 ч: 0,0015, 5 ч: < 0,0001, 6 ч: 0,0036; значения t для часов 1–6, 0 ч: 0,1295, 1 ч: 1,920, 2 ч: 5,582, 3 ч: 5,453, 4 ч: 4,338, 5 ч: 7,691, 6 ч: 3,781. На рис. 2e сывороточные значения K+: P для часов 0–6, 0 ч: 0,8365, 1 ч: 0,0001, 2 ч: 0,0008, 3 ч: < 0,0001, 4 ч: < 0,0001, 5 ч: < 0,0001, 6 ч: < 0,0001; значения t для часов 0–6, 0 ч: 0,2118, 1 ч: 6,156, 2 ч: 4,707, 3 ч: 7,224, 4 ч: 12,24, 5 ч: 7,401, 6 ч: 9,358. pH сыворотки: значения P для часов 0–6, 0 ч: 0,3489, 1 ч: < 0,0001, 2 ч: < 0,0001, 3 ч: < 0,0001, 4 ч: < 0,0001, 5 ч: < 0,0001, 6 ч: < 0,0001; значения t для часов 0–6, 0 ч: 0,9827, 1 ч: 6,285, 2 ч: 9,256, 3 ч: 9,668, 4 ч: 8,427, 5 ч:7,056, 6 ч: 7,034.
На рис. 3b–d точки данных взяты из образцов мозга, репрезентативных для данных условий; эксперимент был повторен в n = 3 таких независимых образцах. На рис. 3b был выполнен однофакторный дисперсионный анализ (P = 0,0001, F4,10 = 19,12) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,009; OrganEx по сравнению с ЭКМО: P = 0,003. На рис. 3c был выполнен однофакторный дисперсионный анализ (P = 0,0098, F4,10 = 6,035) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,0059; OrganEx по сравнению с ЭКМО: P = 0,0356. На рис. 3d был выполнен однофакторный дисперсионный анализ (P = 0,0076, F4,10 = 6,495) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0109.
На рис. 3f–h точки данных взяты из образцов органов (сердца, печени и почек), репрезентативных для данных условий; эксперимент был повторен в n = 5 таких независимых образцах. На рис. 3f был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 52,16) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0429; OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 3g был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 50,79) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,006; OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P = 0,0009. На рис. 3g был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 50,79) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,006; OrganEx по сравнению с 7 ч ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P = 0,0009; на рис. 3h был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 17,79) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0001; OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P = 0,0022.
На рис. 3j,k точки данных взяты из образцов почки, репрезентативных для данных условий; эксперимент был повторен в n = 3 таких независимых образцах. На рис. 3j был выполнен однофакторный дисперсионный анализ (P = 0,0262, F4,10 = 4,398) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0103. На рис.3k был выполнен однофакторный ANOVA (P = 0,0057, F4,10 = 7,082) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0023.
На рис. 4a–c точки данных относятся к репрезентативному органу (мозгу, сердцу и почке) для каждого условия, эксперимент был повторен для n = 3 независимых органов для каждого условия. На рис. 4а был выполнен однофакторный дисперсионный анализ (P = 0,003, F2,6 = 17,73) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0024. На рис. 4b был выполнен односторонний ANOVA (P = 0,0033, F2,6 = 17,07) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0033. На рис. 4c был выполнен однофакторный ANOVA (P = 0,0033, F2,6 = 6,453) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0320.
На рис. 4d все точки данных взяты из репрезентативного эксперимента по перфузии для каждого состояния, эксперимент повторяли n = 5 раз. Был использован двусторонний точный t-критерий Фишера: P = 0,0476.
На рис. 4g каждая точка данных относится к репрезентативной печени для каждого состояния, условие повторялось n = 3 раза. Был выполнен односторонний ANOVA (P < 0,0001, F4,10 = 15,52) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0002; OrganEx по сравнению с 7 ч ПТИ: P = 0,0005; OrganEx по сравнению с ЭКМО: P = 0,0007.
На рис. 4i,k каждая точка данных относится к репрезентативному срезу гиппокампа для каждого условия, эксперимент повторяли n = 3–5 раз для каждого условия. На рис. 4i для дня 1: был выполнен однофакторный дисперсионный анализ (P = 0,0352, F2,10 = 4,766) с апостериорной поправкой Даннетта; на 14-й день: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0027, F2,10 = 11,35) с апостериорной поправкой Даннетта, тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0026. На рис. 4k, для дня 1: был выполнен односторонний ANOVA (P = 0,0077, F2,10 = 8,246) с апостериорной корректировкой Даннетта, тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0216; на 14-й день: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0270, F2,9 = 5,544) с апостериорной поправкой Даннетта, тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,027.
На рис. 1c, d «Расширенных данных» каждая точка взята из репрезентативного эксперимента по перфузии для каждого условия, эксперимент повторяли n = 6 раз. На рис. 1c «Расширенных данных», артериальное давление в канюле: значения P для часов 1–6, 1 ч: < 0,0001, 2 ч: < 0,0001, 3 ч: < 0,0001, 4 ч: < 0,0001, 5 ч: < 0,0001, 6 ч: < 0,0001; значения t для часов 1–6, 1 ч: 12,34, 2 ч: 8,120, 3 ч: 8,869, 4 ч: 9,683, 5 ч: 17,64, 6 ч: 22,96. На рис. 1c «Расширенных данных» давление в венозной канюле: значения P для часов 1–6, 1 ч: < 0,0001, 2 ч: 0,0306, 3 ч: 0,0237, 4 ч: 0,0003, 5 ч: 0,0069, 6 ч: 0,0027; значения t для часов 1–6, 1 ч: 9,058, 2 ч: 2,516, 3 ч: 2,665, 4 ч: 5,516, 5 ч: 3,386, 6 ч: 3,946. На рис. 1d «Расширенных данных» доставка O2: значения P для часов 1–6, 1 ч: < 0,0001, 2 ч: < 0,0001, 3 ч: < 0,0001, 4 ч: < 0,0001, 5 ч: < 0,0001, 6 ч : < 0,0001; значения t для часов 1–6, 1 ч: 10,44, 2 ч: 6,957, 3 ч: 8,578, 4 ч: 9,462, 5 ч: 14,32, 6 ч: 18,56. На рис. 1d «Расширенных данных» потребление O2: значения P для часов 1–6, 1 ч: 0,8432, 2 ч: 0,1815, 3 ч: 0,3195, 4 ч: 0,3667, 5 ч: 0,2152, 6 ч: 0,0394; значения t для часов 1–6, 1 ч: 0,2030, 2 ч: 1,436, 3 ч: 1,048, 4 ч: 0,9455, 5 ч: 1,323, 6 ч: 2,368.
На рис. 2b–e «Расширенных данных» точки взяты из репрезентативного мозга для каждого условия, эксперимент был повторен в n = 3 независимых мозгах для каждого условия. На рис. 2b «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0008, F4,10 = 11,95) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0097; на рис. 2c «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0003, F4,10 = 14,64) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0006. На рис. 2d «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,001, F4,10 = 44,47) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P < 0,001; OrganEx по сравнению с ЭКМО: P < 0,001. На рис. 2e «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,001, F4,10 = 60,70) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 0 ч ПТИ: P = 0,0024; OrganEx по сравнению с 1 ч ПТИ: P < 0,001; OrganEx по сравнению с 7 ч ПТИ: P < 0,001; OrganEx по сравнению с ЭКМО: P = 0,0159.
На рис. 2g–l «Расширенных данных» точки взяты из репрезентативного мозга для каждого условия, эксперимент был повторен в n = 3 независимых мозгах для каждого условия. На рис. 2g «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,011, F4,10 = 5,819) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0287; OrganEx по сравнению с 7 ч ПТИ: P = 0,0045; OrganEx по сравнению с ЭКМО: P = 0,0149. На рис. 2i «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0003, F4,10 = 32,20) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 0 ч ПТИ: P = 0,0243; OrganEx по сравнению с 7 ч ПТИ: P = 0,0157; OrganEx по сравнению с ЭКМО: P = 0,0001. На рис. 2j «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0231, F4,10 = 4,590) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,0137. На рис. 2k «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0002, F4,10 = 17,45) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,09338; OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P = 0,0157. На рис. 2l «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0032, F4,10 = 8,285) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0198.
На рис. 3b, c, e «Расширенных данных» точки данных относятся к репрезентативному органу (легкому, поджелудочной железе, почке) для каждого условия, эксперимент был повторен в n = 5 независимых органов для каждого условия. На рис. 3b «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 45,78) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 3c «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 19,80) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0009; OrganEx по сравнению с 7 ч ПТИ: P < 0,0001; OrganEx по сравнению с ЭКМО: P = 0,0009. На рис. 3e «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,001, F4,20 = 1,915) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0410.
На рис. 3g–j «Расширенных данных» точки данных взяты из репрезентативной почки для каждого условия, эксперимент был повторен в n = 3 независимых почках для каждого условия. На рис. 3g «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,01, F4,10 = 7,983) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,0159; OrganEx по сравнению с ЭКМО: P = 0,0118. На рис. 3i «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,01, F4,10 = 8,286) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,0092; OrganEx по сравнению с ЭКМО: P = 0,0084. На рис. 3j «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,01, F4,10 = 11,12) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,002; OrganEx по сравнению с ЭКМО: P = 0,0022.
На рис. 4b–e «Расширенных данных» точки относятся к репрезентативному органу (сердцу, печени, почке и поджелудочной железе) для каждого условия, эксперимент был повторен для n = 3 независимых органов для каждого условия. На рис. 4b «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,10 = 22,48) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,0018; OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 4c «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0020, F4,10 = 9,392) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 1 ч ПТИ: P = 0,004; OrganEx по сравнению с ЭКМО: P = 0,001. На рис. 4d «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,10 = 23,50) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 1 ч ПТИ: P = 0,0022; OrganEx по сравнению с 7 ч ПТИ: P = 0,0002; OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 4e «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0008, F4,10 = 12,10) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0008.
На рис. 4g–j «Расширенных данных» точки относятся к репрезентативному органу (сердцу, печени, почке и поджелудочной железе) для каждого условия, эксперимент был повторен для n = 5 независимых органов для каждого условия. На рис. 4g «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 14,35) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 4h «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,20 = 13,26) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P < 0,0001. На рис. 4i «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0002, F4,20 = 9,110) с апостериорной поправкой Даннетта; тест множественных сравнений Даннета показал: OrganEx по сравнению с ЭКМО: P = 0,0012. На рис. 4j «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0387, F4,20 = 3,102) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0216.
На рис. 4l, m «Расширенных данных» каждая точка данных относится к репрезентативному мозгу для каждого условия, эксперимент был повторен в n = 3 независимых мозгах для каждого условия. На рис. 4l «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,10 = 37,55) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 0 ч ПТИ: P = 0,0083; OrganEx по сравнению с 1 ч ПТИ: P = 0,0002; OrganEx по сравнению с 7 ч ПТИ: P = 0,016. На рис. 4m «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,10 = 66,81) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 0 ч ПТИ: P = 0,0001; OrganEx по сравнению с 1 ч ПТИ: P < 0,0001.
На рис. 4o, p «Расширенных данных» каждая точка относится к репрезентативному мозгу для каждого условия, эксперимент был повторен в n = 5 независимых мозгах для каждого условия. На рис. 4o «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0547, F4,20 = 2,784) с апостериорной поправкой Даннетта. На рис. 4p «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,1005, F4,20 = 2,244) с апостериорной поправкой Даннетта.
На рис. 5 «Расширенных данных» каждая точка относится к репрезентативному образцу мозга для каждого условия, эксперимент повторялся n = 3 раза для каждого условия. На рис. 5b «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0013, F4,10 = 10,52) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,002; OrganEx по сравнению с ЭКМО: P = 0,0418. На рис. 5c «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0002, F4,10 = 17,06) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0386; OrganEx по сравнению с 7 ч ПТИ: P = 0,0302. На рис. 5d «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P < 0,0001, F4,10 = 23,67) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0001. На рис. 5e «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0003, F4,10 = 14,74) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0006. На рис. 5g «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0264, F4,10 = 4,389) с апостериорной корректировкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,0301; OrganEx по сравнению с ЭКМО: P = 0,0270. На рис. 5h «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0082, F4,10 = 6,365) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0082; OrganEx по сравнению с 7 ч ПТИ: P = 0,005; OrganEx по сравнению с ЭКМО: P = 0,0124. На рис. 5i с расширенными данными был выполнен однофакторный дисперсионный анализ (P = 0,0012, F4,10 = 10,81) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,001; OrganEx по сравнению с ЭКМО: P = 0,0012. На рис. 5j «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0001, F4,10 = 18,96) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,0048; OrganEx по сравнению с ЭКМО: P = 0,0049. На рис. 5l «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0264, F4,10 = 7,430) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0437; OrganEx по сравнению с 7 ч ПТИ: P = 0,0437; OrganEx по сравнению с ЭКМО: P = 0,0437. На рис. 5m «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0082, F4,10 = 6,365) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0082; OrganEx по сравнению с 7 ч ПТИ: P = 0,005; OrganEx по сравнению с ЭКМО: P = 0,0124. На рис. 5n «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0002, F4,10 = 16,23) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с 7 ч ПТИ: P = 0,0013; OrganEx по сравнению с ЭКМО: P = 0,044. На рис. 5o «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0024, F4,10 = 9,035) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 1 ч ПТИ: P = 0,0019; OrganEx по сравнению с 7 ч ПТИ: P = 0,0062; OrganEx по сравнению с ЭКМО: P = 0,0034.
На рис. 6j,k «Расширенных данных» каждая точка взята из репрезентативного среза гиппокампа для каждого условия, эксперимент повторялся n = 3–5 раз для каждого условия. На рис. 6j «Расширенных данных» для дня 1: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0078, F2,9 = 8,749) с апостериорной поправкой Даннета, тест множественных сравнений Даннетта дал результаты OrganEx по сравнению с ЭКМО: P = 0,0245 ;на 7-й день: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0126, F2,10 = 6,995) с апостериорной корректировкой Даннетта, тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0086; на 14-й день: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,005, F2,9 = 10,12) с апостериорной поправкой Даннетта, тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,0037. На рис. 6k «Расширенных данных» для дня 1: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0406, F2,9 = 4,670) с апостериорной корректировкой Даннетта, тест множественных сравнений Даннетта дал результаты OrganEx по сравнению с ЭКМО: P = 0,0375; на 7-й день: был выполнен однофакторный дисперсионный анализ ANOVA (P = 0,0278, F2,9 = 5,476) с апостериорной поправкой Даннетта, тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с ЭКМО: P = 0,0406; на 14-й день: был проведен непарный двусторонний t-критерий: P = 0,8691, t = 0,1735.
На рис. 6m,o «Расширенных данных» точки относятся к репрезентативным органам (сердцу, печени) для каждого условия, эксперимент был повторен для n = 3 независимых органов для каждого условия. На рис. 6m «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0207, F4,10 = 4,760) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта показал: OrganEx по сравнению с ЭКМО: P = 0,00434. На рис. 6o «Расширенных данных» был выполнен однофакторный дисперсионный анализ (P = 0,0063, F4,10 = 6,863) с апостериорной поправкой Даннетта; тест множественных сравнений Даннетта дал следующие результаты: OrganEx по сравнению с 7 ч ПТИ: P = 0,0064; OrganEx по сравнению с ЭКМО: P = 0,0163.
Сводка отчетов
Дополнительную информацию о дизайне исследования можно найти в кратком отчете Nature Research, привязанном к этой статье.
Доступность данных
Набор данных по snRNA-seq внесен в NCBI’s Gene Expression Omnibus [68] и доступен через GEO Series, номер доступа GSE183448.
Доступность кода
Исходный код, который применялся для анализа данных, представленных в этой статье, внесен в GitHub (https://github.com/sestanlab/OrganEx) и общедоступен.
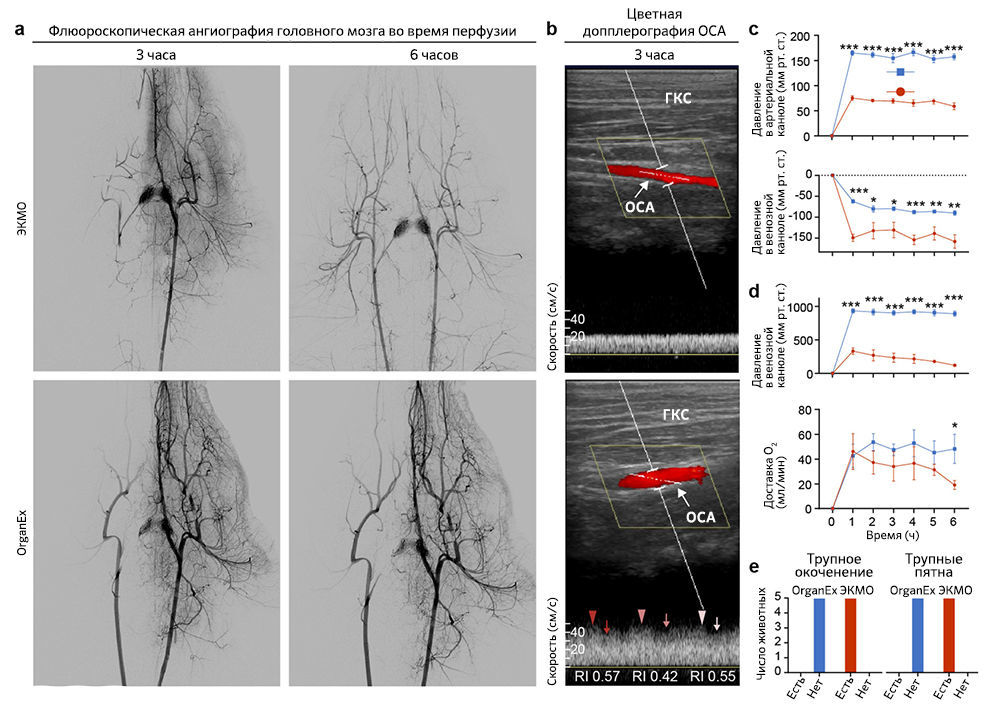
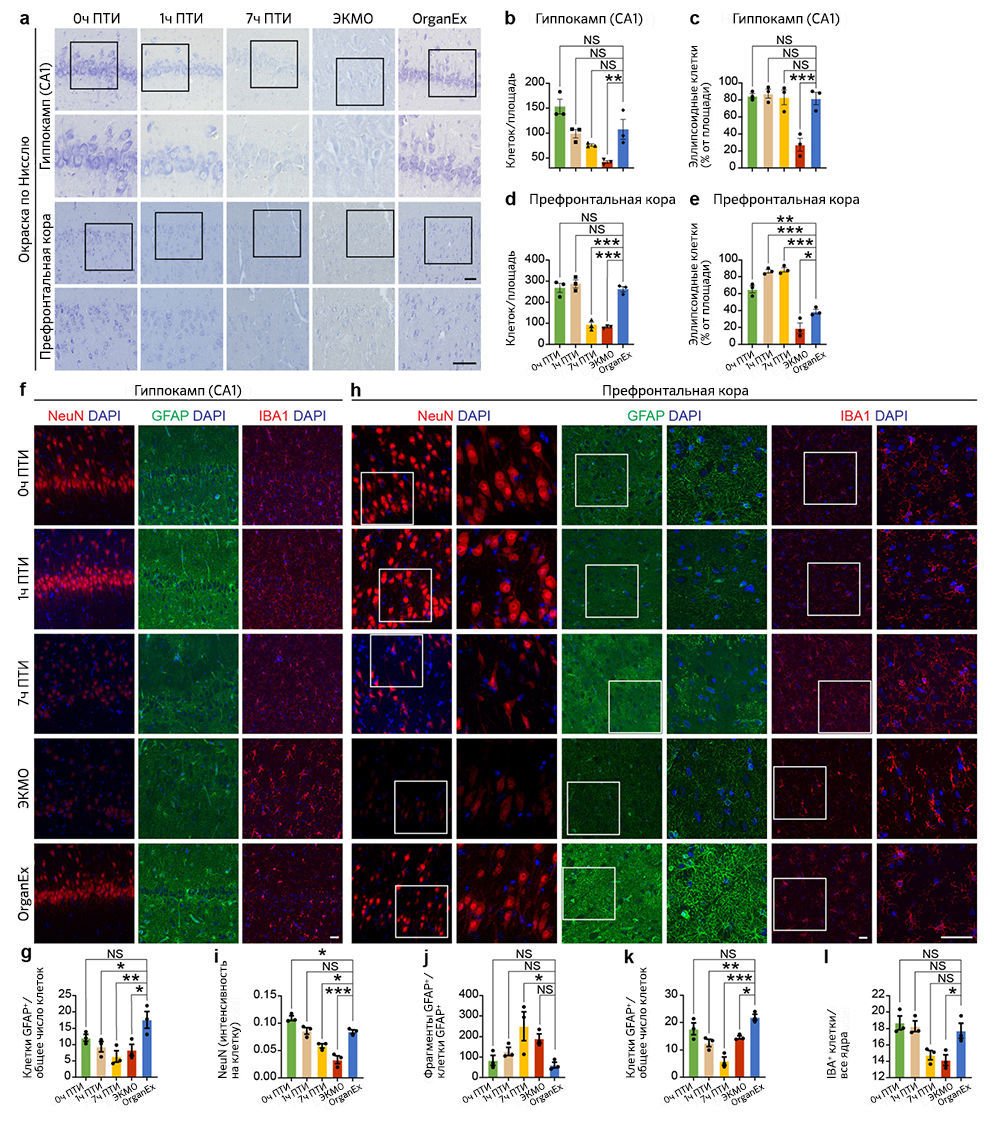
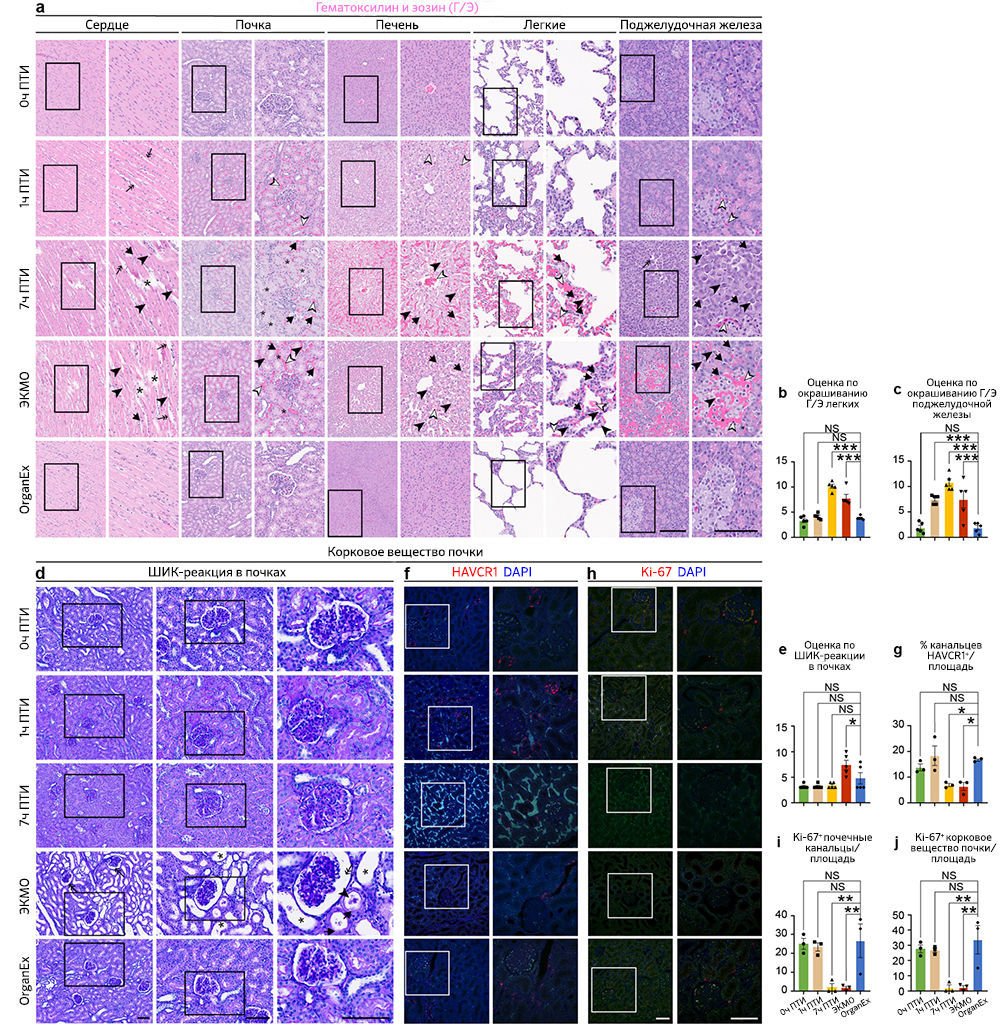
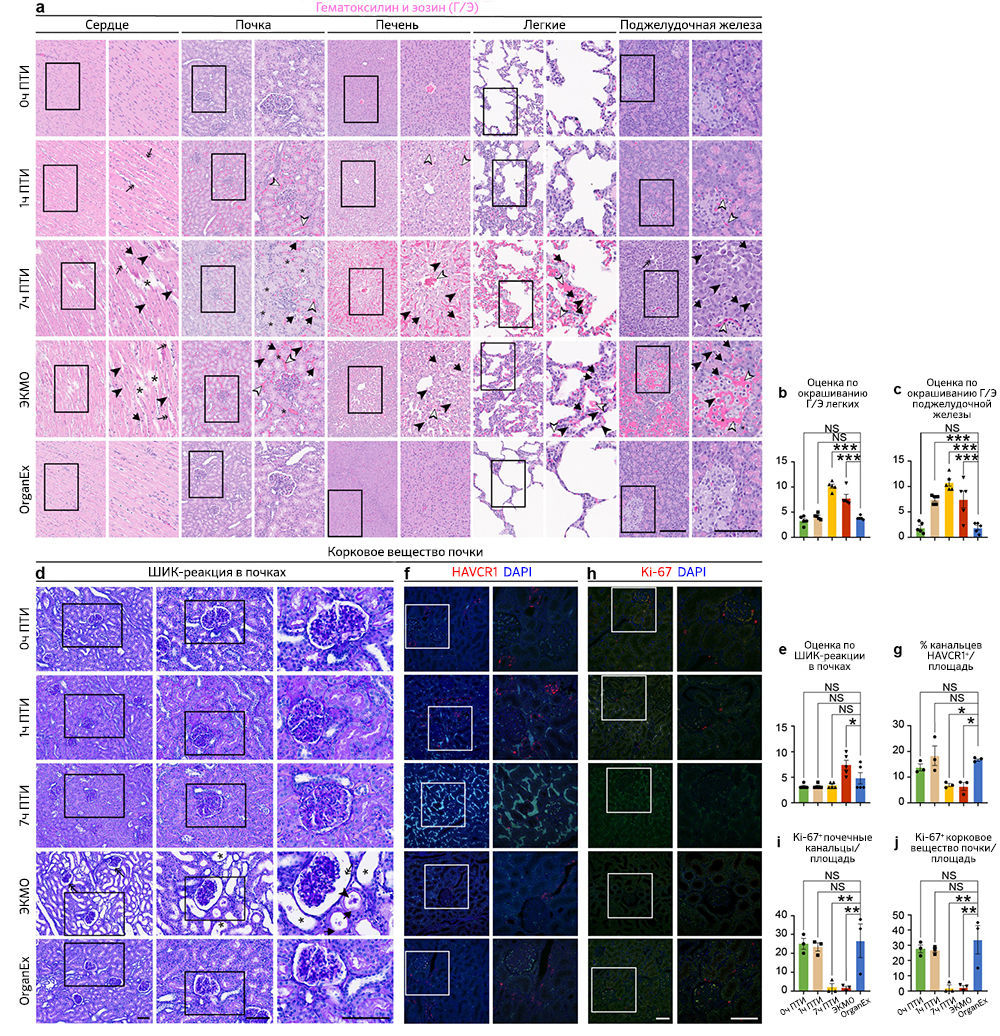
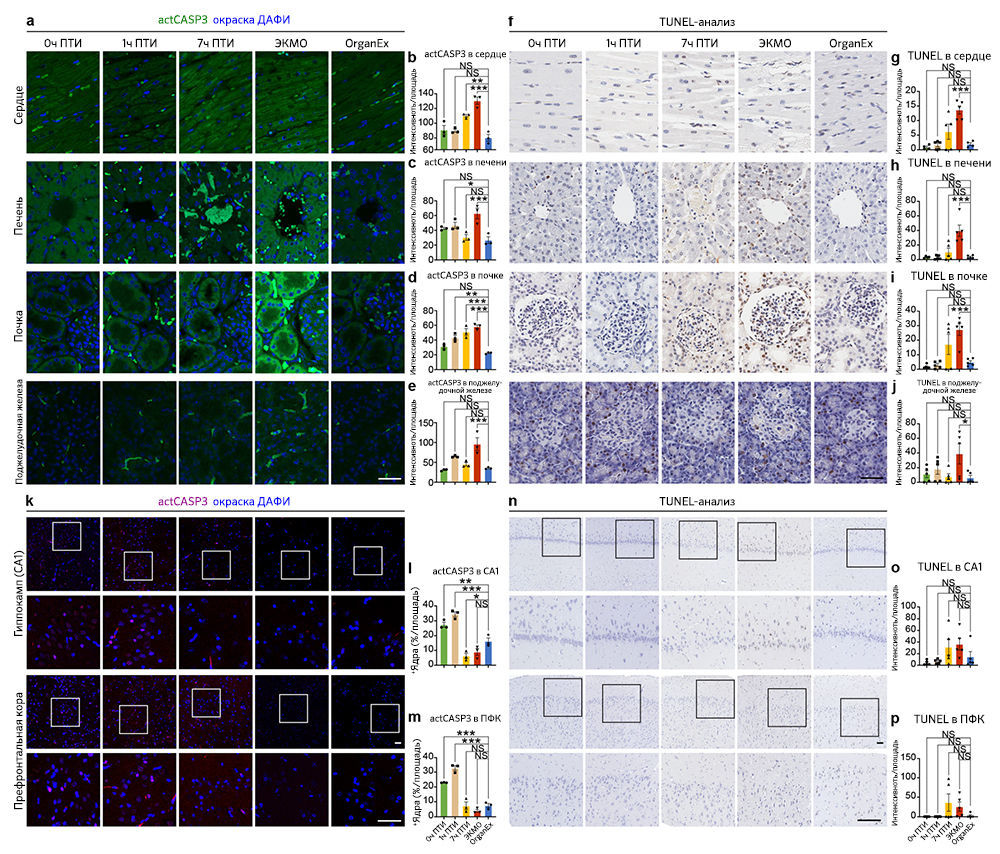
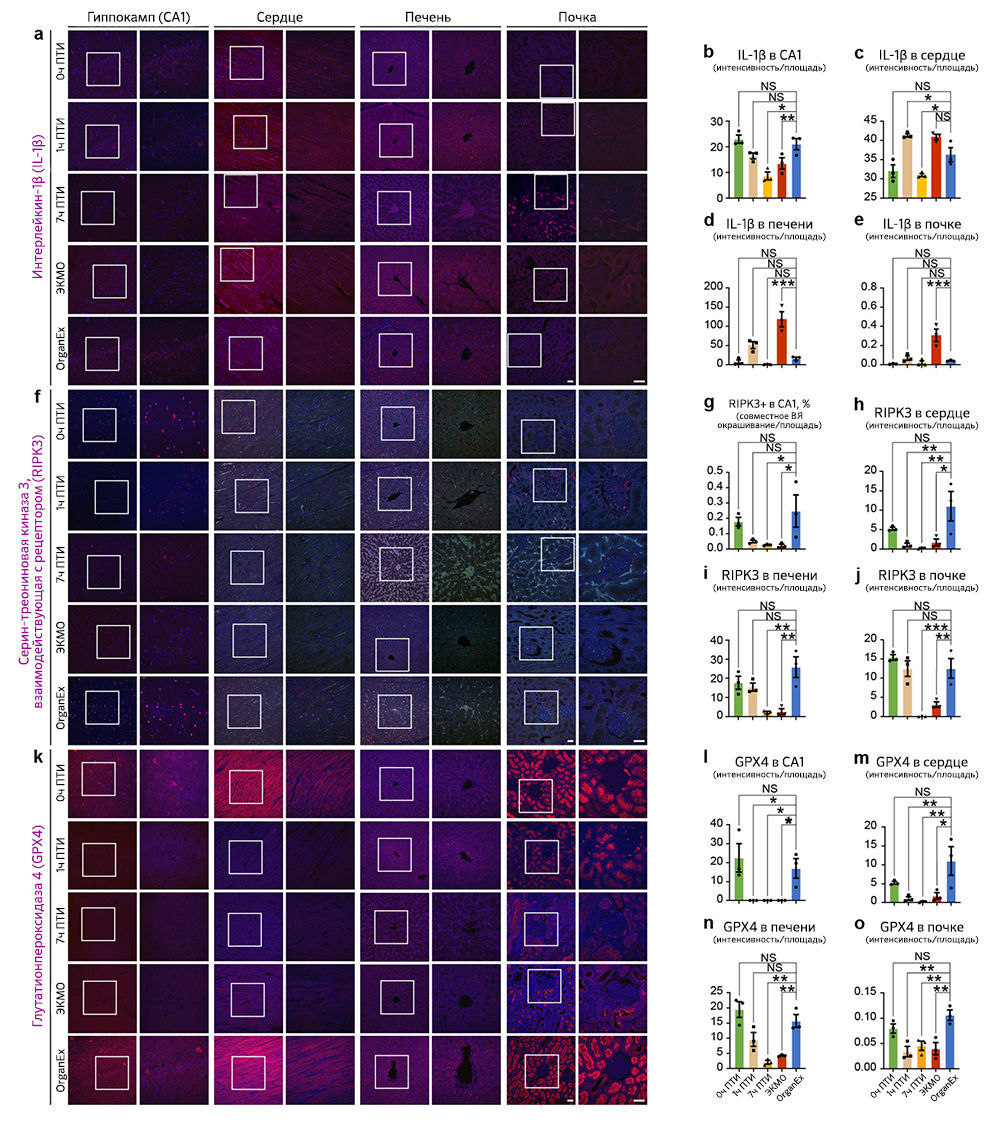
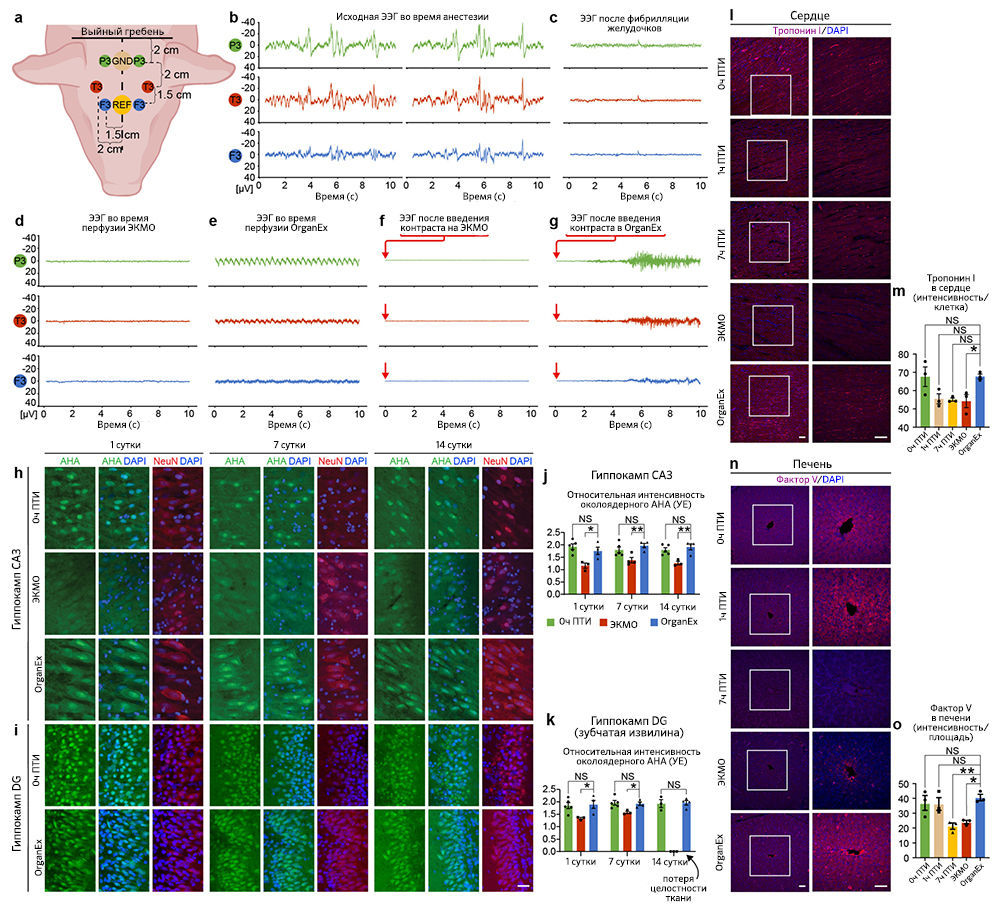
а. Гистограмма, показывающая количество клеток/ядер в органах и биологических повторах. б. Скрипичная диаграмма распределения количества уникальных молекулярных идентификаторов — UMI (верхняя панель) и генов (нижняя панель), обнаруженных во всех биологических повторностях. c–f. Соответствующие анализы snRNA-seq в гиппокампе (c), сердце (d), печени (e) и почках (f). В левом верхнем углу показана подробная схема UMAP, показывающая все t-типы в соответствующих органах. Справа показана экспрессия ключевых маркеров t-типа. В левом нижнем углу показана транскриптомная корреляция между таксономией t-типа, определенной в этом исследовании, и таксономией предыдущих наборов данных человека и мыши [51–54]. к. — клетки; ЭВСП — эндотелиальные клетки венозных синусов печени; энд. — эндотелий; прш. — клетка-предшественник; перит. — перитубулярный; ВКПГ — восходящее колено петли Генле; денд. — дендритный; CТ — собирательные трубочки.
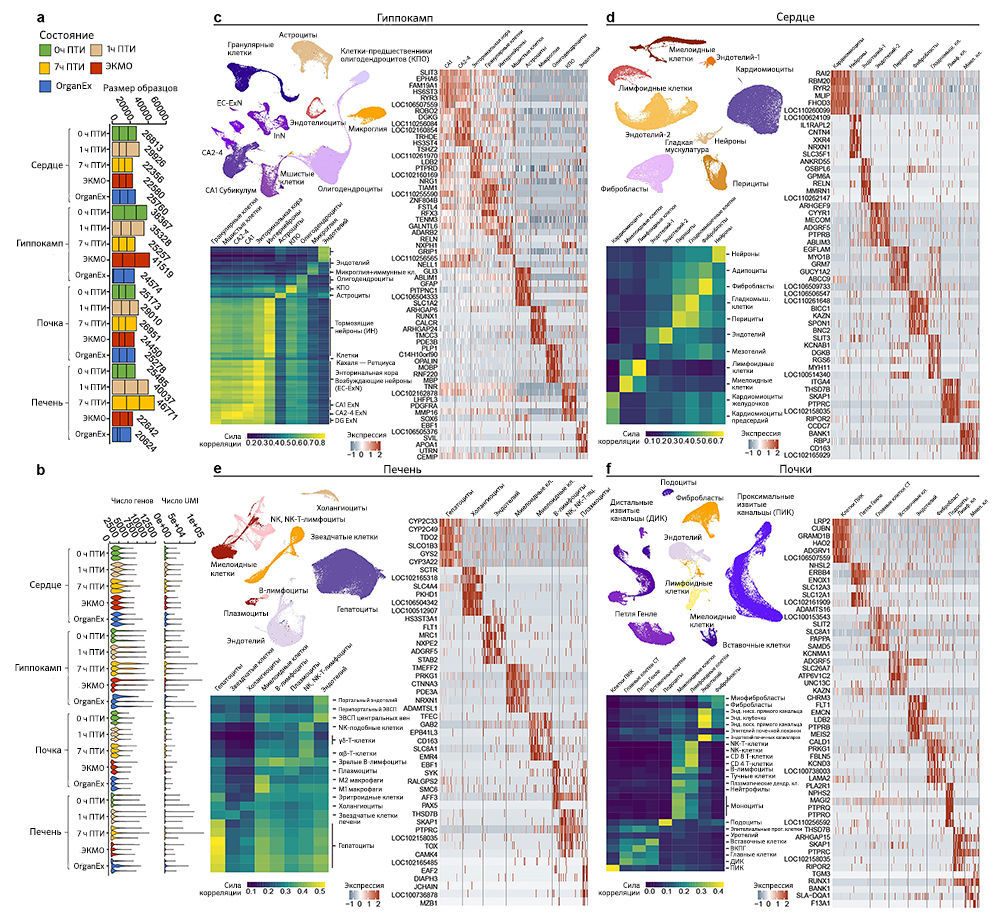
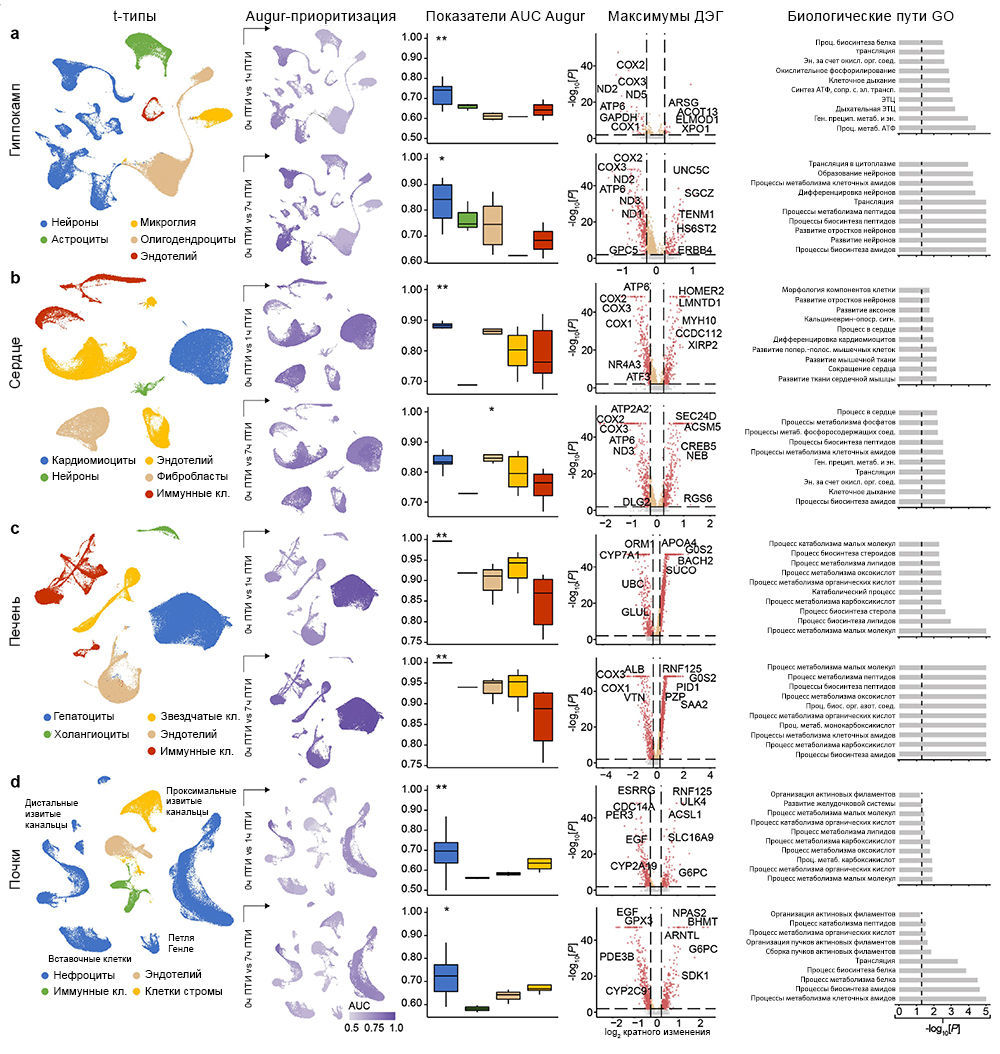
*P < 0,05, **P < 0,01, ***P < 0,001, НЗ: не значимо.

*P < 0,05, **P < 0,01, ***P < 0,001, НЗ: не значимо.
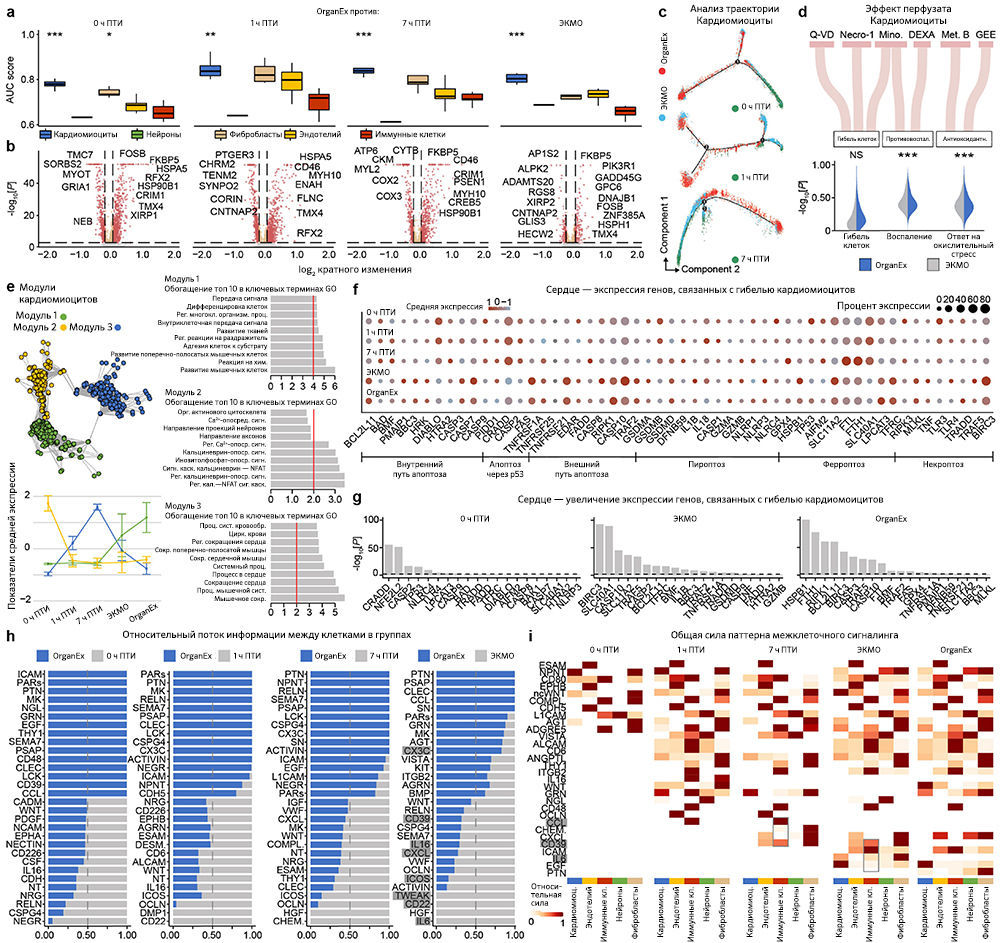
*P < 0,05, **P < 0,01, ***P < 0,001, НЗ: не значимо.
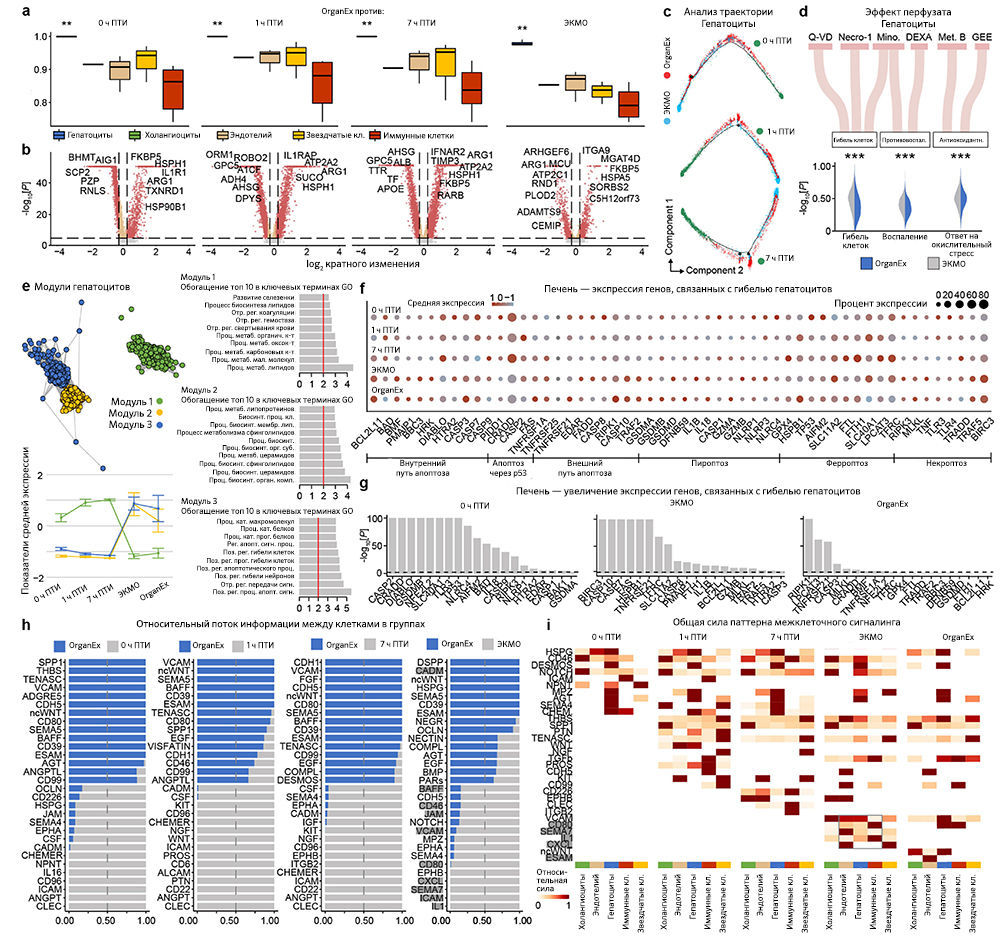
*P < 0,05, **P < 0,01, ***P < 0,001, НЗ: не значимо.
