Применение метформина при различных заболеваниях

Введение
Метформин — известный препарат из группы бигуанидов, широко распространенный из-за своей безопасности и низкой стоимости. Вот уже более 60 лет метформин применяют для лечения сахарного диабета II типа на ранних стадиях из-за его способности быстро и эффективно снижать уровень глюкозы в плазме крови [1]. Со временем были обнаружены и другие варианты применения метформина. Подтверждено его влияние на процессы старения и целесообразность использования при различных заболеваниях. Среди них — злокачественные новообразования (например, рак молочной железы, рак эндометрия, опухоли костной ткани, колоректальный рак и меланома кожи), ожирение, патологии печени, почек и сердечно-сосудистые заболевания. Метформин оказывает разнообразные эффекты, воздействуя на клетки через разные сигнальные пути. Однако механизмы, лежащие в основе многих эффектов, еще предстоит выяснить. Цель этого обзора — кратко описать эффекты метформина и обсудить возможные механизмы его действия.
В 1918 году в исследованиях на лабораторных животных было обнаружено, что гуанидин обладает антидиабетическими свойствами, но, к сожалению, в клинических испытаниях он проявлял токсичность, что побудило ученых искать более безопасные альтернативы [2,3]. Гидрохлорид 1,1-диметилбигуанида, или метформин, был синтезирован в 1920-е годы. С тех пор метформин стал препаратом первой линии для лечения СД2 из-за его ярко выраженной способности понижать уровень глюкозы в плазме [3–5]. В последние годы был обнаружен ряд дополнительных и довольно неожиданных эффектов метформина. Исследования показали, что метформин оказывает значительное влияние на многие онкологические [6,7] и сердечно-сосудистые заболевания (ССЗ) [8], заболевания печени [9], ожирение [10], нейродегенеративные заболевания [11] и заболевания почек [12]. Применение метформина или комбинированная терапия с другими лекарствами показали свою эффективность для лечения различных заболеваний.
Метформин ингибирует митохондриальный комплекс I [13,14], что приводит к активации белка AMPK (аденозин-5'-монофосфат-активированная протеинкиназа) [15]. Митохондриальный комплекс I крайне важен для транспорта электронов. В результате продукция аденозинтрифосфата (АТФ) снижается, а внутриклеточная концентрация аденозиндифосфата (АДФ) увеличивается. Следовательно, уровень аденозинмонофосфата (AMФ) в клетке повышается, в конечном итоге активируя AMPK [14,16]. Более того, недавнее исследование показало, что метформин может активировать AMPK через лизосомный сигнальный путь AXIN/LKB1-v-ATPase-Ragulator [17]. AMPK является ключевым регулятором множества метаболических путей, включая пути метаболизма глюкозы, липидного обмена и поддержание энергетического гомеостаза [18,19]. Кроме того, метформин играет важную роль, подавляя передачу сигналов от рецептора инсулина и инсулиноподобного фактора роста (insulin-like growth factor, IGF), что меняет метаболический гомеостаз [20]. Недавно с помощью анализа белок-белковых взаимодействий методами молекулярной динамики, которые позволяют картировать функции генов и находить молекулярные мишени для терапии, было обнаружено, что метформин может регулировать уровни экспрессии белков, которые отвечают за целый ряд клеточных процессов, включая энергетический обмен, старение клетки и канцерогенез [21]. Однако механизмы, лежащие в основе действия метформина на заболевания, до сих пор полностью не изучены. В этом обзоре с различных точек зрения обсуждаются функции метформина и суммируются лежащие в их основе механизмы, что может послужить основой для будущих исследований.
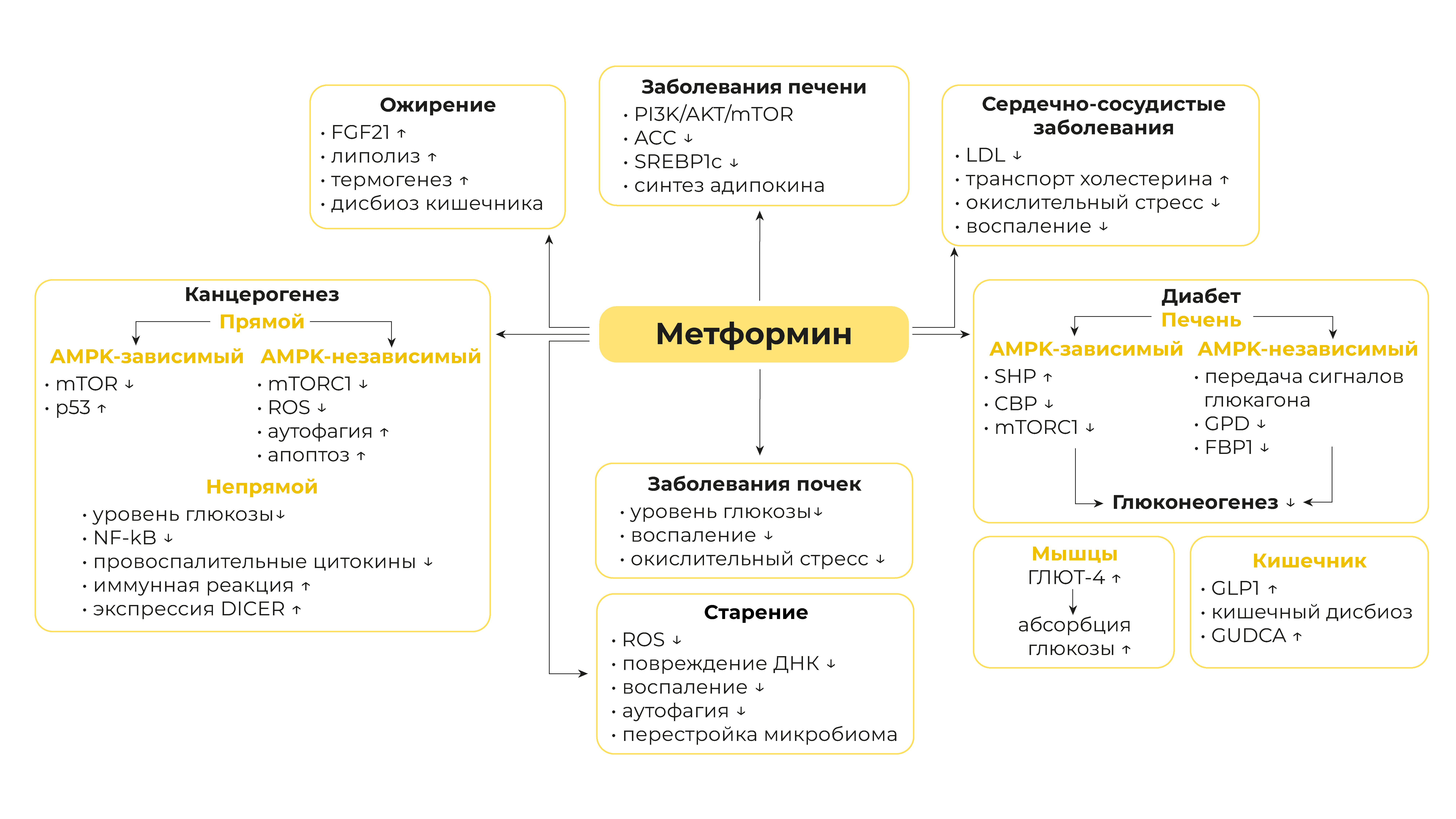
Рисунок 1 | Краткое описание эффектов метформина при различных заболеваниях и разбор его основных механизмов
Метформин и диабет
Многочисленные исследования и клинические испытания показали, что монотерапия метформином или комбинированная терапия с другими антидиабетическими препаратами эффективна при лечении СД2. В исследовании 1995 года показано, что метформин способен снижать уровень глюкозы в плазме, и в последующие десятилетия были обнаружены новые эффекты метформина при лечении диабета. В исследовании 1995 года, проведенном Defronzo с соавт., 289 пациентов с СД2 получали метформин или плацебо. Через 29 недель в группе метформина были выявлены более низкие уровни глюкозы в плазме натощак [22]. В исследовании 1997 года, проведенном Garber и соавт., 451 пациент с СД2 принимал различные дозы метформина (от 500 до 2000 мг в сутки). Через 14 недель было обнаружено, что эффективность метформина зависит от дозы [23]. В 2006 году было опубликовано пятилетнее двойное слепое рандомизированное клиническое исследование, в котором метформин сравнивали с глибенкламидом и розиглитазоном — другими антидиабетическими препаратами. Уровни глюкозы в плазме натощак меньше всего снижались розиглитазоном и больше всего глибенкламидом, при этом метформин демонстрировал промежуточные результаты [24].
В некоторых случаях метформин используется в сочетании с другими антидиабетическими препаратами. Например, в 29-недельном исследовании с участием 632 человек комбинация метформина и глибенкламида позволила эффективнее контролировать глюкозы, чем монотерапия метформином [22]. Глимепирид демонстрировал аналогичные результаты в клиническом исследовании с участием 372 человек [25]. Другое исследование показало, что метформин и троглитазон более значимо снижали уровня глюкозы в плазме натощак и после еды после трех месяцев терапии, чем при лечении одним лишь метформином [26]. Более того, исследования выявили, что комбинированная терапия метформином с ингибиторами дипептидилпептидазы-4 (ДПП-4, глиптинами), ингибиторами натрий-глюкозного контранспортера (SGLT2, глифлозинами) или агонистами рецепторов глюкагоноподобного пептида (ГПП-1, лираглутид и др.) также показала эффективный контроль уровня глюкозы без риска гипогликемии [27,28]. Комбинация метформина и инсулина — еще один способ терапии диабета. В исследовании с 96 пациентами эта комбинация привела к более эффективному контролю уровня глюкозы и массы тела, чем лечение одним метформином [29]. В другом исследовании с участием 390 пациентов комбинация с инсулином также позволила лучше контролировать гликемию, чем монотерапия метформином [30].
Более того, метформин повышает чувствительность к инсулину и снижает уровень инсулина натощак у пациентов с когнитивными нарушениями и нарушением метаболизма глюкозы [31]. Метформин — рациональный выбор для лечения беременных с СД2, с гестационным диабетом (ГСД) и синдромом поликистозных яичников (СПКЯ). Было показано, что метформин эффективнее снижает массу тела пациентов с СПКЯ, чем розиглитазон. На основании исследований in vitro и in vivo, включая исследования на животных и клинические испытания, использование метформина во время беременности становится все более распространенной практикой во всем мире [32]. Тем не менее, его безопасность в данной ситуации все еще вызывает споры. Исследования показали, что дети, подвергавшиеся воздействию метформина, могут иметь более высокую распространенность ожирения (общего и абдоминального), более высокий индекс массы тела и более высокое артериальное давление [33,34]. Другое исследование показало, что пациенты, принимавшие метформин более 10 лет, имели повышенный риск дисфункции бета-клеток и связанной с этим инсулинорезистентности [35]. Хотя могут потребоваться длительные исследования для изучения возможного воздействия метформина на клетки и ткани человека, метформин по-прежнему является предпочтительным вариантом лечения пациентов с СД2.
Метформин оказывает свое антигипергликемическое действие в основном за счет подавления биосинтеза глюкозы в печени через AMPK-зависимые [36,37] или АМРК-независимые пути [38,39]. С одной стороны, метформин ингибирует глюконеогенез путем AMPK-зависимой активации ядерного рецептора SHP (small heterodimer partner) и ингибирования фосфорилирования CREB-связывающего белка CBP [40], подавляя, таким образом, экспрессию генов, кодирующих глюконеогенные ферменты, таких как G6Pase (экспрессирует глюкозо-6-фосфатазу), PEPCK (фосфоенолпируваткарбоксилазу) и PC (пируваткарбоксилазу) [41]. Более того, активация AMPK приводит к ингибированию белкового комплекса mTORC1 (mammalian target of rapamycin complex 1, мишень рапамицинового комплекса I у млекопитающих), что также приводит к подавлению глюконеогенеза [42]. С другой стороны, метформин ингибирует выработку глюкозы в печени AMPK-независимым путем. Исследования показали, что метформин уменьшает воздействие глюкагона [43] или ингибирует митохондриальную глицерол-3-фосфатдегидрогеназу, что впоследствии приводит к нарушению утилизации лактата в ходе глюконеогенеза [39]. Недавнее исследование также продемонстрировало, что метформин напрямую действует на фруктозо-1,6-бисфосфатазу-1 (FBP1), фермент, контролирующий скорость глюконеогенеза, ингибирующий выработку глюкозы в печени [44]. Другие исследования показали, что метформин может также усиливать опосредованный ГЛЮТ-1 (переносчик глюкозы 1) транспорт глюкозы в гепатоциты посредством активации белка IRS2 (второй субстрат инсулинового рецептора, insulin receptor substrate 2), снижая уровень глюкозы в плазме [45].
Помимо снижения синтеза глюкозы в гепатоцитах, метформин также снижает уровень глюкозы за счет усиления опосредованного ГЛЮТ-4 потребления глюкозы скелетными мышцами [46] и абсорбции глюкозы в кишечнике [47]. Метформин также стимулирует высвобождение ГПП-1, тем самым увеличивая секрецию инсулина и снижая уровни глюкозы в плазме. Более того, недавно было выявлено, что микробиота кишечника тоже может быть мишенью метформина. Все больше исследований свидетельствуют о кишечном дисбиозе, развивающемся у пациентов с СД2 [48, 49]. В ходе рандомизированного двойного слепого исследования ученые обнаружили, что метформин влияет на состав и функцию кишечной микробиоты [50], обеспечивая новое понимание механизма, лежащего в основе антидиабетических эффектов метформина. После кратковременного приема метформина количество бактерий Bacteroides fragilis в кишечнике снизилось, что привело к увеличению уровня гликодезоксихолевой кислоты. Повышение уровня гликодезоксихолевой кислоты подавляет экспрессию ядерного фарнезоидного Х рецептора в энтероцитах (farnesoid X receptor, FXR), что увеличивает толерантность к глюкозе [51].
Метформин и онкологические заболевания
Все больше данных показывают, что метформин подавляет рост, выживаемость и метастазирование различных типов опухолевых клеток, в том числе рака молочной железы, печени, опухолей костной ткани, поджелудочной железы, эндометрия, колоректального рака, рака почек и легких [52]. Противораковые свойства метформина возможны в результате его прямого и косвенного регулирования внутриклеточного метаболизма. Прямые эффекты опосредуются AMPK-зависимыми и независимыми путями. Метформин активирует AMPK, что приводит к ингибированию передачи сигналов mTOR, в результате чего нарушается процесс биосинтеза белка, а рост и пролиферация клеток подавляются [53]. Например, метформин может ингибировать взаимодействие между рецепторами, сопряженными с G-белком (GPCR) [54] и системами передачи сигналов от рецептора инсулина: возможно, способствуя ингибированию пролиферации клеток рака поджелудочной железы [55]. Транскрипционный фактор p53 считается критическим геном-супрессором любых опухолей, которые возможны в организме человека [56]. Исследования показали, что р53 тоже участвует в противораковых эффектах метформина [57]. Метформин активирует AMPK, а затем индуцирует фосфорилирование p53, что в итоге предотвращает клеточную инвазию и метастазирование [57]. Метформин также способен ингибировать белковый комплекс mTORC1 — ключевой регулятор роста клеток, который может интегрировать внутриклеточные и внеклеточные стимулы [58] независимым от AMPK путем [59]. Кроме того, метформин подавляет митохондриальный комплекс I, тем самым предотвращая образование активных форм кислорода, что еще больше снижает риск повреждения ДНК, подавляя канцерогенез [60]. Предыдущие исследования также показали, что метформин может предотвращать развитие рака, активируя аутофагию и апоптоз посредством AMPK-независимого пути.
Учитывая косвенные положительные эффекты метформина при онкозаболеваниях, исследования показали, что метформин может влиять на ангионеогенез, функцию фибробластов, ассоциированных с опухолью макрофагов и иммуносупрессию, изменяя микроокружение опухоли [61]. Как антидиабетический препарат, метформин снижает уровень глюкозы в плазме, тем самым подавляя пролиферацию и выживаемость раковых клеток [62]. В других исследованиях сообщалось, что метформин может активировать иммунный ответ, направленный против раковых клеток [16] или снижать активность транскрипционного фактора NF-κB, что приводит к снижению секреции провоспалительных цитокинов [63]. Кроме того, предполагается, что микроРНК опосредует одно из противораковых действий метформина. Исследования показали, что метформин может индуцировать экспрессию гена, кодирующего рибонуклеазу DICER — важного фермента в регуляции работы микроРНК in vitro и in vivo [64]. Недавнее исследование показало, что метформин вместе с гипогликемией натощак снижает метаболическую пластичность и рост опухоли, связанную с осью белков PP2A/GSK3β/MCL-1 [65]. Было высказано предположение, что опухолевые клетки чередуют гликолиз и окислительное фосфорилирование, чтобы адаптироваться к тем или иным метаболическим особенностям организма. Ограничение диеты посредством интервального голодания — новый подход к предотвращению развития опухолей [66], в то время как метформин — один из ингибиторов окислительного фосфорилирования. Было обнаружено, что комбинация метформина и интервального голодания показала самое сильное влияние на рост опухоли, не вызывая потери веса или других токсических воздействий на организм. Это предполагает, что в будущем могут быть разработаны дополнительные стратегии лечения рака метформином.
Рак молочной железы
Рак молочной железы (РМЖ) — одно из самых распространенных злокачественных новообразований у женщин. На его патогенез влияет множество сигнальных путей, и частота его возникновения увеличивается с возрастом [67]. Клеточный метаболизм глюкозы тесно связан с распространением и развитием РМЖ. Несколько исследований показали, что метформин снижает частоту возникновения РМЖ у пациенток с СД2 [68]. Известно, что раковые клетки усиленно усваивают и метаболизируют глюкозу и предпочитают гликолиз, а не окислительное фосфорилирование. Этот феномен известен как эффект Варбурга. Метформин снижает уровень глюкозы, тем самым ограничивая доступность энергии для раковых клеток. Также было показано, что метформин снижает экспрессию синтазы жирных кислот (FAS) — важного компонента пути биосинтеза жирных кислот, тем самым влияя на выживаемость раковых клеток. Трижды негативный рак молочной железы (ТНРМЖ) — это вид рака молочной железы, который крайне сложно лечить из-за отсутствия утвержденных таргетных методов терапии и эффективной химиотерапии с низкой токсичностью [69]. Сообщалось, что белок BACH1 является основным регулятором гликолиза и окислительного фосфорилирования в ТНРМЖ и, следовательно, связан с эффектом Варбурга. Предыдущее исследование показало, что аргинат гема также может подавлять экспрессию BACH1 и полезен при лечении ТНРМЖ [70]. Недавнее исследование показало, что комбинированная терапия аргинатом гема и метформином значительно подавляет рост опухоли при ТНРМЖ [71]. Эти результаты дают нам новое представление об использовании метформина в сочетании с другими препаратами для лечения опухолей.
Гемобластозы
В прогрессировании и лечении множественной миеломы (ММ) важное место занимает сигнальный путь AKT. При ММ экспрессия компонентов AKT всегда высока, даже на поздних стадиях [72]. Исследования показали, что метформин подавляет передачу сигналов пути AKT/mTOR, тем самым нарушая пролиферацию клеток MM. Кроме того, метформин может также ингибировать белок GRP78, чтобы еще больше усложнить образование аутофагосом и увеличить апоптоз, усиливая эффект бротезомиба против ММ [73]. На лейкозы приходится 2,8 % всех онкологических заболеваний и 3,4 % смертей от рака во всем мире. Нарушение активации пути PI3K/AKT/mTOR — один из наиболее частых биохимических признаков лейкоза [74]. Метформин подавляет передачу сигналов пути AKT/mTOR и, следовательно, может быть эффективным в лечении лейкозов. Метформин играет важную роль в подавлении канцерогенеза при лимфомах, блокируя передачу сигналов mTOR без участия AKT, а подавление mTOR впоследствии уменьшает пролиферацию В-клеток и Т-клеток [75].
Колоректальный рак
Колоректальный рак (КРР) также является одним из наиболее распространенных онкологических заболеваний в мире, заболеваемость которого стремительно растет в странах с низким и средним уровнем доходов. Недавние многочисленные исследования, включая фундаментальные, клинические и эпидемиологические работы, показали, что метформин может снижать риск развития КРР. Исследование 2004 года продемонстрировало взаимосвязь между применением метформина и возникновением КРР [76], а в последующие годы о влиянии метформина на развитие КРР сообщалось еще в нескольких исследованиях [77]. Метформин может оказывать влияние через ось кишечник-мозг-печень, но эти механизмы все еще требуют дальнейшего изучения. В кишечнике метформин увеличивает абсорбцию глюкозы и концентрацию лактата. Применение метформина увеличивает пул желчных кислот в кишечнике, что может влиять как на секрецию ГПП-1, так и на уровень холестерина. Кроме того, метформин изменяет кишечный микробиом, влияя на гомеостаз глюкозы, метаболизм липидов и энергетический обмен [78]. Эти изменения способствуют снижению скорости развития КРР.
Рак эндометрия
Рак эндометрия занимает пятое место среди злокачественных новообразований у женщин, причем заболеваемость растет как в развитых, так и в развивающихся странах [79]. Нарушения, вызванные метаболическим синдромом (ожирение и гипергликемия), связаны с развитием рака эндометрия. Метформин является эффективным противодиабетическим препаратом, исследования которого показали влияние на развитие рака эндометрия. Результаты исследований продемонстрировали, что прием метформина улучшает выживаемость больных диабетом и раком эндометрия [80]. Механизмы, задействованные в эффекте метформина при лечении рака эндометрия, в основном представляют собой подавление митохондриального окислительного форсфориллирования и активацию AMPK, которые впоследствии ингибируют различные метаболические пути, включая STAT3, ZEB-1, ACC, mTOR и IGF-1. Это приводит к снижению синтеза белка и жирных кислот, усилению апоптоза и снижению пролиферации клеток, что вносит вклад в подавление рака эндометрия.
Меланома
Меланома является наиболее агрессивным видом злокачественных новообразований кожи и является причиной почти 80 % смертей, связанных с ними. Из-за своей выраженной способности к инвазии, меланома часто метастазирует в лимфатические узлы, печень, легкие и даже в центральную нервную систему [81]. Из-за высокой устойчивости к терапии и способности избегать иммунного ответа меланома представляет собой сложную проблему для современной медицины. В настоящее время доступны два антитела для терапии меланомы: ипилимумаб (анти-CTLA-4) и ниволумаб (анти-PD-1) [82). Однако 55–60 % пациентов не отвечают на терапию, что требует разработки новых стратегий лечения. Метформин может вызывать остановку клеточного цикла в фазе G0-G1 в клетках меланомы. Другое исследование показало, что метформин может уменьшать рост и метастазирование меланомы за счет ингибирования экспрессии белка TRIB3 на мышиных моделях как с диабетом, так и без него [83]. Благодаря активирующему эффекту AMPK метформин может влиять на гибель и пролиферацию клеток меланомы, а также менять микросреду опухоли. Большой интерес представляют также эффекты комбинированного лечения метформином с уже существующими препаратами для лечения меланомы.
Опухоли костной ткани
По сравнению с опухолями, начинающимися в самой костной ткани, более распространенным вариантом является инвазия метастатического рака, особенно рака груди, легких и простаты в кости [84]. Все типы злокачественных опухолей костей влияют на остеолитический процесс из-за активации остеокластов или стимулирующих факторов, которые ответственны за пролиферацию, дифференцировку и образование остеобластов [85]. Мембранный белок RANKL (лиганд рецептора-активатора ядерного транскрипционного фактора NF-kB) играет важную роль в подавлении пролиферации и дифференцировки остеокластов, которые ингибируются AMPK при применении метформина. Более того, метформин подавляет пролиферацию, миграцию и инвазию клеток опухолей костной ткани через сигнальный путь AMPK/mTOR/S6 или MMP2/MMP9 [86].
Метформин и ожирение
Из-за изменений в образе жизни заболеваемость ожирением в последние годы резко возрастает. Ожирение — это многофакторное хроническое заболевание, сопровождающееся другими связанными с ним метаболическими синдромами, такими как диабет, ожирение печени и ССЗ. Ожирение вызвано несоответствием между потреблением и расходом энергии [87]. Данные исследований свидетельствуют о том, что метформин может быть потенциальным средством терапии ожирения и связанных с ним метаболических дисфункций. Стало известно, что у людей, не страдающих диабетом, метформин оказывает слабое, но значимое влияние на потерю веса. У мышей прием метформина в течение 14 недель предотвращал развитие ожирения, вызванного диетой с высоким содержанием жиров, и связанного с ним воспалительного ответа за счет увеличения экспрессии FGF21 (фактора роста фибробластов 21) — ключевого метаболического гормона, который улучшает липолиз в белой жировой ткани для предотвращения накопления жира [88]. Более того, метформин может предотвратить ожирение у мышей, увеличивая метаболическую активность бурой жировой ткани — ткани с большим количеством митохондрий. Благодаря действию термогенина (UCP1, uncoupling protein 1) в бурой жировой ткани происходит термогенез — энергия химических связей рассеивается в виде тепла. С помощью ПЭТ/КТ-визуализации было обнаружено, что метформин в основном поглощается бурой жировой ткани in vivo за счет повышенной экспрессии OCT — переносчика органических катионов [10]. Доказано, что метформин оказывает свое терапевтическое действие против ожирения за счет усиления митохондриального биогенеза (появления новых митохондрий), уменьшения поглощения жирных кислот и стимуляции термогенеза [89]. Более того, исследование показало, что у крыс метформин модулирует микробиоту кишечника и предотвращает ожирение, вызванное диетой с высоким содержанием жиров, что увеличивает количество бактерий, продуцирующих короткоцепочечные жирные кислоты, и снижает микробное разнообразие [90]. Способность увеличивать метаболизм глюкозы также может способствовать уменьшению ожирения.
Метформин и заболевания печени
Печень, которая играет важную роль в физиологии всего организма, а в особенности в гомеостазе глюкозы и метаболизме липидов, является основным органом-мишенью метформина. Дисфункция печени может привести ко многим заболеваниям, таким как диабет, неалкогольная жировая болезнь печени (НАЖБП), цирроз, неалкогольный стеатогепатит (НАСГ) и гепатоцеллюлярная карцинома (ГЦК). Исследования показали, что метформин безопасен для пациентов с циррозом печени и снижает риск смерти на 57 %. У пациентов с диабетом метформин приводил к снижению заболеваемости ГЦК на 50 % и повышению выживаемости, главным образом, за счет влияния на рост клеток и ангионеогенез через сигнальный путь PI3K/AKT/mTOR [91]. Однако преимущества метформина при лечении НАЖБП и гепатита до сих пор остаются спорными. В испытаниях на животных было обнаружено, что метформин предотвращает развитие жировой болезни печени, вызванной диетой с высоким содержанием жиров, у мышей линии ob/ob, у которых снизилось содержание триглицеридов в печени [92]. Было также обнаружено, что у людей метформин снижает частоту возникновения жировой дистрофии печени [93]. Однако другие исследования показали, что метформин не повлиял на гистологическую структуру печени, не повлиял на стеатоз и воспаление [94]. Сообщалось о менее чем 10 случаях гепатотоксичности метформина, что может быть объяснено одновременным приемом других потенциально гепатотоксичных препаратов [95]. Основной причиной НАЖБП является нарушение липогенеза de novo в печени. Этот процесс связан с несколькими факторами транскрипции, включая SREBP, ChREBP и LXR (Х-рецептор клеток печени). Эти факторы влияют на экспрессию ключевых ферментов липогенеза, таких как FAS (синтаза жирных кислот) и SCD1 (стеароил-КоА-десатураза 1) [96]. Инсулинорезистентность также может вызывать НАЖБП согласно известной теории «двух ударов». Лечение метформином вызывает активацию AMPK, что приводит к снижению ингибирования ацетил-КoA-карбоксилазы или SREBP1c, что, в свою очередь, снижает окисление жирных кислот и подавляет синтез жирных кислот. Между тем, метформин влияет на синтез адипокинов, таких как TNF-а и IL-6, которые увеличивают интенсивность окисления жирных кислот и уменьшают липогенез de novo [9]. Путь mTOR может играть важную роль в этих эффектах, особенно при ГЦК. Было также высказано предположение, что метформин может индуцировать экспрессию FGF21, следовательно, предотвращая стеатоз печени, вызванный диетой с высоким содержанием жиров, у мышей [88].
Метформин и сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания являются одной из основных причин смерти и инвалидности в мире. Этиология сердечно-сосудистых заболеваний разнообразна и включает такие факторы, как курение, диабет, ожирение, гиперлипидемию и гипертонию. Диабет 1 и 2 типа часто сопутствует сердечно-сосудистым заболеваниям [97]. Гипергликемия вызывает окислительный стресс, что приводит к дисфункции липопротеинов и эндотелия, повышая риск сердечно-сосудистых заболеваний. Метформин снижает частоту сердечно-сосудистых заболеваний у пациентов с диабетом. Активируя AMPK, метформин ингибирует опосредованную альфа-дикарбонилом модификацию остатков аполипопротеина, в результате влияя на синтез дисфункциональных липопротеинов высокой плотности (ЛПВП) и уменьшая изменения в липопротеинах низкой плотности (ЛПНП). Уменьшение дисфункции ЛПВП улучшает транспорт холестерина и снижает риск сердечно-сосудистых заболеваний. Более того, метформин влияет на процесс окислительного стресса и уменьшает воспаление, вызванное гипергликемией, снижая частоту сердечно-сосудистых заболеваний [98]. СД2 также ассоциируется с более высокой частотой возникновения сердечной недостаточности. На пациентов с диабетом приходится почти треть случаев сердечной недостаточности [99]. Было показано, что метформин улучшает энергетический статус миокарда за счет улучшения клеточного метаболизма липидов и глюкозы через путь AMPK [100]. Недавно рандомизированное контролируемое исследование с участием пациентов с ишемической болезнью сердца без диабета показало, что метформин значительно уменьшает гипертрофию левого желудочка (ЛЖ), один из самых важных прогностических факторов при ишемической болезни сердца. Было выявлено, что метформин в значительной степени снижает саму массу и индекс массы ЛЖ (соотношение массы ЛЖ к росту), массу тела и уровень окислительного стресса [101]. В нескольких исследованиях сообщалось о преимуществах метформина при сердечно-сосудистых заболеваниях и сердечной недостаточности у пациентов с диабетом или без него, и было бы интересно изучить другие возможные применения метформина в будущем.
Метформин и старение
Старение рассматривается как неизбежный жизненный этап, который зависит от генетических и диетических факторов. Качество жизни людей постепенно ухудшается, в конечном итоге они теряют способность к самообслуживанию и рано или поздно попадают в больницу. С древних времен и до наших дней люди постоянно искали различные способы увеличить продолжительность жизни или максимально продлить хорошее качество жизни [102]. Снижение способности к регенерации поврежденных тканей и ухудшение гомеостатических процессов рассматриваются как биологические особенности старения [103]. Старение увеличивает вероятность многих заболеваний, включая диабет, сердечно-сосудистые заболевания, ишемическую болезнь сердца, рак, депрессию, остеопороз и особенно нейродегенеративные заболевания, такие как болезнь Альцгеймера и болезнь Паркинсона. Обычно основными причинами старения являются повреждение ДНК и аутофагия. Старение является результатом повреждения ДНК, которое может быть вызвано воздействием активных форм кислорода, алкилированием, гидролизом, пагубным эффектом химических веществ, а также ультрафиолетовым и другим излучением [104]. Генетические факторы и факторы окружающей среды, участвующие в регуляции аутофагии, также являются критическими факторами в процессе старения [105]. Клиническое применение метформина при процессах старения только начинается. Было показано, что у нематод Caenorhabditis elegans метформин увеличивает продолжительность жизни, однако у людей явного влияния на старение, к сожалению, не наблюдалось. Так или иначе, метформин эффективен при заболеваниях, связанных со старением, таких как диабет, сердечно-сосудистые заболевания и когнитивные нарушения, что приводит к увеличению продолжительности жизни у этих пациентов. У пациентов с СД2 метформин снижал риск смерти от диабета на 42 % [106]. Другое клиническое исследование продемонстрировало, что лечение метформином в течение примерно 24 недель улучшало когнитивные функции и уменьшало симптомы депрессии [107].
Механизмы, с помощью которых метформин влияет на процессы старения, частично зависят от регуляции метаболизма глюкозы. Ингибируя митохондриальный комплекс I, метформин снижает интенсивность продукции активных форм кислорода и, следовательно, снижает уровень повреждения ДНК [60]. Активируя AMPK, метформин подавляет передачу сигналов пути NF-κB и уменьшает воспаление [108]. Метформин также приводит к снижению уровня инсулина и подавляет передачу сигналов IGF-1 и mTOR, что все вместе приводит к подавлению развития воспаления и аутофагии, что позволяет влиять на процесс старения [109]. Кроме того, было показано, что метформин играет важную роль в регуляции микробиома кишечника, что может быть еще одним способом повлиять на старение [110]. Кроме того, метформин уменьшает повреждение нейронов и увеличивает переносимость нехватки кислорода и глюкозы, тем самым улучшая выживаемость нейроцитов и проявляя нейропротекторные функции [108]. Благодаря своей защитной роли метформин может стать хорошим методом воздействия на процессы старения и лечения заболеваний, связанных со старением у людей с диабетом или без него.
Метформин и заболевания почек
Острая почечная недостаточность (ОПН) и хроническая болезнь почек (ХБП) — это два основных заболевания почек, которые определяются как стремительная утрата почечной функции, которая происходит в течение нескольких часов или дней, и прогрессирующая потеря функции почек, которая происходит в течение нескольких месяцев или лет соответственно [111]. По-прежнему отсутствуют эффективные методы лечения этих заболеваний. Диабет считается важной причиной почечной недостаточности, а метформин — интересный вариант для лечения таких состояний, хотя его использование ранее было ограничено [112]. Исследования показали, что ежедневный пероральный прием метформина может замедлить процесс фиброза почек и нормализовать их структуру и функцию. Эти эффекты могут быть опосредованы сигнальным путем AMPK, который может регулировать рост клеток и использование энергии. Другое исследование продемонстрировало, что на модели мышей с ХБП метформин может подавлять повреждение почек и улучшать их функцию за счет передачи сигналов ацетил-КоА-карбоксилазы, опосредованных AMPK [113]. У людей метформин также полезен при заболеваниях почек. За исключением эффектов у пациентов с поражением почек, вызванным диабетом, клинические испытания показали, что непрерывное введение метформина улучшает функцию почек и выживаемость у пациентов с ОПН и ХБП [114]. Следует отметить, что правильная дозировка метформина очень важна при лечении почечных заболеваний. Механизмы, лежащие в основе этих защитных функций почек метформина, могут быть связаны с регуляцией утилизации глюкозы, уменьшением клеточного воспаления и окислительного стресса.
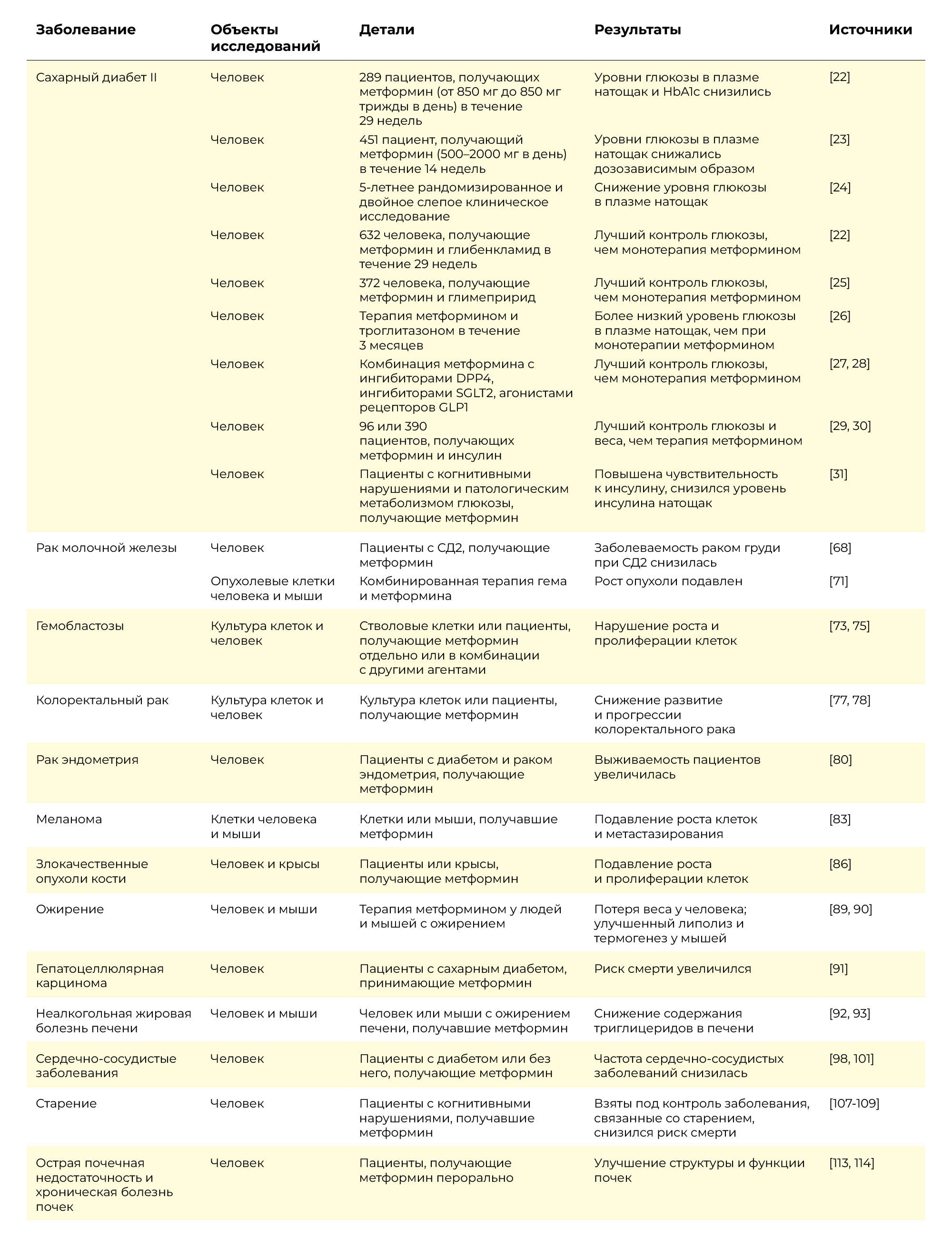
Таблица 1 | Полезные эффекты метформина при различных заболеваниях
Выводы
Метформин — широко используемый препарат с целым рядом полезных эффектов (таблица 1), которые реализуются благодаря различным сигнальным путям (рисунок 1). Наиболее яркой особенностью метформина является, безусловно, его мощные антигипергликемические свойства. Клеточные исследования и исследования на животных показали, что метформин ингибирует экспрессию глюконеогенных генов в AMPK-зависимом или независимом пути, подавляя выработку глюкозы в гепатоцитах. Кроме того, метформин снижает уровень глюкозы за счет снижения затрат лактата для глюконеогенеза, увеличения транспорта и абсорбции глюкозы или изменения микробиоты кишечника. Накопленные результаты клинических испытаний показали, что метформин влияет на течение различных видов рака. Метформин предотвращает рост, выживание и метастазирование опухолевых клеток, а также изменяет микроокружение опухоли, подавляя ее развитие. Основные молекулярные механизмы включают ингибирование передачи сигналов по пути mTOR, активацию p53, аутофагию и апоптоз, снижение образования активных форм кислорода, повреждение ДНК и воспалительную реакцию. Более того, было показано, что метформин оказывает благотворное влияние на заболевания печени, ожирение, сердечно-сосудистые заболевания, возрастные заболевания и заболевания почек, что в конечном итоге снижает смертельные риски. Эти действия метформина связывают с активацией AMPK или ингибированием митохондриального комплекса I, впоследствии влияющими на метаболизм клеток. Все эти знания помогают нам понять принцип действия метформина на заболевания, которые могут стать новыми потенциальными терапевтическими мишенями. Однако эффекты метформина очень сложны, разнообразны и требуют дальнейшего изучения. Учитывая его безопасность и долгосрочное применение у людей, метформин становится многообещающим вариантом лечения многих заболеваний.
