Расслаивающая аневризма аорты
К одним из сложных состояний в сердечно-сосудистой хирургии относятся острые поражения аорты. Группа нозологических единиц, именуемая острым аортальным синдромом (AAS)1 и представленная классическим расслоением аорты, интрамуральной гематомой, пенетрирующей аортальной язвой и ложной аневризмой, требует особого подхода в проведении диагностики и лечения. Расслаивающая аневризма приводит к развитию тяжёлых осложнений — гемоперикарду, гемотораксу и абдоминальному кровотечению, а само расслоение аорты является самой частой катастрофой среди указанной группы заболеваний.
Определение
Расслаивающая аневризма аорты — острое комплексное состояние аорты, при котором сосудистая стенка патологически расширенного участка аорты подвергается разделению на внутренний и наружный слой с образованием внутрипросветной гематомы. Данное понятие сочетает в себе два патологических процесса — аневризму и расслоение — которые вместе приводят к острой ситуации в сердечно-сосудистой хирургии с высоким риском летального исхода.
Первые упоминания об аневризмах аорты восходят к древнегреческим временам и связаны с работами Галена и Антиллуса. В средние века эти вопросы освещались в работах A. Pare, A. Vesalius и других авторов. Впервые расслоение аорты в учебной литературе было описано G.B. Morgagni в 1761 г. в работе «De sedibus et causis morborum anatomen indagatis»2.
Анатомическое строение и патофизиологический процесс
Главный артериальный сосуд организма — аорта — представлена полой трубкой, начинающейся от основания сердца луковицей аорты. В аорте имеется три части: восходящая, дуга и нисходящая. Также магистральный сосуд, точнее его нисходящая часть, анатомически разделен диафрагмой на два отдела — грудной и брюшной.
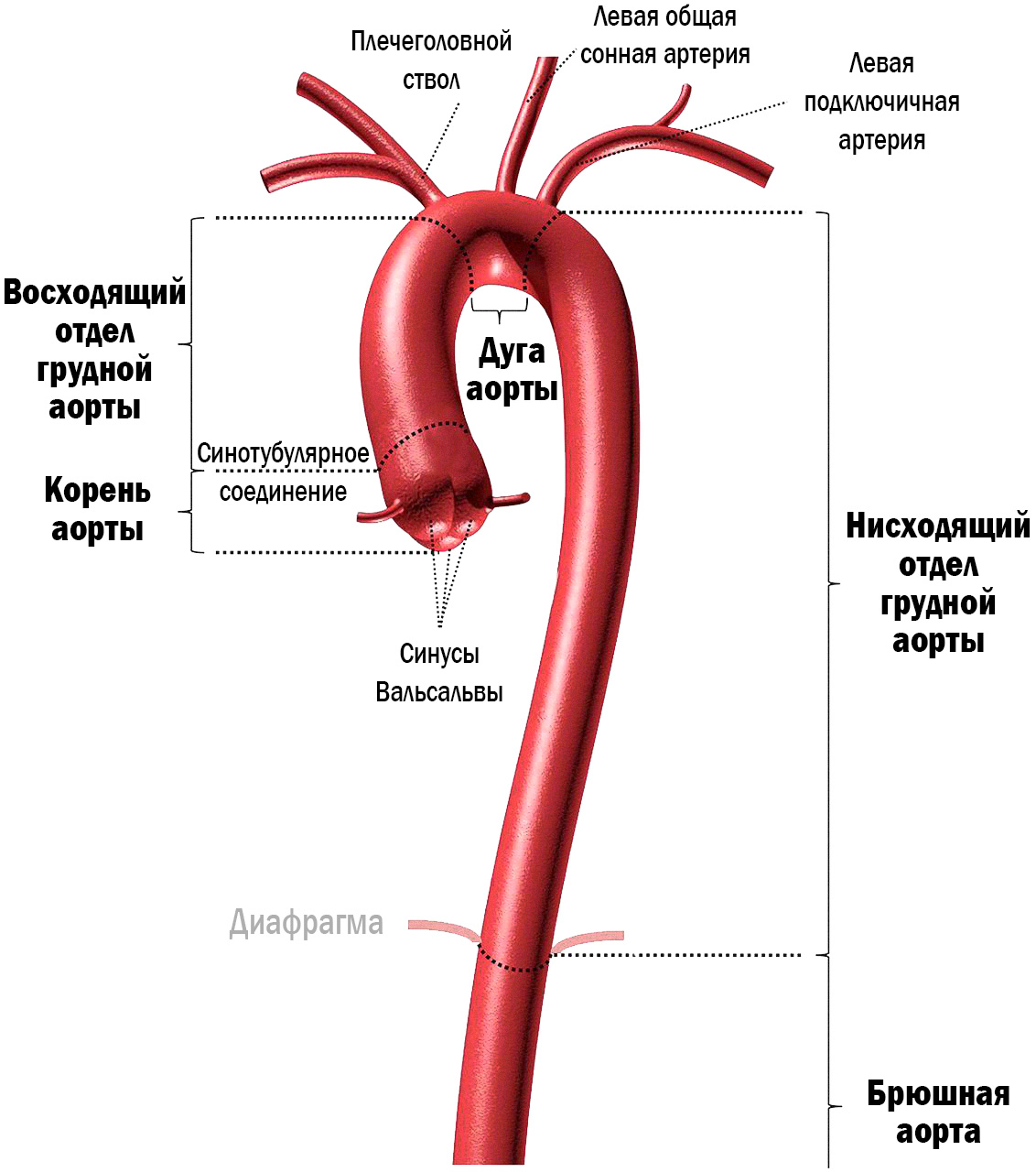
Рисунок 1. Схематичное представление строения аорты
Согласно Европейским клиническим рекомендациям 2014 года аорту следует рассматривать как единый орган3, в котором разделение на отделы (грудной и брюшной) условны в клиническом плане, т.к. совместные поражения двух отделов встречаются чаще чем изолированные и, следовательно, необходим единый мультидисциплинарный подход к диагностике и терапии. В оппозиции к этому, в академической среде принято считать, что лечением патологии грудного отдела занимаются сердечно-сосудистые хирурги, а заболеваниями брюшного отдела занимаются сосудистые хирурги.
При рассмотрении гистологической структуры стенки аорты выделяются три слоя:
- Тонкий внутренний эндотелиальный (tunica intima).
- Толстый средний с наличием коллагеновых волокон, гладкомышечных клеток и эластических мембран (tunica media).
- Наружный адвентициальный коллагеновый с содержанием кровеносных (vasa vasorum) и лимфатических сосудов (tunica adventitia).
Совместно они образуют упругий эластический каркас для полноценного функционирования магистрального сосуда.
Стенка аорты на микроскопическом уровне представлена клетками и внеклеточным матриксом, вместе выполняющими сложные биомеханические функции. Этот состав обеспечивает надлежащую эластичность, прочность и широкую адаптацию к изменениям. При нарушении регуляции структур стенки возникает каскад биохимических и клеточных реакций, приводящих к дезадаптивным изменениям, которые в микропрепарате аорты представлены следующими характеристиками4:
- Дегенерацией медии, проявляющейся потерей и разрушением эластических волокон мембран.
- Потерей гладкомышечных клеток.
- Атеросклерозом, приводящим к замещению эластических волокон и гладкомышечных клеток экстрацеллюлярным матриксом и липидами.
- Дисфункцией эндотелия в интимальном слое и изменением качественного состава внеклеточного матрикса с накоплением аномального протеогликана5.
Указанные изменения могут проявляться одновременно или быть последовательными шагами в патофизиологическом процессе расслаивающей аневризмы аорты.
К аневризмам аорты относят случаи необратимого локального расширения аорты в 2 раза или более по сравнению с нормальным диаметром. Формирование аневризмы, т.е. расширения диаметра аорты, развивается под воздействием различных физических сил, влияющих на стенку сосуда. Крупная аорта сама по себе является сложным динамическим объектом, расширяющимся и сужающимся под воздействием энергии потока крови и сокращения миокарда.
При снижении эластических свойств стенки начинается постепенная дилатация, приводящая к формированию патологически расширенного участка сосуда. Здесь вступает в силу закон Лапласа, согласно которому сила растяжения аорты напрямую связана с радиусом сосуда и давлением крови на его стенку. Действие этого закона проявляется ещё большим растяжением стенки при увеличении радиуса и возрастающей нагрузке на участок. Совместно с этим начинает действовать «режущая» сила турбулентного тока крови, где клеточные элементы с высокой скоростью ударяются об эндотелиальную стенку и как острие ножа формируют надсечки или циркулярные надрезы (чаще всего в 1/3 или 2/3 окружности).
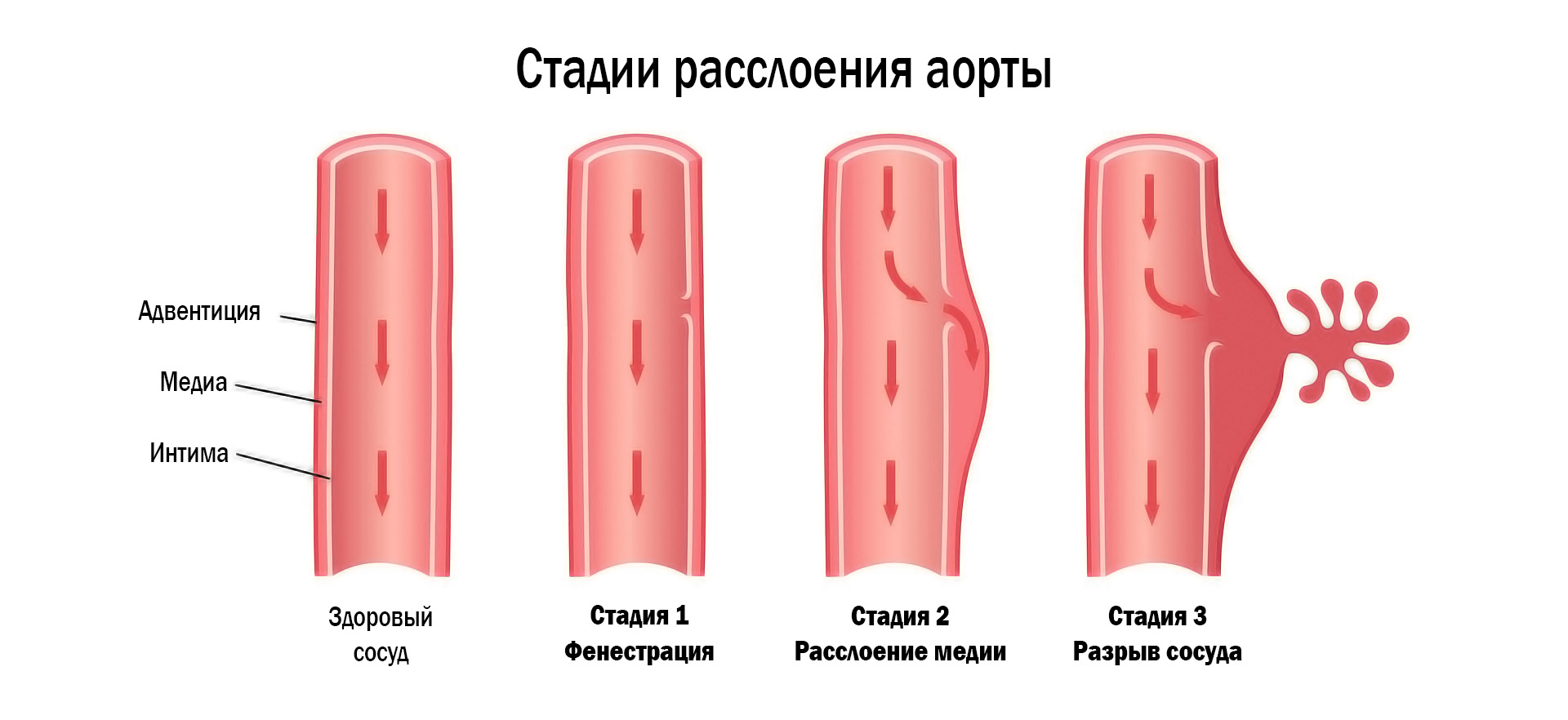
Рисунок 2. Схематичное представление стадий расслоения аорты. Интактный сосуд претерпевает ряд изменений, заканчивающихся разрывом его стенки и последующим сильным артериальным кровотечением.
Начальные шаги процесса приводят к появлению в медии крови, формированию ложного канал в стенке сосуда. Этот канал, начинаясь от первичного дефекта медии (именуемого фенестрацией), имеет тенденцию к дальнейшему росту и распространению в антеградном (при определённых условиях — ретроградном) направлении. На своём пути ложный канал между интимой и медией может образовывать дополнительные разрывы (дистальные фенестры) в эндотелиальном слое, что позволяет снимать компрессию изнутри стенки сосуда.
Если декомпрессии не случается, возникает относительно быстрое нарастание внутрипросветного давления, декомпенсированная деформация элементов медии и последующий разрыв адвентиции с развитием фатального артериального кровотечения.
NB! Не каждая аневризма протекает с образованием расслоения аорты, и не каждое расслоение аорты связано с аневризматическим процессом.
Другим вариантом расслоения аорты является дегенеративно-дистрофический процесс, приводящий к утолщению стенки интимы, нарушению питания и доставки кислорода окружающим тканям без дилатации аорты. В таком случае нарушение кровоснабжения, в т.ч. через vasa vasorum, усиливает тканевой фиброз, дезорганизацию ткани и способствует попаданию крови между слоёв аорты6.
Патогенез расслаивающей аневризмы аорты приобретает следующие этапы: изменение клеточно-тканевого состава, формирование аневризмы аорты, расслоение аорты, разрыв аорты и артериальное кровотечение. Для запуска этого патологического процесса необходимо воздействие, которое происходит с участием факторов риска и предрасполагающих процессов.
Факторы риска
Факторы риска являются комбинированными при сочетании аневризмы и расслоения аорты. К ним относятся:

Эпидемиология
Актуальных данных по эпидемиологии расслоений аорты мало по причине редкости заболевания. Сложность в установлении частоты встречаемости данной патологии составляет высокий уровень смертности до проведения точной диагностики. Годовая численность расслоений аорты по приблизительным подсчётам в популяционном исследовании жителей Европы и Северной Америки с 1980 до 2015 г. составила от 2,5 до 15 случаев на 100000 населения7. По данным регистра IRAD (Международный регистр острого расслоения аорты), средний возраст больных составляет 63 года.
Диагностика и визуализация
Диагностика заболевания комплексная и состоит из классических методов сбора информации — опросов, анамнеза, лабораторных и инструментальных методов. Для формулировки диагноза используются различные визуализирующие средства — рентгенография грудной клетки, КТ с контрастированием, МРТ, трансторакальное или чрезпищеводное-ЭхоКГ, аортография, внутрисосудистое УЗИ и др. Они являются основными источниками ценной информации о локализации, форме и размере сосуда, степени патологического процесса, в частности — аневризмы аорты. Указанные методы визуализации позволяют оценить характеристики и степень расслоения, выявить осложнения. Каждый из способов диагностики имеет свои показатели чувствительности и специфичности, показания и ограничения. Диагностические исследования могут давать различные результаты в соответствии с методологической вероятностью, и их использование в практике требует правильного подбора алгоритма и тактики лечащим врачом.
Классификация
Для комплексного понимания проблемы следует учитывать классификации аневризм и расслоений.
Варианты классификации аневризм аорты
Истинные — стойкое локальное расширение аорты, превышающее ее нормальный диаметр на 50 % и более:
- атеросклеротические (дегенеративные);
- воспалительные;
- постартериотомические;
- врождённые.
Ложные — полость, которая располагается вне сосуда и сообщается с его просветом, изнутри покрыта тромботическими массами и фибрином:
- посттравматические;
- послеоперационные.
Форма измененного участка:
- веретенообразная;
- мешковидная;
- эксцентрическая.
По локализации патологического процесса:
- грудного отдела (корня аорты, восходящей аорты, дуги аорты, нисходящего отдела аорты);
- торакоабдоминальные;
- брюшного отдела.
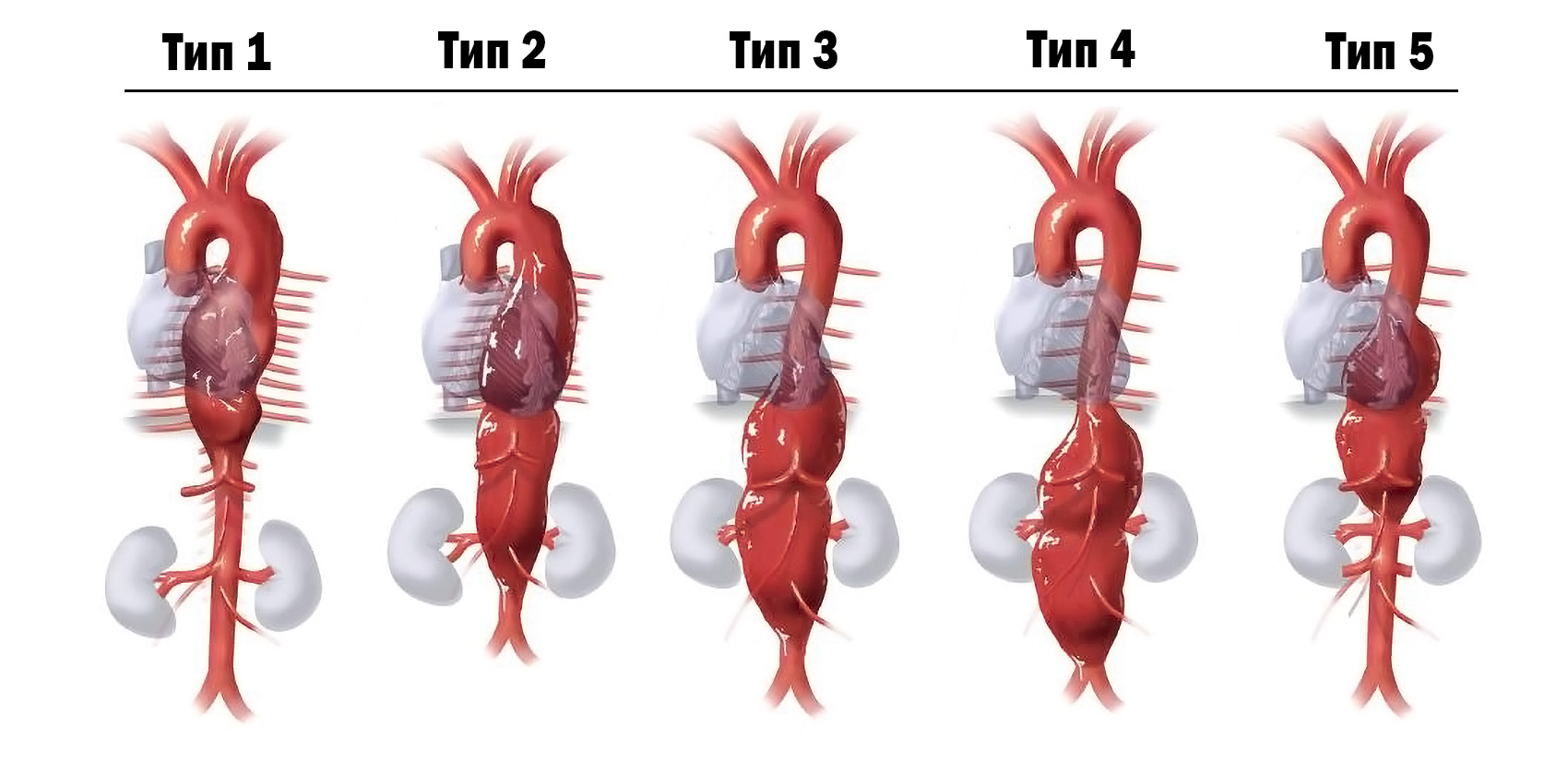
Классификация аневризм брюшного отдела по А.В. Покровскому (1968)
Советский и российский хирург А.В. Покровский предложил следующую схему деления аневризм торакоабдоминального отдела аорты по локализации процесса и вовлечению других сосудов:
I тип — аневризмы проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей.
II тип — аневризма инфраренального сегмента без вовлечения бифуркации (зоны деления аорты на левую и правую общие подвздошные артерии).
III тип — аневризма инфраренального сегмента с вовлечением бифуркации аорты и подвздошных артерий.
IV тип — тотальное поражение брюшного отдела аорты.
У большинства пациентов аневризма имеет инфраренальную локализацию. Частота таких типов поражения аорты составляет 89–96 %. Супраренальное и тотальное поражения имеют более редкий характер по частоте встречаемости.
Классификация торакоабдоминальных аневризм (TAAA) по Crawford S.E. (1986)
Большинство аневризм нисходящей грудной аорты и торакоабдоминальной её части являются вторичными по отношению к дегенерации медии. Зачастую причинами аневризм этих отделов становятся атеросклеротические повреждения. Не меньшую роль играют и воспалительные заболевания, системные патологии.
В 1986 году Crawford с соавт. описал первую классификационную схему торакоабдоминальных аневризм, основываясь на их анатомической протяжённости8. Пациентов, прооперированных в клинике с 1960-й по 1985-й год, было предложено разделить на 4 группы в зависимости от локализации и протяжённости аневризмы.
Варианты классификации расслоения аорты
1) Патогенетическая по Svensson L.G (1999)
В своей работе «Разрыв интимы без гематомы — важный вариант расслоения аорты, который может ускользнуть от современных методов визуализации» американский кардиохирург L.G. Svensson10 применяет патогенетическую классификацию разделения слоёв стенки аорты и описывает возможные варианты генеза острого аортального синдрома.
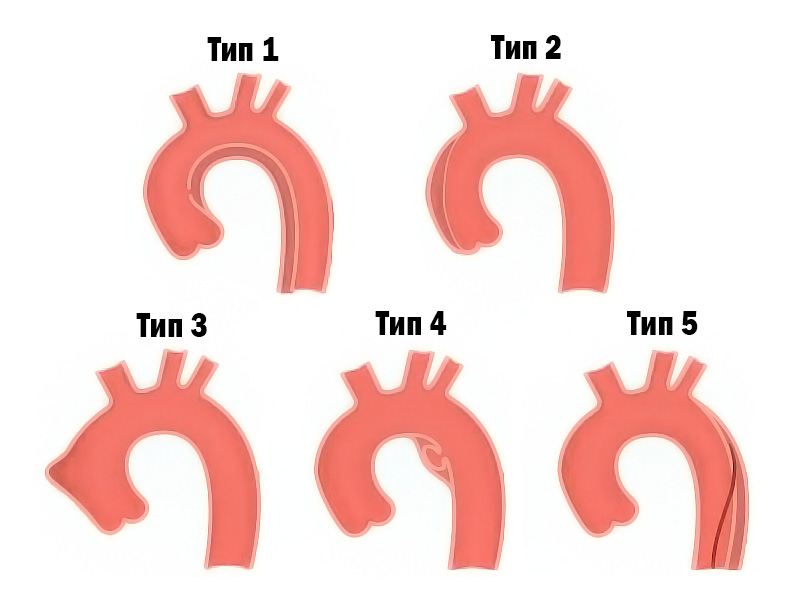
Тип 2) Внутристеночная гематома, которая разделяет интиму и медию, без видимого внутрипросветного дефекта.
Тип 3) Разрыв интимы без образования гематомы и образованием выпирающей деформации в месте повреждения.
Тип 4) Пенетрирующая атеросклеротическая язва, которая обычно повреждает средний слой аорты и образует локализованную гематому.
Тип 5) Ятрогеническое или травматическое расслоение (напр., при травмировании коронарным катетером).
Данная классификация удобна для работы с методами визуальной диагностики (КТ, МРТ и проч.) благодаря поиску и обнаружению не только классических случаев с образованием ложного просвета в стенке аорты, но и редко встречаемых случаев 3-го типа.
2) Стэнфордская (1970)
В соответствии со Стэнфордской (Stanford)11 классификацией различают два типа расслоения:
Тип А — разрыв интимы расположен в восходящей аорте и происходит поражение дуги аорты, а также нисходящей части аорты либо без неё.
Тип В — дефект в интиме нисходящего отдела аорты, при котором расслоение происходит дистально, не затрагивая восходящий участок аорты.
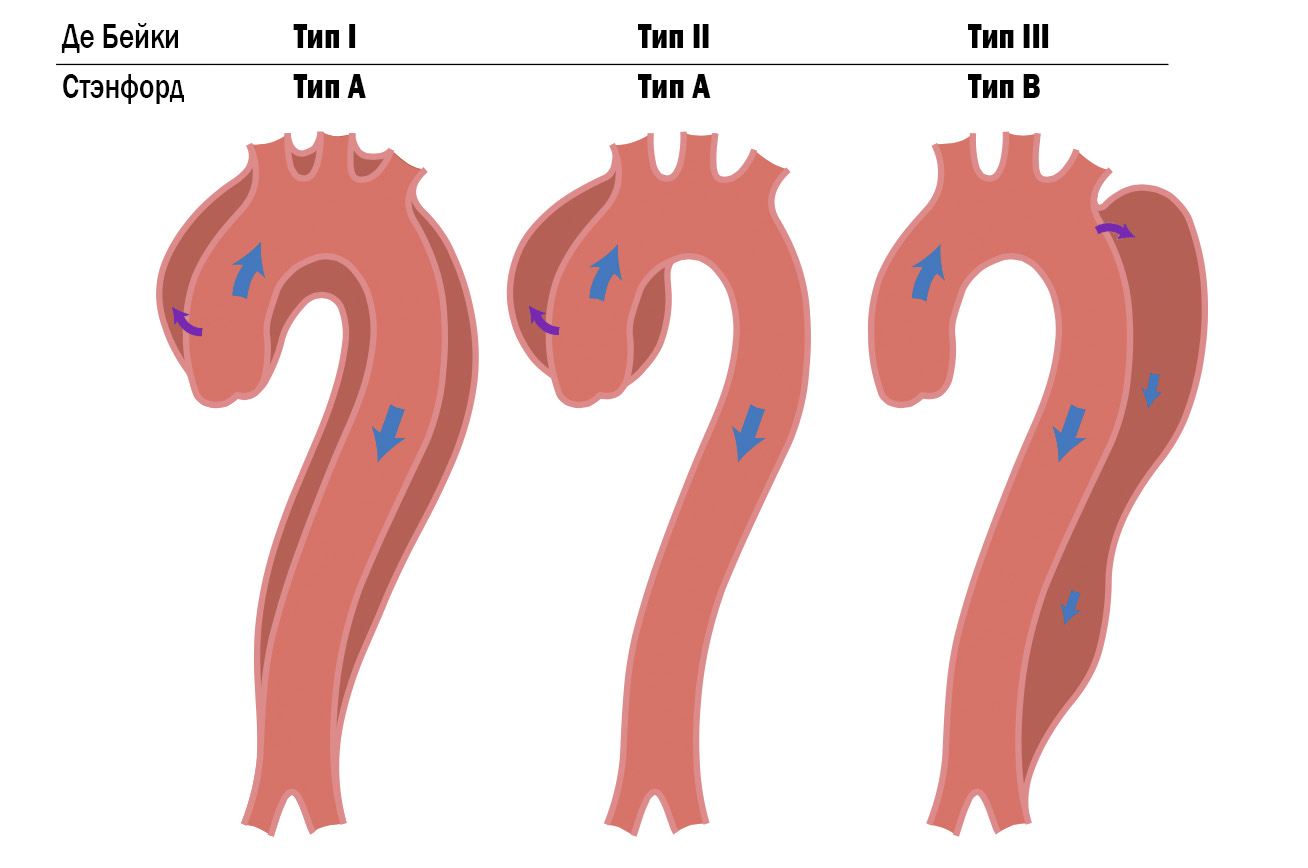
Рисунок 5. Сравнительная схема Стэнфордской классификации и классификации Де Бэйки. Тип A соответствует нескольким типам в классификации Де Бэйки. Фиолетовыми стрелками указано место первичного дефекта, синими стрелками ток крови по руслу.
Особенность этой классификации в тактике лечения. Например, хирургического вмешательства потребуют расслоения типа A, а в расслоениях типа B будут применяться консервативные методы лечения (за исключением осложненных ситуаций).
◆ Модификация Sievers H.H. (2019)
Дополнением к Стэнфордской классификации послужило исследование Sievers H.H.12 и его команды в области дополнительных вариантов расслоения аорты. Проблемой стало отсутствие в основной классификации изолированного поражения дуги или ее сочетанного поражения с нисходящей аортой. Для таких случаев автор предложил ввести дополнительный тип non-A non-B (Не тип-А и не тип-B).
Частота встречаемости типа non-A non-B среди всех острых расслоений по приблизительным расчётам составляет 3–11 %. Согласно исследованиям Sievers с соавт. и Lempel с соавт. пациенты с таким вариантом расслоения моложе и имеют меньшую летальность в сравнении с пациентами с расслоением типа A13. Тактика лечения в данном случае требует дальнейшего изучения.
3) M. de Bakey (1965)
Первейшей в истории классификацией с наибольшим распространением стала классификация американского кардиоторакального хирурга M.E. De Bakey с соавт14. В основе стоит уровень участия в процессе расслоения определенных анатомических структур. Её особенностью стало определение местоположения первичного дефекта.
Так, при I типе расслоение аорты начинается в восходящем отделе и распространяется в дистальном направлении на дугу и другие отделы аорты. Согласно авторам классификации, у пациентов с данным типом патологии часто присутствует недостаточность аортального клапана. Соответствует типу А по Стэнфордской классификации.
При II типе расслоение ограничено только восходящим отделом аорты. Дефект локализуется прямо над клапаном аорты и отмечается относительно тонкий адвентициальный слой стенки. Часто сочетается с недостаточностью аортального клапана, признаками синдрома Марфана. Соответствует типу А по Стэнфордской классификации.
При III типе разрыв интимы располагается в нисходящем отделе после отхождения левой подключичной артерии и распространяется в дистальном направлении грудного отдела аорты на различное расстояние. Соответствует типу B по Стэнфордской классификации
◆ Модификация Robicsek F. (1984)
Одним из тех, кто вписал себя в страницы истории стал американский кардиоторакальный хирург F. Robicsek15. Он ввёл некоторые расширения в изначальную классификацию De Bakey. Модифицированная версия получила больше практического значения в хирургии ввиду более детального описания первичного дефекта и распространённости расслоения по аорте.
При I типе патологический процесс может иметь два варианта течения: расслоение стенки заканчивается слепым мешком в дистальных отделах аорты (IA) или имеет место второй разрыв аорты в дистальном отделе (IB)
Тип II в данной модификации полностью соответствует изначальной классификации.
При III типе дефект стенки будет локализоваться в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии. Процесс расслоения приобретает 4 разновидности:
- III A — расслоение заканчивается слепым мешком выше диафрагмы.
- III B — расслоение заканчивается слепым мешком в дистальных отделах брюшной части аорты.
- III C — расслоение направлено не только дистально, но и распространяется ретроградно на дугу и восходящую часть аорты, заканчиваясь слепым мешком.
- III D — расслоение аорты распространяется на брюшную часть аорты с разрывом интимы в дистальном отделе.
4) Хронологическая периодизация
Различают острое, подострое и хроническое расслоение аорты по времени с момента возникновения симптомов. Однако существует несколько мнений о том, как следует разделять расслоение аорты по хронометражу. Так, в работах Hirst и DeBakey с соавт. острый период длится до 2-х недель между появлением симптомов и диагностикой, а хронический период имеет течение свыше 2-х недель16. В исследовании A. M. Booher с соавт. выделяется острейший (до 24 часов), острый (от 2 дней до недели), подострый (8 дней – 1 месяц) и хронический период (более 1 мес). В настоящее время принято разделение, указанное в Европейских рекомендациях 2014г. и Российских рекомендациях по заболеванию грудной и брюшной аорты 2017 года, где установлено следующее17: острый период (менее 14 дней), подострое расслоение (15 – 90 дней) и хроническое расслоение аорты (> 90 дней).
Большое разнообразие классификаций расслоений аорты обусловлено отсутствием единой стандартизированной системы. В настоящее время ведутся изучения других вариантов разделения патологии — TEM-system, по Россейкину, по Hiratzka и др. Однако они требуют дополнительных подтверждений для широкого применения.
Тактика подбора терапии при расслаивающей аневризме грудного отдела аорты
После проведения диагностического поиска и определения типа расслоения по представленным классификациям следует выбрать путь лечения и дальнейшего ведения пациента.
Тип А по Стэнфорду
Если расслоение аорты затрагивает корень аорты или восходящую аорту (тип А по Стэнфорду или типы I/II по DeBakey), лечение будет заключаться в открытой экстренной операции. Техника операции будет зависеть от пораженного сегмента аорты и общего состояния пациента. Целью операции является предотвращение разрыва аорты и летального исхода, а также коррекция аортальной регургитации и любой нарушенной перфузии. При остром расслоении аорты типа А летальность без операции составляет 50 % в течение первых 48 ч.
Хирургическое лечение в данный момент активно изучается, внедряются новые техники с использованием различных доступов и объемов оперативных вмешательств. У большей части пациентов коррекцию гемодинамических нарушений можно достичь заменой частей аорты (hemiarch, total arch, «хобот слона» и др. операции) в сочетании с протезированием аортального клапана или применения клапансберегающей техники.
Тип B по Стэнфорду
В случае, когда расслоение аорты затрагивает нисходящий грудной отдел (тип В по Стэнфорду или тип III по DeBakey), в лечении может быть использовано несколько стратегий ведения.
Естественное течение расслоения аорты такого типа часто неосложненное, поэтому в отсутствие мальперфузии или других признаков прогрессии заболевания пациенту можно проводить медикаментозную терапию, контролируя болевой синдром, уровень АД и ЧСС. При необходимости выполняются повторные визуализирующие исследования, предпочтительно проведение МРТ или КТ.
Из оперативного лечения при расслоении типа B используется эндоваскулярная технология TEVAR с применением стент-графта, которая является методом выбора при осложненном остром расслоении аорты. Целями TEVAR являются закрытие «первичного» дефекта в интиме и облитерация зон перфорации в нисходящей аорте. Данная технология показывает лучшие показатели в сравнении с открытыми операциями и медикаментозным лечением и широко применяется в хирургической терапии.
Тактика подбора терапии при расслаивающей аневризме брюшного отдела аорты
Консервативных методов лечения больных с аневризмой брюшной аорты не существует. Широко используются открытые операции c левосторонней тораколапаротомией или торакофренолюмботомией с забрюшинным выделением аорты и ее ветвей, эндоваскулярные (EVAR) и гибридные методы проведения хирургического лечения.
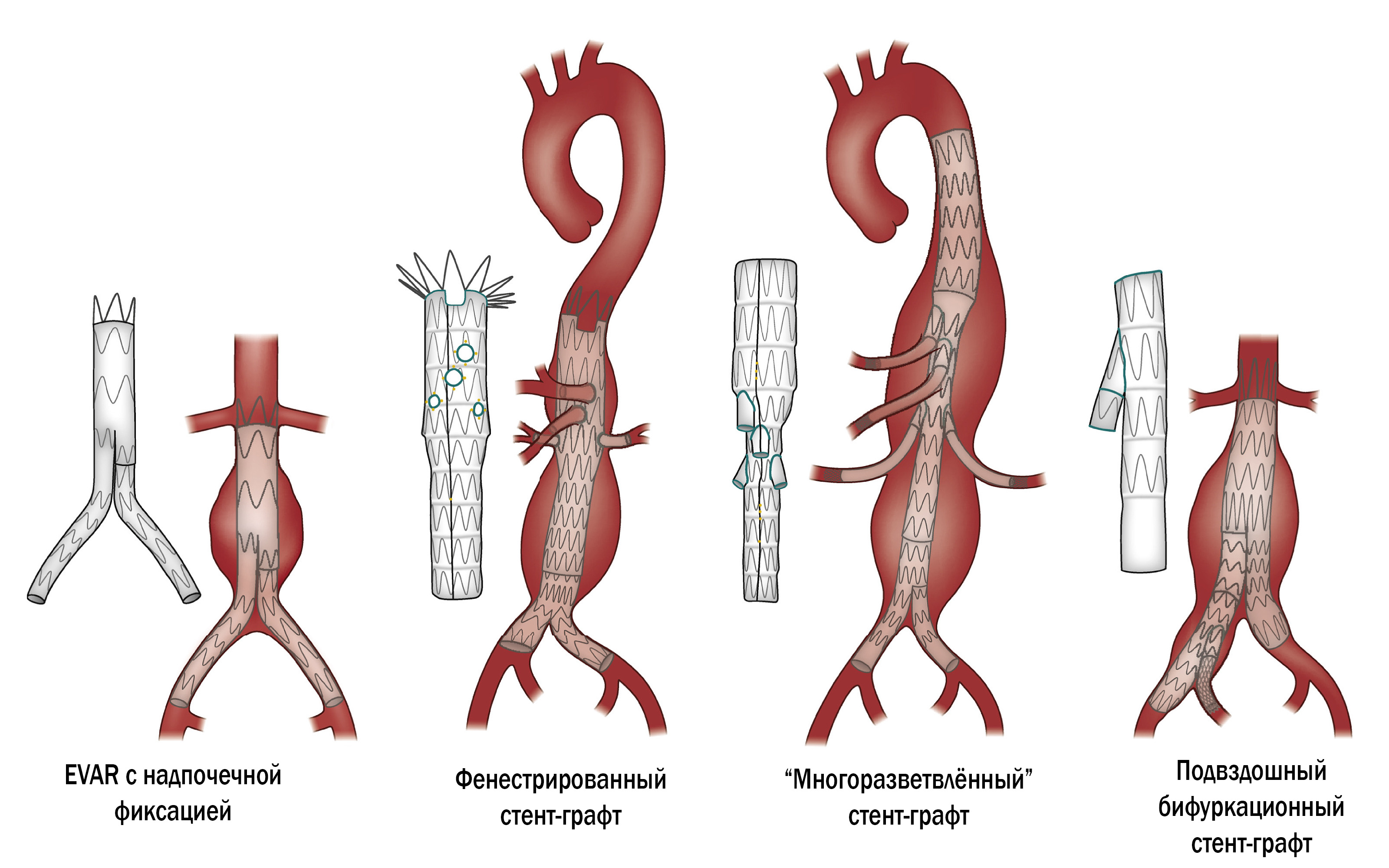
В настоящий момент продолжаются исследования по доступам, тактике и объемам операций, выбору наилучшего метода лечения расслаивающей аневризмы абдоминального отдела аорты для каждого конкретного пациента.
Основное место в лечении патологии аорты по-прежнему остается за хирургической коррекцией. Реконструктивные операции на аорте занимают одно из важнейших положений в сосудистой хирургии. С каждым годом арсенал технических приёмов и их модификаций, материалов, объёмов операций меняется и подстраивается под требования современной медицины. Подробное описание хирургических операций, показаний и методов их проведения будет в дополнительной статье, посвящённой хирургическим техникам лечения расслаивающей аневризмы аорты.
Прогресс, достигнутый за последние годы в диагностике и лечении острого аортального синдрома, предоставил большую базу данных о ведении пациентов с расслаивающей аневризмой аорты. Но вместе с тем обнаружились и «белые пятна» этой патологии. Множественность факторов риска, широкая вариация классификаций, отсутствие стандартизированных подходов для хирургического лечения — всё это даёт различные пути для поиска специфических маркеров ранней диагностики, унификации схем классификации и подбора оптимальной хирургической терапии с целью лучшего понимания и лечения данного заболевания.
Список литературы
- Vilacosta I, San Román JA, di Bartolomeo R, et al. Acute Aortic Syndrome Revisited: JACC State-of-the-Art Review. - Journal of the American College of Cardiology vol. 78,21, 2021. – 2106-2125p. – doi: 10.1016/j.jacc.2021.09.022
- Morgagni GB. De sedibus et causis morborum per anatomen indagatis / G.B. Morgagni. Epist XVII. Typographia Remondiniana, Venetiis, 1761. – 450p.
- Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). - European heart journal vol. 35,41, 2014. - 2873-2926p. -doi:10.1093/eurheartj/ehu281
- Покровский А. В. Клиническая ангиология: Руководство в двух томах. Т. 1. — М.: ОАО «Издательство «Медицина», 2004. - 888 с: ил. - ISBN 5-225-04857-9.
- Shen YH, LeMaire SA, Webb NR, Cassis LA, Daugherty A, Lu HS. Aortic Aneurysms and Dissections Series. - Arteriosclerosis, thrombosis, and vascular biology vol. 40,3, 2020. - 37-46p. - doi:10.1161/ATVBAHA.120.313991
- Ищенко В. Н., Сорокин В. А. Эволюция диагностики и хирургической тактики лечения расслоения аорты / ТМЖ. 2007. №2 (28). – C. 23-27
- Sayed A, Munir M, Bahbah EI. Aortic Dissection: A Review of the Pathophysiology, Management and Prospective Advances. - Current cardiology reviews vol. 17,4, 2021. – 15p. - doi:10.2174/1573403X16666201014142930
- Crawford ES, Crawford JL, Safi HJ, et al. Thoracoabdominal aortic aneurysms: preoperative and intraoperative factors determining immediate and long-term results of operations in 605 patients. - Journal Vasc. Surg. 3(3), 1986.- 389-404p. - doi:10.1067/mva.1986.avs0030389
- Safi HJ, Miller CC 3rd. Spinal cord protection in descending thoracic and thoracoabdominal aortic repair. - Ann Thorac Surg. 67(6), 1999. - 1937-1958p. - doi:10.1016/s0003-4975(99)00397-5
- Svensson LG, et al. Intimal tear without hematoma: an important variant of aortic dissection that can elude current imaging techniques. - Circulation vol. 99,10, 1999. - 1331-1336p. - doi:10.1161/01.cir.99.10.1331
- Daily PO, Trueblood HW, Stinson EB, Wuerflein RD, Shumway NE. Management of acute aortic dissections. - The Annals of thoracic surgery vol. 10,3, 1970. - 237-247p. - doi:10.1016/s0003-4975(10)65594-4
- Sievers HH, Rylski B, Czerny M, et al. Aortic dissection reconsidered: type, entry site, malperfusion classification adding clarity and enabling outcome prediction. - Interactive cardiovascular and thoracic surgery vol. 30,3,2020. - 451-457p. - doi:10.1093/icvts/ivz281
- Lempel JK, Frazier AA, Jeudy J, et al. Aortic arch dissection: a controversy of classification. - Radiology vol. 271,3, 2014. - 848-855p. - doi:10.1148/radiol.14131457
- Debakey ME, et al. Surgical management of dissecting aneurysms of the aorta. - The Journal of thoracic and cardiovascular surgery vol. 49,1965. - 130-149 p. - ISSN 0022-5223
- Robicsek F. Aneurysms of the thoracic aorta. - Vasc. Surg. 2-nd ed. Appleton-Century-Crofts, E. Norwalk, CT, 1984 – 637-684p.
- Hirst AE Jr, Johns VJ Jr, Kime SW Jr. Dissecting aneurysm of the aorta: a review of 505 cases. - Medicine vol. 37,3,1958. - 217-279p. - doi:10.1097/00005792-195809000-00003
- Клинические рекомендации. Рекомендации по диагностике и лечению заболеваний аорты (2017). - Кардиология и сердечно-сосудистая хирургия 11,1, 2018. – С. 7‑67
