Молекулярные основы кахексии
Резкое снижение мышечной массы при хронических заболеваниях — опасное для жизни состояние, эффективного лечения от которого не существует. Определение ведущего молекулярного механизма может предложить новые точки терапевтического воздействия.
Снижение массы тела характерно для пациентов с хроническими воспалительными заболеваниями, как например, злокачественные новообразования, сердечно-сосудистые заболевания, инфекции и нарушения обмена веществ. У таких людей наблюдается снижение аппетита и выраженное снижение массы скелетной мускулатуры и жировой ткани — все это проявление полиорганного синдрома, называемого кахексией [1]. У лиц, страдающих раком и кахексией, определяется более высокий риск слабого иммунного ответа на применяемую терапию и летального исхода по сравнению с пациентами без кахексии [2]. Усилия по смягчению проявлений кахексии включают диетотерапию, особый тренировочный режим и лекарственную терапию (фармацевтическое воздействие на потенциальные соединения-медиаторы) [2]. Однако воздействие на известные ныне молекулярные мишени недостаточно эффективно для предотвращения снижения мышечной массы или же ее восстановления [3-5]. В своей статье в Nature Билджик с соавт. [6] описывают молекулярный механизм, являющийся частью процесса деградации мышечной ткани. Этот механизм может стать новой мишенью терапевтического воздействия для борьбы с кахексией.
Поддержание мышечной массы осуществляется за счет баланса между синтезом и распадом белка. Потеря мышечной массы (что непосредственно связано с процессом кахексии), иначе называемая атрофией, характеризуется выраженным распадом белковых структур и снижением синтеза белка. Считается, что сочетание режима питания и физических упражнений способствует синтезу белка [7,8]. Однако для предотвращения чрезмерного распада белка необходимо идентифицировать молекулы, участвующие в ассоциированном с вышеупомянутым процессом воспаления, и ключевые узлы, в которых сходятся молекулярные сигнальные каскады.
Провоспалительные молекулы, называемые цитокинами, такие как TNF-α, IL-6 и TWEAK, вовлечены в процесс снижения мышечной массы: они активируют белок-транскрипционный фактор NF-κB. Этот сигнальный путь запускает экспрессию и активацию протеолитических ферментов [2]. Как было показано на животных моделях кахексии при раке, ингибирование этих цитокинов или их рецепторов может снизить степень потери мышечной массы. Однако в ходе клинических испытаний такие методы продемонстрировали недостаточную эффективность [3-5], что указывает на вовлеченность в процесс и других медиаторов.
Билджик с соавт. показывают на животных моделях кахексии, что сигнальный путь, элементами которого являются белок EDA (в частности, варианты этого белка EDA2 или EDA-A2), его рецептор EDA2R и сигнальные молекулы NIK и NF-κB (они включаются в каскад реакций следом за перечисленными молекулами), ответственен за мышечную атрофию (см. рис. 1). Как у мышей, так и людей в скелетных мышцах при различных заболеваниях, сопровождающихся мышечной атрофией, наблюдается более высокая степень экспрессии гена, кодирующего EDA2R. Введение EDA в мышечные клетки грызунов или человека (т.н. myotubes — с англ. «мышечные трубочки») в условиях in vitro приводило к уменьшению их размера и индуцировало экспрессию генов, участвующих в мышечной атрофии. Аналогичным образом, повышение экспрессии EDA2 посредством внутримышечного введения мышам вируса, экспрессирующего EDA2, приводило к снижению массы мышечной ткани в месте инъекции.
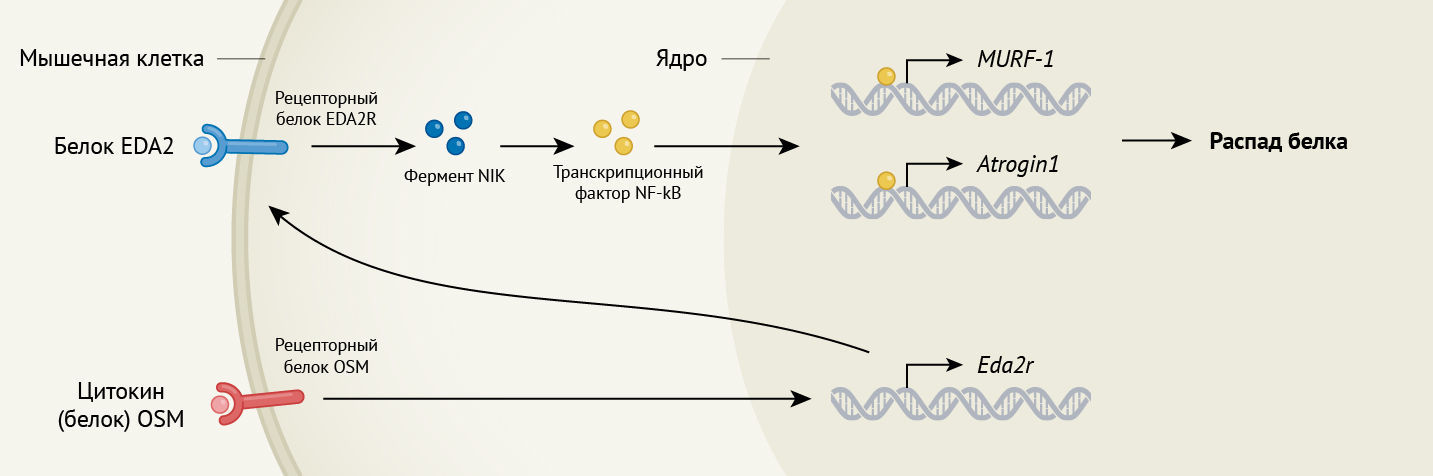
Авторы показывают, что EDA2 запускает мышечную атрофию путем активации белка NIK, который, в свою очередь, запускает NF-κB. NIK принадлежит к группе ферментов киназ, он является ключевым для сигнального пути NF-κB, который вовлечен во многие хронические воспалительные заболевания [9]. Генно-инженерная линия мышей с опухолями, у которой не экспрессирован EDA2R, была защищена от снижения массы тела и мышечной атрофии, однако не от потери жировой массы, что свидетельствует о том, что сигнальная ось EDA2 опосредует снижение мышечной массы во время кахексии при раке.
Билджик с соавт. продвинулись еще на один шаг вперед, чтобы выяснить, как экспрессия гена Eda2r усиливается в скелетных мышцах во время кахексии при раке. Из изученных авторами провоспалительных цитокинов, только OSM усиливал экспрессию Eda2r в «мышечных трубочках» в культурах клеток. OSM это представитель семейства цитокинов ИЛ-6, который передает сигналы посредством своего рецепторного белка OSMR (см. ссылку 10 в оригинале работы). Авторы обнаружили, что содержание OSM было выше в образцах плазмы крови мышей с кахексией, по сравнению с образцами, взятыми у мышей без кахексии, и показали, что OSM может напрямую влиять на развитие мышечной атрофии. Перечисленные эффекты оказались специфичны для мышечной ткани, потому что абляции гена Osmr (кодирует белок OSMR) в скелетных мышцах было достаточно, чтобы предотвратить усиление экспрессии Eda2r и атрофию.
Выводы Билджика с соавт. подтверждают теорию о том, что хроническое воспаление является главным «поставщиком» медиаторов разрушения тканей. Хотя в исследовании авторов и предполагается, что воздействие на OSM и/или сигнальный путь EDA2 может привести к уменьшению мышечной атрофии, для достижения успеха в ходе клинических испытаний необходимо учитывать несколько аспектов. Например, тщательный отбор пациентов с перечисленными выше воспалительными веществами может выявить лиц, у которых блокировка этих медиаторов могла бы принести наибольшую пользу. Важность выявления таких людей связана с тем фактом, что эти воспалительные пути характеризуются различными эффектами, а также с тем, что разные стадии кахексии как заболевания (прекахексии, собственно кахексии и тяжелой кахексии, называемой также рефрактерной кахексией) характеризуются различной последовательностью вовлечения в процесс цитокинов [3]. Изучение этих стадий заболевания в настоящее время ограничено отсутствием животных моделей, в которых полностью бы повторялись патофизиологические изменения этого состояния.
Поскольку снижение мышечной массы и кахексия обнаруживаются при широком спектре хронических воспалительных заболеваний, развитию кахексии могут способствовать различные иммунологические и метаболические сигнальные пути. Таким образом, существует острая необходимость в более точных концепциях и теориях развития кахексии для обеспечения ранней диагностики и формирования более качественной классификации ее стадий. Авторы полагают, что некая «волшебная пуля», способная одним точным воздействием поразить единственную молекулу всей патологической цепи, после чего весь процесс снижения мышечной массы посыпется словно домино, появится совсем не скоро [3]. Вместо этого особые режимы физических упражнений и диетотерапии вместе с фармакологическим воздействием на узлы, в которых сходятся многие патологические цепочки воспаления, в идеале с учетом органоспецифических эффектов, по всей видимости, станут ключом к разработке эффективного лечения кахексии.
