песочница
Аннотация
В сентябре-октябре 2022 года под эгидой International Society of Amyloidosis (ISA) состоялся XVIII Международный симпозиум по амилоидозу, в ходе которого в результате обсуждений были разработаны обновленные рекомендации по номенклатуре амилоида. Несмотря на то, что основные принципы номенклатуры остаются неизменными, все еще продолжаются дискуссии относительно клинической значимости и биохимической природы внутриклеточных белковых агрегатов, особенно связанных с развитием нейродегенеративных заболеваний. В обновленный список белков амилоидных фибрилл человека были добавлены шесть новых белков. Из них три являются полипептидными гормонами и два используются в настоящее время как пептидные препараты. Новый, шестой, белок амилоидных фибрилл представляет собой трансмембранный белок 106B, образующий внутриклеточные амилоидные фибриллы при состояниях, связанных с лобно-височной деменцией. В целом, в настоящее время известно 42 белка амилоидных фибрилл человека.
Читайте также: впвапвап
Введение
XVIII Международный симпозиум по амилоидозу проходил в Гейдельберге, Германия, 4–8 сентября 2022 г. Во время симпозиума состоялось заседание Номенклатурного комитета ISA. После XVII симпозиума ISA в 2020 году состав Номенклатурного комитета претерпел ряд изменений: к сожалению, организация потеряла одного из своих самых влиятельных ученых, профессора Меррилла Д. Бенсона [1]. Кроме того, еще один опытный участник, доктор Жан Сип, вышел из состава комитета. Тем не менее, были приглашены два новых члена: профессор Анджела Диспензиери, (клиника Майо, Рочестер, штат Миннесота) и профессор Маркус Фандрих (Ульмский университет, Германия). Таким образом, были пересмотрены ранее принятые определения и решения, обсуждены новые вопросы, поэтому члены комитета обновили Номенклатурный документ и рекомендации последней версии [2].
Амилоидные фибриллы
Основной структурной единицей амилоида является фибрилла. Амилоидная фибрилла состоит из особых скрученных протофиламентов. Амилоидный протофиламент, в свою очередь, представляет собой слои белка, сложенные в «стопку» в структуре b-слоя, которая при скручивании вокруг идентичных «стопок» образует амилоидную фибриллу. Амилоидные фибриллы могут быть образованы из одного, двух, трех, четырех или большего количества подобных протофиламентов. Протофиламенты связаны друг с другом параллельно через свои боковые цепи. Амилоидные протофиламенты и фибриллы могут быть получены как in vitro из белка, очищенного из отложений ex vivo, так и из синтетических или рекомбинантных пептидов. Такие фибриллы имеют характерное фибриллярное строение, рентгеноструктурные дифракционные особенности и сродство c особыми красителями, такими как тиофлавин Т и конго красный. Кстати, при окрашивании последним отмечается феномен типичного двойного лучепреломления амилоида в поляризованном свете. Недавно стало ясно, что фибриллы, генерируемые in vivo, могут отличаться от фибрилл, полученных из того же предшественника, синтезированного in vitro. Эти различия могут отражать другую конформацию белка или более низкую протеолитическую стабильность фибрилл in vitro по сравнению с фибриллами, выделенными из живых тканей [3]. Еще в 2018 году Номенклатурный комитет согласовал общее определение названия «амилоид», которое по-разному использовалось разными группами исследователей. В медицине его использовали только при патологических отложениях специфических агрегатов фибриллярных белков с особыми микроскопическими свойствами; в частности, сродством к красителю конго красный с проявлением двойного лучепреломления. Тем не менее, теперь ясно, что такое окрашивание может значительно различаться по интенсивности и внешнему виду. Так, в медицине амилоид считался аномальным белком, что пришлось пересмотреть в связи с открытием «функциональных амилоидов» (см. ниже). Биохимики все чаще использовали слово «амилоид» для белковых фибрилл любого типа, включая синтетические или естественные фибриллы. Комитет согласен с тем, что термин «амилоидная фибрилла» должен использоваться для любой фибриллы, поперечно связанной с b-слоем [4]. Рекомендуется использовать слово «амилоид» таким образом, чтобы его природа и происхождение были ясны.
Функциональный амилоид
В природе фибриллы b-слоя имеют целый спектр функций. Некоторые полипептидные гормоны находятся в конформации b-слоев, возможно, не в виде обычных фибрилл; так, меланин связан с фибриллярным носителем b-слоев (p-mel17) в меланосомах. Прочность таких фибрилл используется рядом бактериальных и грибковых микроорганизмов. Бактерии создают различные структуры, таких как биопленки, которые имеют в своем составе фибриллярные композиции b-слоя. Гриб Neurospora crassa экспрессирует гидрофобин EAS, который образует амфипатические амилоидные монослои, облегчающие образование и распространение спор [5]. Все это примеры того, что мы сейчас понимаем как функциональный амилоид.
Классы амилоидных фибрилл
Ранние наблюдения предполагали, что все амилоидные фибриллы имеют сходный или хотя бы похожий внешний вид, несмотря на то, что они произошли от множества разных белков-предшественников. Однако современные биофизические исследования ясно продемонстрировали, что различия все-таки есть. Более того, было обнаружено, что фибриллы, образованные in vitro из рекомбинантного белка (обычно за короткие промежутки времени), могут сильно отличаться от фибрилл, образованных in vivo из того же предшественника (часто в течение длительного периода времени). Тем не менее, в расширенном определении «амилоида» необходимо говорить о разных классах амилоидных фибрилл:
- волокна, синтезированные in vivo и ex vivo, связанные с развитием различных заболеваний;
- функциональные фибриллы, синтезированные in vivo и ex vivo;
- рекомбинантные фибриллы функциональных амилоидных белков, a также белков, которые связаны c развитием заболеваний;
- фибриллы синтетических пептидов или пептидов, не связанных с развитием заболеваний;
- фибриллы из конденсатов и гидрогелей, дающие характерную рентгеновскую дифрактограмму кросс-b.
Амилоид и амилоидоз в медицинской практике
Местный и системный амилоидоз
Термин «амилоидоз» характеризует присутствие амилоидных фибрилл в живом организме. В этой статье различие между местным и системным амилоидозом основано на взаимосвязи между местом образования белка-предшественника фибрилл и его отложением в виде фибрилл, т. е. при системном амилоидозе место синтеза анатомически удалено от места отложения. Некоторые виды амилоида могут появляться во многих органах, но тем не менее классифицируются как локализованные. К ним относятся амилоиды AMed и AEFEMP1, которые в основном поражают сосуды. Насколько известно, их предшественники экспрессируются вблизи мест отложения, но в этом вопросе необходимы дальнейшие исследования. Как уже отмечалось, в некоторых случаях амилоидоз проявляет себя как системный и местный одновременно.
Амилоидные белки и их номенклатура
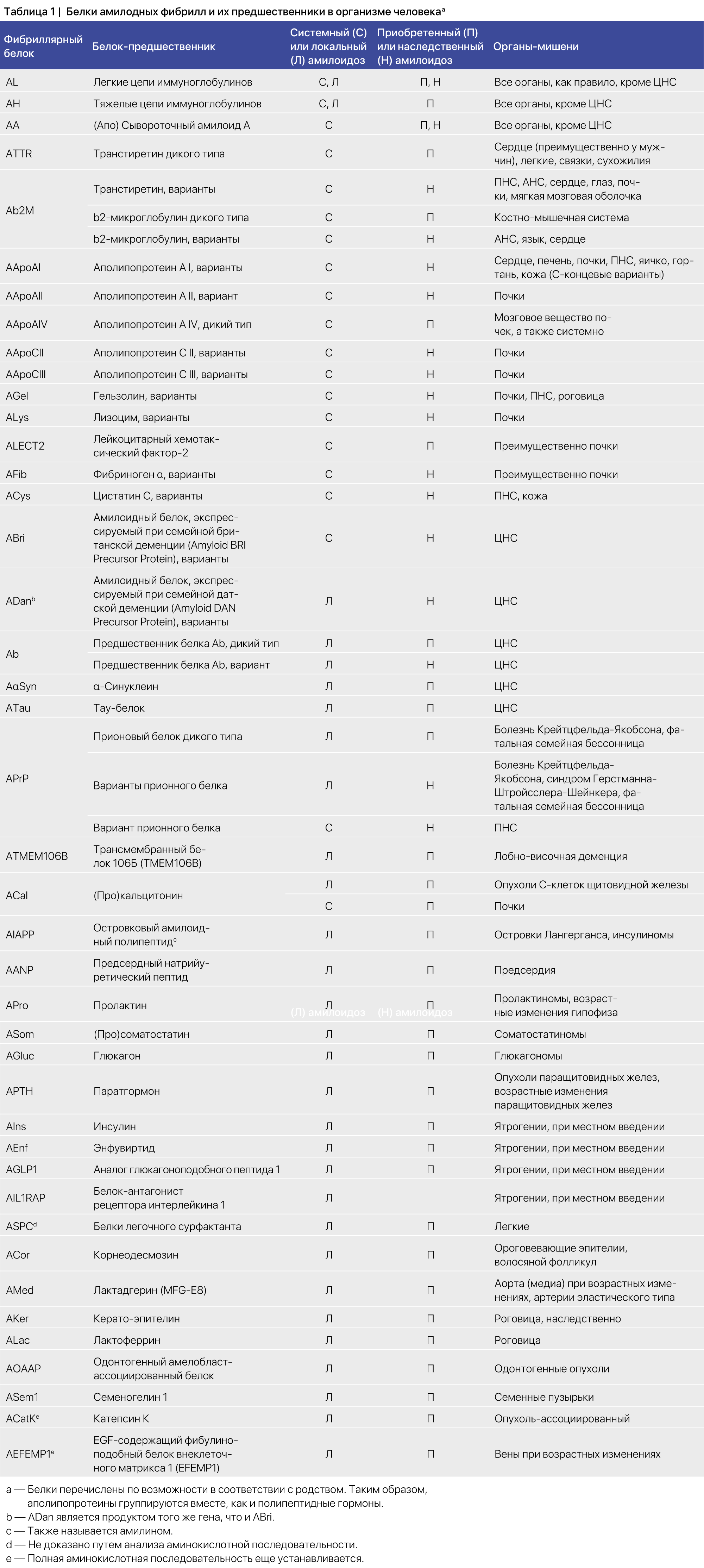
Принципы номенклатуры были даны в более ранних версиях, их историю можно посмотреть в этой статье [4]. Структурные белки в амилоидных фибриллах названы в честь их предшественников в сокращенной форме, перед которой стоит буква A, обозначающая слово «амилоид». Таким образом, амилоидный белок легкой цепи иммуноглобулина назван AL («light chain amyloid»), а транстиретиновый амилоидный белок — ATTR (таблица 1). Название белка может дополнительно уточнять его структуру, например, ATTR-v для особого варианта транстиретинового амилоида, ATTRV30M — для белка c конкретной мутацией или ATTRwt — для формы дикого типа. Для уточнения мутаций Комитет по номенклатуре рекомендует использовать нумерацию, основанную на последовательности зрелого белка, т. е. без указания лидерной последовательности или же пропептидов. Этот принцип может быть проблематичным для обозначения некоторых белков, в таком случае могут потребоваться дополнительные уточнения. Также может использоваться нумерация полного предшественника, но в таком случае — в скобках после зрелого белка: например, TTRV30M в случае с TTR. Подчеркнем, что сокращения относятся именно к белкам, а не к вызываемым ими заболеваниям. Для последних следует использовать название белка, за которым следует «амилоидоз», например, ATTR-амилоидоз или AL-амилоидоз. Могут применяться и клинически значимые спецификации, такие как, например ATTR-кардиомиопатия или AL-нейропатия. В целях унификации авторы номенклатуры рекомендуют уточнять вариант (в случаях, когда это требуется) после названия самого белка, например ATTR-wt или ATTR-v. Обратите внимание, что для обозначения варианта следует использовать букву v (v — variant), а не например, m (m — mutant, мутантный) или h (h — hereditary, наследственный), поскольку последний можно ошибочно принять за «человеческий» (тоже h, но human). Нумерация аминокислотных остатков в рекомбинантных белках должна по возможности совпадать с их нумерацией в фибрилле или белке-предшественнике фибрилл. Была предложена возможность использования hATTR (h — наследственный) вместо рекомендуемого названия ATTRv, особенно когда речь идет о юридических тонкостях. При необходимости это может быть приемлемо в исключительных случаях, но следует четко указать причину такого выбора, а также рекомендуемое название.
Таблица 1 | ываываываыва
Сигнатурные белки амилоида
В отложениях амилоида содержатся не только специфические белки амилоидных фибрилл, но и компоненты, присутствующие в большинстве видов амилоида. Наиболее хорошо изучены сывороточный амилоидный Р-компонент (SAP) и гепарансульфатные протеогликаны (HSPG), оба из которых, по-видимому, важны как для стабильности молекулы самой фибриллы, так и (по крайней мере, это справедливо в отношении HSPG) непосредственно для образования амилоида. Есть и другие белки, которые прикрепляются к фибрилле посредством неизвестных механизмов. Среди прочего, они включают аполипопротеин A-IV и аполипопротеин E в сочетании c соединениями, природа которых все еще изучается. Присутствие этих белков использовалось в масс-спектрометрии в качестве дополнительного доказательства того, что аномальные отложения в ткани действительно содержат амилоид. Данные компоненты были обозначены как «амилоидные сигнатурные белки» [6].
Новые белки амилоидных фибрилл и пересмотр существующей номенклатуры
После последнего обновления Номенклатурной статьи от 2020 года несколько новых белков в организме человека были идентифицированы как амилоиды [2]. Количество белков амилоидных фибрилл в настоящее время составляет 42, из которых 14 появляются только в виде системных отложений, 24 наблюдаются исключительно в виде локальных амилоидов, а четыре могут проявляться в обоих типах (таблица 1). Примечательно, что при подкожном введении самоагрегирующихся белков были идентифицированы две новые ятрогенные формы амилоида. Вероятно, в будущем будет выявлено еще больше таких ятрогенных амилоидов. Очевидно, что клиническая осведомленность об этой возможности очень важна.
Новые белки амилоидных фибрилл человека
Паратгормон
Амилоид является частой находкой в фолликулах паращитовидных желез людей старшего возраста [7, 8], a также при гиперпластических или аденоматозных процессах в паращитовидных железах [7, 9]. Colombat et al. выделили амилоид из аденомы паращитовидной железы, проанализировали материал с помощью масс-спектрометрии и, что неудивительно, обнаружили в этом амилоиде паратиреоидный гормон (ПТГ) в качестве единственного основного белка амилоидных фибрилл [10]. ПТГ человека экспрессируется в виде полипептида из 115 аминокислотных остатков (АО), из которого удалены сигнальный пептид из 25 АО и пропептид из 6 АО с образованием зрелого ПТГ из 84 АО [11]. Как и у большинства других эндокринных амилоидов, в нем не было признаков протеолитического расщепления белка-предшественника. Такой вид амилоида получил название APTH.
Соматостатин
Соматостатин синтезируется в виде полипептида из 116 АО, из которого удален сигнальный пептид, состоящий из 24 АО. Полученный пропептид из 92 АО подвергается дальнейшему процессингу с получением соматостатинов-14 или -28, составляющих С-конец предшественника (просоматостатина) [12]. Соматостатин экспрессируется в дельта-клетках островков Лангерганса, а также в клетках желудочно-кишечного тракта и головного мозга. В двух недавних работах соматостатин описан как белок амилоидных фибрилл при соматостатиномах. В одной из статей содержится описание четырех клинических случаев. Точную форму соматостатина в отложениях определить пока не представляется возможным [13]. В другой статье описан анализ амилоида в нейроэндокринной опухоли двенадцатиперстной кишки, где фибриллярный белок был получен из предшественника соматостатина [14]. Точную часть предшественника, включающую амилоидные фибриллы, не определяли. Такой вид амилоида получил название ASom.
Глюкагон и глюкагоноподобный пептид 1
Глюкагон экспрессируется в виде препробелка из 180 АО, из которого удален сигнальный пептид из 20 АО с образованием пропептида, который далее может процессироваться по-разному, в зависимости от вида синтезирующей клетки [15]. В островках Лангерганса α-клетки образуют 29-пептидный гормон глюкагон, в то время как большая молекула прогормона по-разному обрабатывается в кишечных L-клетках, где продуцируется глюкагоноподобный пептид 1, который секретируется в кровь [16]. Ранее было показано, что глюкагон образует амилоидные фибриллы in vitro [17, 18], поэтому обнаружение амилоида, полученного из глюкагона, в глюкагономе неудивительно [19]. Пептид был внесен в список ожидания в публикации Номенклатуры 2020 года и теперь принят в качестве фибриллярного белка. Такой амилоидный белок называется AGluc. Пока получен только один клинический отчет о локализованном подкожном амилоидозе после повторных инъекций аналога глюкагоноподобного пептида 1 (ГПП-1) лираглутида, пептидного препарата, в котором нативный лизин в положении 28 заменен на аргинин [20]. Препарат назначают пациентам с диабетом второго типа для стимуляции высвобождения инсулина. Анализ амилоида у одного пациента методами масс-спектрометрии и иммуногистохимии показал, что фибриллы образовались из введенного препарата. Данный амилоидный белок получил название AGLP1.
Белок-антагонист рецептора интерлейкина 1
Интерлейкин 1 представляет собой известный провоспалительный цитокин, который сверхэкспрессируется при ряде воспалительных заболеваний, например, при аутоиммунных заболеваниях и ревматоидном артрите. Белок-антагонист рецептора интерлейкина 1 экспрессируется в виде белка из 177 АО, включая сигнальный пептид из 25 АО. Препарат анакинра представляет собой рекомбинантный аналог, который связывается с рецептором IL-1 и, таким образом, проявляет противовоспалительные свойства и используется в терапевтических целях при ревматоидном артрите и ряде других воспалительных заболеваний. Препарат вводят подкожно в разовой суточной дозе 100 мг, которая может варьироваться в зависимости от клинического состояния пациента. В недавнем сообщении были описаны два пациента с выраженными локализованными подкожными отложениями амилоида в месте инъекций [21]. Масс-спектрометрический анализ показал, что они имеют природу белка-антагониста рецептора интерлейкина 1. Белок амилоидных фибрилл в этом случае назвали AIL1RAP.
Трансмембранный белок 106Б (TMEM106B)
Лобно-височная деменция (ЛВД), характерная для ряда церебральных заболеваний, приводящих к деменции, связана с внутринейрональным отложением амилоидных фибрилл. В недавних сообщениях было обнаружено, что белок амилоидных фибрилл в данном случае происходит от С-концевого сегмента TMEM106B, лизосомального трансмембранного белка [22–24]. В головном мозге пациентов, у которых клинически и морфологически диагностирован подтип FTLD-TDP, как сообщает Jiang et al., также обнаружены амилоидные фибриллы типа TMEM106B, а также нефибриллярные агрегаты TDP-43. Schweighauser et al. обнаружили амилоидные фибриллы TMEM106B в головном мозге 22 человек c различными нейродегенеративными заболеваниями, включая спорадические и наследственные таупатии, β-амилоидозы, синуклеинопатии и TDP-43-патии, а также у двух условно здоровых людей. Фибриллы также встречались в нейронах пожилых, но не молодых неврологически здоровых пациентов, что, возможно, свидетельствует о том, что образование фибрилл TMEM106B связано c возрастом. Белок амилоидных фибрилл получил название ATMEM106B.
АА-амилоидоз как наследственное заболевание
Мутация в гене SAA1, приводящая к стойкой гиперэкспрессии SAA1.1 и сопутствующему повышению концентрации этого белка в плазме крови, была описана в семье с идиопатическим АА-амилоидозом [25]. Болезнь стала клинически проявляться, когда носители были в возрасте около 30 лет. Удивительно, но в отличие от зашкаливающих уровней SAA при, например, воспалительных заболеваниях, у членов этой семьи концентрация SAA в плазме была всего вдвое больше, что, однако, привело к развитию системного амилоидоза.
Белки амилоидных фибрилл животных
Только 11 подобных амилоидных форм были биохимически охарактеризованы; тем не менее, продолжаются дальнейшие исследования и по другим формам. В таблицу 2 добавлена одна новая форма амилоидоза у животных.
EGF-содержащий фибулин-подобный белок внеклеточного матрикса 1
EGF-содержащий фибулин-подобный белок внеклеточного матрикса 1 (EFEMP1), описанный ранее как предшественник амилоида в организме человека, был идентифицирован как фибриллярный белок у находящихся под угрозой исчезновения леопардовых кошек Цусима (Prionailurus bengalensis euptilurus). В отличие от того, что мы в настоящее время знаем об этом заболевании у людей, амилоидоз у одного изученного животного имел системное распространение [26].
Комментарий
Амилоидные отложения являются патогенными в случае системного заболевания, но сейчас также становится ясно, что даже олигомерные агрегаты ответственны за прямые токсические эффекты, по крайней мере, при некоторых заболеваниях. То же самое почти наверняка верно для некоторых локализованных амилоидных белков, например, Ab и IAPP.
Потенциальные белки амилоидных фибрилл, находящиеся на стадии изучения
В предыдущей публикации Номенклатуры в эту категорию были включены четыре белка (таблица 3). Глюкагон был перенесен в таблицу 1, в то время как три других белка, включая полисахарид-связывающий белок крыс, галектин 7 и десмин, остаются в стадии изучения. Теперь Комитет добавляет в список потенциальных предшественников амилоида и всем известный белок p53.
Р53
Р53 является онкосупрессором, при мутации которого наблюдается потеря его функции c развитием самых разнообразных злокачественных новообразований. Р53 может преобразовываться в фибриллярные формы с приобретением свойств, сходных с паттерном агрегации других амилоидов, именно поэтому он был предложен в качестве белка амилоидных фибрилл. Однако, по-видимому, для фибрилл p53 in vivo не было обнаружено характерной структуры b-слоя. Еще одна особенность заключается в том, что агрегированный p53 дикого типа, как сообщается, способствует опухолевому росту, так как позволяет клеткам избегать апоптоза [27]. Поскольку в настоящее время в этой области ведутся интенсивные исследования, Комитет по номенклатуре решил оставить этот белок в списке ожидания.
Патологические внутриклеточные белковые агрегаты
Как становится ясно из таблицы 1, при развитии большинства клинических системных амилоидозов человека синтез предшественника фибрилл часто происходит клетками, находящимися на довольно ощутимом расстоянии от места непосредственного повреждения ткани, например, при продукции ATTR в печени с отложением амилоида в миокарде и периферических нервах. Однако предшественники также могут быть синтезированы в клетках, близких к месту отложения внеклеточных фибрилл; например, продуцирование клетками пигментного эпителия сетчатки TTR с фибриллами в стекловидном теле или легких цепей иммуноглобулина плазматическими клетками вблизи локализованных отложений AL-амилоида. В той степени, в которой все предшественники фибрилл имеют определенные конформации, делающие их восприимчивыми к неправильному свертыванию и последующей агрегации, что приводит к фибриллогенезу, синтезирующие клетки должны иметь механизмы, позволяющие избежать токсического действия белков, склонных к агрегации, а также позволять этим молекулам покидать клетку в растворимое неагрегированное состояние. Протеостатическая сеть включает в себя семейство шаперонов, стабилизирующих белок, а также ряд каскадов катаболизма белков и агрегатов с явно неправильной конформацией (протеасомы, аутофагии, лизосомы) [28]. Специфический механизм, используемый клетками при взаимодействии c белками, которые синтезируются в эндоплазматическом ретикулуме и предназначены для секреции, известен как реакция развернутых белков (UPR — unfolded protein response). Он хорошо развит в клетках, продуцирующих большое количество секретируемых белков, таких как, например, гепатоциты или плазматические клетки, и защищает клетку от вредоносного воздействия агрегатов, образованных из большого количества неправильно свернутого белка. Таким образом, отложения амилоида в вышеперечисленных клетках обнаруживаются редко. За клеточную самозащиту многоклеточным организмам приходится платить тем, что секретируемые, потенциально неправильно сформированные, склонные к агрегации белки могут свободно циркулировать, подвергая отдаленные органы риску отложения амилоида в условиях, которые еще остаются на стадии изучения. Оказавшись вне клетки, амилоидные предшественники могут повышать свою стабильность за счет присущей им гомо- или гетеромерной структуры, специфического взаимодействия c лигандами, связывания и ко-транспорта с клеточными и внеклеточными шаперонами, такими, как ERdj3 или кластерин. Еще как вариант, в определенных тканях-мишенях склонность к агрегации и образованию фибрилл может усиливаться резидентными молекулами ткани или внеклеточного матрикса, включая эндопротеазы. Присутствие внутриклеточных агрегатов при нейродегенеративных заболеваниях (например, тау-белок, гентингтин, а-синуклеин) и в некоторых локализациях, таких как островковые бета-клетки, некоторые из которых, как показано, состоят из амилоидных фибрилл (таблицы 1 и 3), предполагает, что протеостатические механизмы в нейронах могут качественно или количественно отличаться от таковых в клетках, которые в ходе эволюции научились секретировать большое количество белков, например, гепатоциты или плазматические клетки. Поскольку сложный протеостатический механизм зависит от энергии, генерируемой митохондриями, возможно, что незначительная митохондриальная дисфункция, усугубляемая старением, может также приводить к агрегации внутриклеточных белков. Агрегаты белков могут и не обладать характерной амилоидной структурой, но они обязательно будут запускать каскад протеотоксических реакций, приводящих к стойкой дисфункции и последующей гибели клеток. Механизмы клеточной токсичности кажутся сходными для амилоидных и неамилоидных внутриклеточных белковых агрегатов. Некоторые белки, которые не имеют структуры фибриллярных белков, являются амилоидогенными, что указывает на то, что внутриклеточные агрегаты могут быть промежуточными звеньями на пути образования амилоида. В настоящее время технически невозможно точно охарактеризовать внутриклеточные токсичные виды. Таким образом, при современном уровне знаний различие между агрегатами внутриклеточных белков, основанное на наличии зрелых фибрилл, к сожалению, не может продемонстрировать большой клинической значимости. С терапевтической точки зрения, поскольку цель состоит в том, чтобы избежать агрегации цитотоксических белков, термин «патологический белковый агрегат» кажется более всеобъемлющим, чем «амилоидный белковый агрегат». Несмотря на то, что авторы Номенклатуры подчеркивают различие между амилоидообразующими белками, они признают, что и другие белки могут вызывать повреждение органов-мишеней через аналогичные или родственные молекулярные механизмы. Еще неизвестно, будут ли будущие методы лечения специфичны для амилоидных агрегатов по сравнению с неамилоидными, или наоборот. С точки зрения Номенклатуры может возникнуть вопрос, могут ли белки в неамилоидных агрегатах называться белком-A или потребуется новое обозначение. В то время как амилоидоз, очевидно, является заболеванием органов-мишеней, современные исследования AL- и ATTR-амилоидоза показывают, что очень хороший терапевтический эффект могут иметь такие меры, как таргетинг на клетки, синтезирующие неправильно структурированные предшественники белка, склонные к агрегации, либо элиминация таких клеток с помощью антиклоновой терапии в случае AL-амилоидоза, либо существенное снижение выработки TTR путем нацеливания РНК или генов в печени.
Комментарий о внутриклеточных белковых агрегатах
Как обсуждалось выше, существует множество внутриклеточных включений, состав которых пока неизвестен, и которые проявляют, по крайней мере, некоторые типичные свойства амилоидных фибрилл (таблица 4).
Список литературы
- 2022 г. Nemolizumab on Moderate-to-Severe Atopic Dermatitis - Clinical Trials Registry - ICH GCP.
- 2022. Atopic Dermatitis Treatment Is Evolving (medscape.com)
- Ревякина В. А. и др. Биологические препараты в терапии атопического дерматита и бронхиальной астмы: фокус на дупилумаб //Педиатрия. Приложение к журналу Consilium Medicum. – 2021. – №. 2. – С. 129-137.
- Инструкция по медицинскому применению лекарственного препарата дупикасент
- IgE–иммуноглобулин E. Клинические рекомендации–Атопический дерматит–2021-2022-2023 (26.08. 2021)–Утверждены Минздравом РФ.
- 2022 г. Data Show Lebrikizumab Atopic Dermatitis Effects Maintained
- Simpson E. L. et al. Efficacy and Safety of Lebrikizumab in Combination With Topical Corticosteroids in Adolescents and Adults With Moderate-to-Severe Atopic Dermatitis: A Randomized Clinical Trial (ADhere) //JAMA dermatology. – 2023.
