Новые подходы к лечению психических расстройств

Психические расстройства — широко распространенные, часто тяжелые заболевания, которые негативно сказываются на жизни миллионов людей во всем мире. Хотя их этиологическая и диагностическая неоднородность уже давно затрудняет поиск лекарств, новое понимание психических заболеваний, основанное на нервных цепях, предлагает важную альтернативу нынешнему пути проб и ошибок как при разработке, так и при клиническом применении методов терапии. В настоящем обзоре рассмотрены новые и разрабатываемые подходы к лечению с особым вниманием к революционному потенциалу методик на основе нервных цепей для точной психиатрии. Представлены ограничения таких моделей, проблемы вывода на рынок точной терапии и важные достижения, необходимые для преодоления этих препятствий.
По оценкам, 970 миллионов человек во всем мире страдают психическими расстройствами [1]. В отличие от многих других хронических заболеваний, психические расстройства часто возникают в детстве, подростковом или юношеском возрасте и сохраняются на протяжении всей жизни, ухудшая функции и качество жизни на многие десятилетия [2]. В результате в совокупности психические заболевания служат ведущей причиной инвалидности с глобальными издержками, исчисляемыми триллионами [3, 4]. Несмотря на наличие множества соматических и психологических методов лечения, доступ к качественной помощи крайне ограничен, а величина эффекта от большинства терапевтических подходов невелика [5]. Общее отсутствие практического понимания патофизиологии заболевания и нехватка надежных диагностических или терапевтических биомаркеров также ограничивают клиническую практику методом проб и ошибок, который может быть длительным, разочаровывающим процессом для пациентов и врачей и по-прежнему оставляет до 60% лиц в состоянии резистентности к терапии [6]. Исторически наиболее распространенная «биологическая» концепция психического заболевания делала акцент на молекулярных и клеточных механизмах и терапевтических мишенях; однако в последнее время как в качестве объяснительной модели, так и в качестве основы для разработки методик стали использоваться организация и функции нервных цепей. Быстрое развитие технологий и передовых аналитических инструментов (как в лаборатории, так и в клинике) и сотрудничество между дисциплинами нейронауки, наряду с десятилетним успехом в психиатрической генетике и геномике, бросают вызов традиционным диагностическим границам и понятию терапевтической специфичности. Появляется перспективный путь в связывании индивидуальных симптомов и кластеров симптомов с механизмами и методами терапии в рамках персонализированного подхода. В этом обзоре авторы расскажут, как методы стимуляции мозга улучшают понимание психических заболеваний, обсудят новые и разрабатываемые подходы к лечению, основанные на понимании психических заболеваний с точки зрения нервных цепей, и рассмотрят факторы, препятствующие поставке прецизионных терапевтических средств на клинический рынок.
Психиатрические заболевания с точки зрения нервных цепей
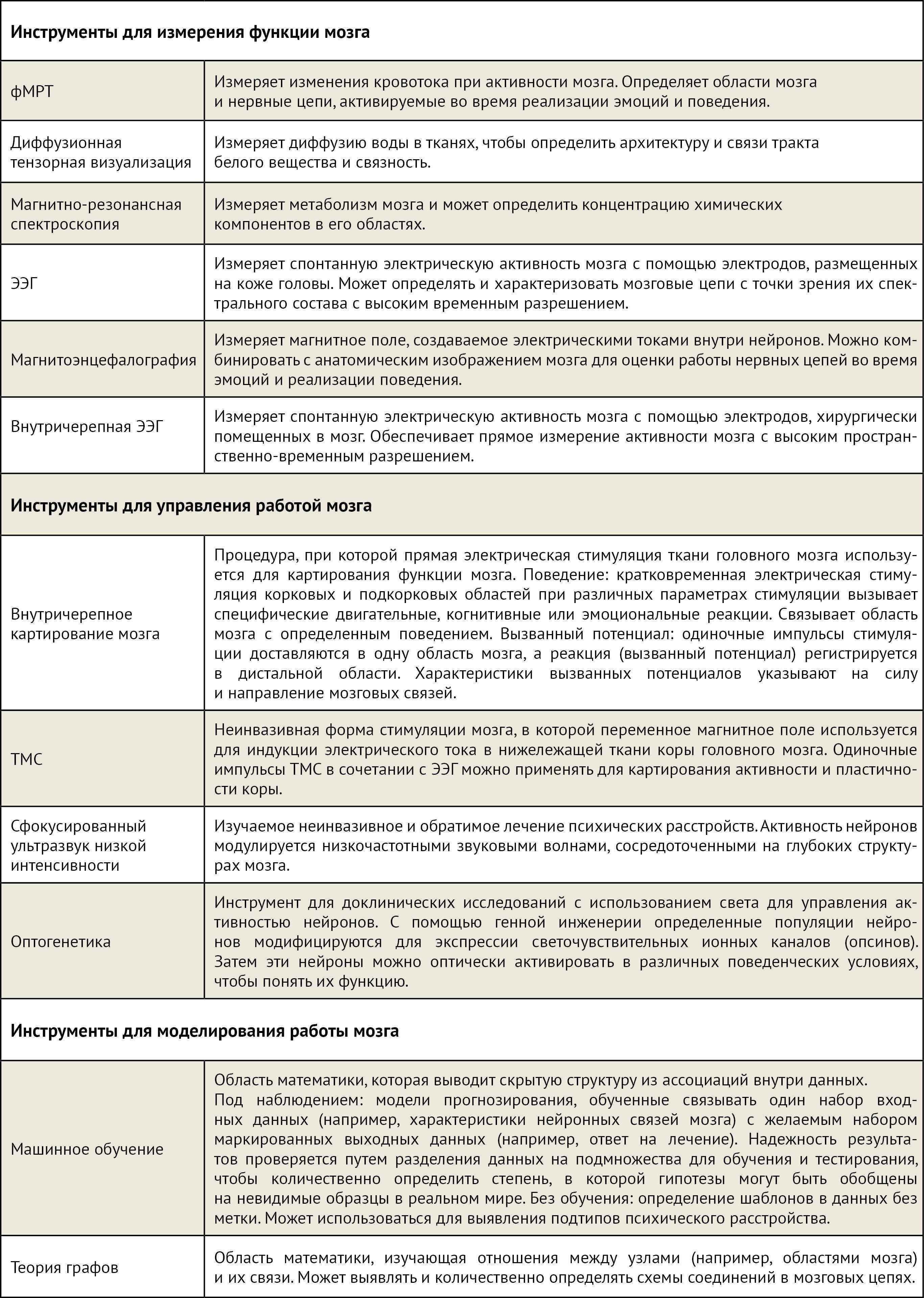
За последние несколько десятилетий концепция психического заболевания перешла от понятия «химического дисбаланса» к концепции, которая фокусируется на генетических рисках, изменениях молекулярного и клеточного развития и функционирования, а также нарушения нервных цепей. Традиционно термин «нейронная цепь» относили к нейронной связи с помощью синаптических контактов и нейромедиаторов [7]. Здесь авторы применяют этот термин для описания взаимосвязей огромного количества нейронов, составляющих «коннектом» мозга [8]. Такие методы, как функциональная магнитно-резонансная томография (фМРТ) и электроэнцефалография (ЭЭГ), могут количественно определить функционально коррелированные области активации, которые определяют такие цепи (таблица 1). С помощью этих инструментов был определен набор основных мозговых цепей, которые постоянно наблюдаются в состоянии при выполнении аффективных или когнитивных задач или в состоянии их отсутствия. Эти цепи включают сеть режима по умолчанию (DMN), участвующую в саморефлексивных процессах без задач; контур отрицательного аффекта, задействованный отрицательными эмоциональными стимулами, такими как угроза или печаль; контур положительных эмоций (также известный как контур «вознаграждения»), участвующий в реакции на социальные и приобретенные вознаграждения; и цепь когнитивного контроля, задействованная в задачах, требующих торможения и избирательного контроля (рис. 1).
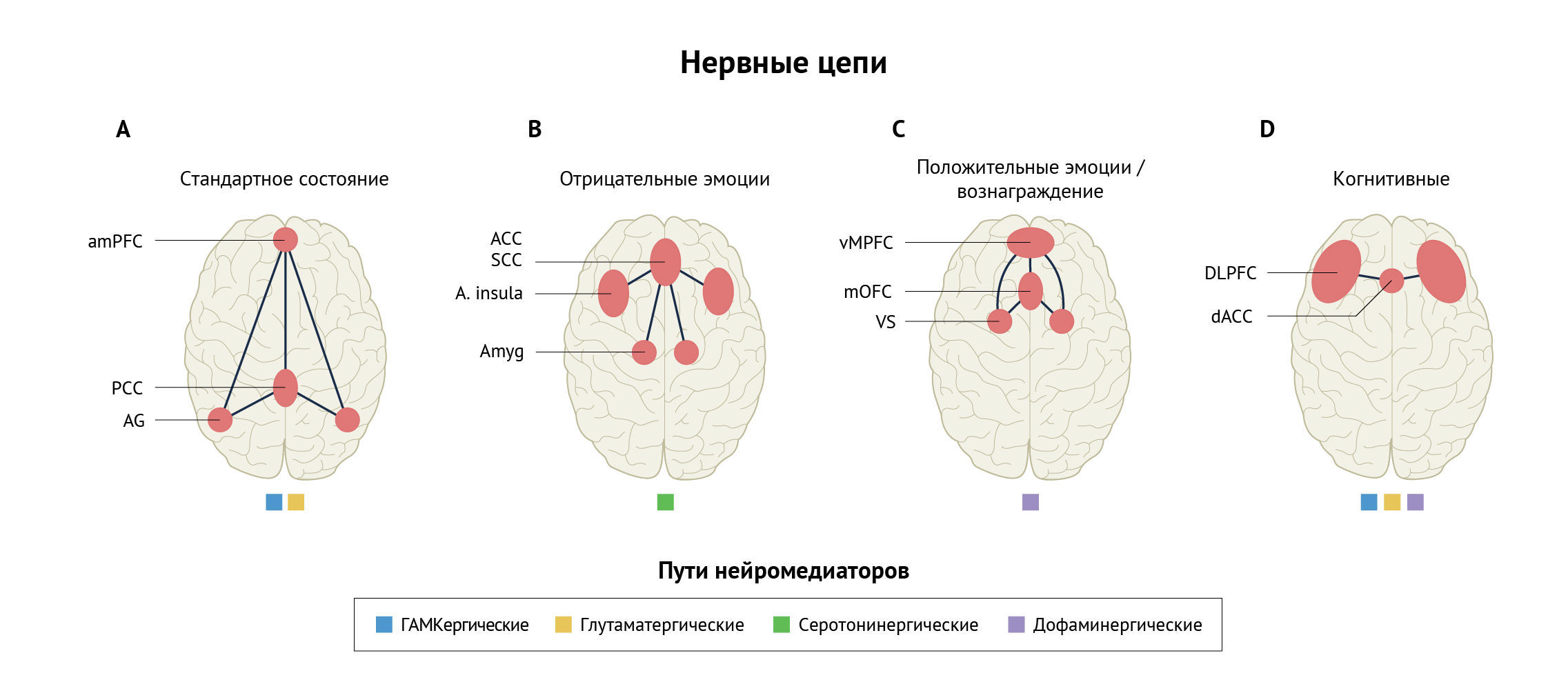
Исследования, анализирующие нарушение функции в этих основных нейронных цепях, а также бесчисленные хорошо проработанные геномные исследования (сосредоточенные либо на общих аллелях, либо на редких мутациях с большим эффектом), не поддерживают четких диагностических границ между психическими состояниями, как указано в Диагностическом и статистическом руководстве (DSM). Частично в ответ на такие выводы Национальный институт психического здоровья США разработал Критерии предметной области исследований (RDoC) [9], в которых особое внимание уделяется нескольким уровням анализа, включая нейронные цепи, поведение, показатели самооценки, физиологию, клетки, молекулы и гены — с надеждой на улучшение патофизиологического понимания и исследования цепей, лежащих в основе гетерогенности психических расстройств. Главной целью RDoC является содействие усилиям по переводу понимания психических заболеваний на уровне схемы в фундаментальную науку посредством клинического применения и, в конечном счете, воздействия на нейронные мишени для более механистического и избирательного подхода к разработке методов терапии. Некоторые утверждают, что способ, которым RDoC моделирует психическое заболевание как континуум «нормального», и тот факт, что он не включает в себя естественную историю любого расстройства (только статичный взгляд), отходит от модели «болезни» психического заболевания и может быть недостатком этой парадигмы [10]. Прогресс в использовании влияния RDoC на нейронные мишени для реализации более избирательных механистических стратегий лечения оказался медленным.
По мере увеличения размеров баз данных появляются новые аналитические подходы, такие как машинное обучение и теория графов (таблица 1), которые позволяют обнаруживать и количественно определять новые паттерны цепей в популяциях пациентов с психическими расстройствами, а также начинают раскрывать новые фенотипы заболеваний. Исследовательские консорциумы используют визуализацию и другие методы для разработки маркеров, связанных с мозгом, которые помогают выбирать методы терапии и прогнозировать исход лечения при депрессии и других расстройствах. RDoC и сходные конструкции применяются для обогащения испытаний новых методов терапии пациентами, более подходящими под механизм действия нового соединения, а также — в качестве конечных точек для результатов испытаний. На сегодняшний день наиболее целесообразными или перекрестно подтвержденными прогностическими маркерами результатов лечения служат специально определенные мишени нейронных цепей, такие как области интереса, участвующие в расстройстве и/или в механизмах действия лекарств.
Новые методы стимуляции и регистрации мозга представляют собой замечательный подход, который позволяет напрямую исследовать этиологию заболевания на уровне нервных цепей. Эти методы обеспечивают прямой доступ к живому человеческому мозгу в сочетании со способностью модулировать активность нервных цепей; уже определены новые принципы взаимосвязей между нервными цепями и поведением и показана возможность персонализированной терапии, направленной на эти цепи. Этот подход может дополнительно выявлять биомаркеры тяжести заболевания и прогнозирования лечения, а также помочь раскрыть механизмы заболевания для разработки новых методов терапии.
Модель нервных цепей может улучшить понимание типов этиологии заболеваний. Она может быть эффективной при определенных методах лечения, но в настоящее время ее не стоит универсально применять ко всем заболеваниям или терапевтическим методам. В следующих разделах авторы обсуждают многообещающие новые подходы к лечению, уделяя особое внимание тем, которые соответствуют схеме на основе нервных цепей; а также те, для которых эта модель еще недостаточно исследована, но которые представляют широкий интерес в этой области.
Таблица 1 | Инструменты для измерения, модуляции и моделирования работы мозга.
Стимуляция мозга как инструмент исследования и терапии
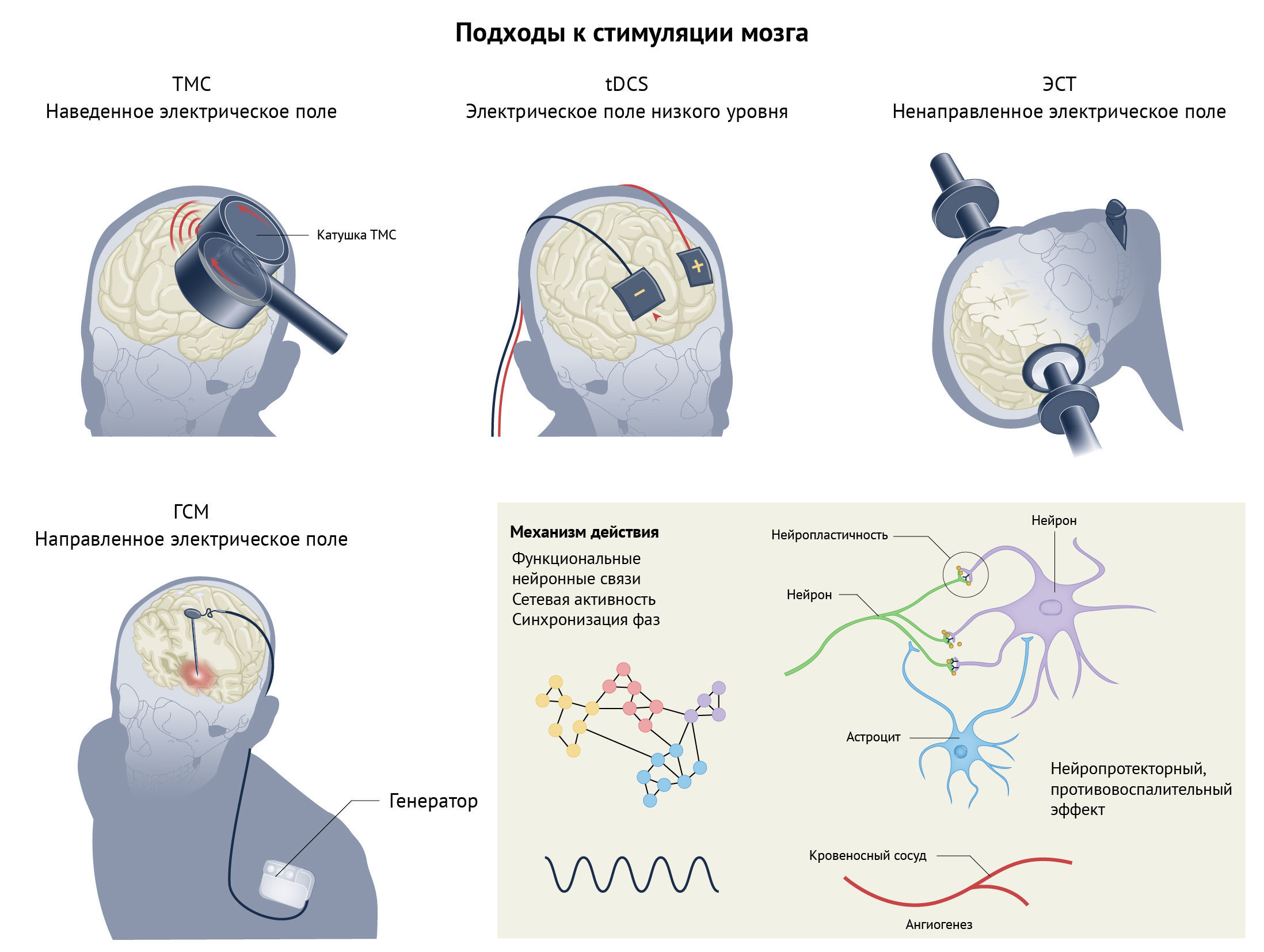
Стимуляция мозга — эффективная альтернатива фармакологическим средствам для лечения психических расстройств; несколько общих подходов показаны на рис. 2. Хотя во всех этих подходах для модулирования функции мозга (связь, активность, колебательная активность) применяется электрическая активность, они различаются по силе и фокусности электрических полей. Повторяющаяся транскраниальная магнитная стимуляция (пTMС) и транскраниальная стимуляция постоянным током (тСПТ) представляют собой неинвазивные подходы, направленные на кору головного мозга. Глубокая стимуляция мозга (ГСМ) позволяет напрямую модулировать более глубокие (подкорковые) структуры с высочайшей пространственной и временной точностью и обладает огромным потенциалом для лечения психических расстройств, поскольку позволяет точно модулировать активность любого узла в цепи с нарушенной функцией.
В ГСМ электрод хирургическим путем имплантируется непосредственно в специфическую для заболевания структуру мозга-мишень, а стимуляция регулируется генератором импульсов, обычно размещаемым под кожей в грудной клетке [11]. Стимуляция проводится непрерывно с интенсивностью и частотой, выбранными в клинике путем тестирования нескольких параметров и наблюдения за влиянием на симптомы пациента. Такая процедура обычно используется для лечения болезни Паркинсона и в этом контексте может значительно восстановить двигательную функцию. В 2009 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предоставило исключение для гуманитарных устройств для ГСМ-лечения обсессивно-компульсивного расстройства (ОКР) после того, как ряд исследований показал существенное уменьшение симптомов [12]. Направленное воздействие на переднюю капсулу было впервые использовано для ГСМ у пациентов с ОКР на основании его хирургического последствия — передней капсулотомии (было показано, что создание поражения в этой области облегчает симптомы). В 2003 году Хелен Мейберг показала, что ГСМ, воздействующая на подмозолистую поясную кору (ППК) — область, участвующую в эмоциональном поведении, — может лечить большое депрессивное расстройство даже у пациентов, устойчивых к другим методам терапии [13]. Дополнительные открытые испытания направленного воздействия на ППК [14] или вентральную капсулу / вентральное полосатое тело (VC/VS) [15] (область, иннервируемая дофаминергическими нейронами, которые, как известно, участвуют в обработке вознаграждения и прогнозировании ошибок), показали аналогичные эффекты и вызвали воодушевление в связи с перспективой лечения большого депрессивного расстройства (БДР) путем устранения дисфункциональной активности мозга. Однако затем последовало несколько рандомизированных контролируемых испытаний с разочаровывающими результатами. Испытание ГСМ ППК для БДР было преждевременно остановлено после шестимесячного анализа отсутствия целесообразности в 2012 году, а второе рандомизированное исследование VC/VS ГСМ не показало значительного улучшения симптомов по сравнению с плацебо-стимуляцией [16, 17]. Причины неудач, вероятно, отчасти связаны с отсутствием точного направленного воздействия или персонализированной терапии.
С тех пор появилось несколько убедительных достижений, которые обещают лучший эффект по сравнению с традиционной ГСМ. Одной из них является новая концепция коннектомной мишени, при которой для направленного воздействия на мозговые цепи, связанные с заболеванием, электрическим током стимулируются тракты белого вещества или их пересечения (а не изолированные области мозга). Для определения правильного местоположения на основе анатомии каждого человека используется визуализация [18]. Для БДР было показано, что стимуляция в месте пересечения трактов белого вещества, проходящих через ППК, лучше всего предсказывает ответ на терапию [19], а проспективное воздействие на эту область дало частоту ответа 73% через шесть месяцев и частоту ответа 82% через год [20]. Сходным образом, при ОКР несколько мишеней вдоль корково-стриарно-таламокортикальной петли, которая выступает из передней капсулы, показали положительный эффект; и ретроспективный анализ продемонстрировал, что стимуляция части передней капсулы, которая непосредственно соединяет области префронтальной коры с субталамическим ядром, предсказывала клиническое улучшение вне зависимости от расположения электродов [21].
Тем не менее, доклинические и клинические исследования показали, что стимуляция различных областей мозга вызывает широкий спектр эмоций, а это говорит о том, что вряд ли существует единственная мишень в мозгу, достаточная для лечения разнородных психических расстройств. Разочарование в связи с отсутствием воспроизводимости мелкомасштабных визуализационных исследований, сосредоточенных на интересующих анатомических областях, и неспособностью клинических психиатрических исследований дать окончательное представление о механизмах, лежащих в основе психических расстройств, возродили интерес к использованию экспериментальных манипуляций с мозговыми цепями. Использование электрической стимуляции для понимания взаимосвязей между структурой и функцией мозга не ново; Уайлдер Пенфилд применял этот подход для картирования соматосенсорного гомункула много десятилетий назад [22], но сложные и разнообразные поведенческие эффекты и инвазивный характер этой процедуры на какое-то время ограничивали его использование [23]. Тем не менее, в настоящее время несколько групп показали, что стимуляция разных частей мозга вызывает разные аффективные переживания в моделях на животных [24–27] и в исследованиях с участием людей [28–36].
В одном из недавних исследований было проведено картирование функций мозга с помощью электрической стимуляции (таблица 1) перед внедрением ГСМ, чтобы выявить активность дисфункциональной цепи, лежащую в основе индивидуальных симптомов депрессии. При этом были раскрыты ключевые принципы взаимосвязи между симптомами депрессии, настроением и нервной стимуляцией, и сделано предположение о важности увязки времени стимуляции с наличием негативного симптоматического состояния [34]. Множественная стимуляция корково-лимбической цепи вызывала широкий спектр быстро возникающих субъективных переживаний (т. е. тревоги, удовольствия, энергии) и, как было установлено, давала ответ на «дозу», сохранялась после периода стимуляции и зависела от контекста. Эмоциональное состояние пациента во время стимуляции определяло клиническую реакцию воспроизводимым образом, что позволяет предположить, что существует важная взаимосвязь между текущим профилем симптомов пациента и терапевтическим эффектом стимуляции. Способ стимуляции определенной области также играет роль в ее эффекте. В другом продолжающемся исследовании используется картирование «стимул–реакция» для определения оптимальных параметров стимуляции на основе как их сетевых, так и клинических эффектов [37].
Во ходе картирования электрической стимуляции внутричерепные регистраторы обеспечивают обратную связь о подключении к сети и реакции на стимуляцию. Внутричерепная активность ЭЭГ показывает наличие некоторых неврологических симптомов; например, патологические колебания бета-частот коррелируют с двигательными симптомами при болезни Паркинсона [38]. Хотя есть данные, что ЭЭГ с поверхности головы регистрирует состояния возбуждения или внимания [39], биомаркеры состояний динамических симптомов и глубинные источники этих сигналов, могущие быть мишенями, остаются неизвестными для психиатрии. В одном исследовании многодневный период картирования мозга позволил ученым сопоставить внутричерепную активность ЭЭГ с тяжестью симптомов и определить электрографический маркер плохого настроения у одного человека, а именно высокочастотную активность в миндалевидном теле — области мозга, участвующей в обработке эмоций [40]. Удалось выявить структурно и функционально связанную депрессивную подсеть, состоящую из миндалевидного тела и областей VC/VS; соответственно, стимуляция узла VC/VS улучшала основные симптомы депрессии и снижала высокочастотную активность в миндалевидном теле.
Эти результаты побудили исследователей рационально разработать персонализированную ГСМ-терапию. С помощью устройства, способного как воспринимать нейронную активность, так и проводить стимуляцию, непрерывно регистрировалась нейронная активность миндалевидного тела, а фокальная стимуляция автоматически доставлялась в VC/VS только при обнаружении электрографического биомаркера тяжелого симптоматического состояния [40]. Такая регулируемая биомаркерами терапия в режиме реального времени, называемая ГСМ с обратной связью, привела к быстрой ремиссии у экспериментального пациента всего лишь при 30 минутах стимуляции в день. Для определения межиндивидуальной изменчивости биомаркеров и терапевтических эффектов персонализированной ГСМ с обратной связью будет необходима дальнейшая работа с более крупными группами пациентов. Тем не менее, концепция лечения хронического расстройства путем временного направленного воздействия на симптоматические состояния, определяемые объективными маркерами мозга, предлагает новую основу для прецизионной терапии в психиатрии. Новая клинически доступная система ГСМ, которая позволяет воспринимать и регистрировать нейронную активность (Medtronic's Percept), является захватывающим достижением, которое может выявить новые биомаркеры тяжести симптомов в больших популяциях [41]. Кроме того, возможность исследовать клеточные популяции и проекции, лежащие в основе таких биомаркеров и цепей, с использованием оптогенетики (таблица 1) на животных моделях обещает множество захватывающих экспериментальных открытий [42, 43].
Также быстро развивается направленное воздействие на нервные цепи с помощью техники неинвазивной стимуляции мозга пTMС (рис. 2). Этот метод не имеет пространственного или временного разрешения ГСМ, но может обеспечить таргетное неинвазивное лечение в стандартной психиатрической клинике и в настоящее время одобрен FDA для лечения резистентных к терапии БДР и ОКР, а также тревожно-депрессивного расстройства [44, 45]. При этом подходе переменное во времени магнитное поле воздействует на кожу головы через катушку транскраниальной магнитной стимуляции (ТМС) и индуцирует электрическое поле в подлежащих тканях, которое может деполяризовать нейроны коры головного мозга. Тип катушки, ее расположение на мозге и частота магнитных импульсов приводят к различным клиническим эффектам и влияниям на нервные цепи [46–48]. Стандартный курс лечения состоит из 20–30 сеансов в течение 4–6 недель с продолжительностью сеанса 30–40 мин для стандартной пТМС 10 Гц. Было обнаружено, что новая парадигма стимуляции, прерывистая стимуляция тета-всплеска, должна иметь аналогичную эффективность примерно за одну десятую времени сеанса терапии [49]. Дорсолатеральная префронтальная кора (DLPFC), область, участвующая в высших когнитивных функциях, служит мишенью при БДР и традиционно определяется с помощью измерений с кожи головы, которые могут быть неточными. Недавние данные свидетельствуют о том, что результаты терапии можно улучшить, используя визуализацию для направленного воздействия на цепь, включающую область в DLPFC, которая имеет самую высокую отрицательную связь с передней поясной корой (ПрПК) — областью, играющей ключевую роль в когнитивных функциях и эмоциях [50]. В одном исследовании весь курс лечения ТМС был сжат до пяти дней за счет проведения десяти сеансов прерывистой тета-стимуляции в день с индивидуальной функциональной связью под контролем МРТ, и авторы сообщили об удивительной частоте ремиссии на уровне 86,4% [51]. Достижения, которые могут еще больше улучшить рациональную схему лечения, включают новые катушки, которые способны достигать более глубоких структур мозга [47], ЭЭГ-синхронизированную терапию [52] и многонаправленную ТМС [53].
Электрическое воздействие, не затрагивающее направленно нервную цепь, — это электросудорожная терапия (ЭСТ) — процедура, разработанная в 1930-х годах, которая включает подачу электрического тока на кожу головы, чтобы преднамеренно вызвать кратковременный припадок безопасным и контролируемым образом (рис. 2). Хотя ее механизм остается не до конца изученным, ЭСТ может вызывать нейропластические изменения, позволяя мозгу формировать новые связи [54]. Несмотря на отсутствие специфического воздействия на нервные цепи, ЭСТ остается наиболее эффективной терапией БДР с частотой ремиссии более 70% (по сравнению с 30% при применении типичных антидепрессантов) [55]. Однако ее применение ограничивают побочные эффекты и стигматизация, и существует значительный интерес к разработке новых неинвазивных методов лечения, которые могут воздействовать на глубокие структуры мозга без необходимости анестезии. Одним из новых методов лечения является сфокусированный ультразвук низкой интенсивности (таблица 1), который использует звуковые импульсы для обратимого изменения нервной активности и может с высокой точностью воздействовать на структуры глубоких мозговых цепей [56]. Пилотное исследование депрессии продемонстрировало снижение беспокойства и улучшение настроения [57], и в настоящее время проводятся дальнейшие исследования.
Большие данные для картирования человеческого мозга и выявления диагностических маркеров и маркеров восприимчивости
Параллельный и дополняющий подход к выявлению дисфункциональных цепей на индивидуальном уровне заключается в поиске паттернов патологических цепей, связанных с заболеванием или симптомами, в больших наборах данных нейровизуализации на уровне популяции. К исследованию многих особенностей мозга, таких как связь каждого вокселя (трехмерного «пикселя», представляющего крошечный куб мозговой ткани) фМРТ с каждым другим вокселем, и выведение скрытой структуры из ассоциаций между ними, применили математический подход с использованием машинного обучения. Толчок к сотрудничеству для создания больших наборов данных и применения этих аналитических подходов впервые проявился в области психиатрической геномики и был встречен со значительным успехом (вставка 1). Цель этих усилий состояла в том, чтобы определить маркеры диагностической восприимчивости. Частота общих аллелей с небольшим эффектом в популяции и успешное применение крупномасштабных полногеномных ассоциативных исследований позволяют рассчитать показатели полигенного риска — кумулятивную меру индивидуального генетического риска. Несмотря на то, что этот тип генетического профилирования по-прежнему востребован в клинике, он потенциально может способствовать проведению генетически обоснованных, клинически значимых исследований в области дифференциальной диагностики, естественного течения заболеваний и ответа на терапию [58].
Вставка 1

Важный урок, извлеченный из неудачных попыток воспроизвести небольшие исследования связей генов-кандидатов, заключается в том, что очень крупные наборы данных нейровизуализации могут иметь решающее значение для выявления диагностических маркеров или маркеров восприимчивости. Воспроизводимость или ее отсутствие является хорошо известной проблемой нейровизуализации для усредненных по группе данных из-за низкой статистической мощности, ошибок программного обеспечения, отсутствия соответствующей коррекции для множественных сравнений и неполной стандартизации методов анализа [59]. Многочисленные крупномасштабные метаанализы активации при выполнении задачи и визуализации в состоянии покоя или структурной визуализации выявили общую патологию при заболеваниях, но не выявили эффекта диагностики, специфического к нервным цепям, или домена RDoC [60–62]. Недавний анализ, объединяющий несколько наборов данных структурной визуализации и функциональной связи в состоянии покоя, исследовал корреляции между этими показателями визуализации и индивидуальными вариациями субклинических «симптомов» у здоровых участников и выявил гораздо меньшие размеры эффекта, чем ожидалось [63]. Результаты подчеркивают необходимость проявлять осторожность при поиске индивидуальных различий в поведении, а также в состоянии покоя и при структурной визуализации [64].
Мультимодальные количественные метаанализы, объединяющие данные нескольких модальностей МРТ, могут помочь отличить истинную патологию, специфичную для заболевания, от многочисленных ложноположительных результатов, описанных в литературе. В одном из таких исследований удалось успешно определить специфические для БДР результаты по объединенным пространственно нормализованным структурным и функциональным данным [65]. Дальнейшее объединение данных по дополнительным методам МРТ и ЭЭГ с использованием аналогичных методов метаанализа на основе координат обещает повысить воспроизводимость [66].
Новые методы лечения и биомаркеры на основе нервных цепей
Использование прогностических биомаркеров или биомаркеров ответа на терапию для новых методов лечения может помочь определить, какие люди и механизмы служат мишенями для каждого лечения, и тем самым повысить статистическую достоверность и увеличить размер эффекта в клинических исследованиях. Согласно рекомендациям Национальных институтов здравоохранения (NIH)–FDA, прогностический биомаркер выявляет лиц, которые могут получить пользу от лечения, а биомаркер ответа на терапию указывает на биологический эффект лечения, не обязательно предполагая выводы о связи между этими биологическими механизмами и клинической эффективностью [67]. Консорциумы, занимающиеся маркерами прогнозирования и ответа на результаты лечения, включают PReDicT (Прогнозирование ответа на лечение депрессии), EMBARC (Установление модераторов и биосигнатур ответа на антидепрессанты в клинической помощи), iSPOT-D (Международное исследование по прогнозированию оптимизированного лечения депрессии) и FAST- MAS (Испытания с быстрым провалом при расстройствах настроения и тревожного спектра). Одним из новых направлений является использование мишеней ответа на лечение с помощью фМРТ в качестве конечных точек клинических испытаний (относящихся к нацеливанию на более избирательные механизмы действия лекарств) вместо классически определенных диагнозов DSM. Другой иллюстрируется подходами кластеризации машинного обучения с наборами данных ЭЭГ или комбинированными данными визуализации и лечения [68] для выявления новых подгрупп заболеваний [69–71]. Во многих исследованиях прогностические модели с перекрестной проверкой, основанные на дисфункции нейронных цепей, продемонстрировали перспективность увеличения текущей вероятности ответа на доступные методы лечения методом проб и ошибок [72–74]. Ниже приводится несколько иллюстративных примеров, которые подчеркивают взаимосвязь четырех основных мозговых цепей с результатами лечения, измеренными с помощью фМРТ, и связанные с этим усилия по выявлению прогностических биомаркеров и биомаркеров ответа на терапию на основе цепей (рис. 1). В таблице 2 перечислены методы лечения, связанные с конкретными нервными цепями, которые дали положительные результаты испытаний фазы II или находятся на стадии одобрения FDA.
Ангедония и цепь вознаграждения
Ангедония — снижение способности испытывать удовольствие — представляет собой симптом, наблюдаемый при множестве психических расстройств [75, 76]. Она связана с дисфункцией корково-стриарных цепей, взаимодействием с мезолимбическими дофаминовыми системами и нарушением функционирования конструкций, описанных в системе положительной валентности RDoC [9, 75]. Было обнаружено, что у пациентов, получавших одобренные в настоящее время антидепрессанты, в состоянии покоя более высокая связь между интересующими исследователей областями цепей вознаграждения (измеренная с помощью фМРТ) и более высокая поведенческая чувствительность (измеренная с помощью компьютерного моделирования выполнения задания на вознаграждение). Это позволяет выявить людей, которые реагируют на стимулирующее воздействие ингибитора обратного захвата норадреналина и дофамина бупропион после отсутствия ответа на селективный ингибитор рецептора серотонина (СИОЗС) сертралин [77]. Было обнаружено, что машинное обучение с использованием активации цепи вознаграждения в ответ на задание предсказывает специфическую реакцию на бупропион по сравнению с плацебо [78]. Эти результаты указывают на потенциальную перспективность методик воздействия на цепи вознаграждения в качестве прогностических биомаркеров. Изменения в активации полосатого тела — ключевой области положительной цепи мозга «положительная эмоция — вознаграждение», также демонстрируют потенциал в качестве биомаркера ответа на новые селективные методы терапии. Применение прамипексола — селективного антагониста дофаминовых рецепторов 3 — было связано с изменениями как в активации полосатого тела, так и в сопутствующем уменьшении ангедонии [79, 80]. Изменения в активации полосатого тела и ангедонии также наблюдались в рамках исследования, которое связывает биомаркер ответа в полосатом теле с предполагаемым механизмом действия антагониста κ-опиоидных рецепторов (который стимулирует выделение дофамина в полосатом теле) [81, 82] и средства, открывающего калиевые каналы (подтип KCNQ2–KCNQ3) [83, 84].
Негативные эмоции и кортиколимбическая нервная цепь
Изменения в реактивности миндалины и цепи негативных эмоций присутствуют при множестве психических расстройств и связаны с взаимодействием с серотонинергическими системами [85]. Было обнаружено, что у пациентов с БДР во время обработки негативных аффективных стимулов гипореактивность миндалины, количественно определяемая с использованием стандартизированного метода фМРТ при решении задач [86], предсказывает дифференциальный ответ на СИОЗС по сравнению с ингибиторами серотонин-норадреналиновых рецепторов [72, 87]. Реактивность миндалин также показывает ранние изменения после терапии СИОЗС эсциталопрамом, что говорит о его перспективности в качестве биомаркера ответа [88]. BI 1358894 — ингибитор ионных каналов TRPC4 и TRPC5 [89], завершил испытания фазы I с применением биомаркеров реакции по фМРТ на активацию миндалины и обработку эмоций и проходит испытания фазы II для БДР [90], посттравматического стрессового расстройства (ПТСР) и пограничного расстройства личности. Неспособность подавлять нервные цепи негативных эмоций во время сна может благоприятствовать возникновению подтипа БДР с проблемами сна и бодрствования, чрезмерным возбуждением и физическими симптомами, связанными со стрессом. Антагонист орексина 2, селторексант, разрабатывается для лечения признаков депрессии во время сна-бодрствования и пробуждения [91], и орексин может помочь снизить реактивность центральной миндалины, которая лежит в основе этих признаков, через участие в серотонинергических путях [92].
Исполнительная функция и цепь когнитивного контроля
О нарушении цепи когнитивного контроля и исполнительных процессов сообщается при шизофрении, БДР, ПТСР, тревоге и расстройствах внимания, что может быть еще одним характерным признаком со стороны нервной системы и мишенью для терапии [93, 94]. В модуляторном взаимодействии с цепями когнитивного контроля, среди прочего, участвуют норадренергическая и дофаминергическая нейромедиаторные системы. К новым методам лечения, предназначенным для улучшения когнитивных процессов и лежащей в их основе функции когнитивных цепей и оцениваемым с использованием поведенческих характеристик в когнитивных тестах и фМРТ, относится иклепертин (также известный как BI 425809). Иклепертин представляет собой ингибитор переносчика глицина 1 (GlyT1), который получил статус революционного препарата FDA для лечения когнитивных нарушений при шизофрении [95].
Депрессия и DMN
Еще одна известная цепь — DMN. Существует смешанная картина результатов для DMN и результатов лечения; сопоставимость их была поставлена под сомнение различными стратегиями дизайна исследования и аналитическими методами [96]. Было обнаружено, что гипоконнектность DMN характеризует персистирующее депрессивное расстройство; по сравнению с плацебо она нормализуется с помощью дулоксетина — обычно назначаемого при этом ингибитора серотонин-норадреналиновых рецепторов [97] Было обнаружено, что лобные узлы DMN нормализуются при приеме стандартных антидепрессантов при депрессии в пожилом возрасте и сопутствующей тревожности [98], а DMN в задних узлах коррелирует с улучшением симптомов после применения СИОЗС эсциталопрама при гериатрической депрессии [99], что указывает то, что узлы DMN могут выступать в качестве биомаркеров ответа. Выявлено, что гипоконнектность DMN при отсутствии задач до лечения предсказывает последующее отсутствие ремиссии при приеме обычно назначаемых антидепрессантов, в то время как неповрежденные нейронные связи DMN предсказывают ремиссию при лечении антидепрессантами [73]. Связи DMN также изучались как предполагаемый биомаркер схемы для новых терапевтических методов. Базовые нейронные связи ППК в пределах DMN последовательно вовлекалась в ответ на ТМС [96, 100], при этом испытуемые, как правило, демонстрируют более низкую связность перед TMS и бо́льшую обратную связь ППК с лобными областями цепей когнитивного контроля. Обнаружено, что зуранолон (SAGE-217) [101, 102], который в настоящее время находится в фазе III разработки для лечения БДР и послеродовой депрессии (ПРД), модулирует нейронные связи DMN в состоянии покоя, а предполагаемый механизм действия заключается в изменении возбудительно-тормозного баланса системы γ-аминомасляной кислоты (ГАМК) [96, 100].
Таблица 2 | Новые методы лечения и их предполагаемое влияние на нервные цепи
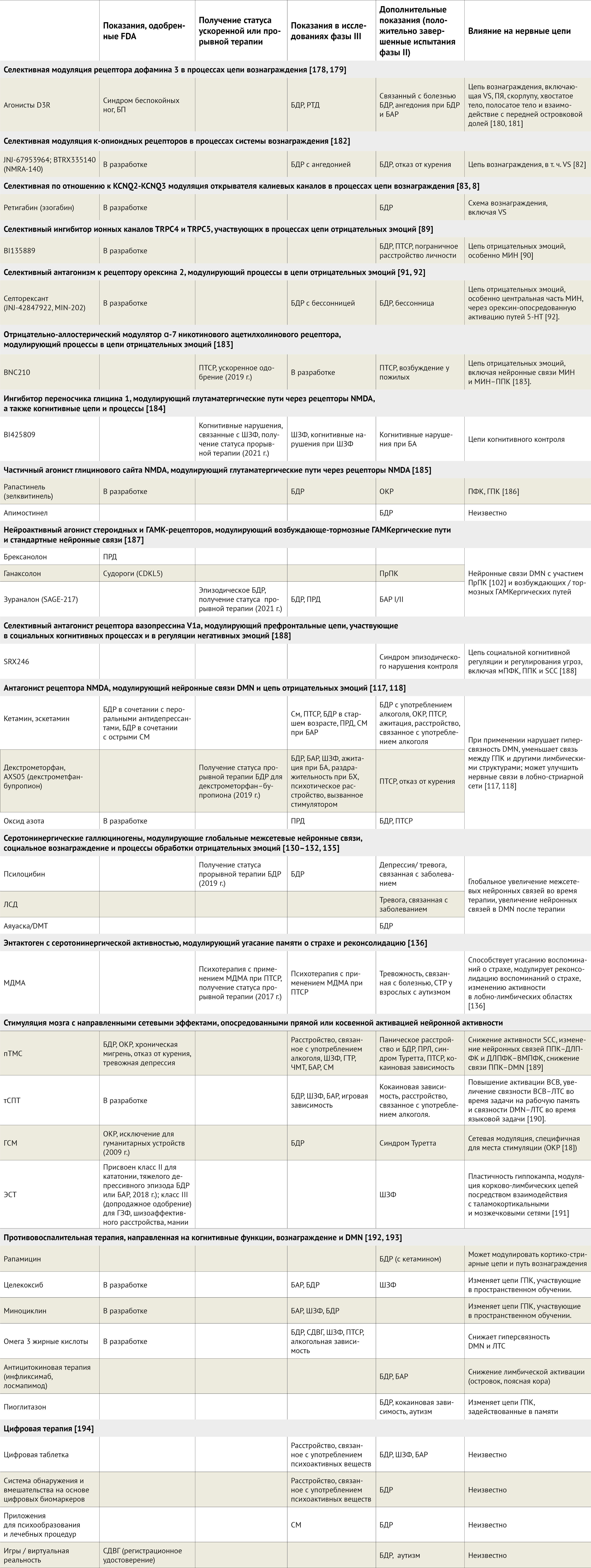
РТД — резистентная к терапии депрессия; БАР — биполярное аффективное расстройство; ШЗФ — шизофрения; БП — болезнь Паркинсона; БА — болезнь Альцгеймера; СМ — суицидальные мысли; БХ — болезнь Ханиингтона; СТР — социальное тревожное расстройство; ГТР — генерализованное тревожное расстройство; ЧМТ — черепно-мозговая травма; СДВГ — синдром дефицита внимания и гиперактивности; D3R — дофаминовый рецептор 3; CDKL5 — циклин-зависимая киназа 5; V1a — рецептор вазопрессина 1A; МИН — миндалина; ГПК — гиппокамп; ПФК — префронтальная кора; мПФК — медиальная префронтальная кора; ВМПФК — вентромедиальная префронтальная кора; ПЯ — прилежащее ядро; ВСВ — вентральная сеть внимания; ЛТС — лобно-теменная сеть.
Новые методы лечения, в которых отсутствуют прогностические, ответные и механистические биомаркеры
Несмотря на привлекательность применения модели на основе нервных цепей ко всем психическим расстройствам и методам лечения, можно столкнуться с недостатком понимания их механизмов. Хотя может оказаться, что все нарушения головного мозга можно лечить на уровне нервной цепи, нарушение функций этих цепей вряд ли будет этиологией каждого фенотипа заболевания и, следовательно, не может быть единственной или оптимальной мишенью терапии. Ни один обзор новых подходов к лечению в психиатрии не будет полным без упоминания быстродействующей терапии, галлюциногенов или иммунотерапевтических средств. Известно, что эти методы воздействуют на мозг, но они не специфичны по отношению к нервным цепям, и пока нет четких маркеров заболевания, предсказывающих ответ на терапию, хотя соответствующие исследования продолжаются. В следующих разделах обсуждаются эти методы лечения и сопутствующая литература, касающаяся эффектов нервной цепи, и обсуждаются аспекты, в которых модели на основе цепей не работают.
Быстродействующие препараты
Быстродействующие препараты, такие как кетамин, представляют собой первый новый класс фармакотерапевтических средств за последние десятилетия (таблица 2). Как и при некоторых формах стимуляции мозга, клинические эффекты этих фармакотерапевтических соединений наблюдаются в течение нескольких часов. Такое невероятное, почти немедленное устранение симптомов тяжелой патологии предполагает, что реорганизация цепи или другие механизмы действия могут происходить в различных временных масштабах, и новые методы лечения могут быть направлены как на быстро начинающиеся, так и на устойчивые изменения. Кетамин представляет собой синтетический диссоциативный анестетик и антагонист рецепторов N-метил-d-аспартата (NMDA) [103]. Плацебо-контролируемое исследование, опубликованное в 2006 году, продемонстрировало, что однократное внутривенное вливание кетамина в течение 40 минут значительно уменьшало резистентность к лечению БДР по сравнению с плацебо с появлением эффекта всего через два часа после инфузии [104]. Последующие исследования подтвердили эти результаты для БДР [105] и оценили эффективность при суицидальных мыслях [106,] ПТСР [107, 108], ОКР [109] и ПРД [110]. Интраназальная форма S-энантиомера, эскетамина (Spravato), была одобрена FDA для лечения резистентного БДР (в сочетании с пероральным антидепрессантом) и БДР с острым суицидальным поведением в 2019 и 2020 годах, соответственно [111–114]. Для антидепрессивных эффектов кетамина решающее значение имеют нейропластические процессы, опосредованные всплеском глутамата, хотя недавние данные также указывают на агонизм по отношению к опиоидным рецепторам [115, 116]. Хотя клинические эффекты кетамина для резистентных к лечению заболеваний выглядят многообещающими, в настоящее время не хватает знаний о биомаркерах прогнозирования и ответа на основе нервных цепей, а также о механизмах, которые опосредуют клинический ответ. Нейровизуализационные исследования кетамина дали смешанные результаты. Было обнаружено, что при БДР отвечающих на терапию пациентов характеризуют более слабые нейронные связи в состоянии покоя перед инфузией с участием ППК и лобных областей DMN с последующей относительной нормализацией этих связей после инфузии кетамина [117, 118]. Тем не менее, различия перед воздействием не воспроизводились при анализе области интереса и анализе данных всего мозга [117]. Связь между задней областью DMN и островковой долей, которая служит основной областью цепей отрицательных эмоций и других, также была положительно связана с посткетаминовым клиническим ответом [117]. Напротив, при фМРТ с задачей (в отличие от состояния покоя) более высокая исходная активность ППК, вызванная положительными стимулирующими испытаниями, коррелирует с уменьшением ангедонии [119]. В исследованиях фМРТ с задачами, вызывающими отрицательные эмоции, было обнаружено, что кетамин снижает гиперактивность миндалины перед инфузией в цепи негативных эмоций, что коррелирует с изменением ангедонии и общим снижением депрессии [117, 118]. Другие диссоциативные анестетики, в том числе декстрометорфан [120] и закись азота [121], в рандомизированных исследованиях также показали быстрое и значительное снижение тяжести БДР и, как считается, оказывают сходные влияния на нервные цепи. В совокупности эти результаты дают надежду на выявление биомаркеров ответа на терапию на основе нервных цепей, которые также прольют свет на механизмы, с помощью которых кетамин оказывает свое клиническое действие. Необходимы дополнительные исследования, чтобы отделить систематические эффекты между исследованиями, особенно с учетом того, что работы на сегодняшний день сильно различаются с точки зрения времени визуализации по отношению к введению кетамина, условий визуализации, методологии анализа и характеристик популяции. Также неизвестно, отражают ли смешанные результаты различные подтипы расстройства или эффекты взаимодействия различных пероральных антидепрессантов у пациентов.
Положительная аллостерическая модуляция ГАМК типа А (ГАМКА) (эффект, который усиливает ингибирование ГАМК) представляет собой новый механизм действия, который также обладает быстродействующим эффектом [122]. В 2019 году одобрение FDA получил брексанолон для ПРД, став первым препаратом, одобренным специально для этого показания [123]. Хотя его необходимо вводить путем внутривенной инфузии в течение 60-часового периода, в настоящее время изучаются новые лекарственные формы, в том числе зелкистенел для перорального введения [124].
Психоделики
За последние десять лет резко возрос интерес к психоделической медицине. С одной стороны, рост популярности психоделиков противоречит цели направленного воздействия на нервные цепи и рационального дизайна лечения. Эти соединения растительного происхождения, используемые на протяжении тысячелетий, воздействуют на мозг глобально. Тем не менее, возобновление энтузиазма по поводу их использования может быть отчасти связано с ростом понимания психических заболеваний на основе нервных цепей и роли нейропластичности в их изменениях. Псилоцибин — классический галлюциноген, полученный из гриба Psilocybe, — в 2019 году получил от FDA статус революционного препарата для лечения БДР [125]. В терапевтических испытаниях было показано, что две дозы с интервалом в три недели безопасны и сравнимы по эффективности с лечением эсциталопрамом в течение шести недель [126], при этом антидепрессантная активность наблюдалась в течение 24 часов после введения. Активные метаболиты классических галлюциногенов действуют преимущественно как полные или частичные агонисты серотониновых (5-НТ2А) рецепторов [127]. Дальнейшая активация рецепторов глутамата, NMDA и α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты способствуют быстрому нейротрофическому и нейропластическому эффекту [128, 129]. Во время гиперпластического периода сообщалось об усилении глобальных межнейронных связей со специфическими связями сенсорной коры [130–132] с последующей контекстно-зависимой реорганизацией после воздействия [132]. Имеющиеся данные указывают на то, что для достижения терапевтической эффективности необходима психотерапия до и после воздействия, и эта эффективность коррелирует с положительным качеством психоделического опыта [133, 134]. Подобная реструктуризация сети после воздействия также наблюдалась для диэтиламида лизергиновой кислоты (ЛСД)* [130], N,N-диметилтриптамина (ДМТ, N,N-ДМТ)* [135], кетамина [118] и 3,4-метилендиоксиметамфетамина (МДМА)* [136]. Клинические испытания психоделиков затруднены из-за отсутствия адекватного плацебо, стоимости мониторинга на месте медицинскими работниками, включения веществ в список 1, а также их способности изменять реальность и потенциально вызывать привыкание [137, 138]. Выявление негаллюциногенных антидепрессантов, способствующих пластичности, с большей специфичностью к нервным цепям, находится в стадии изучения и может иметь решающее значение для удобного пути к клиническому рынку [139].
*ЛСД (ЛСД-25, d-лизергид), МДМА и N,N-диметилтриптамин (ДМТ, N,N-ДМТ), а также их производные внесены в Список наркотических средств, психотропных веществ и их прекурсоров, оборот которых в Российской Федерации запрещен.
Иммунотерапия
Иммуномодулирующая терапия психических заболеваний привлекает все большее внимание на основании новой литературы о влиянии системного воспаления на мозг и поведение [140, 141] (вставка 2 и рис. 3). Воспалительные биомаркеры обнаруживаются при множестве психических заболеваний, включая аффективные и тревожные расстройства, ПТСР, психотические расстройства и ОКР [140, 142–145]. Они связаны с отсутствием ответа на обычные антидепрессанты и нейролептики и могут предсказать ответ на ЭСТ и кетамин [146–149]. С помощью биомаркеров воспаления, которые могут выявлять соответствующие подгруппы пациентов с психическими расстройствами, теперь существует возможность направленно воздействовать на пути воспаления, связанные с патологией психических расстройств.
Основываясь на исследованиях воздействия воспалительных стимулов на людей, можно утверждать, что воспаление надежно задействует нервные цепи, которые регулируют мотивационную обработку, скорость психомоторики и чувствительность к угрозам [150–156]. Изменения в этих нервных цепях сопоставляются с поведением ангедонии, психомоторной заторможенности и тревоги и, следовательно, представляют собой привлекательные мишени для терапии на основе нервных цепей при психических расстройствах [140]. Например, экзогенное введение воспалительного цитокина интерферона α пациентам с инфекционными заболеваниями и злокачественными опухолями, а также введение брюшнотифозной вакцины или эндотоксина здоровым добровольцам продемонстрировало вызванное воспалением снижение активности в областях мозга, связанных с вознаграждением, включая вентральное полосатое тело, а также увеличение активности в зонах, связанных с угрозой, включая дорсальную часть ППК, островок и миндалину [150–153, 157]. Кроме того, было показано, что усиление эндогенного воспаления влияет на функциональные нервные связи в кортико-стриарных и корково-лимбических цепях, отвечающие за обработку мотивации и психомоторную скоростью, а также чувствительность к угрозам и избегание потерь [150, 154, 156, 158].
Исследования на лабораторных животных и с участием людей также выявили изменения нейромедиаторов, связанные с влиянием воспаления на нервные цепи. Действительно, вызванное воспалением снижение доступности и выделения дофамина в полосатом теле связано со снижением мотивации на основе усилий [153, 159]. Более того, увеличение уровня глутамата в базальных ганглиях влияет на локальную когерентность нейронной активности и, в конечном счете, ослабляет функциональные связи во многих нейронных сетях, включая те, которые участвуют в обработке вознаграждения [160].
В исследованиях изучалась эффективность соединений с противовоспалительными свойствами, включая ингибиторы циклооксигеназы 2 (например, целекоксиб), миноциклин, омега-3 жирные кислоты и терапию, направленную на цитокины, а также препараты, воздействующие на иммунометаболизм (например, пиоглитазон для пациентов с расстройствами настроения и шизофренией) [161, 162] (таблица 2). Хотя метаанализ литературы показал скромную эффективность, результаты не оправдали ожиданий. Кроме того, в двух недавних исследованиях не было обнаружено отличий целекоксиба и миноциклина от плацебо при лечении депрессии [163, 164]. Тем не менее, полученные на сегодняшний день результаты следует интерпретировать с осторожностью, поскольку практически во всех исследованиях не удалось стратифицировать пациентов на основе воспаления, не проводилось оценки вовлечения мишеней в иммунную систему или головной мозг, а переменные первичного исхода не были сопоставлены с известным воздействием воспаления на определенные мозговые цепи и поведение [140]. Включение этих элементов дизайна в будущие клинические испытания поможет реализовать потенциал иммуномодулирующих стратегий для лечения вызванных воспалением трансдиагностических симптомов при психических заболеваниях.
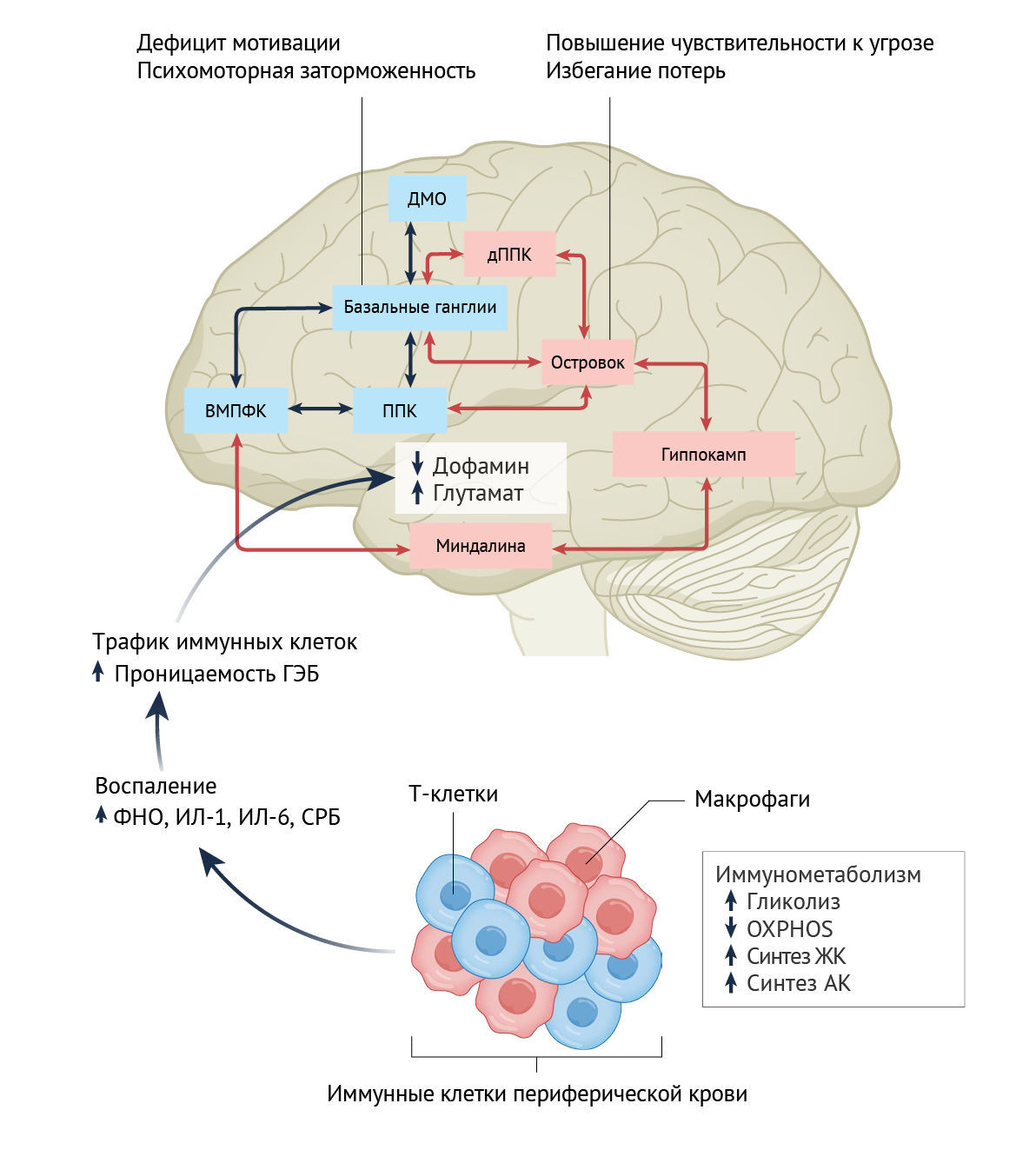
IL — интерлейкин; СРБ — С-реактивный белок; ДМО — дополнительная моторная область.
Вставка 2

Прецизионная психиатрия: проблемы и перспективы
Создание препаратов для лечения заболеваний центральной нервной системы в целом связано с высоким уровнем неудач, длительным временем разработки и высокими затратами по сравнению с другими областями медицины; это привело к тому, что многие фармацевтические компании полностью отказались от соответствующих усилий [165]. Хотя прецизионная психиатрия могла бы стать решением проблемы, существуют трудности в реализации такого подхода. Новые результаты генетики и нейровизуализации, которые не поддерживают четких диагностических границ ГСМ, не соответствуют текущей системе диагностических показаний, используемой плательщиками и регулирующими органами. FDA и Европейское агентство по лекарственным средствам активно разрабатывают структуру для использования доменов симптомов и цепей в качестве мишеней для лекарств и конечных точек клинических испытаний, уделяя особое внимание исследованиям биомаркеров фаз I–II, подтверждающим концепцию, и исследованиям, демонстрирующим специфичность к подтипам заболеваний. Необходима дальнейшая проверка или характеристика нервных цепей-мишеней для принятия новых подходов этими регулирующими органами. Сосредоточение внимания на четко определенных областях мозга, которые связаны с интересующим поведением, может лечь в основу способа разработки удобных показателей на уровне пациента, подходящих для суррогатных конечных точек. Решающее значение будет иметь продолжение коллективной работы научного сообщества для создания и расширения совместных консорциумов и определения методологических стандартов для улучшения воспроизводимости. Интеграция мультимодальных данных, включая генетику, ЭЭГ, фМРТ, когнитивные задачи, клинические данные и истории болезни с применением вычислительных подходов, также может помочь полностью охватить гетерогенность кластеров симптомов и определить подгруппы, которые предпочтительно реагируют на тот или иной вариант лечения.
Еще одной проблемой является эволюционная дистанция между часто используемыми модельными системами животных и человеческим мозгом. Доклинические модели психических расстройств не обладают прогностической достоверностью [166]. Недавние достижения расширяют арсенал средств для изучения биологии на уровне контуров в человеческом мозге. Среди них — возможность имплантации сходных с человеческим мозгом скоплений клеток, называемых органоидами, в нервные цепи грызунов для контроля поведения [167], а также возможность проводить ex vivo исследования функций нервных цепей в неповрежденном мозге человека посмертно [168]. Экспериментальные манипуляции с функциями нервных цепей у людей с помощью очаговой электрической стимуляции или других новых форм нейромодуляции и прямая оценка изменений симптоматики может обеспечить огромный потенциал для прецизионной психиатрии, особенно если установленные связи между нервной цепью и симптомами можно будет затем перенести на животные модели для определения причинных молекулярных и клеточных эффектов.
Еще одним недавним достижением, которое может повысить вероятность успеха молекул-кандидатов, является возможность сосредоточить поиск лекарств на поведенческих последствиях нарушения функции нервной цепи, а не на конкретных механизмах действия. Подход к анализу временных рядов, называемый секвенированием движений, выводит «язык» из естественных сегментов или «слогов» поведения грызунов, вызванного препаратами, используя тысячи часов видеозаписей сотен животных. Их можно использовать для выявления связей поведенческих «единиц», вызванных приемом лекарственных средств, с конкретными нервными цепями, лежащими в основе клинических симптомов, таких как гиперактивность и тревога, а также для определения класса и дозы препарата [169].
В настоящее время общепринятыми показателями результатов в клинических испытаниях психических расстройств служат самооценки пациентов или рейтинговые шкалы врачей, которые представляют собой субъективные оценки болезненного состояния пациента, требуют периода ретроспективного анализа в течение недели или более и, как известно, плохо согласуются с поведенческими показателями [170]. Они могут скрывать соответствующие паттерны симптомов, которые проявляются в более тонком временном масштабе, или поведенческую динамику, имеющую решающее значение для выявления биомаркеров диагностического или терапевтического ответа [170]. Проверенные, стандартизированные меры, которые оценивают тяжесть симптомов в более короткие промежутки времени, также помогут в разработке новых способов стимуляции мозга и быстродействующих терапевтических средств. Благодаря достижениям в сенсорных технологиях и искусственном интеллекте одним из решений этой проблемы могут стать цифровые поведенческие показатели, которые уже обещают прогнозирование параметров лечения ГСМ на индивидуальном уровне [171–174] и тяжести симптомов на уровне популяции [175]. Следующим шагом будет определение того, в какой степени цифровые сигналы могут действовать как суррогаты соответствующих мозговых цепей, особенно с учетом множества проблем с интерпретируемостью, связанных с различением клинически значимой вариации и вариации, вызванной измерениями или контекстуальными факторами [176]. Действительно, недавняя попытка Национального института здоровья по количественной оценке и синхронизации поведения мозга была направлена на то, чтобы объединить исследователей из разных научных дисциплин для количественной оценки поведенческих данных высокой плотности с одновременной записью мозговой активности и фиксацией контекстуальных данных из окружающей среды (https://event.roseliassociates.com/bbqs-workshop/). Ключевое значение будет иметь решение вопросов этики и конфиденциальности, связанных с глубоким динамическим фенотипированием медицинских данных [177].
Учитывая поразительную сложность человеческого мозга и природу психиатрических симптомов, включающих наиболее характерные для человека функциональные аспекты, неудивительно, что прецизионная психиатрия возникала медленно. Тем не менее, недавний прогресс в технологиях, методах лечения и биомаркерах приближает нас к этой цели в то время, когда увеличение терапевтического арсенала в психиатрии необходимо как никогда. Этот обзор не исчерпывающий; авторы сосредоточились на новых и разрабатываемых терапевтических подходах, которые возникают благодаря более глубокому пониманию нейронных цепей, но фундаментальные достижения в других областях психиатрии, таких как анализ медицинских записей на основе данных, компьютерные модели в психиатрии и терапевтические подходы, сочетающие механистические и цифровые воздействия также важны для прогресса в этой области. Вместе эти достижения дают надежду на благоприятное будущее для психиатрии и улучшение качества жизни пациентов и их семей.
