Нейрональный контроль мочеиспускания. Часть 2.

Уротелий — слой эпителиальных клеток, выстилающих слизистую оболочку мочевого пузыря (МП), со времен его открытия традиционно рассматривался как пассивный барьер, защищающий мочевой пузырь от вредных компонентов мочи. Сегодня же известно, что уротелий — это структура со своими сенсорными и сигнальными функциями, которые позволяют ему реагировать на химические и физические стимулы.
Уротелий как новая сенсорная структура
Идея о том, что уротелий во время наполнения МП может стимулировать нервные окончания, была впервые предложена Ferguson [1]. Позже Rong и соавторы представили прямые доказательства, что АТФ и его аналоги, выделяемые уротелием во время растяжения, стимулируют окончания афферентных нервов [2]. Последующие исследования подтвердили сигнальную функция уротелия, на окончаниях нервных волокон обнаружили пуринергические рецепторы (P2X и P2Y). Физиологическая значимость рецепторов P2X также была подтверждена в экспериментах, в которых делеция гена рецептора P2X3 подавляла афферентную передачу, что приводило к нарушению рефлекса мочеиспускания и вызывало задержку мочи [3]. Помимо P2X рецепторов, на окончаниях нервных волокон имеются ванилоидные рецепторы, которые активируются при ацидозе (один из механизмов возникновения боли при ишемии и воспалении в МП), а также могут стимулироваться продуктами метаболизма арахидоновой кислоты. Таким образом, уротелий и нервные волокна реагируют не только на физиологические раздражители, но и на патологические стимулы.
Рецепторы, экспрессируемые на уротелии, благодаря которым он получает сигналы от других клеток
Большое количество разных подтипов мускариновых рецепторов экспрессируется на уротелии. Кроме того, на уротелиальных клетках расположено множество других рецепторов, например:
- никотиновые рецепторы,
- пуринергические рецепторы P2X и P2Y,
- рецепторы транзисторных потенциалов (TRPs: TRPV, TRPA1 и TRPM8),
- рецепторы к нейрокинину (NK2),
- рецепторы к адренергическим молекулам,
- рецепторы к брадикинину (B1, B2),
- рецепторы к простагландину Е (подтип EP1),
- рецепторы к аденозину (A1, A2a/b и A3),
- эстрогеновые рецепторы (Erα, Erβ),
- тропомиозин-рецепторная киназа A (TrkA),
- механочувствительные ионные каналы,
- рецепторы к фактору роста нервов.
Все вышеперечисленные рецепторы и каналы позволяют уротелию взаимодействовать с веществами, растворенными в моче (пурины и фактор роста нервов), и химическими медиаторами и пептидами, благодаря чему переходный эпителий (ПЭ) может отвечать на большое количество различных сигналов.
Медиаторы уротелия
Наиболее важное вещество, высвобождаемое ПЭ МП в ответ на изменения давления, pH или осмолярности мочи, — это АТФ. Уротелий выделяет и другие вещества, такие как ацетилхолин, оксид азота, субстанция Р и простагландины. Все эти химические вещества преобразовывают различные сенсорные сигналы, приходящие к ПЭ МП, и активируют или ингибируют реакции, происходящие в близлежащих клетках.
Виды рецепторов, участвующих в афферентной иннервации МП, и пути передачи сигналов
Существует несколько путей передачи сигналов от уротелия к чувствительным нейронам. Вопрос о том, какой из них играет доминирующую роль в афферентной иннервации МП, остается открытым, однако на сегодняшний день главенствующая роль отдается АТФ-опосредованной активации пуринергических рецепторов (P2X), что приводит к старту афферентной активности нервных окончаний [4]. Помимо пуринергических рецепторов, на нервных окончаниях было обнаружено большое разнообразие других рецепторов (TrkA, NK2 и TRPs), которые также принимают участие в передаче сигналов от ПЭ МП.
Нейротрансмиттерная регуляция выделения уротелиальных медиаторов
Контроль выделения медиаторов — сложно устроенная система сенсорной сигнализации.
Как уже было сказано, основной медиатор, выделяемый уротелием, — это АТФ, за его высвобождение отвечают нейротрансмиттеры, которые действуют на мускариновые и пуринергические рецепторы и выделяются эфферентными нервными волокнами. Самое интересное, что ацетилхолин и АТФ только запускают процесс высвобождения АТФ, а далее, благодаря тому, что клетка сама начинает продуцировать АТФ, она же усиливает химический сигнал от нервов.
Роль миофибробластов
Открытие субуротелиального слоя миофибробластов (также называемого интерстициальными клетками) привело к предположению, что эти клетки вместе
с афферентными нервами, уротелием и гладкой мускулатурой образуют единую сенсорную систему, реагирующую на растяжение мочевого пузыря. Обнаружение на их поверхности P2X рецепторов предполагает, что они также могут отвечать на АТФ-опосредованную сигнализацию ПЭ.
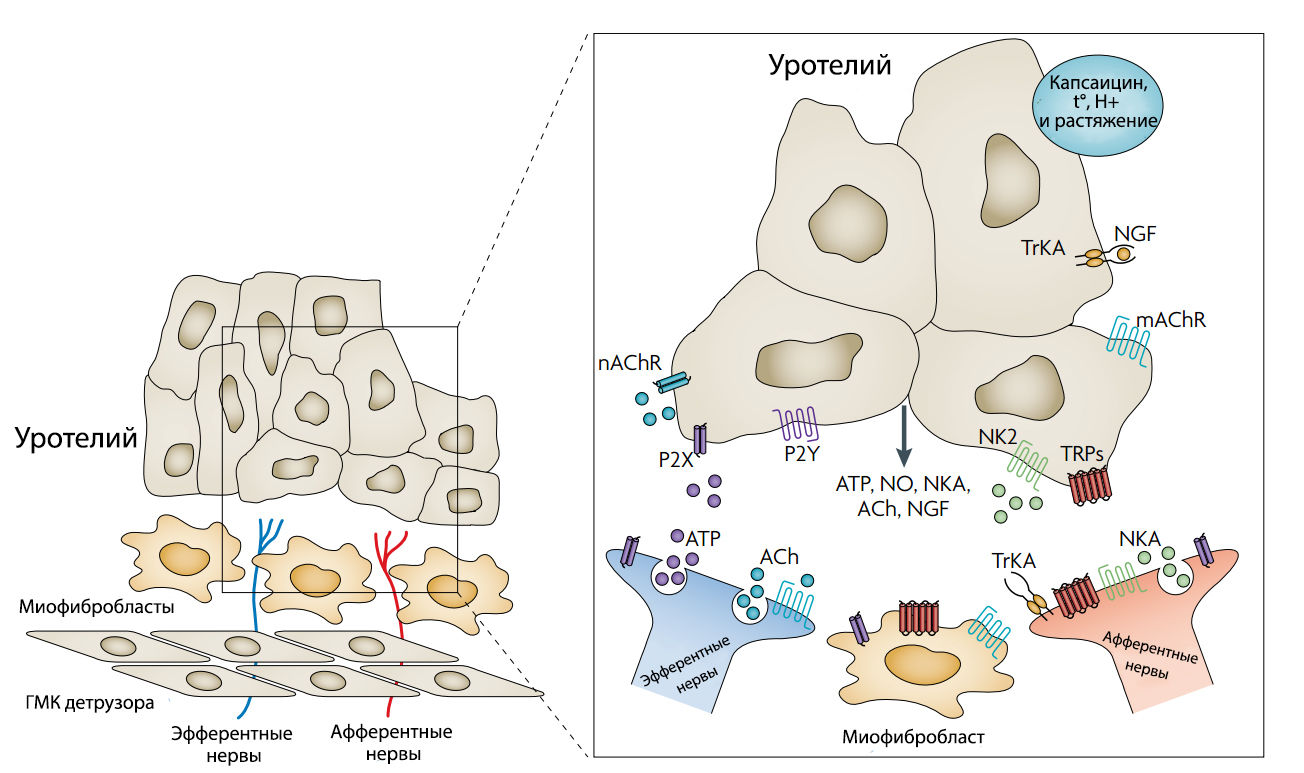
Рисунок 1 | Графическая модель, отображающая возможные взаимодействия между уротелием, миофибробластами и нервными окончаниеми в мочевом пузыре.
nAChR — никотиновый холинорецептор;
mAChR — мускариновый холинорецептор;
P2X и P2Y — пуринергические рецепторы;
NKA — нейрокинин 2;
TRPs — рецепторы транзисторных потенциалов;
ACh — ацетилхолин;
NGF — фактор роста нервной ткани;
TrkA — тропомиозин-рецепторная киназа A.
Источники:
- Ferguson DR, Kennedy I, Burton TJ. ATP is released from rabbit urinary bladder epithelial cells by hydrostatic pressure changes--a possible sensory mechanism? J Physiol. 1997;505:503–11
- Rong W, Spyer KM, Burnstock G. Activation and sensitisation of low and high threshold afferent fibres mediated by P2X receptors in the mouse urinary bladder. J Physiol. 2002;541:591–600.
- Cockayne DA, Hamilton SG, Zhu QM, Dunn PM, Zhong Y, Novakovic S, et al. Urinary bladder hyporeflexia and reduced pain-related behaviour in P2X3-deficient mice. Nature. 2000;407:1011–5.
- Ueda, Norichika, et al. "Intravesical ATP instillation induces urinary frequency because of activation of bladder afferent nerves without inflammatory changes in mice: A promising model for overactive bladder." Biochemical and biophysical research communications 506.3 (2018): 498-503.
- Liao L., Madersbacher H. (ed.). Neurourology: Theory and Practice. — Springer, 2019.
- Clare J. Fowler et al. The neural control of micturition. — Nature Reviews | Neuroscience, volume 9. — June 2008.
