Аутофагия
Аутофагия — это процесс прижизненной деградации с помощью лизосом измененного метаболитами содержимого цитоплазмы для поддержания клеточного и энергетического гомеостаза [1]. Аутофагия считается «программируемой» гибелью всей клетки или отдельных ее частей. У млекопитающих аутофагия наблюдается во многих физиологических процессах: реакции на голодание, контролировании роста клеток, процессах врожденного иммунитета и защите от старения, избавлении от долгоживущих белков и поврежденных органелл, при дифференцировке и трансформации клеток (Рис. 1). Это играет важную роль в поиске решений лечения ряда заболеваний, включая канцерогенез и нейродегенеративные болезни [2].
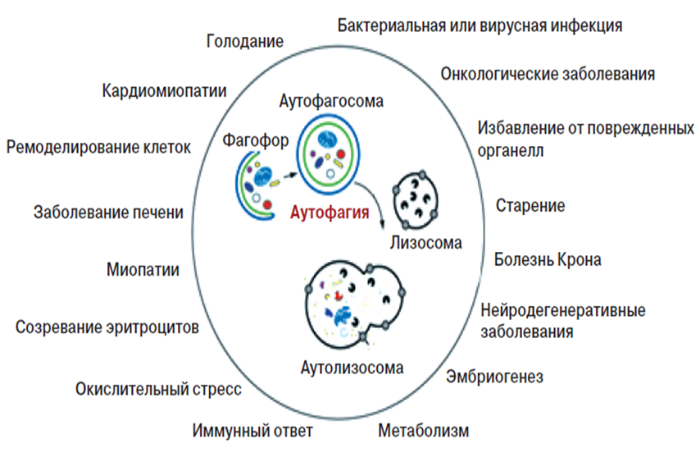
Рисунок 1 | Некоторые физиологические процессы, которые сопровождаются участием аутофагии
Процесс «самопоедания» впервые был отмечен Портером К.Р. и его учеником в 1962 году, когда они сообщили о увеличении числа лизосом в клетках печени крыс после добавления глюкагона и о том, что некоторые лизосомы содержали в себе митохондрии. Термин «аутофагия» ввели в 1963 г. Кристиан де Дюв и Новиков А.Б., описывая его как процесс доставки цитоплазматического материала клетки в лизосомы с целью последующей деградации [3]. О «программируемой» гибели клетки или ее частей заговорили еще в 1990-х годах, когда впервые поступили данные о том, что некоторые группы ученых обнаружили гены, связанные с процессом аутофагии.
Однако только в 2016 году Есинори Осуми получил Нобелевскую премию по медицине и физиологии за исследование аутофагии в дрожжевых клетках и обнаружение с помощью генетического подхода полутора десятков генов, которые отвечают за образование аутофагосом. В дальнейшем исследование функционирования белковых продуктов этих генов привело к выяснению молекулярных механизмов индукции, протекания и регуляции аутофагии [4].
Согласно современным данным, аутофагия подразделяется на три типа: микроаутофагия, шаперон-зависимая аутофагия, макроаутофагия (Рис. 2).
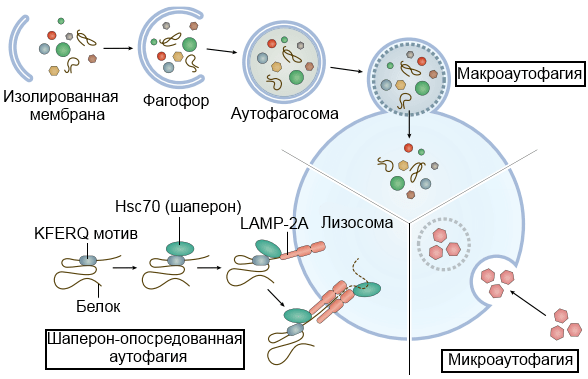
Рисунок 2 | Типы аутофагии
Микроаутофагия. Макромолекулы и обломки клеточных мембран попадают в лизосому путем инвагинации ее мембраны. Благодаря этому клетка может расщеплять белки при нехватке энергии или «строительного материала». Данный тип аутофагии подробно описан и наблюдается у дрожжей, однако слабо охарактеризован у млекопитающих.
Шаперон-зависимая аутофагия. При данном типе аутофагии не требуется реорганизация лизосомальной мембраны или формирование дополнительных везикул. Данный процесс происходит при участии цитоплазматических белков-шаперонов семейства Heat shock protein 70 (Hsp 70), вспомогательных белков и Lysosome-associated membrane protein type 2A (LAMP-2). При участии белков происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они подвергаются деградации.
Макроаутофагия. При данном типе из участка цитоплазмы, окруженного мембранным компартментом, формируются аутофагосомы, которые потом соединяются с лизосомами, образуя аутофаголизисомы. Именно в них и происходит дальнейшая деградация органелл и остального содержимого аутофаголизосомы. При этом процесс аутофагии можно разделить на несколько основных стадий: инициацию, элонгацию, формирование аутофагосомы и формирование аутофаголизосомы. Все стадии процесса контролируются специфическими генами Autophagy-related Genes (ATG). Именно при данном типе аутофагии происходит деградация митохондрий, эндоплазматического ретикулума, пероксисом, рибосом, белков, липидов и РНК.
Существуют и механизмы регуляции процессов аутофагии: сигнальный путь PI3K класса I, активируемый в ответ на ростовые факторы; сигнальный путь PI3K класса III, регулирующий количество аминокислот в клетке, и сигнальный путь LKB1/AMPK, который чувствителен к уровню АТФ. Основным компонентом вышеуказанных путей регуляции является киназа mTOR, которая ингибирует процесс аутофагии в клетках.
Есинори Осуми при изучении белка LC3 млекопитающий, гомолога дрожжевого белка ATG8, обнаружил укороченную и липидированную формы данного белка — LC3-I и LC3-II соответственно. Именно эти формы в настоящее время считаются маркерами аутофагосом и индикаторами аутофагии.
Роль аутофагии в гемопоэзе. Недавние исследования показали, что ген Atg7 является важнейшим регулятором гемопоэтических стволовых клеток, при его отсутствии происходит усиление пролиферации и повреждение ДНК. Также основные белки регуляторы аутофагии (Atg5, LC3, Beclin-1) обнаруживаются в лимфоцитах CD4+ и CD8+, и их содержание повышается в активированных Т-клетках [5]. Кроме того, Atg5 участвует в развитии В-клеток, а его отсутствие приводит к патологиям данного типа клеток.
Аутофагия значительно влияет и на окончательную дифференцировку ретикулоцитов, избавляя их от митохондрий. При ингибировании mTOR процесс аутофагии позволяет уменьшить размер мегакариоцитов и вызывает задержку их дифференцировки. Кроме того, имеются данные, что активация аутофагии является непосредственным участников в формировании иммунного ответа [6].
Роль аутофагии в канцерогенезе. Известно, что неопластические клетки имеют свойство подавлять в себе процессы апоптоза, в связи с этим возможность запустить аутофагию считается более перспективным выходом для супрессии неопластического процесса. Однако по литературным данным указывается, что запуск аутофагии данного типа клеток на разных стадиях канцерогенеза может дать и отрицательные результаты, наоборот ингибируя перерождение нормальных клеток в опухолевые [6]. Кроме этого, аутофагия важна и в процессах опухолевой прогрессии, а именно инвазии и метастазирования.
Роль аутофагии в нейродегенеративных заболеваниях. Возможность клеток самим избавляться от дефектных белков и органелл особенно актуальна для неделящихся долгоживущих клеток, таких как нервные клетки. Так, при болезни Альцгеймера в клетках накапливается агрегаты неправильно свернутого белка бета-амилоида, а при болезни Паркинсона — альфа-синуклеина. Удаление данных частиц может помочь в достижении положительной динамики в вышеуказанных заболеваниях и, как следствие, замедлению их прогрессирования. Однако мутации в ATG-генах, нарушение баланса между образованием аутофагосом и их деградацией в лизосомах приводят к гибели нервных клеток.
Аутофагия вовлечена во многие процессы жизнедеятельности всех клеток организма. И нарушение данного процесса влечет за собой развитие многих патологий. Остаются еще нерешенные вопросы влияния аутофагии на дифференцировку и развитие большинства клеток организма. До сих пор не полностью понятны механизмы ингибирования и супрессии аутофагии и последствия к которым приведет то или иное состояние в отдельных системах организма. Кроме того, остаются споры о влиянии аутофагии на канцерогенез и изменение этого процесса при взаимодействии с различными лекарственными препаратами, но в настоящее время активно продолжаются клинические исследования ингибиторов аутофагии, использование которых представляется перспективным в терапии злокачественных новообразований.
Источники:
- Kuballa P., Nolte W.M., Castoreno A.B., Xavier R.J. Autophagy and the immune system // Ann. Rev. Immunol. – 2012. – 30.
- Janeway C.A. Jr., Medzhitov R. Innate immune recognition // Ann. Rev. Immunol. – 2002. – 20.
- Ashford T.P., Porter K.R., Cytoplasmic components in hepatic cell lysosomes // The Journal of Cell Biology. – 1962. – 12.
- The Nobel Prize in Physiology or Medicine 2016 // The Nobel Foundation. – 3 October 2016.
