Кишечные бактерии нивелируют сахароснижающий эффект акарбозы

В этом выпуске Nature Metabolism, ученые описывают связь между плохими ответами на терапию и глюкозидазой кишечных бактерий, которая способствует распаду акарбозы (средства против сахарного диабета). Повсеместное распространение микроорганизмов в микробиоме человеческого кишечника способно в значительной степени снизить эффективность терапии акарбозой у многих пациентов.
Пероральные противодиабетические средства с определенным эффектом применяются уже в течение нескольких десятилетий. Тем не менее еще только предстоит разобраться со многими аспектами, как например, различием ответов на применяемую терапию у разных людей или диапазоном развивающихся побочных эффектов [1]. За последнее десятилетие ученое сообщество пришло к выводу, что ответ на эти вопросы кроется, по крайней мере частично, в микробиоме конкретного пациента. Авторы выяснили, что несколько классов противодиабетических препаратов, в том числе, метформин и инкретины, способны менять состав и функционирование кишечного микробиома, что, в свою очередь, может влиять на метаболизм глюкозы и чувствительность к инсулину [2].
Микробиом кишечника может оказывать влияние и на биодоступность и метаболизм противодиабетических препаратов, что приводит к различным исходам лечения. В частности, объяснением таких различий может служить деградация лекарственных соединений под действием микробов. В этом выпуске Nature Metabolism Тьян с соавт. [3] описывают путь деградации противодиабетического препарата акарбозы, в основе которого лежит гидролитическая активность глюкозидазы кишечных бактерий.
Обычно акарбоза принимается перорально, непосредственно перед едой. Препарат ингибирует ферменты альфа-глюкозидазы человека, например, амилазу слюны и поджелудочной железы, тем самым замедляя переваривание сложных углеводов и степень повышения концентрации глюкозы в крови после приема пищи [4]. Большая часть принятой дозы акарбозы остается неабсорбированной в кишечнике, что приводит к интенсивному взаимодействию с микробиомом кишечника.
Действительно, было описано несколько видов таких взаимодействий: акарбоза ингибирует систему утилизации крахмала у штаммов Bacteroides thetaiotaomicron и Bacteroides fragilis [5], снижает адаптационные возможности кишечных микробов в условиях in vitro [6] и связана с изменением состава микробиома у пациентов [7]. Но реальная клиническая значимость подобных взаимодействий оставалась неизвестной.
Tьян с соавт. [3] предоставляют доказательства того, как взаимодействие акарбозы и микробиома может влиять на терапевтический эффект применения этого средства. Впервые группа исследователей наблюдала выраженные различия концентрации глюкозы в крови у отдельных людей (в когорте было 393 человека, страдающих сахарным диабетом 2 типа и получавших лечение акарбозой) (см. рис. 1а). Интересно, что результаты анализов образцов фекалий пациентов, плохо реагирующих на препарат, продемонстрировали высокую способность расщеплять акарбозу, что указывает на существование некоего пути деградации, опосредованного микробиомом. Для определения видов бактерий, которые способны разлагать акарбозу, авторы культивировали образец стула пациента с наихудшей реакцией на препарат (т.е. образец с высокой активностью деградации акарбозы), поэтапно увеличивая его концентрацию для того, чтобы произошло максимальное накопление толерантных к акарбозе бактерий. Благодаря этому методу удалось выделить 18 штаммов разрушителей акарбозы, все из которых принадлежали виду Klebsiella grimontii. Известно, что эта факультативная анаэробная бактерия колонизирует тонкий кишечник, где акарбоза ингибирует расщепление полисахаридов. Действительно, как было показано на мышиной модели диабета, штамм TD1 K. grimontii ослаблял сахароснижающий эффект акарбозы.
Идентифицировав бактерию, способную разлагать акарбозу, авторы обратились к поиску возможного механизма, по которому K. grimontii расщепляет лекарство. Используя методы транскриптомики, они культивировали штамм K. grimontii TD1 в среде с минимальным содержанием крахмала в качестве единственного источника углерода, что сделало рост бактерий зависимым от амилазы. Добавив акарбозу для ингибирования активности амилазы, они «заставили» K. grimontii TD1 активировать гены, способствующие расщеплению акарбозы (работу этих генов можно было количественно определить с помощью секвенирования РНК). Параллельно, используя протеомику, авторы разделили на фракции клеточные лизаты, выделив таковые с высокой активностью расщепления акарбозы. Белки в составе таких фракций идентифицировали методом масс-спектрометрии. Результаты как транскриптомики, так и протеомики свидетельствуют об одном и том же: существует неизвестная ранее глюкозидаза, которую авторы назвали «глюкозидазой, предпочитающей акарбозу» (Apg; от англ. acarbose-preferred glucosidase). В эксперименте in vitro или в условиях гетерологической экспрессии в Escherichia coli фермент оказался способен проводить гидролиз акарбозы с образованием акарвиозин-глюкозы и акарвиозина (см. рис. 1b). В значительной степени оба продукта были неспособны ингибировать α-амилазу свиней (рис. 1с). Поразительно, однако максимальная активность фермента наблюдалась в анаэробных условиях при pH 7,5 и температуре 37 °C — т.е. в условиях, сходных с физиологическими в кишечнике человека. Это открытие подняло новый вопрос: как акарбоза может быть субстратом для бактериальной глюкозидазы, однако при этом и ингибитором человеческой глюкозидазы, к примеру, α-амилазы. С помощью молекулярного 3D-моделирования авторы выяснили, что остатки молекулы-субстрата в каталитическом сайте глюкозидазы Apg расположены иначе, по сравнению с α-амилазой человека, что обеспечивает гидролиз акарбозы. В таком случае продукты ее деградации оказываются слишком маленькими, чтобы эффективно занимать карман для связывания лиганда в составе α-амилазы человека, что приводит к снижению ингибирования фермента.
Раскрыв механизм деградации акарбозы, авторы вернулись к анализу ее клинической значимости: в когорте пациентов с диабетом 2 типа, у более чем 98 %, получавших акарбозу, присутствовали бактерии, обладающие Apg-подобными ферментами. Для сравнения, около 14 % здоровых людей являются носителями apg+ бактерий. При этом такие факторы, как место жительства (в географическом плане), пол и ИМТ обеспечивают формирование индивидуальных различий распространенности и численности таких микроорганизмов. Интересно, что распространенность apg+ бактерий оказалась наивысшей среди людей в Китае, где часто принимают акарбозу. Согласно этому, Apg и Apg-подобные ферменты, синтезируемые микробиотой кишечника, могут влиять на эффективность лекарственных средств и успешность терапии у многих пациентов.
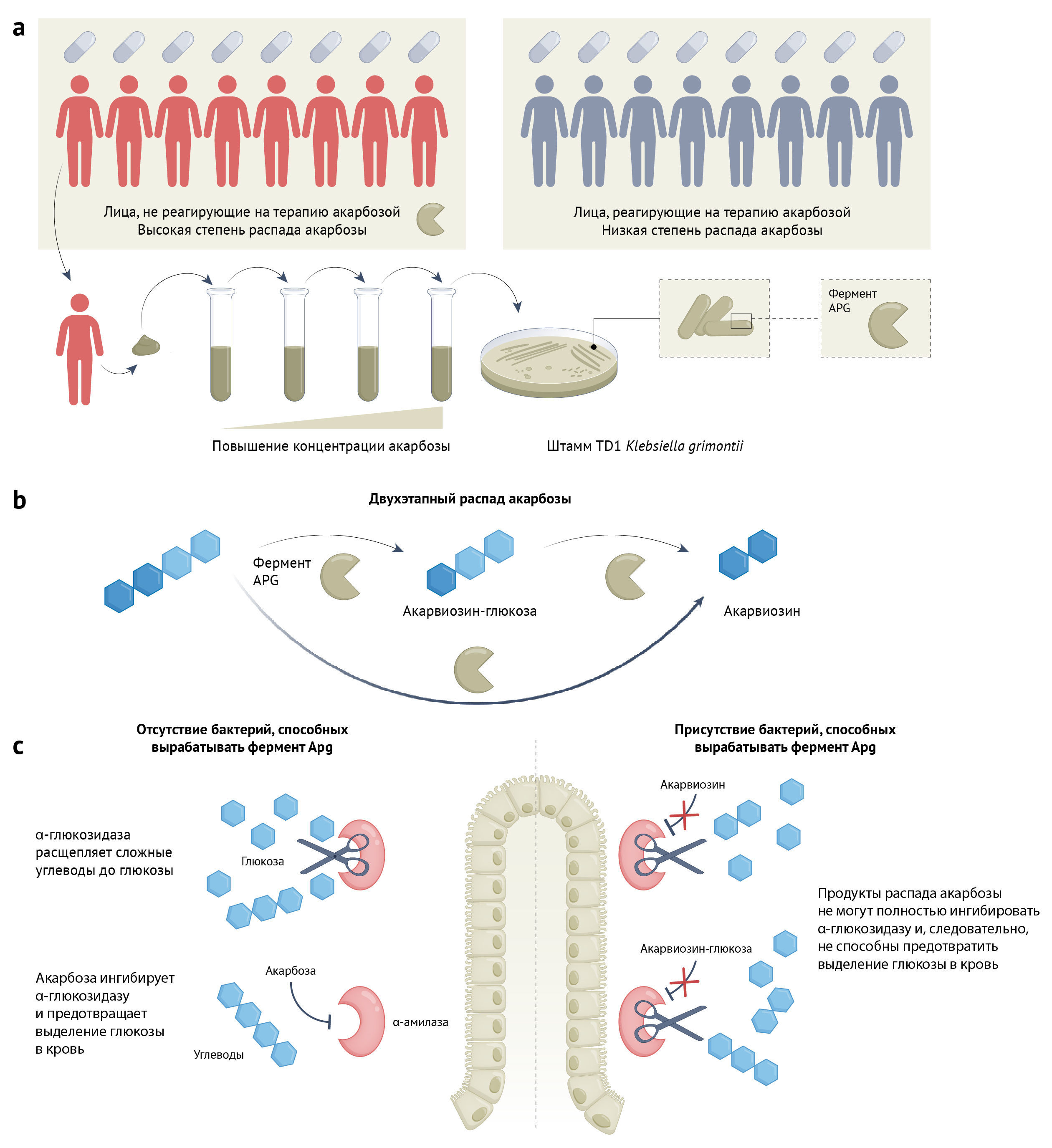
с — Бактерии, синтезирующие Apg, уменьшают выраженность ингибирующего эффекта акарбозы на α-амилазу человека. Результатом этого становится выделение глюкозы в кровь и устойчивость к терапии.
Исследование Tьян с соавт.[3] инновационно в нескольких отношениях. Во-первых, авторы выявили новый путь инактивации акарбозы, который влечет за собой гидролиз препарата. Это отличается от уже известного пути с фосфорилированием акарбозы [8]. Как и глюкозидаза Apg, киназы акарбозы широко распространены в микробиоме человека. Это говорит о том, что устойчивость к акарбозе — некая общая стратегия защиты, возникшая независимо у разных кишечных микробов. Почему устойчивость к акарбозе является полезной особенностью для бактерий кишечника, остается неясным: возможно биологическая роль ее заключается в детоксикации родственных акарбозе эндогенных соединений или для успешного получения сложных углеводов в качестве источников пищи. Во-вторых, Тьян с соавт. обнаружили новую бактериальную глюкозидазу, которая способна расщеплять акарбозу. Другие глюкозидазы уже были описаны ранее, хотя непосредственная связь таких ферментов с исходом лечения не была обнаружена [9]. Поскольку часто в геноме кишечных бактерий гены углеводного обмена представлены в изобилии, а также демонстрируют значительную степень разнообразия [10], можно предположить, что вскоре будут открыты новые подобные ферменты. В-третьих, в своей работе авторы демонстрируют инактивацию посредством бактерий лишь одного ингибитора α-глюкозидазы. Следует ожидать, что другие ингибиторы α-глюкозидазы могут повторять судьбу акарбозы [11], равно как и другие препараты на основе углеводов, а также пищевые добавки. Таким образом, по всей видимости, данное исследование лишь приоткрывает завесу тайны, и вскоре стоит ожидать появления новых подобных наблюдений. Наконец, авторы представляют дорожную карту того, как в экспериментальных условиях выявить ферменты, разлагающие лекарства. В основе метода лежит требование: необходимо, чтобы подозреваемую бактерию можно было культивировать. В настоящем исследовании авторы работали с чистой культурой, однако этот подход может быть адаптирован и к культурам бактериальных сообществ.
Это исследование служит напоминанием о важности микробного метаболизма лекарств. Новый уровень понимания путей деградации лекарств, в процесс чего непосредственно вовлечен микробиом, имеет огромный потенциал для персонализированных и более эффективных стратегий терапии.
