Изучение роли гентинтгтина: от развития нервной системы к нейродегенерации

Появляется все больше данных о том, что белок гентингтин играет решающую роль в развитии нервной системы [1]. Болезнь Гентингтона — это нейродегенеративное заболевание, вызванное увеличением числа повторов CAG в гене HTT, что ведет к экспрессии мутантного белка гентинтгтина. Эта мутация вызывает значительную утрату нейронов — особенно в полосатом теле и в коре головного мозга, — что приводит к появлению целого ряда двигательных и когнитивных нарушений и психопатологических симптомов. Хотя существует несколько гипотез, точный механизм, с помощью которого гентинтгтин провоцирует нейродегенерацию, остается неясным. Учитывая взаимосвязь между геном HTT и развитием нервной системы, разумно предположить, что нейродегенерация, наблюдаемая при болезни Гентингтона, может быть отсроченным следствием ранних изменений такого развития, вызванных наличием гентинтгтина. В недавнем выпуске журнала Brain Эстевес-Фрага и его коллеги [2] исследовали связи между генетической топографией, утратой клеток коры и общей траекторией прогрессирования заболевания. Команда применила метод магнитно-резонансной морфометрии и и диффузионную МРТ для создания карт мозга при болезни Гентингтона, сопоставляя их с контрольными данными, чтобы выявить области коры со значительной потерей клеток. Последующее сочетание этих изображений с данными об экспрессии генов из «Атласа человеческого мозга» Аллена позволило создать подробную панораму генетического ландшафта болезни Гентингтона и ее потенциального влияния как на развитие нервной системы, так и на нейродегенерацию.
Выдающимся открытием в ходе этой работы стала стойкая положительная корреляция между утратой клеток коры и экспрессией генов, отвечающих за развитие. В частности, в областях со значительной атрофией коры также обнаружилась наибольшая экспрессия генов, участвующих в развитии. Напротив, для синаптических и метаболических генов, известных как ответственных за нейродегенерацию, авторы обнаружили отрицательную корреляцию, и более высокая экспрессия этих генов была связана с меньшей потерей клеток коры [2]. Такая дихотомия указывает на сложный баланс между генетическими основами болезни Гентингтона и наблюдаемыми морфологическими изменениями головного мозга.
В связи с этими наблюдениями перед авторами стоит трудная задача — попытаться интерпретировать сложное взаимодействие между геном HTT и развитием нервной системы в контексте растущего объема литературы, посвященной этой теме. Исследователи полагают, что, поскольку пациенты с болезнью Гентингтона имеют один мутантный аллель и один аллель дикого типа, то у них будет понижен уровень гентингтина дикого типа, что может быть недостаточно для поддержания нормального развития. Подтверждение этой теории потери функции можно найти, используя доклинические животные модели, показывающие, что снижение содержания гентингтина дикого типа во время нормального развития приводит к дегенерации коры и полосатого тела [3]. Однако эта теория, по-видимому, контрастирует с другой гипотезой о роли гентингтина в развитии нервной системы и хореей Гентингтона, которая хорошо подтверждается данными литературы. Согласно этой гипотезе, существует три аспекта функции гена HTT, которые важно учитывать при оценке его роли в развитии нервной системы: (I) HTT, по-видимому, действует исключительно за счет доминантной функции своего самого длинного аллеля; (II) эффекты HTT зависят от количества повторов CAG во всем аллельном континууме как ниже, так и выше порога заболевания; и (III) роль HTT в развитии мозга, вероятно, создает функциональное преимущество на раннем этапе жизни и, возможно, в ходе эволюции человеческого мозга подвергалась положительному отбору. Важно отметить, что именно создание этого раннего функционального преимущества может привести к уязвимости к дегенерации в более позднем возрасте.
Если говорить о первом пункте, то доклинические исследования показали, что ген НТТ влияет на энергетический обмен и экспрессию генов по механизму полного доминирования [4]. Более того, тот же механизм отвечает за хорошо известный феномен, согласно которому количество повторов CAG сильно коррелирует с возрастом начала заболевания [5]. В исследованиях развития человеческого мозга было показано, что ген HTT влияет на структуру мозга и когнитивные функции, в том числе когда количество CAG-повторов ниже патологического, причем эффекты обусловлены только самым длинным аллелем [6]. Наконец, у лиц с болезнью Гентингтона фенотип тех, кто гомозиготен по гену HTT, не отличается от фенотипа людей, гетерозиготных по HTT [7]. Это сравнение подтверждает теорию о том, что мутантный HTT действует доминантным образом, поскольку дополнительный мутантный аллель HTT, по-видимому, не имеют клинического эффекта. Кроме того, оно опровергает представление о том, что отсутствие дикого типа гентингтина отрицательно влияет на развитие нервной системы и, следовательно, на нейродегенерацию, поскольку можно ожидать, что гомозиготные носители будут иметь значительные изменения в развитии нервной системы, которые предрасполагают их к более тяжелому течению заболевания.
Существует множество данных в пользу идеи о том, что HTT действует в аллельном континууме (спектре) CAG-зависимым образом. В исследовании детей с нормальным диапазоном числа CAG-повторов (15–34) большее количество CAG-повторов было связано с благоприятными изменениями в структуре мозга и лучшими когнитивными функциями [6]. У детей-носителей мутантного гена HTT эта закономерность сохраняется, при этом каждое увеличение длины повтора CAG приводит к улучшению когнитивных навыков и увеличению объема мозга [8,9]. В совокупности это подтверждает теорию о том, что функция гентингтина линейно создает фенотипические вариации по всему аллельному континууму.
Биологи-эволюционисты уже давно постулировали, что гены с триплетными повторами могут генерировать ряд фенотипов, создавая изменчивость, необходимую для адаптивной эволюции. Недавняя работа показала, что полиглутаминовый тракт, кодируемый CAG в гене HTT, находится под сильным эволюционным давлением отбора. Более того, увеличение количества CAG-повторов значительно коррелировало с изменениями в транскрипционных сетях генов, управляющих функцией нейронов, подтверждая гипотезу о том, что большее количество CAG-повторов может приводить к развитию более зрелых, лучше связанных и более функциональных нейронов [10]. Это подтверждается клиническими исследованиями, которые показывают, что увеличение длины повторов CAG приводит к увеличению объема мозга и улучшению когнитивных навыков. Важно отметить, что исследования детей с повторами CAG в патологическом диапазоне показали, что их когнитивные навыки значительно лучше, чем у детей с нормальным количеством повторов, что подтверждает идею о том, что мутантный гентингтин не только управляет функцией мозга, но и создает функциональное преимущество в раннем возрасте [8].
Результаты Эстевеса-Фраги и его коллег предоставляют дополнительные данные о том, что вызванные гентингтином изменения в развитии нервной системы, вероятно, вносят значительный вклад в будущую нейродегенерацию при болезни Гентингтона [2]. Но как раннее функциональное преимущество может подготовить почву для последующей нейродегенерации? У детей с мутацией в гене HTT увеличение объема полосатого тела с раннего возраста до 18 лет определялась дефектным белком и зависела от длины CAG-повторов [9]. За первоначальной гипертрофией полосатого тела следовало линейное снижение объема головного мозга, что резко контрастирует с тем, как меняется объем мозга у детей без мутантного гена. Более того, чем больше число повторов, тем значительнее снижается объем полосатого тела. Это подчеркивает связь между ранним преимуществом и последующей дегенерацией и подтверждает теорию о том, что нейронные цепи, которые развились с целью функционального превосходства, возможно, также содержали структурные дефекты, которые делают их особенно уязвимыми для дегенерации. Одна из возможностей заключается в том, что ход развития и дегенерации при болезни Гентингтона — это просто ускоренная траектория нормальных процессов. В частности, рост и развитие головного мозга в раннем возрасте может привести к ускорению процесса старения (рис. 1).
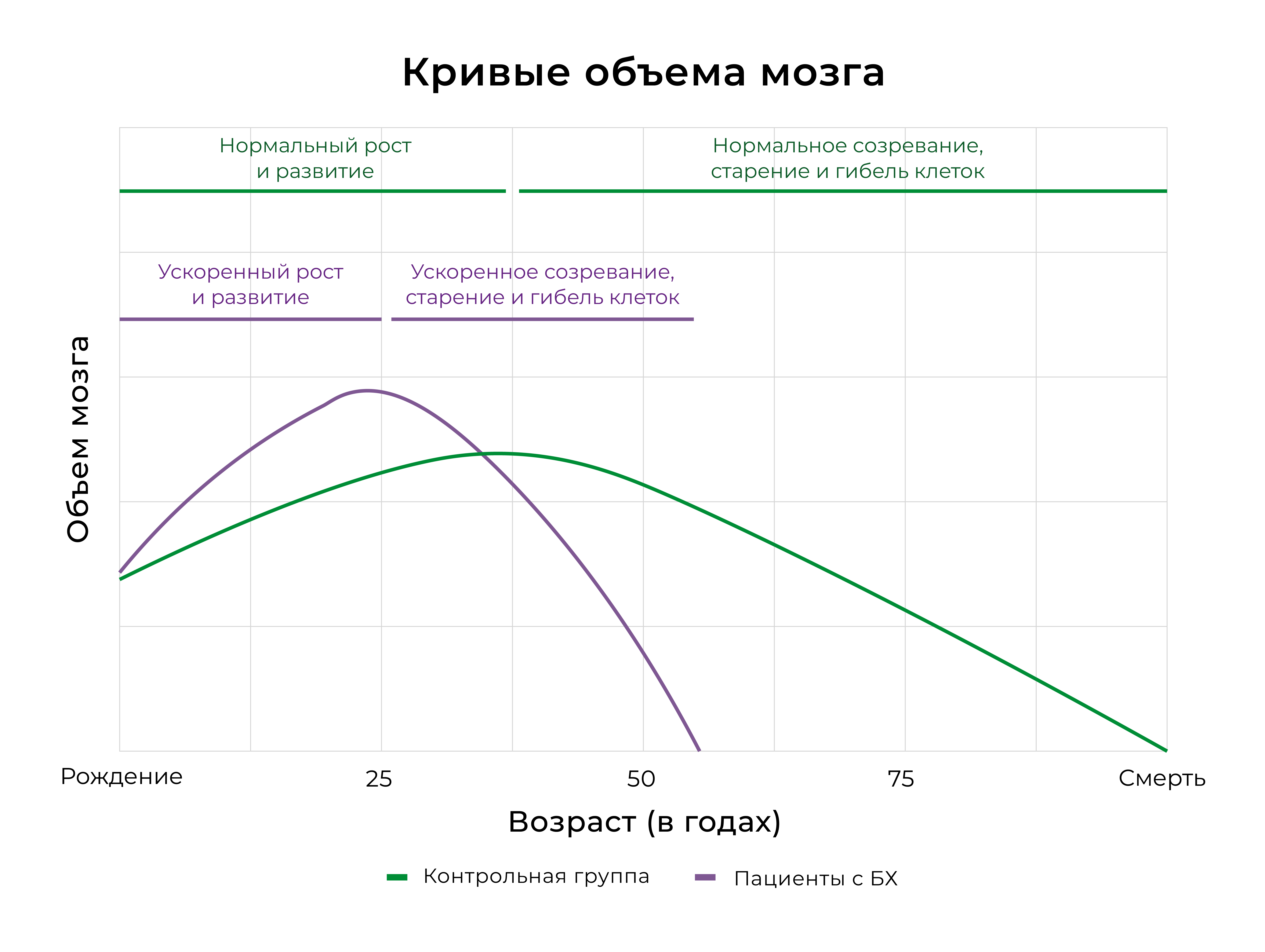
Рисунок 1. Развитие нервной системы и нейродегенерация при болезни Гентингтона.
У лиц из контрольной группы (зеленая линия) происходит нормальное развитие головного мозга, и его пик приходится примерно на 30 лет, с медленным снижением объема, связанным с нормальным старением. У пациентов с болезнью Гентингтона (фиолетовая линия) в более раннем возрасте происходит гипертрофия головного мозга, что может быть связано с когнитивными преимуществами. Однако такое благоприятное развитие нервной системы создает уязвимость, что приводит к ускорению процессов старения и нейродегенерации.
Роль мутантного гентингтина в развитии мозга имеет важное значение для текущих стратегий разработки лекарств, направленных на снижение его количества. Конечная цель — выключить ген, вызывающий заболевание, достаточно рано, чтобы вовсе предотвратить возникновение заболевания. Однако, чтобы полностью созреть, человеческому мозгу требуется около 30 лет, и нужна большая осторожность, прежде чем пытаться снизить концентрацию белка, про который известно, что он полезен для раннего функционирования мозга. К сожалению, методы лечения, направленные на снижение уровня гентингтина в более позднем возрасте, могут быть неэффективными, поскольку они не устраняют уязвимость, созданную дефектным белком во время развития нервной системы. Напротив, более эффективной может оказаться терапия, предназначенная для защиты нейронов, которые приобретают уязвимость в результате наблюдаемых изменений развития нервной системы. Например, известно, что у пациентов с болезнью Гентингтона происходит нарушение функции митохондрий. Если присутствие мутантного гентингтина приводит к развитию более функционально эффективных нейронных цепей, которые при этом требуют больше энергии, они будут особенно восприимчивы к биоэнергетическому дефициту и, следовательно, могут разрушаться под действием даже нормальных процессов, таких как старение. Терапия, направленная на преодоление такого биоэнергетического дефицита, может замедлить нейродегенерацию, защищая уязвимые нейроны.
Исследование Эстевеса-Фраги и его коллег [2] заполняет многие пробелы в понимании динамики между генетической топографией и потерей нейронов коры при болезни Гентингтона. Хотя работа авторов проливает свет на потенциальную основу развития нейродегенерации, связанной с болезнью Гентингтона, это исследование также поднимает множество новых вопросов. Теперь ответственность ложится на исследователей, которые должны интегрировать полученные результаты с другими исследованиями создавая всеобъемлющую картину роли гентингтина в развитии нервной системы.
