Лучевая терапия локализованного рака предстательной железы
Введение
Рак предстательной железы (РПЖ) является одним из наиболее распространенных видов рака среди мужской части населения. В 2020 году среди всех впервые выявленных онкологических заболеваний у мужчин европейских стран РПЖ диагностировался в 23,2 % случаев; чаще всего его обнаруживали у мужчин возраста старше 45 лет [1]. РПЖ может быть как первичной локализации, так и метастатическим очагом другой онкологической патологии. Более подробно о РПЖ - его классификации, методах диагностики и принципах лечения уже ранее написано в обзоре «Онкоандрология» на портале Medach.
▶ Читайте также: Онкоандрология
При РПЖ T1–T4 N0 M0 врачу и пациенту предоставляется выбор из нескольких методов лечения: радикальной простатэктомии, антиандрогенной гормональной терапии, лучевой терапии. В зависимости от способа воздействия на организм последний вариант разделяется на брахитерапию и лучевую терапию внешним пучком; в зависимости от типа используемого излучения - фотоны, протоны или другие заряженные частицы; по совмещению лечения - единственная лучевая терапия или комбинация лучевой терапии с другими методами лечения.
Общей целью всех видов облучения является доставка дозы излучения к опухоли, достаточно высокой для уничтожения опухолевых клеток. При этом не должно происходить повреждения нормальных тканей. Основной мишенью терапевтического облучения в клетке являются цепочки дезоксирибонуклеиновой кислоты (ДНК). При радиационно-индуцированном повреждении ее происходит прямая гибель клеток, нарушается клеточный цикл и изменяется внеклеточное микроокружение.
Развитие методов лучевой терапии предоставляет широкие возможности для подбора конкретных индивидуальных методов согласно специфике РПЖ и достижения положительных эффектов как в краткосрочной, так и в долгосрочной перспективе.
Дистанционная лучевая терапия

Показания к проведению дистанционной лучевой терапии при РПЖ согласно Клиническим рекомендациям лечения РПЖ:
- Локализованный РПЖ (T1–T2 N0 M0);
- РПЖ с распространением в соседние органы и ткани (T3–T4 N0 M0) в сочетании с гормональной терапией.
Дистанционная лучевая терапия различается, главным образом, по виду ионизирующего излучения на квантовую (фотонную) и корпускулярную. В основе корпускулярного излучения лежит радиация частиц (протоны, электроны и проч.) и доставка их в терапевтическую мишень - РПЖ. Энергия частиц, проходя через органы и ткани, экспоненциально уменьшается, что приводит к распределению дозы излучения по различным зонам организма в пределах установленных на приборе границ. Так, например, протоны и тяжелые ионы, которые относительно велики и имеют положительный заряд, высвобождают почти всю свою энергию в конце своего пути сквозь ткани, что называется «пиком Брэгга».
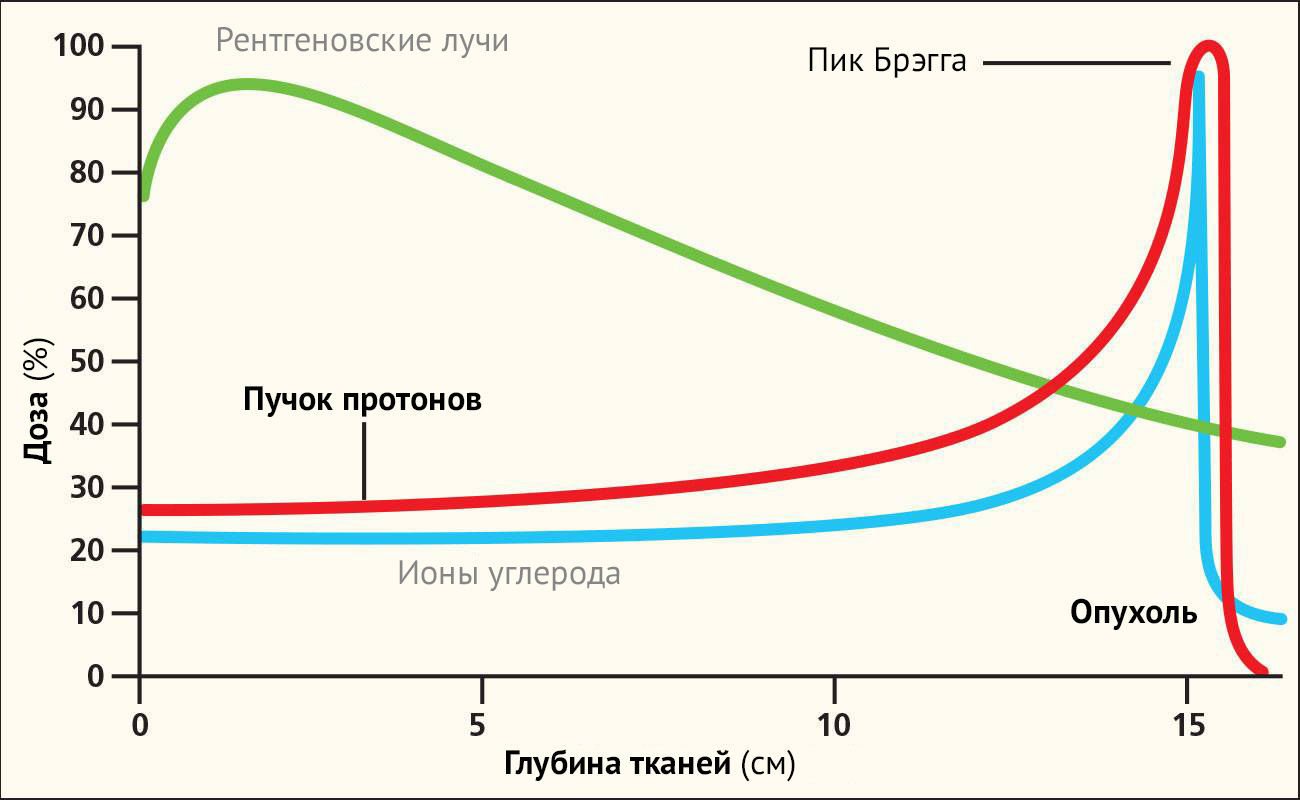
Следовательно, задание правильной траектории протонного пучка способствует увеличению доставки [излучения] в целевую область, при этом ее доза практически не выходит за пределы мишени в конце пути пучка. Это снижает дозу облучения и сохраняет интактность окружающих тканей.
Органами риска при проведении лучевой терапии РПЖ являются прямая кишка, мочевой пузырь, луковица полового члена, кишечник, головка бедренной кости. При их облучении в высокой дозировке возникают осложнения в виде местных радиационных поражений. Поэтому крайне важно ограничить распространение корпускулярной и фотонной энергии по организму пациента.
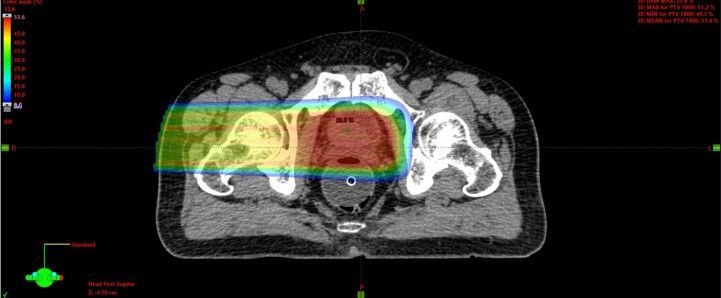
Протонная терапия увеличивает терапевтический коэффициент и минимизирует воздействие излучения на нормальные ткани за счет использования физических свойств самого протонного пучка - в этом её преимущество относительно фотонной терапии. Однако применение протонной терапии остается относительно редким методом терапии ввиду высокой стоимости лечения и небольшого числа центров протонной терапии с необходимым оборудованием.
Конформная дистанционная лучевая терапия – новая стандартизированная веха в лечении РПЖ. Она проводится на специальном оборудовании - линейных ускорителях электронов. Лечебный эффект реализуется посредством тормозного излучения высокоэнергетических электронов, а в наведении излучения используются электронно-вычислительные программы. Это позволяет с учетом гетерогенности тканей и неровности поверхности простаты, пораженной раком, выбрать наиболее рациональные условия лучевого воздействия, принимая во внимание трехмерность проекций визуализаций.
Ряд рандомизированных исследований показал безопасность и эффективность умеренно гипофракционированной (обычно вводимой 20 фракциями) и ультрагипофракционированной (часто вводимой 5-7 фракциями) лучевой терапии предстательной железы по сравнению с традиционными режимами фракционирования с дозировкой 1,8–2,0 Гр в день [4]. Стандартно режим конформной терапии подбирается согласно стратификации риска прогрессирования РПЖ и суммарная дозировка достигает 74-81 Гр с возможностью применения адъювантной гормональной терапии по показаниям.
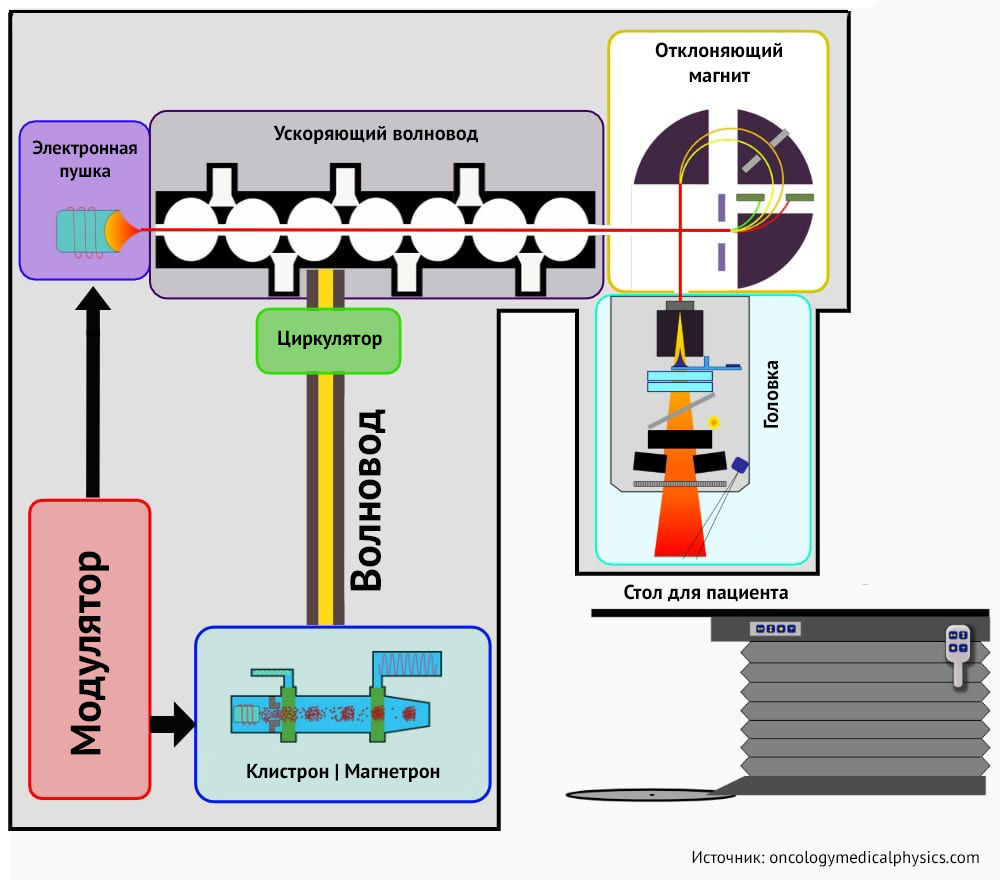
Лучевая терапия с модуляцией интенсивности (IMRT – один из вариантов конформной дистанционной лучевой терапии) оптимизирует введение дозы облучения в границах простаты, с высокой точностью действует на РПЖ и при этом щадит прилегающие нормальные ткани, тем самым увеличивается терапевтический эффект [6]. Используются в практике и 3D-конформная лучевая терапия, терапия с визуальным контролем (IG-IMRT).
КТ и МРТ контроль
Дистанционная лучевая терапия требует визуальный контроль органа-мишени и окружающих структур. Для отображения формы, размеров простаты в медицине используется компьютерная или магнитно-резонансная томография (МРТ). Компьютерная томография (КТ) чаще встречается в практике, а качество изображения различных по плотности структур находится на уровне, достаточном для проведения лучевой терапии. Особенностью простаты и семенных пузырьков, как и других мягких тканей, является возможное их смещение в ходе лечения по причине деградации опухоли, и отслеживание этого процесса посредством КТ затруднено.
Для мониторинга анатомических изменений тканей во время проведения лучевой терапии РПЖ подходит система визуализации конусно-лучевой компьютерной томографии (КЛКТ), которая позволяет отслеживать анатомические изменения в ходе проведения лучевой терапии и повышает надежность межфракционного распределения доз воздействующего излучения. Однако низкое разрешение КТ мягких тканей ограничивает точность внутрифракционной визуализации в режиме реального времени, где лучшим визуализирующим эффектом обладает МРТ.
МРТ обеспечивает превосходную визуализацию мягких тканей по сравнению с компьютерной томографией, в результате уменьшается риск ошибки в неверном выборе зон влияния на простате и других тканях, снижается лучевая нагрузка на ткани окружения. По оценке пациентов, проходивших лечение под контролем МРТ, степень выраженности клинических симптомов по шкале IPSS была меньше, а качество жизни - лучше, в сравнении с КТ контролем. По данным исследования А. Кушана с соавт, опубликованном в 2023 г., у 6,8 % пациентов (5 из 72) было выявлено увеличение баллов по шкале IPSS спустя 1 месяц после окончания терапии под контролем МРТ. В то же время число пациентов с увеличением баллов по IPSS в группе КТ-контролируемой терапии было больше и составило 19,4% (14 испытуемых, P = 0,01) [7].
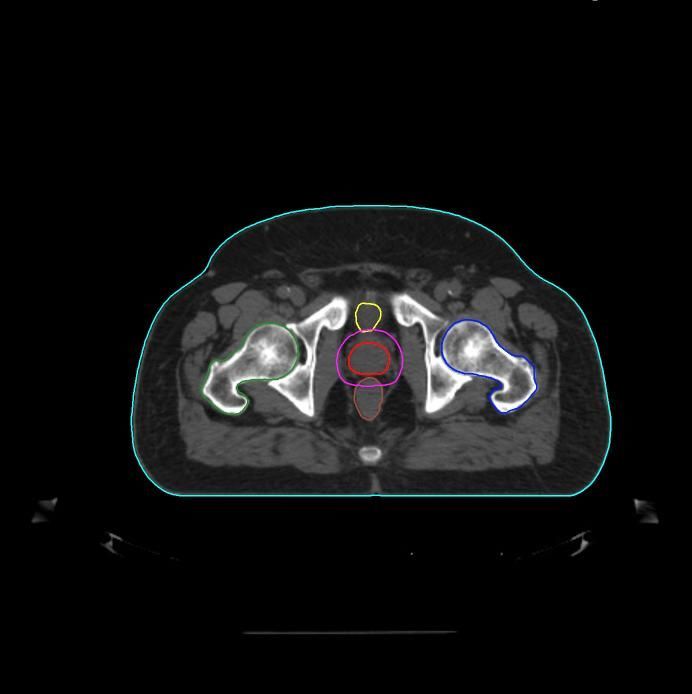
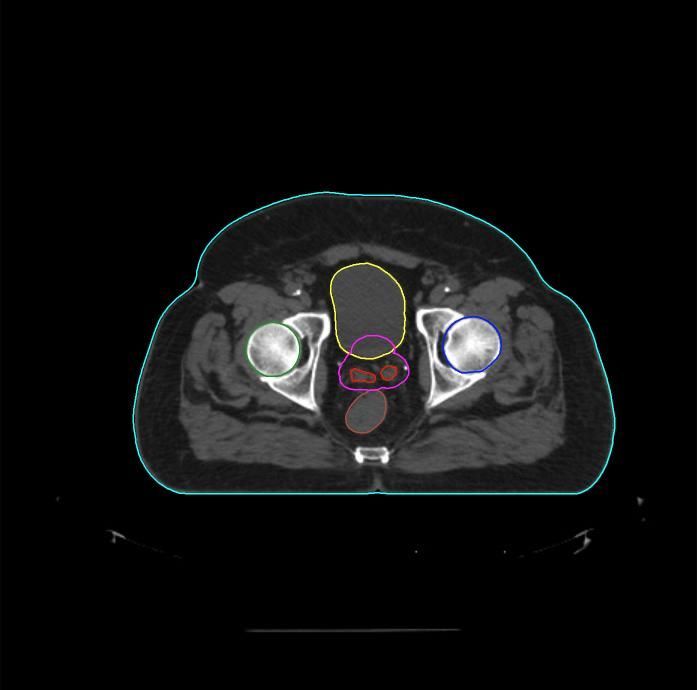
Согласно Клиническим рекомендациям лечения РПЖ, к использованию дистанционной лучевой терапии имеется ряд противопоказаний:
- Сопутствующие инфекционно-воспалительные заболевания мочеполовой системы, кишечника, свищи;
- Предшествующее облучение области малого таза;
- Постоянный уретральный катетер;
- Инфравезикальная обструкция;
- «Микроцистис» - уменьшение в размерах мочевого пузыря;
- Декомпенсированные соматические заболевания;
- Психические расстройства;
- Кахексия.
Эти ограничения можно частично обойти, если использовать для терапии внутритканевое введение радиоактивных источников. Т.е. если использовать брахитерапию.
Брахитерапия
Существует два вида брахитерапии (БТ) для лечения рака предстательной железы: высокодозная (ВДБТ), которая включает кратковременное введение источника высокой мощности непосредственно в простату, и низкодозная (НДБТ), где источник низкой мощности устанавливается на постоянной основе. Оба вида БТ основаны на использовании гамма-излучения непосредственно внутри простаты.
БТ позволяет использовать оптимальные градиенты облучения от опухоли к нормальной ткани, т.е. окружающие ткани получают меньшую лучевую нагрузку, чем при использовании дистанционной лучевой терапии. Международная комиссия по радиационным частицам и измерениям (International Comission оn Radiation Units & Measurements, ICRU) разделила БТ соответственно величине мощности лучевой нагрузки: от 40 до 200 сГр/ч – НДБТ, > 1200 сГр/ч – ВДБТ.

Шкала Глиссона – оценочная шкала гистологической дифференцировки РПЖ. Эта балльная система была внедрена патологоанатомом Дональдом Глисоном на основании данных гистологического исследования материала предстательной железы 2911 пациентов [9]. Наименее агрессивная опухоль предстательной железы оценивается в 2 балла, а наиболее агрессивная низкодифференцированная опухоль - в 10 баллов.
Абсолютными противопоказаниями для БТ согласно Клиническим рекомендациям лечения РПЖ являются:
- Метастазы опухоли;
- Невозможность проведения анестезии;
- Наличие прямокишечной фистулы;
- Ожидаемая продолжительность жизни пациента менее 5 лет.
В БТ могут использоваться различные радиоизотопы с особенными свойствами периода полураспада и выделения энергии. Наиболее часто применяются иридий-192 (Ir-192), кобальт-60, йод-125 (I-125) и палладий-103 (Pd-103) [10]. Например, для ВДБТ используется источник Ir-192, имеющий период полураспада 72-74 суток и выделяющий при своем распаде 400 кэВ, а для НДБТ используются источники I-125 (период полураспада 60 дней) или Pd-103 (период полураспада 17 дней), каждый из которых выделяет меньшую энергию при распаде, по сравнению с источниками для ВДБТ [11].
С точки зрения современной радиобиологии, при проведении лучевой терапии РПЖ предпочтительно применение режимов гипофракционирования и, следовательно, высокодозной брахитерапии. Использование ВДБТ для лечения РПЖ является эффективной методикой наравне с дистанционной лучевой терапией, а также с НДБТ. Принципиальные достоинства ВДБТ заключаются в точном следовании лечебному плану с учетом топографии между различными зонами интереса, расположенными в предстательной железе и за ее пределами. Помимо этого, за короткое время выполнения процедуры не изменяются анатомия самой ПЖ и ее взаиморасположение с прямой кишкой, мочевым пузырем и уретрой, тогда как при НДБТ структуры могут менять свое положение с течением времени терапии.
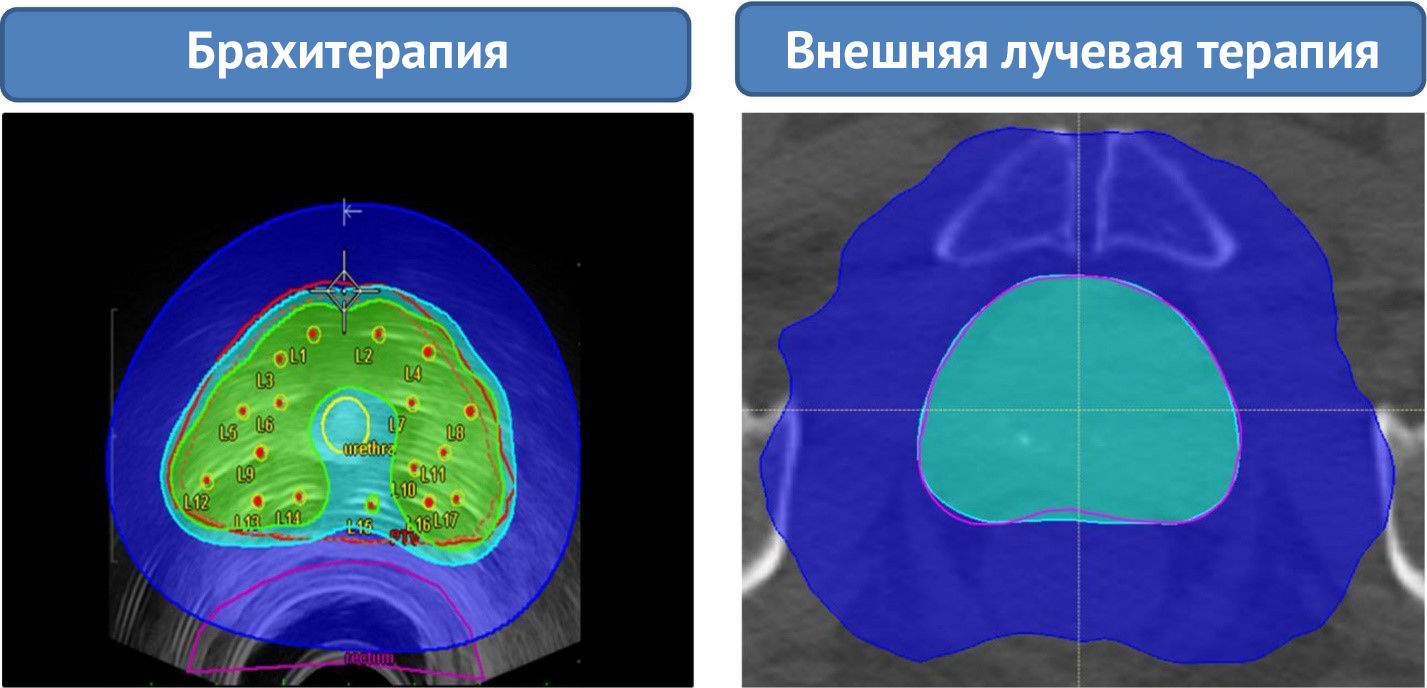
Зеленые, светло-голубые, темно-синие и зеленые контуры демонстрируют зоны, которые получили нагрузку в 18 Гр, 14,25 Гр и 6 Гр соответственно. При внешней лучевой терапии ни одна часть предстательной железы не могла быть подвергнута нагрузке в 18 Гр. Одновременно наблюдалось значительное увеличение объема нормальной ткани, получавшей 6 Гр, по сравнению с ВДБТ (442 см3 против 133 см3), что в дальнейшем может привести к большему по объему фиброзу.
Клинический целевой объем лучевой БТ (CTV) определяется капсулой предстательной железы, но может дополнительно включать в себя семенные пузырьки и экстракапсулярное пространство. Для монотерапии НДБТ I-125 рекомендованная доза для CTV составляет 145 Гр, согласно европейским рекомендациям брахитерапии простаты от 2022 г. [12]. В отечественных клинических рекомендациях лечения РПЖ при имплантации I-125 суммарная доза вариабельна и составляет 140–160 Гр (для I-125) и 110-125 Гр (при имплантации в простату Pd-103). Введение изотопа (фракционирование) происходит единожды при НДБТ. Для ВДБТ рекомендовано получение пациентом 2-х фракций по 10–15 Гр каждая или 3-х фракций по 10–11,5 Гр каждая.
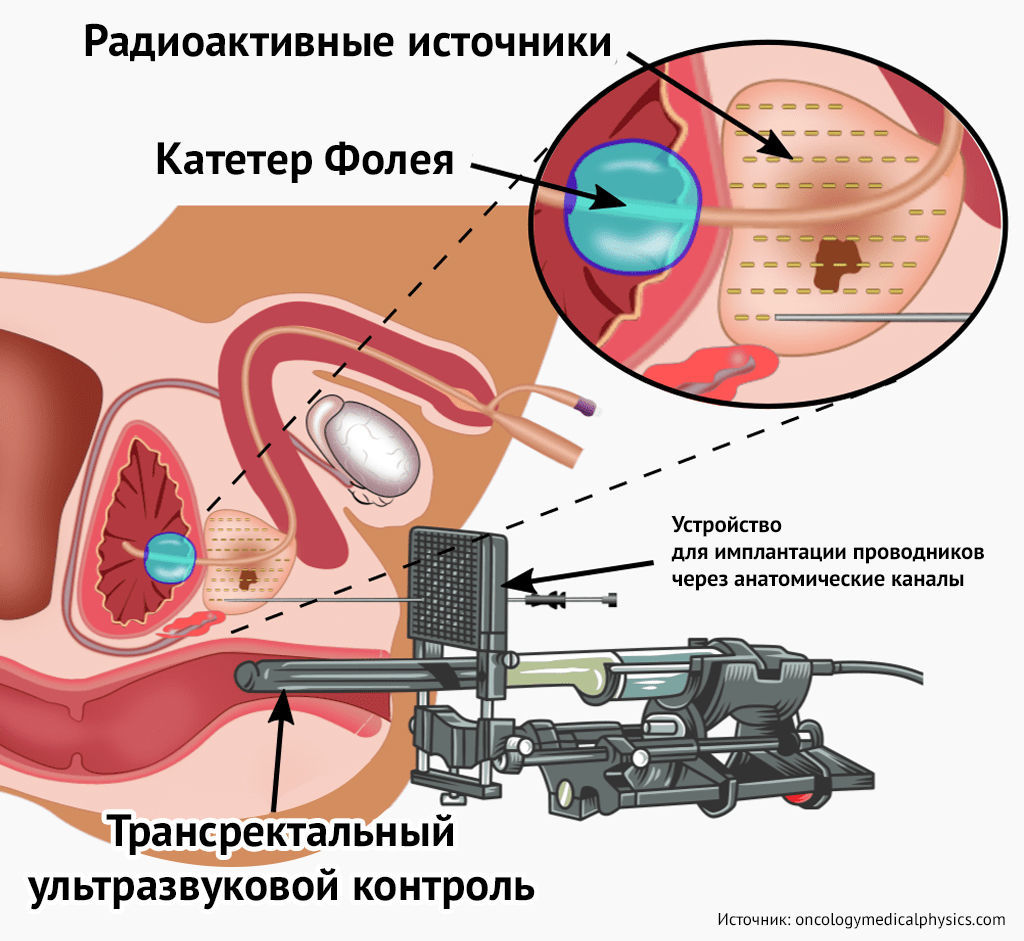
Введение микроисточников изотопов в простату проводится под анестезией (чаще всего применяется эпидуральный наркоз) чрезкожно под УЗИ-контролем. Изотопы имплантируются в ткань предстательной железы через специальные иглы-троакары и могут оставаться в организме навсегда (при НДБТ) или извлекаться через время, необходимое для получения нужной дозы излучения (при ВДБТ). Обе процедуры являются как самостоятельными методами лучевой терапии, так и дополнениями к дистанционной лучевой терапии или гормонотерапии в зависимости от выбранной стратегии лечения.
Результаты лучевой терапии локализованного РПЖ
После имплантации брахитерапии осложнения могут состоять в увеличении баллов по шкале IPSS и в задержке мочи. Долгосрочными осложнениями могут быть недержание мочи, эректильная дисфункция, лучевой проктит. Эти побочные эффекты необходимо сопоставлять с побочными эффектами других вариантов лечения: недержанием мочи и эректильной дисфункцией (при хирургическом вмешательстве) и лучевыми поражениями кишечника (при дистанционной лучевой терапии). Так, в исследовании от 2017 года показателей качества жизни среди 1141 мужчин с локализованным РПЖ, было показано, что, в сравнении с активным наблюдением, ухудшение симптома недержания мочи было связано с радикальной простатэктомией. Усиление обструкции мочевыводящих путей и их повреждение было связано с двумя методами - дистанционной лучевой терапией и БТ. Ухудшение симптомов со стороны кишечника - с дистанционной лучевой терапией [14]. Преимущественно, частота возникновения осложнений не различалась между активным наблюдением и активным лечением в течение 24-х месяцев.
В исследовании от 2017 года Джея П. Чески с соавт. были использованы данные лечения 2557 пациентов, проходивших НДБТ, внешнюю лучевую терапию и хирургические вмешательства. Команда авторов пришла к выводу, что и НДБТ, и лучевая терапия позволили добиться лучшего биохимического контроля РПЖ, чем хирургическое вмешательство, но в тоже время другие результаты, такие как специфическая для РПЖ 5-ти и 10-ти летняя выживаемость остались одинаковыми (P = 0,0004) [15].
Таким образом в современном арсенале врачей-онкологов и радиотерапевтов находится множество способов воздействия на локализованный рак предстательной железы. Каждый из методов, в том числе и лучевая терапия, имеет свои ограничения и возможности применения, и выбор тактики лечения зависит от конкретной клинической ситуации пациента с раком предстательной железы.
Список литературы
- Prostate cancer burden in EU-27. European Cancer Information System 2021 [URL] https://ecis.jrc.ec.europa.eu/... (дата обращения 10.05.2024)
- Клинические рекомендации МЗ РФ «Рак предстательной железы», 2021 г. [URL] cr.minzdrav.gov.ru/schema/12_3 (дата обращения 16.05.2024)
- Wu Y. Y., Fan K. H. (2022). Proton therapy for prostate cancer: current state and future perspectives. The British journal of radiology, 95 (1131), 20210670. doi.org/10.1259/bjr.20210670
- Corkum M. T., Achard V., Morton G., Zilli T. (2022). Ultrahypofractionated Radiotherapy for Localised Prostate Cancer: How Far Can We Go? Clinical oncology (Royal College of Radiologists (Great Britain)), 34(5), 340–349. doi.org/10.1016/j.clon.2021.12.006
- Introduction to Clinical Linear Accelerators. OncologyMedicalPhysics Images [URL] oncologymedicalphysics.com/introduction-to-clinical-linear-accelerators/ (дата обращения 16.05.2024)
- Alexander S. E., McNair H. A., Oelfke U., Huddart R., Murray J., Pathmanathan A., Patel P., Sritharan K., van As N., Tree A. C. (2022). Prostate Volume Changes during Extreme and Moderately Hypofractionated Magnetic Resonance Image-guided Radiotherapy. Clinical oncology (Royal College of Radiologists (Great Britain)), 34 (9), e383–e391. doi.org/10.1016/j.clon.2022.03.022
- Kishan A. U., Ma T. M., Lamb J. M., Casado M., Wilhalme H., Low D. A., Sheng K., Sharma S., Nickols N. G., Pham J., Yang Y., Gao Y., Neylon J., Basehart V., Cao M., Steinberg, M. L. (2023). Magnetic Resonance Imaging-Guided vs Computed Tomography-Guided Stereotactic Body Radiotherapy for Prostate Cancer: The MIRAGE Randomized Clinical Trial. JAMA oncology, 9 (3), 365–373. doi.org/10.1001/jamaoncol.2022.6558
- eContour.org Cases Images [URL] econtour.org/cases (дата обращения 20.05.2024)
- Gleason D. Histologic grading of prostate cancer: a perspective. Hum // Pathol. — 1992.— Vol. 23, № 3.— Р. 273–279
- Chargari C., Deutsch E., Blanchard P., Gouy S., Martelli H., Guérin F., Dumas I., Bossi A., Morice P., Viswanathan A. N., Haie-Meder C. (2019). Brachytherapy: An overview for clinicians. CA: a cancer journal for clinicians, 69(5), 386–401. doi.org/10.3322/caac.21578
- Канаев С. В., Новиков С. Н., Новиков Р. В., Носов А. К., Петров С. Б., Рева С. А. Брахитерапия рака предстательной железы: сравнительная характеристика методик. Онкоурология. 2015;11(2):69-76. doi.org/10.17650/1726-9776-2015-11-2-69-76
- Henry A., Pieters B. R., André Siebert F., Hoskin P., UROGEC group of GEC ESTRO with endorsement by the European Association of Urology (2022). GEC-ESTRO ACROP prostate brachytherapy guidelines. Radiotherapy and oncology : journal of the European Society for Therapeutic Radiology and Oncology, 167, 244–251. doi.org/10.1016/j.radonc.2021.12.047
- Prostate Brachytherapy. OncologyMedicalPhysics Images [URL] oncologymedicalphysics.com/prostate-brachytherapy (дата обращения 22.05.2024)
- Chen R. C., Basak R., Meyer A. M., Kuo T. M., Carpenter W. R., Agans R. P., Broughman J. R., Reeve B. B., Nielsen M. E., Usinger D. S., Spearman K. C., Walden S., Kaleel D., Anderson M., Stürmer T., Godley P. A. (2017). Association Between Choice of Radical Prostatectomy, External Beam Radiotherapy, Brachytherapy, or Active Surveillance and Patient-Reported Quality of Life Among Men With Localized Prostate Cancer. JAMA, 317(11), 1141–1150. doi.org/10.1001/jama.2017.1652
- Jay P. Ciezki, Michael Weller, Chandana A. Reddy, Jeffrey Kittel, Harguneet Singh, Rahul Tendulkar, Kevin L. Stephans, James Ulchaker, Kenneth Angermeier, Andrew Stephenson, Steven Campbell, Georges-Pascal Haber, Eric A. Klein. A Comparison Between Low-Dose-Rate Brachytherapy With or Without Androgen Deprivation, External Beam Radiation Therapy With or Without Androgen Deprivation, and Radical Prostatectomy With or Without Adjuvant or Salvage Radiation Therapy for High-Risk Prostate Cancer, International Journal of Radiation Oncology, Biology, Physics, Volume 97, Issue 5, 2017, Pages 962-975 ISSN 0360-3016, doi.org/10.1016/j.ijrobp.2016.12.014
