Новая мишень для лечения печеночной энцефалопатии
Согласно новым данным Ruminococcus gnavus, живущий в кишечнике, может вызывать печеночную энцефалопатию, стимулируя синтез нейротоксичных моноаминов и у части пациентов с циррозом. Это открытие позволяет по-новому взглянуть на терапию данного состояния, а также использовать особенности взаимодействия макроорганизма с этим микробом в качестве прогностического биомаркера.
Печеночная энцефалопатия (ПЭ) является серьезным осложнением цирроза, однако в течение десятков лет выяснение точных механизмов патогенеза ПЭ представляло трудную задачу для исследователей. Это тормозило инновационный процесс в прогнозировании, мониторинге и терапии этого инвалидизирующего состояния. Несколько современных клинических исследованиях ПЭ были сфокусированы на терапии гипераммониемии, однако у многих пациентов с ПЭ содержание аммиака является нормальным или лишь незначительно повышенным, а эффект от применения препаратов, снижающих уровень аммиака, часто не соотносится с клиническими первичными конечными точками [1,2]. В своей статье для Nature Medicine Хэ с соавт. [3] описывают методику, которая определяет новый потенциальный механизм ПЭ (рис. 1), что открывает потенциал для дальнейших исследований в области разработки биомаркеров и лекарственных средств.
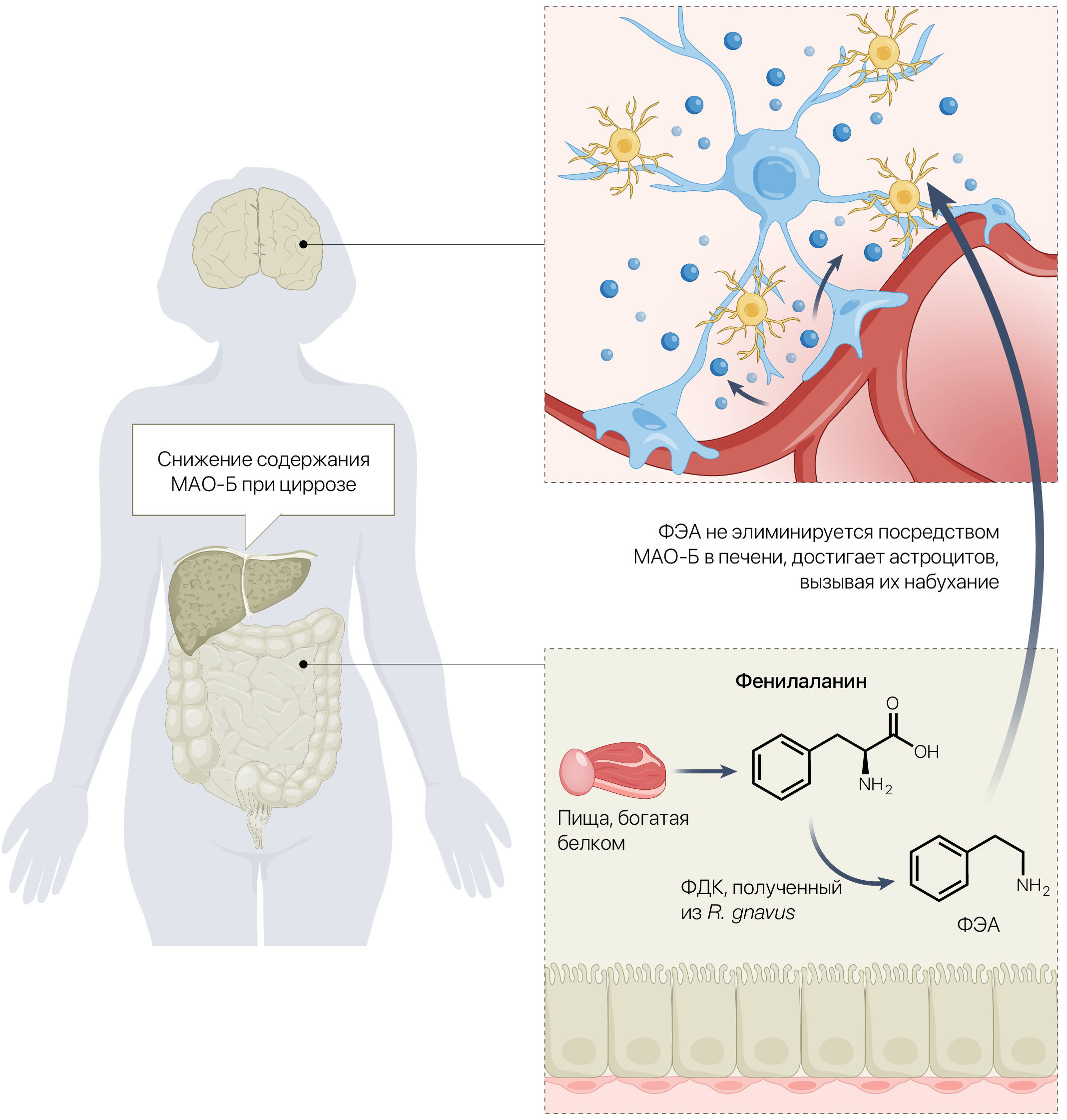
Авторы воспользовались метагеномными данными стула, полученными от нескольких когорт пациентов с циррозом печени, для систематического анализа нейротоксического потенциала нескольких метаболических путей. В конечном итоге было обнаружено выраженное усиление синтеза моноаминов. Дальнейший скрининг показал, что фермент фенилаланиндекарбоксилаза (ФДК), полученный из кишечной бактерии R. gnavus, является ключевым в процессе синтеза моноаминов, а содержание этого фермента повышено у пациентов с циррозом. В серии хорошо контролируемых экспериментов на мышах высокая активность ФДК была выявлена только у грызунов с циррозом, кишечник которых был колонизирован R. gnavus. У этих же мышей наблюдались повышенное накопление в мозге ключевого метаболита ФДК фенилэтиламина (ФЭА), стимулированное ФЭА разбухание астроцитов и нейровоспаление. Также, мыши демонстрировали поведение, характерное для ПЭ. 80 % ФЭА метаболизируется в печени, и, следовательно, нарушение функции печени приводит к повышению системной концентрации этого метаболита и его накоплению в мозге. Авторы подтвердили результаты в клинических условиях: у людей с ПЭ наблюдалось более высокое содержание R. gnavus в фекалиях, увеличение экспрессии гена PDC (кодирует ФДК) и увеличение содержания ФЭА в сыворотке, что подтверждает гипотезу о том, что синтез моноаминов, вызванный R. gnavus, играет роль в развитии ПЭ.
Эта гипотеза не совсем нова. Еще десятки лет назад ученые интересовались нарушением регуляции моноаминов, рассматривая его как потенциальный механизм патогенеза ПЭ. Результаты вскрытий свидетельствовали, что у людей с циррозом печени были повышены уровни МАО-Б (фермента, ответственного за элиминацию моноаминов, в том числе и ФЭА) в мозге [4]. Возможно, повышение уровня МАО-Б в мозге явилось компенсаторным механизмом при высокой концентрации ФЭА. Насколько известно, применение ингибиторов МАО, антидепрессантов первого поколения, никогда не подвергалось систематическому анализу у пациентов с циррозом. Теоретически эти препараты должны ингибировать МАО-Б, что приведет к еще более высокому содержанию ФЭА, и, следовательно, можно было бы ожидать, что они ухудшат течение ПЭ.
В клинической практике наблюдается следующее: после установки трансюгуляторного внутрипеченочного портосистемного шунта (TIPS) при рефрактерном асците или варикозном кровотечении у 30–50 % пациентов с циррозом разовьется ПЭ. Однако предсказать, у кого именно, сложно. Некоторые клинические факторы, такие как пожилой возраст, саркопения, гипонатриемия и тяжесть заболевания печени, являются предрасполагающими к развитию пост-TIPS ПЭ, однако точность прогноза несовершенна [5]. В качестве биомаркеров пост-TIPS ПЭ рассматривались содержание аммиака в сыворотке, клинические шкалы и нейропсихиатрические тесты, однако успех их применения оказался умеренным [5,6]. Применение более точного прогностического биомаркера способно повысить эффективность профилактического лечения ПЭ после TIPS, что в настоящее время не введено в клинические рекомендации [5]. Исследование Хэ с соавт.[3] предполагает, что ФЭА может быть новым многообещающим прогностическим биомаркером; авторы провели корректировку с учетом сопутствующих переменных и обнаружили, что высокие исходные уровни ФЭА были связаны с 7-кратным повышением риска пост-TIPS ПЭ [3]. Однако недавнее исследование побочных метаболических изменений после установки TIPS не привело к обнаружению существенных изменений уровней ФЭА, а также связи между ФЭА (или другими моноаминами) и развитием пост-TIPS ПЭ [7]. Учитывая эти неоднозначные результаты, использование ФЭА в качестве биомаркера потребует обширной оценки и валидации — в том числе, стандартизации на нескольких участках для обеспечения минимальной вариабельности от теста к тесту и валидации предсказательной способности во внешних когортах — прежде чем его можно будет считать действительным прогностическим биомаркером пост-TIPS ПЭ. Если его валидировать как простой биомаркер анализа крови, ФЭА будет обладать рядом практических преимуществ, по сравнению с другими биомаркерами.
Помимо того, что они являются потенциальными прогностическими биомаркерами для ПЭ, R. gnavus, ФДК и ФЭА являются потенциальными терапевтическими мишенями. Хэ с соавт.[3] обнаружили, что ингибирование ФДК или ФЭА у мышей обращает вспять каскад нейротоксических событий и смягчает клинические эффекты [3]. Ученые также отмечают, что ФЭА и дофамин структурно схожи и, как таковые, могут конкурентно связываться с рецепторами друг друга. Поэтому, возможно, что прямой ингибитор ФЭА также будет ингибировать дофамин, что приведет к депрессии или паркинсонизму у пациентов. Хэ с соавт.[3] не сообщили о влиянии ингибирования R. gnavus, ФДК или ФЭА на дофаминовую систему и активацию его рецепторов. Будущая работа по пониманию связи между влиянием на ФДК и/или ФЭА и активацией дофаминового пути невозможна без дальнейших исследований.
Важно отметить, что существующие препараты могут быть нацелены на этот новый механизм ПЭ. Структурное сходство между ФЭА и дофамином также означает, что вполне вероятно, что препараты для лечения болезни Паркинсона, которые усиливают выработку и высвобождение дофамина в мозге, могут оказаться конкурентами с ПЭА и подавлять его эффекты. Ранее было показано, что флумазенил, антагонист бензодиазепиновых рецепторов, используемый в клинической практике для устранения передозировки бензодиазепинов, повышает уровень моноаминов в мозге, в том числе и метаболита дофамина, а также устраняет нарушение двигательной активности в крысиной модели ПЭ [8]. Однако клинические доказательства по флумазенилу только низкой степени достоверности, подтверждающие краткосрочную пользу при лечении ПЭ [9]. Возможно, что для категорий людей с ПЭ, отобранных по проверенным биомаркерам, может быть достигнута польза от вышеуказанных методов лечения.
Важно отметить, что путь синтеза моноаминов, связанный с ПЭ, может быть более значимым фактором у некоторых пациентов, чем у других. В широкой популяции пациентов с ПЭ наблюдается неоднородность в клинической картине ПЭ, в составе микробиома и функциональных профилях, а также в восприимчивости к лечению. Например, R. gnavus более распространен у пациентов с ПЭ, которые клинически не реагируют на рифаксимин (антибиотик, используемый в лечении ПЭ) [10]. Пациенты, у которых путь синтеза моноаминов посредством R. gnavus является основной причиной ПЭ, могут не так хорошо реагировать на терапию, нацеленную на другие пути патогенеза ПЭ, и поэтому могут нуждаться в индивидуализированной таргетной терапии. Будущие исследования должны также изучить факторы, способствующие пролиферации R. gnavus у лиц с циррозом, на основании чего возможно формирование стандартов профилактической терапии (например, диеты или других методов, влияющих на микробиом).
Таким образом, ПЭ, по меньшей мере у некоторых категорий пациентов, может быть результатом синтеза моноаминов бактериями R. gnavus. Изложенные выше данные являются на сегодняшний день наиболее убедительным доказательством этого патологического пути, и необходимо проведение дальнейших исследований, чтобы понять, возможно ли по итогам изучения этого пути выявить полезные прогностические клинические биомаркеры или направления терапии.
