ГПП-2 ослабляет метаболические эффекты антипсихотиков
Антипсихотики используются при тяжелых психических заболеваниях, но приводят к существенному набору массы тела и нарушению метаболизма глюкозы. В текущем выпуске Nature Metabolism представлены результаты, демонстрирующие, что глюкагоноподобный пептид-2 (ГПП-2) минимизирует метаболические нарушения, вызванные приемом антипсихотика оланзапина.
Антипсихотики применяются в лечении шизофрении и других психических расстройств, однако это ассоциируется с побочными эффектами метаболического характера, такими как увеличение веса и нарушение обмена глюкозы [1]. В популяции, где велико бремя преждевременной смертности от сердечно-сосудистых заболеваний, эти побочные эффекты помимо прочего связаны с плохой приверженностью пациентов к лечению и негативным влиянием на качество жизни и когнитивные функции. Поэтому существует насущная потребность в препаратах, побочные эффекты которых будут менее выражены. Согласно имеющимся на данный момент сведениям, агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1) способны тормозить набор веса и улучшать метаболизм глюкозы у пациентов, принимающих антипсихотики [2], а будущие методы лечения метаболических побочных эффектов, вызванных антипсихотиками, по всей видимости, будут нацелены на рецепторы гормонов-инкретинов [3]. В своей работе Пэн и Фэн с соавт. [4] применили аналог инкретинового гормона глюкагоноподобного пептида-2 (ГПП-2) тедуглутид, чтобы продемонстрировать, что он также предотвращает нарушение метаболической регуляции, вызванное антипсихотиком оланзапином.
Тедуглутид — это лекарство, которое помогает людям с синдромом короткой кишки лучше усваивать питательные вещества и уменьшает необходимость в внутривенном питании. Он представляет собой искусственную версию гормона GLP-2, который стимулирует рост слизистой оболочки кишечника. Препарат вводится под кожу один раз в день. Среди возможных побочных эффектов — тошнота, боли в животе и отеки, а также есть небольшой риск разрастания тканей кишечника, поэтому за пациентами нужно наблюдать. В США он продаётся под названием Gattex, а в Европе — Revestive.
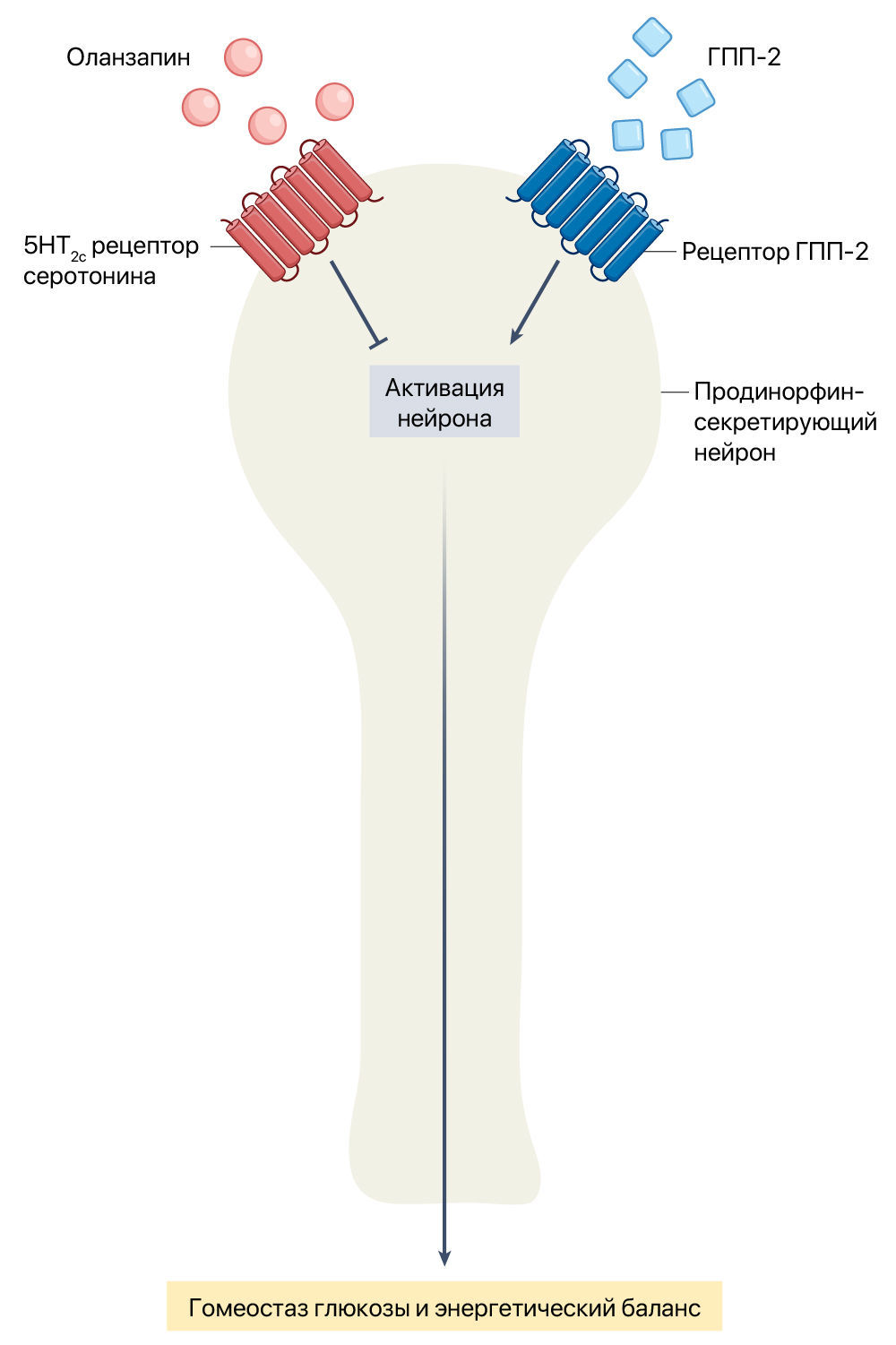
Оланзапин воздействует на различные рецепторы, в том числе, и на рецептор серотонина 2C (5HT2c) [5]. Он действует как антагонист 5HT2c, вызывая набор веса и нарушение толерантности к глюкозе [6]. Кроме того, известно, что активация 5HT2c в проопиомеланокортиновых нейронах приводит к снижению массы тела [7]. В текущем исследовании на мышах Пэн и Фэн с соавт. [4] сфокусировались на продинорфиновых нейронах (далее в тексте как Pdyn) в вентромедиальном гипоталамусе, которые также экспрессируют 5HT2c. Используя метод локальной фиксации потенциала (patch-clamp), авторам удалось продемонстрировать, что агонист 5HT2c усиливает нейрональную активацию Pdyn, а оланзапин сам по себе снижает нейрональную активацию Pdyn. Это позволяет предположить, что оланзапин действует как обратный агонист 5HT2c (рис. 1). Разрушение нейронов Pdyn вызывало гиперфагию, увеличение веса и нарушение метаболизма глюкозы в отдаленной перспективе, что было похоже на нарушения, наблюдаемые при длительном введении оланзапина мышам. Эти побочные эффекты удалось смягчить с помощью генетического нокдауна 5HT2c в вентромедиальном гипоталамусе или активацией нейронов Pdyn. Авторы также показывают, что кратковременное введение оланзапина через ингибирование Pdyn приводит к гипотермии. Это позволяет предположить, что метаболическая дисфункция, вызванная хроническим введением оланзапина, может быть частично обусловлена гиперфагией, вызванной гипотермией [8].
Пэн и Фэн с соавт. [4] также исследовали механизмы, посредством которых тедуглутид смягчает неблагоприятные метаболические эффекты, вызванные оланзапином. Интерес к тедуглутиду был инициирован тем, что он предотвратил гипотермию, вызванную приемом оланзапина. Рецептор ГПП-2 — рецептор, связанный с G-белком, который обнаруживается в различных областях мозга [9–11], и его отключение в проопиомеланокортиновых нейронах приводит к увеличению веса и нарушению метаболизма глюкозы [11,12]. Авторы обнаружили, что рецептор ГПП-2 экспрессируется в нейронах Pdyn [4]. Важно отметить, что также было обнаружено, что гипотермия, увеличение веса и нарушение метаболизма глюкозы, вызванные оланзапином, предотвращаются введением ГПП-2. Это предполагает существование основного механизма, посредством которого он тормозит ингибирование нейронов Pdyn, вызванное оланзапином.
Кроме того, авторы обнаружили интересные половые различия. Неблагоприятные метаболические эффекты оланзапина в большей степени выражены у самок мышей, чем у самцов, что согласуется с результатами клинических испытаний [13]. Более того, авторы использовали мышей, которым вводили блокатор NMDA-рецепторов MK-801 (модельный препарат, который воспроизводит симптомы шизофрении), чтобы показать, что активация нейронов Pdyn не мешает положительному влиянию оланзапина на преимпульсное торможение. Эти результаты свидетельствуют о том, что ГПП-2 не подавляет антипсихотические эффекты оланзапина, что являет собой важное наблюдение, если тедуглутид будет изучаться в клинических условиях.
Работа Пэна и Фэна с соавт.[4] также поднимает вопросы для будущих исследований. Какое перекрестное взаимодействие между рецепторами 5HT2c и ГПП-2 в нейронах Pdyn? Тедуглутид используется у людей для лечения синдрома короткого кишечника [9]. Следовательно, могут ли аналоги ГПП-2 использоваться в клинических условиях для предотвращения набора веса, вызванного оланзапином? Известно, что антипсихотики способны нарушать метаболизм глюкозы в результате увеличения веса, но также независимо от изменений массы тела [1]. Следовательно, в контексте лечения оланзапином, способен ли ГПП-2 улучшать метаболизм глюкозы вне зависимости от изменений массы тела? Поскольку антипсихотики также нарушают липидный обмен [14], улучшает ли ГПП-2 липидный профиль пациентов, принимающих антипсихотики? Авторы обнаружили, что другие антипсихотики, а именно клозапин и рисперидон, которые нацелены на нейроны, экспрессирующие 5HT2c, также ингибируют продинорфиновые нейроны. Следовательно, распространяются ли благоприятные эффекты ГПП-2 на другие антипсихотики, в том числе и препараты, которые не антагонистичны по отношению к 5HT2c? Ответы на эти и другие вопросы приблизят нас к поиску эффективных методов лечения метаболических нарушений, вызванных антипсихотиками. В условиях почти полного отсутствия целевых стратегий лечения ятрогенной метаболической дисфункции, новые препараты-инкретины обладают потенциалом для повышения качества жизни, приверженности антипсихотическим препаратам и продолжительности жизни людей с тяжелыми психическими заболеваниями.
