Молекулярный переключатель зависимости
Специальный молекулярный переключатель оказывает влияние на аддиктивное (зависимое) поведение и определяет, какой силы окажется реакция организма на наркотики, вызывающие привыкание. Группа исследователей из Гейдельбергского и Сорбонского университетов (Париж) пришли к такому выводу в ходе экспериментов на мышах (в качестве наркотического средства использовался кокаин). Исследователи под руководством профессора Хилмара Бадинга (Гейдельберг) и профессора Питера Ванхаута (Париж) продемонстрировали, что белок Npas4 регулирует структуру и функцию нервных клеток, которые ответственны за зависимое поведение у мышей. Когда в ходе эксперимента количество Npas4 оказывалось сниженным, реакция животных на кокаин была значительно слабее.
По словам ведущего автора исследования Томаса Лиссека, в животной модели Npas4 выступает как молекулярный регулятор чувствительности к наркотическим средствам, вызывающим зависимое поведение и злоупотребление. Авторы выражают надежду, что результаты этой работы приведут к лучшему пониманию природы зависимости у людей и смогут получить клиническое приложение. Будучи врачом и ученым, он проводит исследование для докторской диссертации о молекулярных сигнальных механизмах, связывающих нейрональную активность с транскрипцией генов в Междисциплинарном центре нейронаук (IZN) при Гейдельбергском университете. Исследователь также полагает, что полученные результаты подтверждают существование биологической основы зависимого поведения, сходной с развитием сахарного диабета или сердечно-сосудистых заболеваний.
Рисунок 1 | Культура клеток нейронов из полосатого тела мыши
Белок Npas4 является так называемым транскрипционным фактором. Томас Лиссек поясняет, что можно рассматривать Npas4 как дирижера, который координирует, сколько и каких молекул будет производится в клетке. Молекулы, на которые Npas4 действует в первую очередь, регулируют паттерны электрической активности и структуру нервных клеток, а также влияют на количество синапсов между ними. Когда экспериментальным путем количество Npas4 снижалось, уменьшалось и количество межклеточных контактов между нейронами. Впоследствии у мышей наблюдалась более слабая реакция на кокаин, чем при большем количестве белков Npas4.
Также результаты этой работы ученых из Гейдельберга и Парижа демонстрируют, что Npas4 контролируется посредством особых механизмов регуляции. Индукция экспрессии этого белка происходит только с помощью сигналов, вызывающих повышение концентрации кальция в ядрах нейронов. Например, активация дофаминовых рецепторов (что являет собой наиболее обсуждаемый механизм развития зависимости) не способствует увеличению количества Npas4. Команды исследователей Хилмара Бадинга и Питера Ванхаута также смогли подтвердить эту особенность на примере нейронов, полученных из стволовых клеток человека.
Необычный механизм регуляции экспрессии Npas4 представляет интерес как для фундаментальных биологических исследований, так и для разработки клинических методов лечения зависимости. Профессор Бадинг (директор отдела нейробиологии IZN) добавляет, что воздействие на Npas4 и связанный с ним сигнальный путь контроля зависимого поведения являются многообещающими методами терапии.
Исследование проводилось в рамках немецко-французского проекта сотрудничества и финансировалось, в частности, Немецким исследовательским фондом (DFG) и Национальным агентством исследований (ANR, Франция). Результаты опубликованы в журнале EMBO Reports.
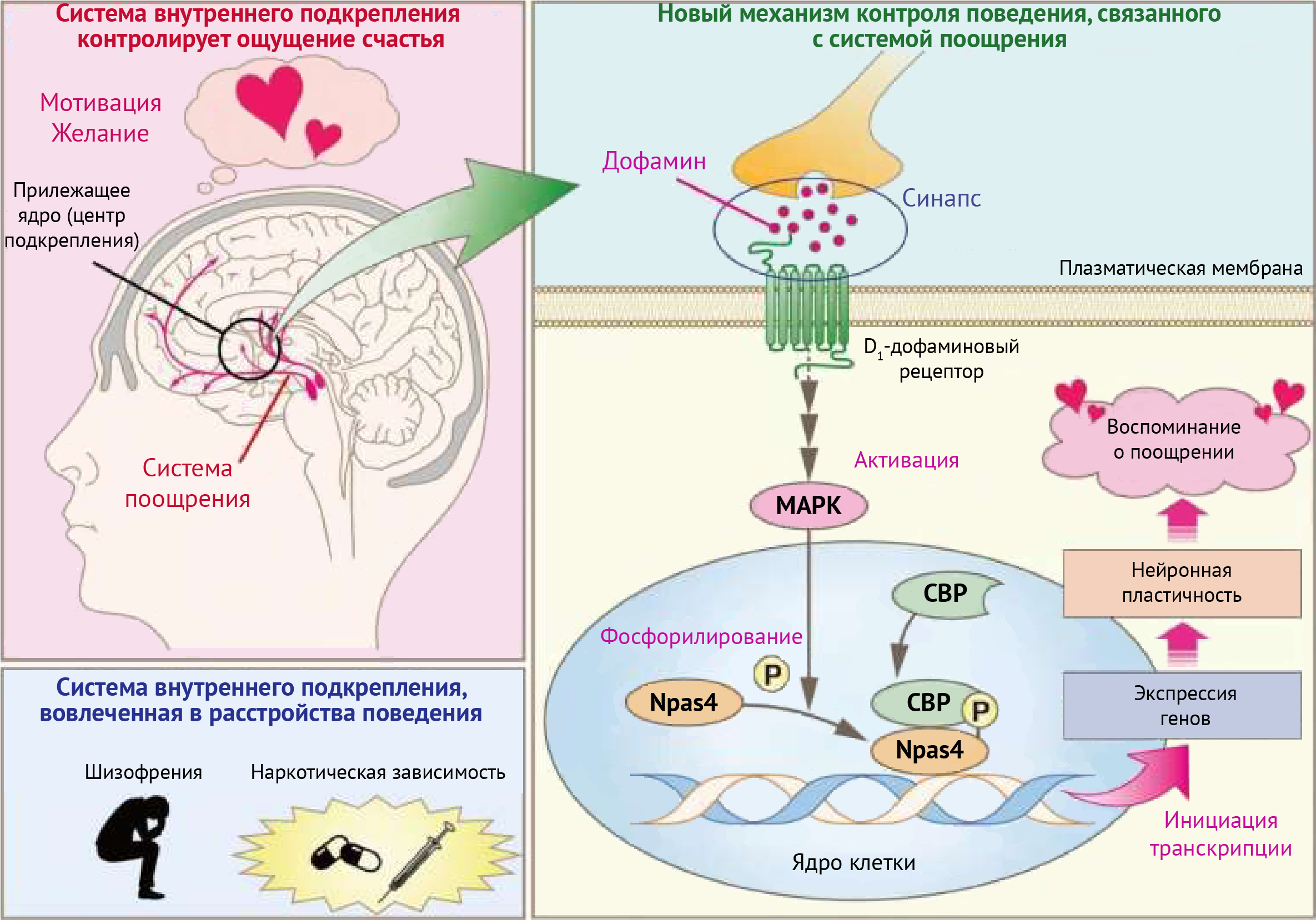
Рисунок 2 | Новый механизм регуляции поведения, связанного с системой внутреннего подкрепления (система поощрения) может быть применен в качестве базиса новых подходов к лечению шизофрении и аддиктивных расстройств.
