Рисдиплам для антенатальной терапии спинальной мышечной атрофии
Рисдиплам — низкомолекулярный препарат, который модулирует сплайсинг гена SMN2, повышает содержание белка SMN (т.н. белок выживаемости мотонейронов) у лиц со спинальной мышечной атрофией (СМА) и уменьшает выраженность симптомов заболевания [1,2]. Плоду с риском тяжелой формы СМА (СМА 1 типа), по причине наличия отягощенного семейного анамнеза (умерший старший брат с генетически подтвержденной СМА 1 типа), была проведена диагностика на наличие СМА с помощью амниоцентеза. В ходе анализа не были обнаружены копии SMN1 (что подтверждает диагноз СМА), однако были выявлены две копии SMN2 (что является предиктором СМА 1 типа) [3]. Согласно ранее полученным сведениям, рисдиплам переносится биологическими средами организма через плаценту, и, следовательно, существует возможность пренатального лечения [4].
Управление по контролю за качеством пищевых продуктов и медикаментов (FDA) США и местная комиссия по биомедицинской этике одобрили план исследования только с одним испытуемым пациентом. Родители предоставили письменное информированное согласие в консультации с независимым адвокатом. Компания F. Hoffmann–La Roche предоставила научное консультирование по безопасности пренатального влияния препарата и предоставила рисдиплам бесплатно в качестве исследуемого продукта в соответствии с соглашением о конфиденциальности со спонсором (St. Jude Children’s Research Hospital).
Мать ребенка принимала рисдиплам перорально в дозе 5 мг/сут в период между 32 неделями 5 днями беременности и родами (произошли на сроке 38 недель и 6 дней). Также она проходила еженедельный контроль на предмет акушерского здоровья и побочных эффектов, связанных с приемом препаратов, а плод подвергался УЗ-диагностике на предмет роста, активности и анатомического развития. Далее, спустя 8 дней после рождения, рисдиплам вводился младенцу перорально, что продолжалось ежедневно, вплоть до февраля 2025 года (суммарно — 30 месяцев).
Концентрация рисдиплама, а также содержание белка SMN и нейрофиламентов оценивалось в крови матери и младенца и амниотической жидкости при рождении. Устойчивые минимальные уровни рисдиплама в плазме у матери составляли приблизительно 14 нг/мл. По сравнению с концентрациями в плазме матери, концентрация препарата при родах составляла 33 % в амниотической жидкости и 69 % в пуповинной крови. Результаты серийных измерений содержания белка SMN в образцах крови, а также легких цепей и фосфорилированных тяжелых цепей нейрофиламентов в образцах плазмы, полученных от матери и младенца, обобщены в таблице 1.
Таблица 1. Фармакокинетические и фармакодинамические исследования у матери и младенца.*
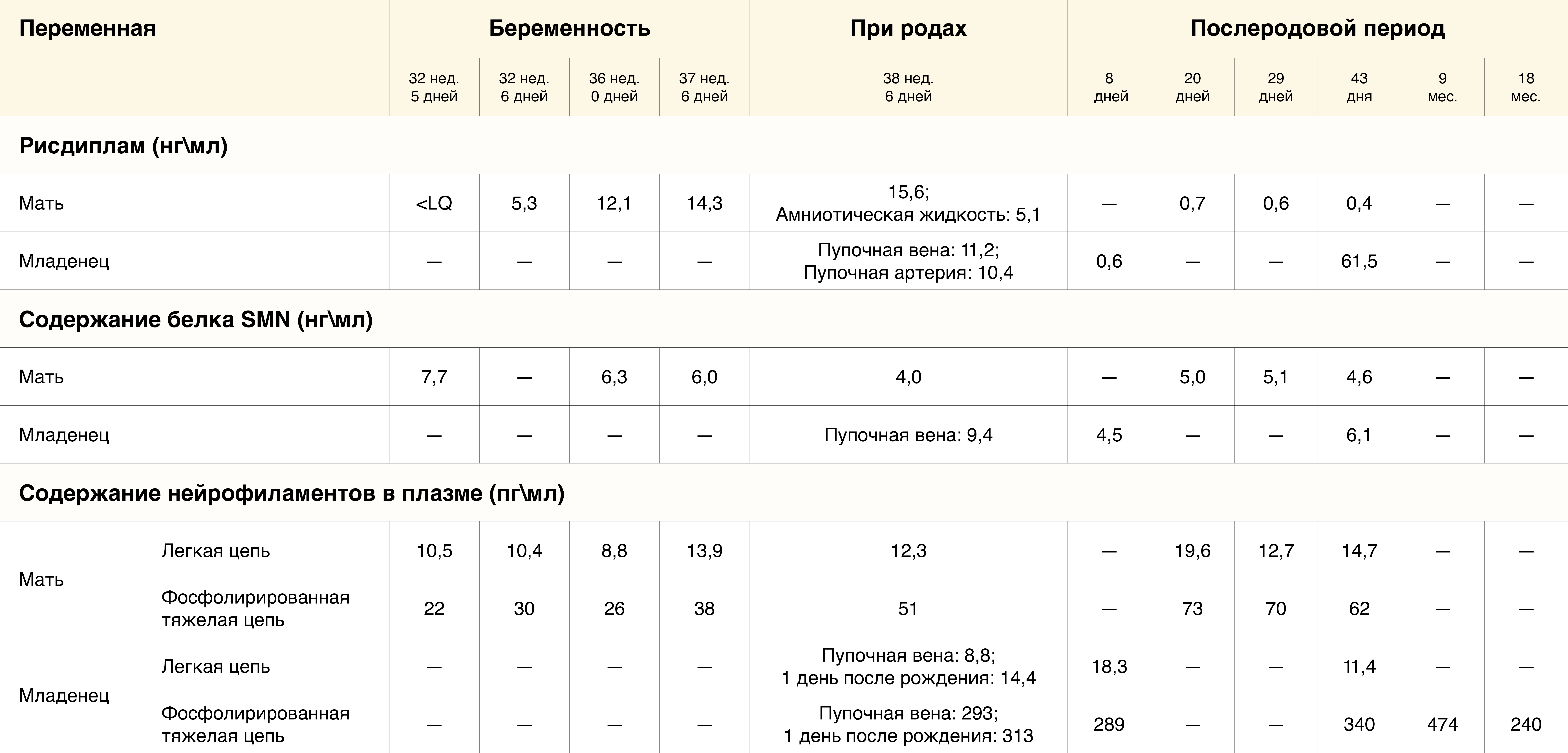
* Значения получены из образцов периферической венозной крови, если не указано иное. LQ — нижняя граница определяемых концентраций в анализе; SMN — белок выживаемости мотонейронов.
† Образцы на 32 неделе 5 дней беременности были получены до введения первой дозы рисдиплама. Образцы на 32 неделе 6 дней беременности были получены через 23 часа после получения первой дозы.
‡ В исследовании FIREFISH, испытуемыми в котором были младенцы с симптомами спинальной мышечной атрофии (СМА), в медианном возрасте 6,7 месяцев (диапазон от 3,3 до 6,9), медианная концентрация белка SMN в цельной крови составила 1,31 нг/мл (диапазон от 0,58 до 4,82) в когорте низкой дозы и 2,54 нг/мл (диапазон от 1,10 до 6,40) в когорте высокой дозы [2].
§ Содержание нейрофиламентов, которое было зафиксировано у нормально развивающихся младенцев (в возрасте от 0 до 360 дней): легкая цепь — примерно до 20 пг/мл, фосфорилированная тяжелая цепь — примерно до 1000 пг/мл [5]. У младенцев с СМА, у которых были обнаружены гомозиготные по гену SMN2, типичные уровни следующие: легкая цепь — примерно до 1100 пг/мл, с приблизительным медианным уровнем 200 пг/мл; и фосфорилированная тяжелая цепь — примерно до 30 000 пг/мл, с приблизительным медианным уровнем 8000 пг/мл [5].
При рождении младенец выглядел нормальным, но после рождения у него был выявлен шум в сердце из-за дефекта межжелудочковой перегородки. Дефект разрешился самостоятельно. У младенца была также слегка снижена острота зрения с транзиторным фиксационным нистагмом, что объясняется гипоплазией зрительного нерва в обоих глазах, и легкий правый гемипарез, связанный с гипоплазией левой половины среднего мозга. На момент написания новости у младенца присутствовала глобальная задержка развития без регресса. Микрочиповое и секвенирование генома с длинным чтением не выявило другого такого генетического нарушения, как например, мутаций генов HESX1, OTX2 и SOX2, которые являются генами, связанными с развитием септооптической дисплазии и нейроэндокринными расстройствами.
Никаких признаков СМА, таких как гипотония, слабость, арефлексия или фасцикуляция, на момент написания статьи не выявлено. Исследования двигательной функции, УЗИ скелетных мышц и электрофизиологические исследования проводились каждые 6 месяцев: они показали соответствующее возрасту развитие периферических нервов и мышц.
Плод с СМА получал рисдиплам через пероральное введение матери. В последующем, препарат вводился ребенку вплоть до возраста в 30 месяцев, и отсутствие проявлений СМА было связано с лечением. Повышение содержания белка SMN и сниженные уровни нейрофиламентов подтверждают таргетное воздействие препарата и его влияние на развитие двигательных нейронов [2,5]. Согласно подсчетам исследователей, врожденные аномалии возникли на ранней стадии развития плода, до воздействия рисдиплама, и точная причина их не была выявлена; эти изменения не наблюдались у животных, которым вводили рисдиплам во время пренатального и постнатального развития [4]. Результаты этого отдельного случая не могут быть использованы для широкого обобщения, но могут стать основанием для рассмотрения пренатального лечения рисдипламом СМА, выявленной in utero.
