Не все ПНЖК одинаково полезны

Пища является источником необходимых нутриентов для роста и пролиферации клеток. В то время как сбалансированная диета улучшает состояние здоровья, избыток питательных веществ, в том числе углеводов и жиров, может нарушать клеточные процессы, увеличивая риск развития таких патологий, как злокачественные новообразования. А следовательно, критически важно понимать, как конкретные нутриенты влияют на механизмы роста клеток на молекулярном уровне. Ключевым компонентом этого механизма является фермент, именуемый мишенью рапамицина у млекопитающих (mTOR). mTOR взаимодействует с другими белками, образуя комплексы mTORC1 и mTORC2, которые регулируют различные аспекты анаболизма [1]. Тем не менее, то, как mTORC распознает питательные вещества, в частности липиды или жиры, остается в значительной степени неизученным. Koundouros и соавт. [2] описывают механизм, с помощью которого mTORC1 распознает омега-6 линолевую кислоту (ω-6 ЛК) — длинноцепочечную полиненасыщенную жирную кислоту (ПНЖК) из пищи. Авторы предоставляют данные о том, как определенные виды рака зависят ω-6 ЛК необходимой для их роста.
ПНЖК в клетках млекопитающих нужны для построения клеточных мембран, а также они могут метаболизироваться в другие производные липидов, которые служат топливом или сигнальными молекулами. Однако, в отличие от большинства жиров, как ω-6 ЛК, так и другая ПНЖК, омега-3 альфа-линоленовая кислота (ω-3 АЛК), являются незаменимыми жирными кислотами, что означает, что они не могут синтезироваться в организме человека. Вместо этого они должны поступать из пищи (рыба, орехи и растительные масла). Стоит отметить, что ω-6 ЛК в большей степени представлена в западной диете, тогда как ω-3 AЛК — в средиземноморской. Хотя некоторые исследования подчеркивают пользу для здоровья от ПНЖК, точные объемы потребляемых с пищей этих жиров являются спорными вопросами [3]. Истоки неоднозначности лежат в ограниченном представлении о том, какие у этих липидов мишени для внутриклеточного взаимодействия. Koundouros и соавт. попытались прояснить ситуацию, показав, что именно ω-6 ЛК, а не ω-3 AЛК или ее производные, является прямым активатором mTORC1. Таким образом, авторы обнаружили связь ω-6 ЛК с главным механизмом внутриклеточного роста. Это подкрепляет представление о том, что избыточное количество жира в пище, пусть даже такой необходимой ПНЖК, как ω-6 ЛК, может обернуться неблагоприятными последствиями: потенциально избыточной стимуляцией mTORC1 и, следовательно, нарушением регуляции клеточного роста.
Koundouros и соавт. обнаружили, что влияние ω-6 ЛК на mTORC1 зависит от содержания липидного шаперона — белка номер 5, связывающегося с жирными кислотами (FABP5). Подобно иным FABP, FABP5 связывается с различными типами молекул жиров и позволяет им, в особенности гидрофобным длинноцепочечным жирным кислотам, преодолевать водную среду кровотока и клеток. FABP5 привлек внимание из-за своей роли в патогенезе нескольких заболеваний и в липидном обмене [4]. Оказалось, что FABP5 действует как «соединительная муфта» между ω-6 ЛК при активации mTORC1 (см. рисунок). В присутствии ω-6 ЛК FABP5 связывается с компонентом mTORC1, называемым регуляторно-ассоциированным белком mTOR (белок Raptor). Это взаимодействие ускоряет сборку комплекса mTORC1 и взаимодействие с субстратом. Активация mTORC1 с помощью комплекса ω-6 ЛК-FABP5 усиливает фосфорилирование специфических субстратов, включая рибосомальную протеинкиназу S6 (S6K) и эукариотический фактор инициации трансляции 4E-связывающий белок 1 (4E-BP1), которые регулируют синтез белка [5].
Точный механизм, посредством которого ω-6 ЛК-FABP5 активирует mTORC1, неясен, хотя, по всей видимости, в него входят Ras-ассоциированные гуанозинтрифосфатазы (ГТФазы) (Rag) и ГТФ-связывающий белок Rheb (также относится к семейству Ras), которые также опосредуют активацию mTORC1 в ответ на [изменение] концентрации аминокислот [6]. Согласно выводам исследования, предполагается, что mTORC1 интегрирует поступление различных питательных веществ для координации сигналов роста. В частности, ω-6 ЛК активирует mTORC1 даже в отсутствие аминокислот и факторов роста, что подразумевает, что липиды могут обеспечивать различные регуляторные сигналы для активации mTORC1. Другие липиды, такие как фосфатидная кислота, олеиновая кислота и пальмитат, также активируют mTORC1 [7], однако им не требуется FABP5 [2]. Чтобы выяснить, как mTORC1 распознает весь спектр различных липидов, необходимо проведение новых исследований. Определение того, как активация mTORC1 и mTORC2 под действием липидов влияет на динамический транспорт липидов, задействованных в сборке мембран и других анаболических процессах, станет перспективной областью для будущих исследований.
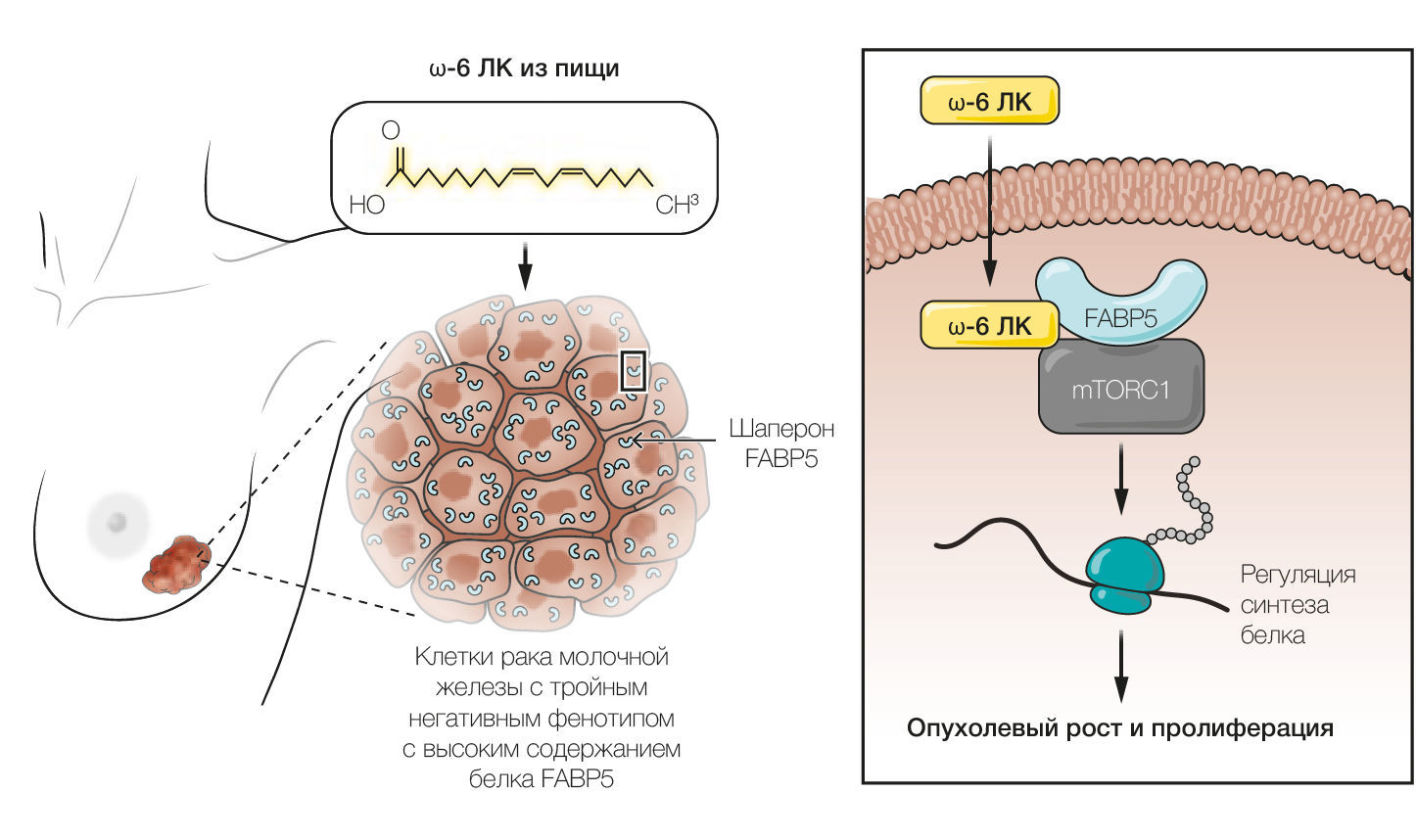
Какова роль конкретно ω-6 ЛК в процессах озлокачествления? Хотя FABP5, по сравнению с другими FABP, экспрессируется повсеместно степень этой экспрессии возрастает при нескольких типах рака, как например, при раке молочной железы [8]. Высокая экспрессия FABP5 связана с плохой безрецидивной выживаемостью у пациентов с раком молочной железы. Koundouros и соавт. выяснили, что количество FABP5 выше при раке молочной железы с тройным негативным фенотипом [при котором отсутствуют рецепторы эстрогена и прогестерона, а также рецептор эпидермального фактора роста 2 (HER2)], по сравнению с раком молочной железы с рецептор-положительными клетками.
Используя клеточные модели, авторы продемонстрировали, что уровень экспрессии и способность FABP5 связывать жирные кислоты важны для активации mTORC1 посредством ω-6 ЛК. Примечательно, что у мышей, которым имплантировали клетки трижды негативного рака молочной железы, наблюдался усиленный рост опухоли при использовании диеты, содержащей ω-6 ЛК, а не с ω-3 AЛК, что подтверждает представление о том, что опухоли, в которых содержится много FABP5, характеризуются бОльшей потребностью в ω-6 ЛК из пищи. Это поднимает вопрос о том, как изменяется экспрессия FABP5 во время возникновения и прогрессирования опухоли. Повышенная экспрессия FABP5 при раке часто коррелирует с повышенной экспрессией других регуляторов липидного метаболизма и пролиферации клеток [9], что указывает на скоординированную регуляцию этих генов. Вопрос о том, способствуют ли такие ткани, как жировая, увеличению содержания FABP5 в кровотоке, доставляя липиды к опухолям и другим тканям, требует дальнейшего изучения [10]. Поскольку ω-6 ЛК поступает только с пищей, ограничение её потребления может быть полезным для пациентов с высоким содержанием FABP5. Изучение того, как избыточное получение жира из пищи участвует в перепрограммировании как клеточного, так и общего метаболизма организма, что впоследствии нарушает регуляцию экспрессии генов, станет источником понимания работы механизмов, лежащих в основе возникновения и прогрессирования рака.
В настоящее время исследуется фармакологическое воздействие на FABP при раке [11]. Существуют также клинические попытки воздействия на mTOR при раке, хотя в силу токсичности были продемонстрированы скромные результаты [12]. Сочетание ингибирования mTOR и FABP5 или блокада их взаимодействия вместе с ограничением ω-6 ЛК в рационе может стать стратегией терапии рака, пролиферация клеток которого зависит от работы оси ω-6 ЛК–FABP5–mTORC1. Сбалансированное потребление ω-6 ЛК и ω-3 АЛК уже набирает обороты как часть инициативы по «оздоровлению» иммунитета [3]. В ходе будущих исследований необходимо изучить, как управление количеством поступающих с пищей этих липидов перенастраивает сигналы роста в различных типах клеток, предотвращая развитие рака.
