Эволюционная теория рака: проблемы и потенциальные решения
Модель клональной эволюции рака была разработана в 1950–1970-х гг. и благодаря генетическим исследованиям в XXI веке стала центральной в биологии рака. Хотя она доказала свою ценность, наблюдения фенотипической пластичности, негенетических форм наследования, негенетических детерминант устойчивости клонов и недревовидной передачи генов зародили некоторые сомнения в ее структуре. Существует даже путаница в определении клона, которую авторы пытаются разрешить. Эффективность и ценность модели клональной эволюции зависит от эмпирической степени вовлеченности эволюционных процессов в рак, и от ее теоретической способности учитывать эти эволюционные процессы. Здесь мы выявляем ограниченность теоретической эффективности модели клональной эволюции и предлагаем решения для преодоления этих ограничений. Хотя и не утверждается, что клональная эволюция может объяснить всю полноту природы рака, но эта модель способна интегрировать в себя многие сложности динамики рака и улучшить его понимание.
Введение
Раковые опухоли представляют собой неоднородные в пространстве и времени популяции клеток. Такое разнообразие — одна из основных клинических проблем, ограничивающая эффективность большинства методов лечения рака, поскольку практически всегда существует некое подмножество клеток, устойчивых к любому лечению. Гетерогенность опухоли ограничивает точность прогноза и способность предсказать ответ на то или иное вмешательство, поскольку биопсия может не отражать всего разнообразия новообразования, а его изменения во времени в значительной степени носят стохастический характер. Для эффективного лечения рака необходимо лучшее понимание механизмов, задействованных в этой диверсификации. В 21 веке объяснением этого разнообразия стала теория клональной эволюции: раковые клетки диверсифицируются за счет накопления генетических и эпигенетических изменений, которые могут изменить относительную пригодность клеток и, как следствие, приводить к расширению или сужению клона в результате естественного отбора. Здесь к опухолевым клеткам можно успешно применять принципы эволюции и инструменты популяционной генетики. Однако эволюционный взгляд на развитие рака был поставлен под сомнение, когда выяснилось, что фенотипическая неоднородность опухолей в значительной степени не зависит от генетики клонов. Учитывая, что естественный отбор влияет на фенотип и зависит от его наследуемости, эти данные бросают вызов значимости модели клональной эволюции. Самое время оценить сильные и слабые стороны этой модели, а также возможности для ее совершенствования. Для этого сначала нужно изучить, что известно об эволюции раковых клеток, проведя исторический и современный обзор литературы. Затем провести анализ теоретической структуры модели, выделив лежащие в ее основе предположения. Таким образом, необходимо выявить теоретические и концептуальные противоречия и трудности, присущие данной модели. В заключении будут предложены перспективы, которые могут помочь решить некоторые из этих проблем и повысить значимость клональной эволюции в раке.
Что такое модель клональной эволюции?
Историческая перспектива
Модель клональной эволюции — это абстрактная модель, изображающая эволюцию раковых клеток в организме пациента. Ее авторство часто приписывают Питеру Новеллу, но сам Новелл утверждал, что он обобщает идеи, которые были разработаны научным сообществом. Наблюдение внутриопухолевой гетерогенности и идея о том, что раковые клетки эволюционируют, существовали еще до 1976 года, а успех был достигнут позже. В 1950-х годах понятие эволюции часто использовалось в онкологии для описания прогрессирования рака, хотя не всегда имелся ввиду дарвиновский процесс. За время исследования кариотипа раковых клеток подтвердилась гипотеза, впервые выдвинутая Теодором Бовери, согласно которой опухоли могут возникать из хромосомных дефектов, вызванных аномальными митозами, что предполагало клональное происхождение рака. Кариотипирование также привело к наблюдению вариации в количестве хромосом у раковых клеток и сыграло решающую роль в выявлении их эволюции. Кариотипические наблюдения непосредственно поставили вопрос о том, состоят ли опухоли из множества штаммов клеток, каждая из которых имеет фиксированное число хромосом, или может ли меняться кариотип опухолевых клеток, и если да, то являются ли такие изменения случайными, наследственными или отобранными.
Т. С. Хаушка ссылается на «последовательность отбора мутаций, аналогичную филогении» и утверждает, что «специфические кариотипы опухолей имеют конкурентное значение для выживания». Для решения вопроса о клональном происхождении рака использовалось множество методов, включая открытие филадельфийской хромосомы, случайную соматическую инактивацию одного из двух аллелей фермента глюкозо-6-фосфатдегидрогеназы у женщин или перестройки тяжелой цепи иммуноглобулина.
Все эти эксперименты объединяются в гипотезу о клональном происхождении рака, а внутриопухолевая гетерогенность возникает из последующих вариаций, которые подвергаются селекции. В большинстве исследований эволюционные понятия остаются на втором плане, но в некоторых из них напрямую обсуждаются эволюционные принципы, применимые к раку. Английский цитогенетик К. Э. Форд посвятил статью селективному давлению в здоровых, облученных или раковых соматических клетках, отстаивая гипотезу о том, что «несбалансированные кариотипические изменения влияют на вероятность выживания и пролиферации» и, таким образом, кариотипическая структура клеточной популяции является результатом действия селективных сил на возникающую в ней изменчивость. Ж. Лежен утверждал, что гипотеза отбора необходима для согласованности модели клональной эволюции и указывал на использование кариотипов для реконструкции «естественной истории клона», сравнивая такую реконструкцию с «подходом палеонтологов восстанавливающих, от формы к форме, историю филума». После прекрасного доклада Новелла об эволюционной модели рака наступила научная тишина. Эволюционная биология рака не развивалась в течение десятилетий, и лишь несколько ученых работали, опираясь на основы, заложенные Новеллом. Только в XXI веке эта область набрала обороты. Вероятно, интерес к эволюции рака вернулся неслучайно, ведь благодаря высокопроизводительному секвенированию начали генерироваться обширные массивы генетических данных по раковым опухолям.
Вскоре появились наблюдения, подтверждающие клиническую значимость внутроопухолевой гетерогенности и клональных экспансий, а также то, что терапия нередко отбирает уже существующие клоны с мутациями, обеспечивающими устойчивость к лечению. Дальнейшие исследования показали, что эволюционный подход к лечению рака может привести к значительному увеличению времени до прогрессирования и общей выживаемости. На фоне всего этого появляются обзоры о том, как эволюционная биология и экология применяются в лечении рака.
Как эволюционируют раковые клетки?
Любая популяция организмов с разнообразием наследуемых свойств, которые могут привести к различиям в адаптивности, может эволюционировать путем естественного отбора. Поскольку мутации вызывают наследственное разнообразие среди клеток и некоторые из них могут менять адаптивные механизмы, соматические клетки также подвергаются эволюции путем естественного отбора. Открытым остается вопрос: эволюционируют ли они под действием естественного отбора и в какой степени? Вопрос, который обсуждается учеными и философами. Важно понимать, что раковые клетки могут эволюционировать с помощью множества механизмов. Одни развиваются путем естественного отбора, другие же опухоли практически не демонстрируют признаков естественной селекции и, в основном, развиваются путем нейтральной эволюции. Математическая модель нейтральной эволюции согласуется с генетическими данными примерно в 1/3 солидных опухолей, множественной миеломы и хронического миеломоноцитарного лейкоза. Другая панель исследований показала, что отрицательная селекция, преобладающая в зародышевой линии, практически отсутствует в раке и соматической эволюции. Хотя клональная эволюция первоначально рассматривалась как непрерывный постепенный процесс, было показано, что изменения могут происходить “всплесками”. Клональная эволюция может происходить в режиме стазиса, постепенных изменений и рывков, однако при этом “молекулярные часы” могут идти с разной скоростью, а сама эволюция протекать по линейному или разветвленному пути. Существует множество процессов, лежащих в основе клональной эволюции раковых клеток.
Кроме того, хотя традиционно модель клональной эволюции берет за единицу отбора опухолевую (стволовую) клетку, отбор может происходить на более высоких уровнях (рис. 1a), то есть на группах клеток. Например, ведутся споры о том, существует ли эволюция путем естественного отбора между метастазами, причем каждый метастаз считается отдельным “родителем”, порождающим вторичные метастазы. Отбор на более высоком уровне может происходить не только между колониями раковых стволовых клеток и их не-стволовыми потомками, но и между эпителиальными пролиферативными единицами, например, криптами толстой кишки, способными делиться и отмирать. Отбор при раке может происходить и на субклеточных уровнях, через эволюцию подвижных элементов генома или внехромосомной ДНК и, возможно, микроядер, если они могут реплицироваться независимо от репликации клетки (рис. 1b). Тот факт, что отбор может действовать на дополнительных уровнях, выше и ниже клетки, не нарушает модель клональной эволюции. Точно как и многоуровневый отбор, выше и ниже уровня организма, он не нарушает теорию эволюции, а скорее добавляет ей сложности.
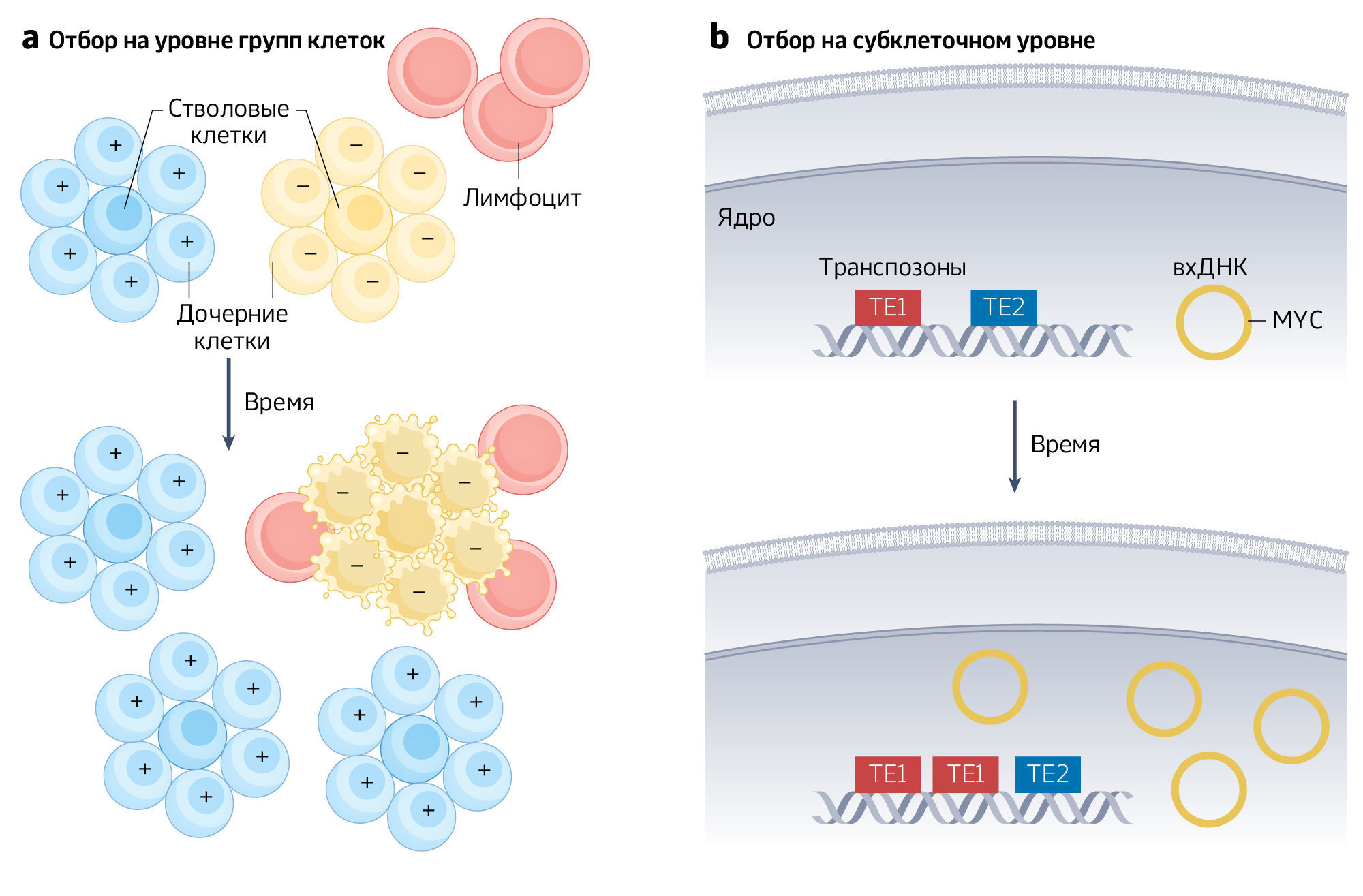
б) Молекулярный уровень, внехромосомная ДНК (вхДНК) может увеличивать число копий генов, связанных с раком (например, MYC) независимо от хромосом. Аналогично, транспозоны (TE1 и TE2) могут реплицироваться внутри генома.
В чем ценность модели клональной эволюции?
Модель клональной эволюции объединяет современные знания об эволюции раковых клеток. Она представляет собой высокотеоретическую основу и направлена не только на описание, но и на реконструкцию прошлой и предсказание потенциальной будущей эволюции (например, устойчивости к лечению), объяснение явлений, происходящих у пациентов, и создание основы для новых терапевтических вмешательств. Эти свойства авторы назвали теоретической ценностью модели клональной эволюции. Основная теоретическая ценность модели заключается в объяснении того, как и почему рак изменяется с течением времени и в ответ на терапию. Филогенетическая реконструкция позволяет описать естественную историю развития рака.
Например, клональные мутации (также называемые “стволовыми” или трункальными мутациями) обычно отличаются от субклональных мутаций (то есть мутаций, которые появляются только на “ветви” филогенетического древа опухоли). Филогенетические реконструкции могут выявить изменения в воздействии (экспозиции) и мутационных процессах с течением времени.Таким примером может служить потеря связанной с афлатоксином B1 мутационной сигнатуры у африканских мигрантов с гепатоцеллюлярной карциномой спустя годы после прибытия во Францию. Вопреки ожиданиям, метастазы могут возникать на ранних стадиях канцерогенеза. Выводы, извлеченные из этих филогенетических реконструкций, также облегчают подбор лекарств (например, таргетинг на клональную, а не субклональную мутацию) и помогают предсказать риск терапевтической резистентности путем отбора устойчивых мутаций, таких как мутация T790M рецептора эпидермального фактора роста (EGFR), вызывающая устойчивость к ингибиторам EGFR первого поколения при раке легкого. Похожим образом резистентность к фармакотерапии проявляется для многих мутаций, и клиницисты опираются на эти знания, чтобы подобрать подходящую схему терапии. Опираясь на показатели клональной эволюции, модель клональной эволюции также используется для стратификации риска и прогноза, такие как внутриопухолевая гетерогенность, для предсказания склонности предраков прогрессировать до инвазивного заболевания, и вероятности рака привести к летальному исходу.
Модель клональной эволюции предсказывает, что различные условия окружающей среды будут изменять способность мутировавших клонов к экспансии. Например, в кроветворной системе с возрастом возникают мутантные клоны, и этот процесс называют клональным гемопоэзом. К клональному гемопоэзу могут привести различные изменения окружающей среды, например, старение, химиотерапия, инфекции и курение. Однако все они, как правило, выбирают различные типы мутаций. Клональный гемопоэз также сопровождается различными мутациями и различной динамикой с возрастом. Это также помогает объяснить позднее возникновение рака, поскольку снижение приспособленности здоровых клеток с возрастом обеспечивает более слабых конкурентов для отбора мутантных клонов. Отметим, что теорию промоции (теорию стадий канцерогенеза) иногда противопоставляют теории соматических мутаций, но в контексте клональной эволюции эти две теории совместимы, поскольку приспособленность зависит как от внутренних свойств клетки, так и от внешних свойств. Более того, модель клональной эволюции привела к глубокому концептуальному переходу, который рассматривает рак как динамический процесс. Она способствовала дискредитации терапевтической стратегии поиска «волшебной пули» и потребовала изменений в исследовательской и лечебной практике. Модель предсказывает, что наиболее прогрессирующие виды рака чаще всего не поддаются никакому лечению. Это привело к появлению различных предложений по разработке терапии на основе эволюционных принципов, таких как лекарственные «каникулы», смена препаратов в процессе лечения и адаптивная терапия, управляющая клональной динамикой, чтобы не дать терапевтически устойчивым клонам выйти из-под контроля. Годы наблюдений и экспериментов, проверяющих аспекты модели клональной эволюции, подтвердили ее теоретическую ценность. Однако она не объясняет всего фенотипа рака. Помещение раковых клеток в другое микроокружение заставляет их вести себя по-другому. Яркой иллюстрацией этого являются примеры, когда помещение раковых клеток в здоровую среду может «нормализовать» их поведение. Внутриопухолевая фенотипическая гетерогенность может в значительной степени не зависеть от генотипа, и все чаще признается в качестве важного фактора, способствующего внутриопухолевой гетерогенности и предотвращению лечения, признается фенотипическая пластичность.
Допущения и ограничения модели
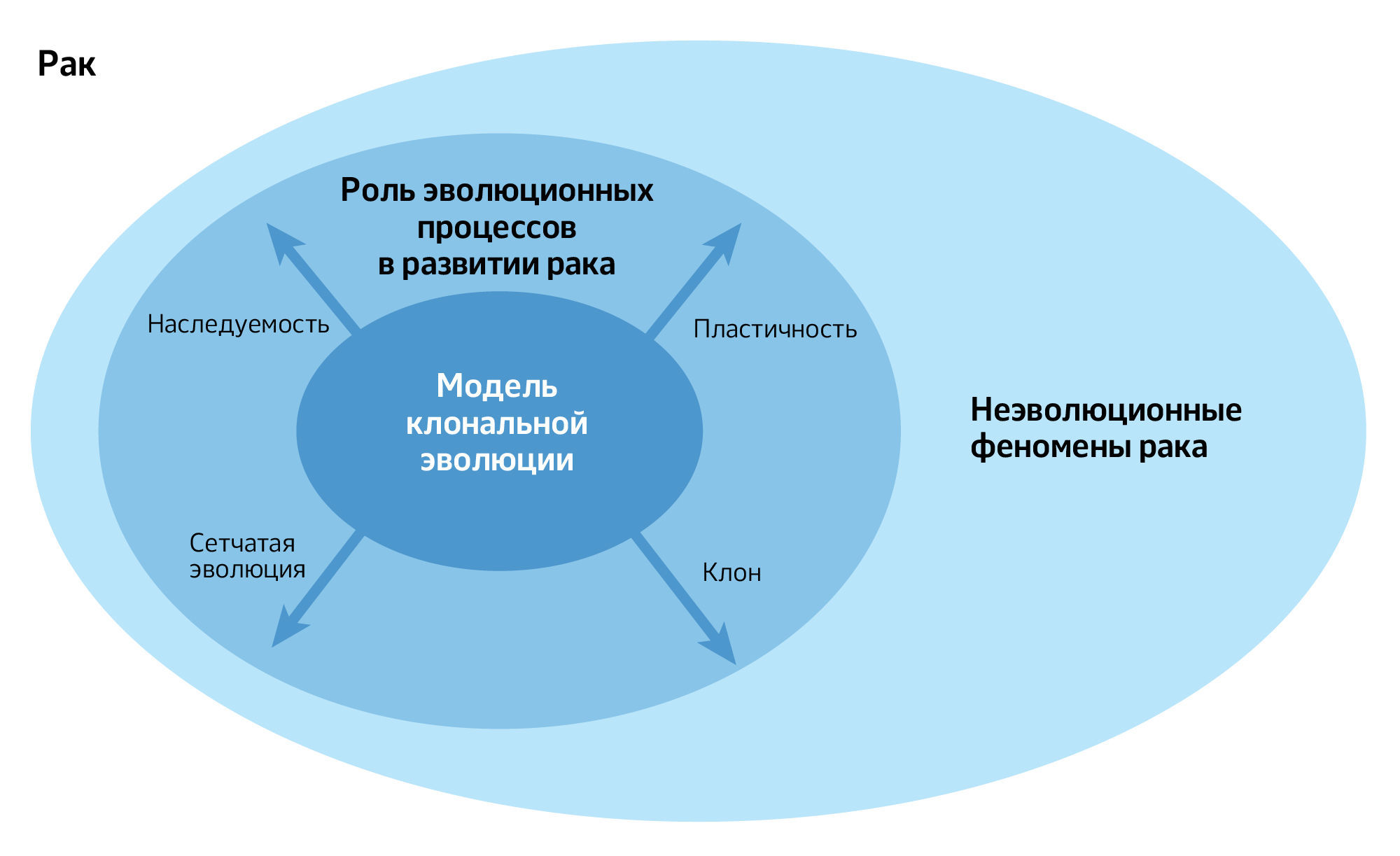
Эффективность модели клональной эволюции определяется двумя различными аспектами: фактическим, то есть тем, в какой мере эволюционные процессы участвуют в развитии рака, и теоретическим — тем, насколько существующая модель клональной эволюции способна адекватно описать эти процессы. Исходное допущение модели состоит в том, что эволюционные механизмы действительно играют роль в канцерогенезе, и это подтверждается десятилетиями накопленных данных. Однако открытым вопросом остается степень значимости модели: модель клональной эволюции становится тем более релевантной, чем сильнее на развитие рака влияют эволюционные процессы.
Отдельной проблемой является теоретическая состоятельность модели. В ее нынешнем виде она может лишь частично отражать реальную роль эволюционных процессов в развитии опухолей. Поэтому важно различать трудности, связанные с фактическим вкладом эволюции в рак, и ограничения, обусловленные теоретическими возможностями самой модели. Последние могут быть преодолены путем ее дальнейшего расширения и уточнения.
В современной модели клональной эволюции можно выделить два ключевых, но проблематичных допущения. Во-первых, предполагается, что фенотип раковых клеток, в частности их приспособленность, в значительной степени определяется генотипом (что отражает историческое доминирование генетических подходов в исследованиях клональной эволюции). Во-вторых, предполагается, что родственные связи между опухолевыми клетками образуют разветвленное древо, хотя ни одно из этих условий не является необходимым для эволюции как таковой. Далее мы подробно рассмотрим оба допущения, анализируя границы применимости и критику модели и проводя грань между теми ограничениями, которые действительно сужают возможности эволюционных теорий в объяснении рака (фактические ограничения), и теми, которые скорее указывают на направления улучшения текущей модели клональной эволюции (теоретические ограничения).
Допущение 1: приспособленность в значительной степени зависит от генотипа.
Модель клональной эволюции опирается на современный эволюционный синтез, который представляет собой количественную генетическую теорию дарвиновской эволюции, определяющая эволюцию как изменение частот генетических вариантов у популяции в пространстве и времени. Как математическая и теоретическая модель, она требует некоторых упрощающих предположений, в частности, организм сводится к его генетике. В онкологии были выявлены и охарактеризованы специфические генетические изменения, играющие ключевую функциональную роль в развитии и эволюции заболевания, что в 1980-е годы привело к утверждению концепции онкогенов и генов-супрессоров опухолей. Однако из биологии развития хорошо известно, что один и тот же генотип может вызывать совершенно разные фенотипы в нормальных клетках, и это также применимо к раковым клеткам. Предположение о том, что приспособленность раковых клеток во многом зависит от их генетики, сталкивается с рядом проблем.
Идентификация ключевых генов клональной эволюции представляет собой сложную задачу
Крупные консорциумы приложили немало усилий для секвенирования опухолей с целью выявления генов, связанных с раком, и было выявлено несколько факторов, искажающих результаты, таких как размер генов и их расположение в уязвимых (нестабильных) участках генома. Статистическую значимость присутствия некоторых мутаций необходимо оценивать в зависимости от некоторых фоновых факторов, таких как частота мутаций каждого нуклеотида, структурных вариаций и чистоты образца. Учитывая, что мутации в типичных генах-драйверах рака присутствуют в соматических здоровых тканях, крайне важным представляется сравнение частоты мутаций в раке с их частотой в нераковых тканях. Например, мутации NOTCH1 часто встречаются при раке пищевода и раке кожи, что позволяет предположить, что он является драйверным геном в этих видах рака. Однако поскольку мутации NOTCH1 чаще встречаются в нормальном эпителии кожи и пищевода, чем в раковых опухолях этих тканей, мутации NOTCH1 могут играть защитную роль в отношении как рака кожи, так и рака пищевода. Таким образом, выявление мутаций-драйверов — задача далеко не простая.
Существует также концептуальная проблема идентификации генов, связанных с раком. Одна и та же мутация может быть нейтральной или даже вредной («вредоносная» мутация) в одном контексте и стать драйвером в другом, и наоборот. Концепция «клетки происхождения» иллюстрирует этот феномен: одна и та же мутация может оказывать разное влияние в зависимости от того, в какой клетке она возникает. Аналогичным образом, терапия изменяет среду обитания клеток, что может отбирать клоны со специфическими устойчивыми мутациями, которые распространяются во время лечения и регрессируют при отмене терапии. Лечение оказывает резкое и быстрое селективное давление, но возможны и более медленные изменения с теми же последствиями. Например, старение изменяет ландшафт приспособленности клеток, так что мутация может быть нейтральной или даже пагубной у молодого человека, но оказаться выгодной в условиях старения. Приспособленность по определению всегда соотносится с конкретным окружением. А окружение раковых клеток меняется как в ходе естественного развития болезни, так и в результате старения, вмешательств и других изменений.
Трудности, связанные с выявлением драйверных мутаций, осложняют попытки по определению клонов на основе драйверных мутаций (см. вставку 1).
Традиционно идентичность клона определяется по генотипу или, скорее, его части. Типичным определением клона является, например, “набор клеток, которые происходят от общего предка и, таким образом, имеют общие генетические особенности”. По практическим соображениям исследования клональной эволюции часто опираются на анализ драйверных мутаций. Однако в ряде работ используются методы, позволяющие более широко охватывать геном, такие как секвенирование всего экзома или даже всего генома, которое не требует априорного знания о том, какие именно мутации вовлечены в канцерогенез. Наконец, в некоторых исследованиях отдается предпочтение использованию нейтральных мутаций в качестве более беспристрастного способа отслеживания клональной эволюции.
Существует также более фундаментальная онтологическая и эпистемическая проблема идентификации клона. Модель клональной эволюции опирается на реконструкцию клонов на основе неполной информации: мы не имеем доступа ни ко всем раковым клеткам, ни ко всем наследуемым свойствам каждой отдельной клетки. Это может привести к «клональной иллюзии», когда субклональная мутация кажется клональной, потому что биопсия была взята только в пределах субклона. Это также зависит от выбора, сделанного исследователями в отношении того, какие изменения важны для определения клона, а какие можно игнорировать. На реконстукцию клональной эволюции влияет изменение списка мутаций, которые считаются значимыми и, следовательно, используемых для этой реконструкции. Например, количество выявленных клонов будет зависеть от количества изученных генов и глубины секвенирования. В качестве экстремальной иллюстрации этого вопроса, можно определить клон как набор геномно идентичных клеток. Однако секвенирование всего генома на уровне одной клетки, вероятно, покажет, что каждая отдельная раковая клетка уникальна и, следовательно, считается новым клоном, что делает концепцию клона бесполезной. История модели клональной эволюции показывает, что выбор изменений, которые следует использовать для определения клона, менялся с течением времени, что подчеркивает произвольность в определениях клонов. При плюралистическом подходе можно утверждать, что правильное или наилучшее определение клона будет зависеть от перспектив и целей, которых придерживается исследователь. Вопрос о том, является ли разграничение клонов проблемой, и в какой степени, во многом зависит от того, каких задач ожидают от модели клональной эволюции. Например, это существенно для исследований, оценивающих внутроопухолевую гетерогенность путем подсчета клонов. Гораздо менее значимой эта проблема оказывается для тех работ, цель которых — реконструкция филогенетических связей между различными опухолевыми клетками (например между метастазами в различных локализациях).
Существует несколько альтернативных взглядов на клональную идентичность: в настоящее время несколько исследований используют эпигенетику для реконструкции эволюции рака. Некоторые из них поддерживают фенотипическую или функциональную клональную идентичность. Например, клон был определен как “группа клеток с одинаковым фенотипом, которые постоянно выражают этот фенотип со времени их последнего общего предка”. Согласно этому определению, набор стволовых клеток можно назвать клоном, если они имеют одинаковый фенотип и имели недавнего общего предка, но при этом исключить все нестволовые клетки, которые были частью той же ветви на древе клеточных линий. В отличие от этого, в биологии развития клон определяется как «in vivo потомки одной предковой клетки», что эквивалентно монофилетической кладе в филогенезе. В основе любой опухоли лежит древо клеточных линий, описывающее родственные связи и историю клеток внутри рака. Определение клонов сводится к тому, как именно это эволюционное дерево разделяют на части (рис. 2).
Гены — не единственный наследственный материал
В настоящее время хорошо известно, что многие эпигенетические свойства наследуются при делении клеток и могут способствовать клональной эволюции, включая эволюцию метастазирования и устойчивость к лекарствам. Однако эпигенетика охватывает широкий спектр явлений, некоторые из которых доминируют и наследуются, в то время как другие находятся под контролем клетки и могут изменяться в ответ на те или иные сигналы, например, во время дифференцировки. Наследственные изменения могут быть включены в клональную эволюцию в качестве эпимутаций.
Исследования выявили согласованность между генетической и эпигенетической клональной эволюцией, что логично, учитывая существование единой линии раковых клеток. Кроме того, внутри одного генетического клона может существовать множество эпигенетических субклонов, и наоборот. Это снова поднимает вопрос о том, какую информацию использовать для разграничения и подсчета клонов (рис. 2 и вставка 1). Эпигенетические изменения ставят под сомнение теоретическую точность клональной эволюции, когда модель опирается только на генетические мутации, но не ставит под сомнение ее фактические масштабы.
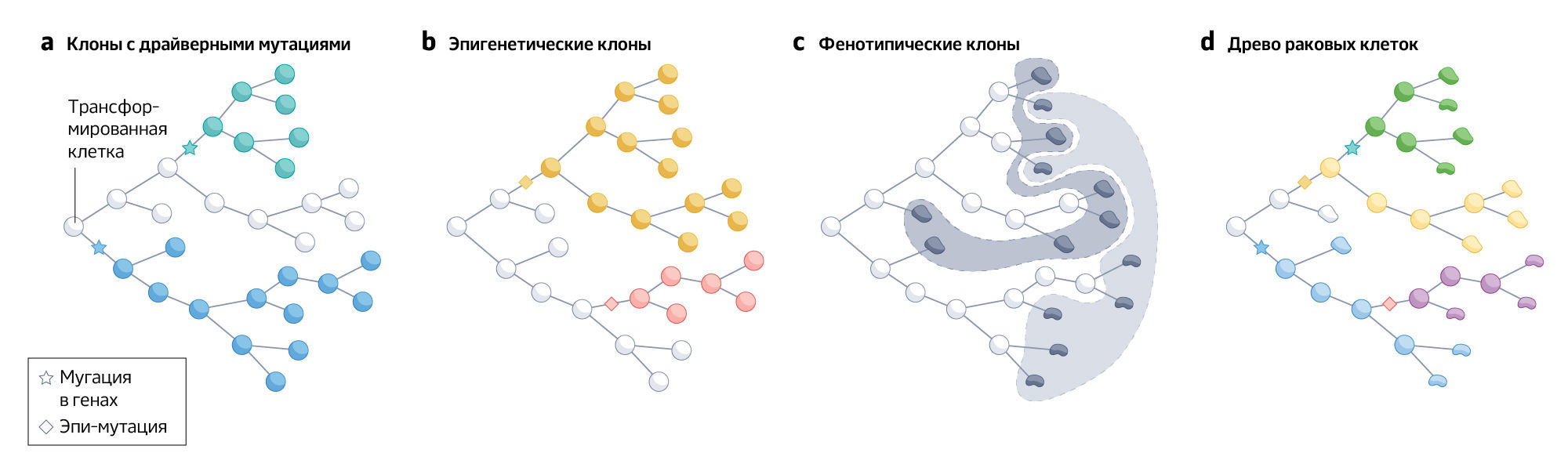
б) Древо раковых клеток с клонами, идентифицированными по эпигенетическим изменениям. Выявлены три клона: первый клон (белый) указывает на эпигенетическое состояние первой трансформировавшейся клетки, второй клон (красный) указывает на эпигенетическое состояние, опосредованное наследственным эпигенетическим изменением (обозначен красным ромбом), а третий клон (желтый) обозначает клетки с выраженным эпигенетическим изменением (желтый ромб). Это не те же клоны, что и генетические клоны.
c) Фенотипические клоны. Если рассматривать только фенотипические характеристики, то можно выделить два клона, обозначенные серыми заштрихованными областями.
d) Древо раковых клеток, с генетической, эпигенетической и фенотипической информацией. Генетическая, эпигенетическая или фенотипическая эволюция могут происходить одновременно в разных временных масштабах. Бирюзовый генетический клон является смешанным и содержит оба типа клеток, в то время как белый и синий генетические клоны содержат разные типы клеток. Желтый эпигенетический клон смешанный, в то время как красный и белый эпигенетические клоны содержат один и тот же тип клеток. Существует ли три, пять или более клонов? Обратите внимание, что эти различные формы эволюции могут быть более или менее заметны на разных стадиях или в разных местах.
Наследственные свойства могут выходить за рамки генетического материала и его эпигенетических изменений. Поскольку размножение клеток происходит путем деления, дочерние клетки наследуют часть материнской цитоплазмы, включая органеллы, РНК и белки. Они также наследуют микроокружение, которое материнская клетка могла изменить. Это может привести к кратковременной наследуемости фенотипа клеток с временными рамками, зависящими от колебаний и скорости обновления этих молекул и микроокружения. У бактерий использование «сестринских машин», которые разделяют две дочерние клетки в независимые каналы роста, показало, что негенетические признаки представляют собой различные модели «памяти» на разных временных интервалах: от двух до десяти поколений. В клеточной линии меланомы было идентифицировано 227 генов, которые показали временную наследуемость высокой экспрессии (около 40 часов, реже достигала 5 дней), из которых 162 ранее были связаны с резистентностью к терапии. Клетки, отобранные по высокой экспрессии двух переходно наследуемых генов, а именно EGFR и рецептора фактора роста нервов (NGFR), показали гораздо более высокий уровень резистентности к ингибитору MEK траметинибу, чем клетки, не прошедшие отбор.
Наследование свойств на разных временных отрезках остается практически незамеченным, однако, учитывая короткую продолжительность терапевтических вмешательств, эти альтернативные формы наследования могут иметь клиническое значение. Как будет обсуждаться в разделе «Наследование и временные масштабы», совершенствование нашего понимания наследования может улучшить теоретические представления о клональной эволюции.
Один генотип может проявляться во множестве фенотипов
Нормальные соматические клетки в многоклеточных организмах фенотипически пластичны. Фенотипическая пластичность уже давно изучается в как свойство развивающихся клеток и все чаще признается важной и для рака. Начиная с одного генотипа, клетки могут принимать различные фенотипы в результате, по меньшей мере, трех неисключительных процессов: дифференцировки, реакций на внешние сигналы и стохастических колебаний (в уровнях генетических продуктов и эпигенетических модификаций). Последние два процесса могут включать дедифференцировку, трансдифференцировку или другие изменения состояния клеток, например, метаболические. Раковые клетки наследуют и изменяют фенотипическую пластичность нормальных клеток, из которых они развились.
В настоящее время фенотипические вариации, не зависящие от генотипа, не учитываются моделью клональной эволюции. Таким образом, клеточная пластичность ставит под вопрос границы модели клональной эволюции: чем сильнее в возникновении рака задействованы ненаследуемые формы пластичности, тем меньше пространства остается для собственно эволюционных механизмов. Например, исследование состояния покоя и рецидивов в рецептор эстрогена-положительном раке молочной железы, получающем адъювантную эндокринную терапию, показало, что у части раковых клеток из случайного разнообразия клонов терапия стохастически индуцирует состояние покоя, которое до вмешательства проявлялось нестабильно. В таких случаях эволюция путем естественного отбора не играет большой роли в способности раковых клеток выживать после лечения. Однако концептуальная неясность в отношении фенотипической пластичности осложняет дискуссию. Некоторые случаи пластичности могут быть наследственными и на самом деле являются лишь теоретической проблемой, которая может быть включена для улучшения модели клональной эволюции. Во-первых, фенотип раковых клеток часто зависит от негенетических, но наследуемых свойств, таких как эпимутации. Такое фенотипическое разнообразие, обусловленное эпигенетическими факторами, можно легко интегрировать в модель клональной эволюции путем включения эпимутаций. То же самое должно быть применимо к любому другому негенетическому наследуемому свойству, которое вносит вклад в фенотип клетки.
Во-вторых, степень фенотипической пластичности может быть наследственной и кодироваться в геноме или эпигеноме (обзор приведен в источнике 154). Определенные клеточные линии могут быть более пластичными, чем другие, что дает им преимущество при изменяющихся микроокружениях. Другие клетки имеют удивительно стабильные фенотипы, например, полностью дифференцированные клетки. Некоторые (эпи)мутации могут повышать пластичность клеток, и отбор на эти (эпи)мутации будет происходить косвенно, через прямой отбор на фенотипы, которые они реализуют. Существует соответствующая литература по эволюции частоты мутаций и эволюции фенотипической пластичности, которая может быть использована для интеграции последней в модель клональной эволюции.
В-третьих, фенотипическая пластичность включает в себя целый ряд явлений, таких как дифференциация (устойчивый, направленный, предсказуемый процесс в многоклеточных организмах), реакция на внешние сигналы (также частично предсказуемая, хотя и обусловленная сигналами микроокружения) и стохастические колебания (непредсказуемые).Различия между этими процессами имеют значение, если мы хотим учитывать эмпирические ограничения эволюционного объяснения рака. Причину, по которой эти типы пластичности необходимо концептуально различать, можно проиллюстрировать двумя гипотетическими контрастными примерами. Первый — когда при лечении происходит отбор стволовых клеток из-за их апрегуляции эффлюксных насосов, отбор на них будет поддерживать клональный состав. Это происходит потому, что все генетические клоны содержат раковые стволовые клетки, хотя размер клонов может меняться в зависимости от доли таких стволовых клеток в разных клонах. Второй — если проводится лечение, специфически направленное на одну из фаз клеточного цикла, то отбираются медленно делящиеся или непролиферирующие клетки, и если состояние покоя индуцируются определенным микроокружением, то выживут те клоны, которые окажутся в этом микроокружении. Эти два случая представляют собой разные проблемы для модели клональной эволюции. В первом случае сохранение всех генетических клонов может скрыть происходящий отбор стволовых клеток. Во втором случае устойчивость может быть ошибочно приписана генетике клона, в то время как устойчивость вызвана его местоположением. Другие сценарии, связанные с пластичностью, также могут поставить под сомнение модель клональной эволюции. Например, в модели клональной эволюции единицами отбора считаются стволовые раковые клетки, но так как может происходить дедифференцировка, это позволяет нестволовым клеткам вносить свой вклад в эволюционную динамику.
Хотя фенотипическая пластичность в ответ на внешние стимулы существенно ограничивает фактическую роль клональной эволюции, формы пластичности, основанные на дифференцировке и стохастических флуктуациях, создают скорее теоретические трудности. До тех пор пока дифференциация остается надежной и предсказуемой, этот тип пластичности может быть включен в математические модели клональной эволюции. Аналогично, стохастическая пластичность поддается математическому моделированию и может быть включена в эволюционные модели рака.
Один и тот же фенотип может образовываться разными генотипами
Такие явления — это следствие конвергентной эволюции, фенотипической пластичности или ненаследственных факторов. Селективное давление может отбирать один и тот же фенотип в независимых линиях, что хорошо учитывается в эволюционных моделях рака. Авторы утверждают, что отличительные черты рака — это случаи конвергентной эволюции, которая происходит благодаря естественному отбору, действующему на неродственные клетки. Этот вызов генетической эволюционной модели рака привел к гипотезе, что больше ясности и контроля можно получить, сосредоточившись на эволюции фенотипов. Как утверждалось выше, процессы дифференцировки и реакции на сигналы окружающей среды могут приводить к сходным фенотипам независимо от лежащей в основе генетики. Существуют и другие ненаследственные детерминанты фенотипа, которые могут не зависеть от генетики клонов. Например, формированию злокачественного фенотипа может способствовать транспорт раковыми клетками белков, липидов и нуклеиновых кислот через внеклеточные везикулы. На мышиной модели глиомы было показано, что раковые клетки с мутировавшим EGFR могут передавать укороченныю онкогенную форму EGFRvIII раковым клеткам, лишенным мутации, что приводит к приобретению этими клетками мутантного фенотипа. Различение наследственных и ненаследственных детерминант фенотипа принципиально важно, так как именно ненаследуемые особенности напрямую ставят под вопрос фактический масштаб применимости модели клональной эволюции. В то же время эволюционная теория может учитывать такие ненаследуемые компоненты как форму ненаправленной вариации, вводя в модели фенотипической эволюции меры наследуемости или эволюционируемости признаков.
Предположение 2: линия раковых клеток представляет собой древо.
Модель клональной эволюции предполагает древовидную форму клеточных линий, при которой клеточные линии разделяются и умирают, но не сливаются. Клоны определяются происхождением от одной общей клетки-предшественницы (вставка 1). Наследование происходит вертикально, от материнской клетки. Более того, основание модели клональной эволюции на клеточных линиях неявно предполагает, что клетки являются единственной единицей отбора. Несколько наблюдений ставят под сомнение эти предположения.
Слияние клеток и способы размножения раковых клеток
Раковые клетки могут сливаться в жизнеспособные, размножающиеся клетки, которые могут дать начало клональным популяциям клеток. Слияние клеток при раке считается редким явлением и в основном игнорируется. Однако в ряде исследований сообщалось о слиянии между раковыми и нераковыми клетками (гибридомы - известный случай такого слияния) или между различными раковыми клетками. У пациентов в контексте трансплантации костного мозга были зарегистрированы слияния с гемопоэтическими клетками, что позволяет использовать маркеры для отслеживания слияний клеток. В качестве примера можно привести случай, когда у матери, перенесшей трансплантацию костного мозга от своего сына, впоследствии развилась карцинома почки, причем часть раковых клеток содержала как хромосомные изменения раковых клеток, так и Y-хромосому из клеток ее сына. В другом исследовании были проанализированы биопсии опухолей семи пациентов с различными видами рака (аденокарцинома протоков поджелудочной железы, почечно-клеточная карцинома, плоскоклеточная карцинома головы и шеи и аденокарцинома легкого) и во всех из них были обнаружены признаки слияний между раковыми клетками и лейкоцитами. Опираясь на этот результат, исследователи провели поиск циркулирующих гибридных клеток у пациентов с раком поджелудочной железы и обнаружили, что количество циркулирующих гибридных клеток коррелирует с распространенностью заболевания и ассоциируется с плохим прогнозом, чего нельзя сказать о не слившихся циркулирующих опухолевых клетках. Это позволяет предположить, что слияния могут повышать риск прогрессирования рака.
Роль слияния клеток в эволюции раковых клеток изучалась in vitro и на животных моделях. Гибриды линий раковых клеток и макрофагов, после трансплантации мышам, имели более короткое время удвоения, чем материнская линия раковых клеток, что говорит о том, что слияние клеток может повысить приспособленность клеток. Слияние клеток также может придать раковым клетки новые свойства. Например, слияние с гемопоэтическими клетками, такими как макрофаги, может наделить слившиеся раковые клетки способностью к миграции. В ряде исследований слияние рассматривается как как возможный альтернативный механизм (но не исключающий) дарвиновскому объяснению клональной эволюции метастазов, согласно которому способность к метастазированию приобретается в процессе эволюции путем естественного отбора. Другие исследования показали, что слияние между между линиями раковых клеток может привести к появлению новых клеточных линий, более злокачественные и терапевтически устойчивые, чем исходные. Слияние клеток также обсуждалось как возможный механизм получения раковых стволовых клеток. И наконец, слияние клеток — это механизм, который может генерировать разнообразие за счет последующей стохастической утраты генетического материала. Слияние клеток не компрометирует фактические масштабы клональной эволюции, но добавляет уровень сложности в отношении процессов, вовлеченных в их эволюцию, который в настоящее время не учитывается моделью клональной эволюции.
Горизонтальный перенос генов
Модель клональной эволюции предполагает, что наследование происходит вертикально при делении клеток. Однако существует несколько механизмов горизонтального переноса генов, таких как обмен митохондриями и ДНК. Совместная культура клеточной линии рака легкого, лишенной митохондриальной ДНК (mtDNA), с негематопоэтическими клетками костного мозга или фибробластами кожи, а также трансплантация клеточных линий рака молочной железы, лишенных mtDNA, продемонстрировали восстановление митохондриальной функции за счет переноса митохондрий.
Введение митохондрий из мезенхимальных стромальных клеток (МСК) в раковые клетки приводило к увеличению окислительного фосфорилирования, производства АТФ, а также миграции и пролиферации раковых клеток. Было показано in vitro, что горизонтальный перенос митохондрий через туннельные нанотрубки из эндотелиальных клеток в клетки рака молочной железы MCF7 повышает химиорезистентность к доксорубицину. Аналогичные результаты были также получены при совместном культивировании со стромальными клетками костного мозга in vitro или после приживления острых миелоидных бластных клеток острого миелоидного лейкоза от пациентов или клеточных линий мышей. Совместное культивирование стволовых клеток глиобластомы (СКГ) и МСК также приводило к метаболической перестройке ГСК после переноса митохондрий из МСК в ГСК, что привело к увеличению пролиферации и устойчивости ГСК к темозоломиду.
Горизонтальный перенос генов также может происходить в раке благодаря поглощению ДНК из внеклеточных везикул, включая апоптотические тельца от умирающих раковых клеток. Это было показано in vitro и в экспериментах на мышах и может быть предотвращено путем обработки ДНКазами. Было показано, что микровезикулы переносят онкогены, такие как MYC или HRASV12, которые могут быть поглощены другими клетками. Масштаб и значимость горизонтального переноса генов при раке посредством внеклеточных везикул остаются открытым вопросом. Горизонтальный перенос генов не противоречит эволюционной модели рака, а напротив, усложняет её. Адаптация под действием естественного отбора может происходить не только через горизонтальный перенос в дополнение к вертикальному наследованию.
Трогоцитоз и горизонтальный перенос. Помимо переноса генов, фенотипические свойства также могут горизонтально передаваться через трогоцитоз - механизм переноса фрагментов мембран между клетками. Трогоцитоз является важным явлением для эволюции раковых клеток, поскольку он позволяет клеткам приобретать новые фенотипические свойства независимо от их генетики и эпигенетики, что приводит к несоответствию между генотипом и фенотипом. Например, в мышиной модели рака толстой кишки с использованием человеческих ксенотрансплантатов, раковые клетки приобрели мембранные белки лимфоцитов, включая клеточные маркеры лимфоцитов, а также иммунорегуляторные поверхностные белки, подавляющие активацию иммунных клеток. Аналогичные результаты были получены на мышиной модели лейкемии, хотя в этом исследовании уже естественные клетки-киллеры (NK) и CD8+ T-клетки приобретали рецептор-чекпоинт PD1 (белок 1 программируемой клеточной гибели) из лейкозных клеток, что приводит к подавлению противоопухолевого иммунитета NK-клеток.
Трогоцитоз был вовлечен в избегание от химерных антигенных рецепторов Т (CAR-T) и CAR-NK клеток. Трогоцитоз может иметь значение для клональной эволюции только в том случае, если индуцируемый им фенотип может быть передан хотя бы через одно клеточное деление. Материалы клеточной поверхности частично сохраняются в процессе клеточного деления, но симметрия наследования дочерним клеткам неизвестна, как и число делений, после которых фенотип утрачивается. Еще один процесс, который может придать клеткам свойства, которые изменяют их приспособленность к жизни при определенном селективном давлении — клеточный каннибализм. Например, метастатические клетки меланомы могут каннибализировать Т-клетки, что позволяет им выживать в условиях отсутствия сыворотки. Аналогично было показано, что клеточная линия рака молочной железы каннибализирует мезенхимальные стромальные клетки, что также повышает выживаемость в условиях голодания за счет индукции состояния покоя. Опять же, его вклад в клональную эволюцию зависит от наследуемости этих фенотипов. Горизонтальная передача фенотипов, обусловленных трогоцитозом или клеточным каннибализмом, снижает наследуемость этих фенотипов и тем самым уменьшает фактический масштаб модели клональной эволюции.
Внутриклеточные микроорганизмы
Хотя клональная эволюция относится к эволюции раковых клеток, наличие микроорганизмов (вирусы, бактерии, грибы) внутри раковых клеток может потребовать включения их в клональную эволюцию. Вирусы были связаны с канцерогенезом уже давно, а в случаях, когда они непосредственно вызывают рак и даже интегрируются в раковые геномы, они становятся частью генетического материала, который эволюционирует в раке. Недавние исследования показали, что бактерии и грибы находятся не только вокруг некоторых раковых клеток, но и могут обитать внутри них, и даже было высказано предположение, что большинство внутриопухолевых бактерий являются внутриклеточными и обитают как в раковых, так и в иммунных клетках. Внутриклеточные микроорганизмы могут изменять функциональные свойства и приспособленность клеток-хозяев, тем самым способствуя клональной эволюции. Например, они могут повышать приспособленность раковых клеток: при колоректальном раке бактерии Fusobacterium nucleatum ассоциируются с повышенной опухолегенностью. Fusobacterium-положительные опухоли приживались в ксенотрансплантатных моделях, тогда как отрицательные по Fusobacterium — нет, и это различие устранялось антибиотиками. Бактерии могут подавлять или вызывать иммунные реакции, например, посредством презентации пептидов, а также могут опосредовать устойчивость раковых клеток к терапии, например, через метаболизм химиопрепаратов в неактивную форму. Вирус папилломы человека подавляет несколько механизмов супрессии опухолей и повышает приспособленность неопластических клеток, которые он инфицирует.
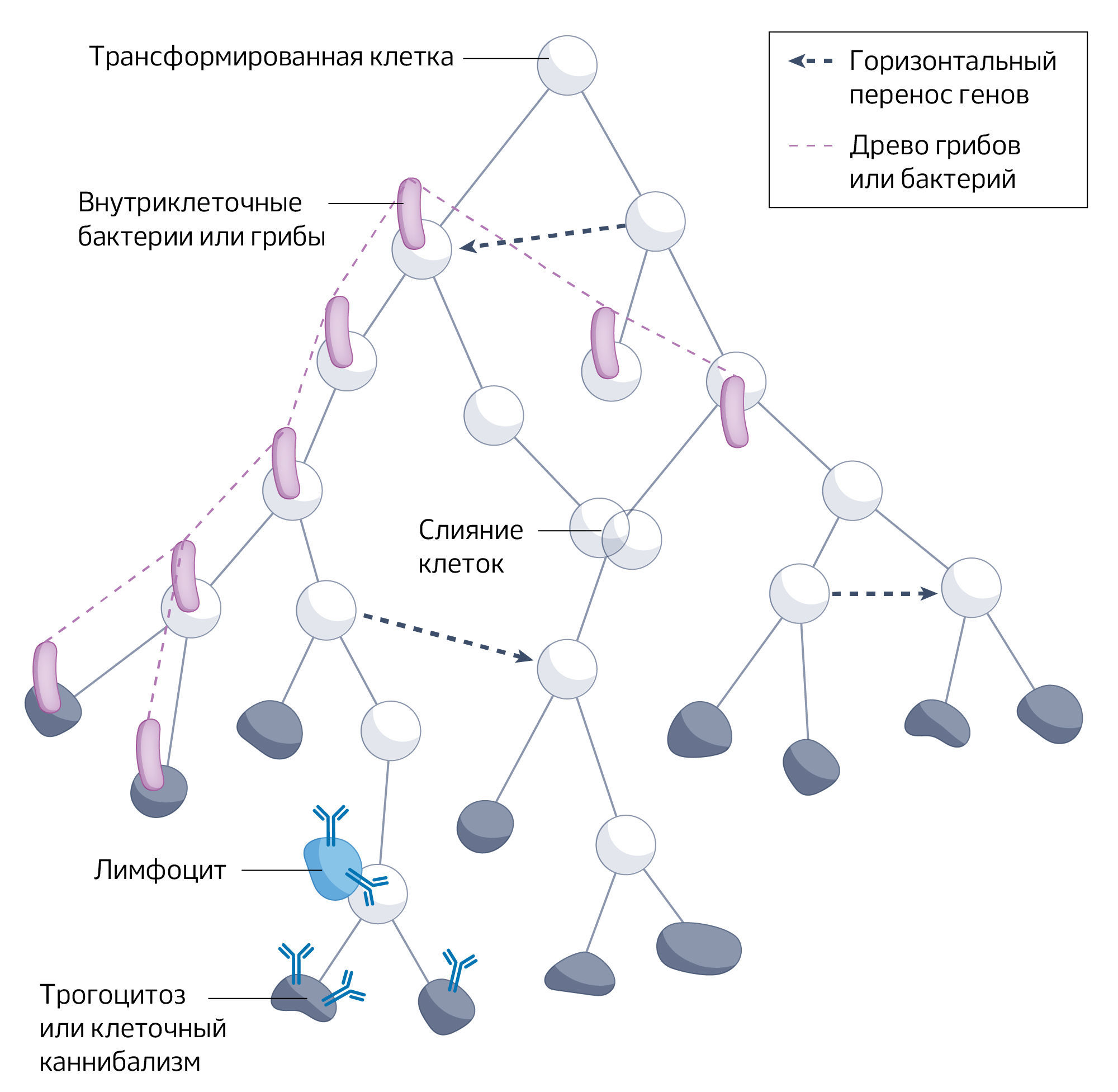
Таким образом, внутриклеточные микроорганизмы могут вносить вклад в клональную эволюцию предсказуемыми способами, которые могут быть реализованы в модели клональной эволюции. Гетерогенное и очаговое распределение внутриклеточных бактерий привело к понятию «микробного внутриклонального разнообразия», когда разная приспособленность раковых клеток одного и того же генетического клона зависит от присутствия внутриклеточных бактерий. Однако существуют теоретические проблемы, препятствующие интеграции роли микроорганизмов в клональную эволюцию. Одна из них — способ передачи этих микроорганизмов. Они могут передаваться как вертикально и, таким образом, представлять собой просто субклон инфицированных раковых клеток, так и горизонтально, переходя от одной клетки к другой. Во втором случае они ставят под сомнение древовидную форму наследственности у раковых клеток. Кроме того, сами бактерии могут претерпевать собственную эволюционную динамику. Биоинформационный анализ метаболической активности внутриопухолевых бактерий позволил предположить, что бактерии находятся под собственным селективным давлением, формируемым опухолевыми клетками и их микроокружением. Таким образом, на линии раковых клеток и линии микроорганизмов могут действовать различные селективные процессы, а эволюция раковых клеток может представлять собой не простое ветвящееся дерево, а включать слияние и передачу признаков между ветвями (рис. 3). Генетическое и негенетическое наследование может быть не только вертикальным, но и иногда горизонтальным. Кроме того, клональная эволюция может касаться не только раковых клеток, но и внутриклеточных бактерий и грибов, которые могут изменять приспособленность раковых клеток. Эти механизмы ставят под сомнение в первую очередь теоретическую эффективность существующей модели клональной эволюции, но не фактическую степень участия раковых клеток в эволюции. Таким образом, они открывают возможности для улучшения теоретической мощности модели клональной эволюции.
Совершенствование теории рака
Проблемы и ограничения модели клональной эволюции, рассмотренные в разделе «Предположения и ограничения модели», дают возможность возможности для улучшения модели. Мы сосредоточимся на четырех потенциальных расширениях модели клональной эволюции: разнообразие и временные рамки наследования за пределами генетики, фенотипическая пластичность, модели сетчатой эволюции, и концепция клона.
Наследственность и временные масштабы
Наследственность — центральное понятие для любой эволюционной теории. Эволюция невозможна без наследования. Однако наследование имеет нечеткое определение, которое является предметом спора. Было предложено несколько классификаций форм наследования. Например, различают внутренние и внешние каналы наследования. Внутреннее наследование включает факторы, которые передаются при делении клеток (или слиянии клеток), такие как генетическое и эпигенетическое наследование. Внешнее наследование включает все передачи информации, которые не передаются через деление клеток. Внутреннее наследование можно проследить по клеточным линиям, в то время как внешнее наследование — нет. Генетические модели наследования сравнительно просто адаптировать к эпигенетическим, по крайней мере когда речь идет о случайно изменяющихся эпигенетических состояниях. Однако внутреннее наследование может также выходить за рамки генетики и эпигенетики. Одним из подходов к изучению наследуемых фенотипов, являющихся ни генетическими, ни эпигенетическими, может быть количественная оценка их наследуемости с использованием уравнения селекционера (breeder’s equation). Измеряя изменения фенотипа раковых клеток (in vitro или in vivo) в различных временных масштабах и при различных селективных давлениях, онкобиологи могли бы количественно определить степень наследственности интересующего фенотипа. Это позволит учесть как внутренние, так и внешние способы наследования, включая не(эпи)генетическое наследование в цитоплазме и строение ниши. Обратите внимание, что эти меры наследственности зависят от степени наследственной изменчивости в популяции. Фенотип может быть наследуемым, но не будет казаться таковым, если в популяции отсутствует вариабельность субстратов, кодирующих этот фенотип.
В раке существует внешнее наследование, по крайней мере, через создание ниш. Существует форма коэволюции между организмами и нишами, которые они изменяют. Эта коэволюция может быть представлена в формальных моделях эволюции. Когда неопластические клетки участвуют в строительстве ниши, активируя фибробласты, привлекая иммунные клетки, индуцируя ангиогенез и иным образом изменяя свое микроокружение, они генерируют форму внешнего наследования, которая изменяет давление отбора на себя и, таким образом, изменяет их собственные эволюционные траектории. Временные рамки такого внешнего наследования могут быть длительным. Например, активированные фибробласты могут сохранять свой проопухолевый фенотип даже в отсутствие раковых клеток, через аутокринные петли, эпигенетические изменения и даже генетические изменения и даже генетические изменения. Были предприняты усилия, чтобы начать интегрировать экологию в модель клональной эволюции, но учет создания ниш остается сложной задачей.
Также ведутся споры о том, какой вид наследования имеет большее значение. Один из аргументов заключается в том, что существует причинная асимметрия между факторами, передающимися в течение многих поколений, и факторами, передающимися в течение одного поколения, причем первые играют более существенную роль в эволюции, поскольку они могут накапливаться в течение длительных периодов времени под действием естественного отбора. Однако при раке селективное давление изменяется в совершенно иных временных масштабах. Старение медленно изменяет селективный ландшафт в течение десятилетий. Отличительные признаки рака, необходимые для трансформации, должны сохраняться в течение всего периода неопластической прогрессии, который может занимать десятилетия. Краткосрочные формы наследования не смогут внести значимый вклад в эти длительные процессы эволюции путем естественного отбора. Однако существуют и другие барьеры на пути неопластической прогрессии, например выживание в кровотоке при метастазировании, который, вероятно, необходимо преодолевать лишь в течение нескольких часов или дней. В этом случае наследование некоторых ключевых белков от родительской клетки или наличие ниши, например скопления неопластических клеток, которые могут безопасно перемещаться по кровотоку, может продлиться достаточно долго, чтобы доставить неопластическую клетку в новое метастатическое микроокружение. Аналогичным образом, такие методы лечения, как радиотерапия и химиотерапия, которые оказывают интенсивное селективное давление на раковые клетки, часто применяются в течение всего нескольких поколений клеток, что сходно с временными рамками цитоплазматического наследования. Ориентация на генетическую клональную эволюцию может лишь частично отражать события эволюции, происходящие в короткие сроки, и в этом отношении улучшить модель можно несколькими способами. Один из подходов предполагает реконструкцию клональной эволюции с помощью различных молекулярных часов. Изменения в ДНК, вариантах числа копий (CNV) и однонуклеотидных вариантах (SNV) в основном накапливаются годами. Метилирование CpG-сайтов происходит быстрее, чем SNV, хотя эти скорости могут существенно различаться в зависимости от конкретного участка генома. Другие эпигенетические модификации гистонов или клеточного состояния, происходящие через сигнальную трансдукцию и переходы к новым аттракторным состояниям в генетической регуляторной сети могут происходить быстро и потому могут требовать введения собственных молекулярных часов в моделях клональной эволюции. Будущие исследования должны охарактеризовать временные шкалы различных механизмов наследования (рис. 4). Любое фенотипическое изменение, которое длится меньше, чем продолжительность жизни клетки, не может быть значимым наследуемым свойством для клональной эволюции. Любое фенотипическое изменение, которое длится меньше, чем время действия селективного давления, будет оказывать незначительное влияние на эволюцию клеточной популяции в ответ на это давление. В отличие от этого, механизмы наследования, вызывающие фенотипические изменения, которые длятся столько же или дольше, чем селективное давление, будут важны для реакции популяции на это давление, пока в популяции клеток существует соответствующая вариабельность. Существуют математические методы для разделения различных форм наследования, включая генетическое, эпигенетическое и экологическое наследование.

Фенотипическая пластичность
Фенотипическая пластичность может ослабить связь между генотипами и фенотипами, снижая наследуемость фенотипа и, тем самым ослабляя действие естественного отбора. Однако фенотипическая пластичность сама по себе может рассматриваться как адаптивный фенотип и также может эволюционировать под действием естественного отбора. По крайней мере, одна историческая теоретическая база поддерживает вклад фенотипической пластичности в генетическую эволюцию: эффект Болдуина — процесс, при котором первоначальная фенотипическое приспособление впоследствии усиливается генетической адаптацией. Эффект Болдуина, в его упрощенной форме, означает трехступенчатый процесс: сначала некоторые особи (в нашем случае раковые клетки) приспосабливаются к изменениям окружающей среды посредством фенотипической пластичности. Эта начальная фаза фенотипической пластичности позволяет некоторым особям избежать вымирания. Во-вторых, в выжившей популяции происходят некоторые генетические (и, следовательно, наследственные) изменения, которые позволяют ей выжить в новой среде без необходимости “платить” за фенотипическую пластичность. В-третьих, эти генетически обусловленные фенотипы получают преимущественно в результате естественного отбора и в конечном итоге распространяются в популяции, поскольку достигают тех же или более подходящих фенотипов, чем фенотипически пластичные особи, без без необходимости платить за пластичность, которая может быть метаболически требовательным процессом. Таким образом, эффект Болдуина - это частный случай, когда адаптация, изначально индивидуальная и ненаследственная, становится наследственной и отбирается. В ряде исследований предлагаются механизмы первоначальной фенотипической адаптации, которые впоследствии подвергаются генетическому отбору. Например, при воздействии ингибиторов EGFR большинство клеток рака легких с EGFR-мутацией погибает, но некоторые из них могут выжить благодаря фенотипической адаптации, переходя в персистирующее состояние. Секвенирование и лекарственный скрининг для рецидивирующих клонов, развившихся из персистирующих клеток одного первоначального клона с EGFR-мутацией, выявили вторичный отбор гетерогенных механизмов резистентности, что указывает на пример эффекта Болдуина.
Аналогичным образом было отмечено, что в ряде случаев мутация резистентности EGFR T790M отсутствует на момент начала терапии и может возникать впоследствии из персистирующих клеток. Персистирующие клетки при этом не обязательно находятся в состоянии покоя. Кратковременное воздействие винкристина может активировать эффлюксные насосы, которые защищают клетки от препарата, позволяя им сохраняться в активно пролиферирующем состоянии. Эта активация стабильно наследуется эпигенетическими модификациями, которые впоследствии могут быть стабилизированы генетическими изменениями. Эффект Болдуина долгое время игнорировался в эволюционной биологии как второстепенное явление, которое просто «выигрывает время» и, таким образом, представляет интерес только в тех случаях, когда селективное давление меняется слишком быстро, чтобы традиционный процесс вариации и отбора не успевает привести к адаптации. Рак - как раз одна из тех ситуаций, когда селективное давление может меняться быстро (например, с началом лечения), и выигрыш времени может стать важнейшим эволюционным механизмом, который можно поместить в модель клональной эволюции.
Ретикуляция, интрогрессия и открытые линии
Обычно предполагается, что клеточные линии образуют древо, но, как обсуждалось в разделе «Предположение 2: линия раковых клеток представляет собой древо», может происходить слияние раковых клеток, и наследование может быть горизонтальным, с возможной передачей митохондрий, внехромосомной ДНК, фрагментов клеток, таких как мембраны, или внутриклеточных бактерий и грибов. Эти процессы нарушают предположение о древовидности и влияют на филогенетическую реконструкцию, поскольку клеточное древо не обязательно совпадает с деревьями отдельных генов (рис. 3). Это также влияет на деконволюцию клонов в массовых анализах поскольку горизонтальный перенос генов и слияние клеток нарушают многие из предположений, на которых основаны эти алгоритмы. В пределах одной клеточной линии могут сосуществовать несколько несогласующихся генетических деревьев, отражающих разнообразные потоки генов, возникающие в результате всех этих независимых процессов. Подобные нарушения линий встречаются у прокариот, что привело к появлению концепции сетчатой (reticulate) эволюции. Явление ретикуляции заставило многих утверждать, что древо жизни жизни является искажением. Возможно, правильнее представлять эволюцию как сеть или паутину переплетающихся ветвей. Были разработаны и использованы различные показатели, такие как факторы согласованности и индексы разнообразия для “бескорневых” деревьев, а также созданы новые вычислительные методы и статистические подходы для выявления латерального переноса и анализа филогенетических сетей. В целом пересмотренный взгляд на эволюцию, который сложился вокруг сетчатой эволюции, требует многоуровневой перспективы, иногда также называемой интегративной эволюцией, в рамках которой в наблюдаемое разнообразие вносят вклад множество генетических миров. Эти концептуальные и вычислительные инструменты открывают возможности для улучшения нашего понимания клональной эволюции. Учитывая, что горизонтальный перенос генетического материала может служить эволюционным “коротким путем” к приобретению функциональных адаптаций, таких как способность к метастазированию или множественная лекарственная устойчивость, важно оценивать последствия подобных сетевых событий в прогрессировании рака и переходить к интегративной модели клональной эволюции.
Количественная оценка клонального разнообразия
Подсчет клонов как косвенный показатель внутриопухолевой гетерогенности и эволюции раковых клеток основан на двух неявных предположениях: что клетки внутри клона однородны (внутриклональная однородность) и отличаются от клеток других клонов (межклональная гетерогенность), так что их их количество отражает разнообразие популяции опухолевых клеток. Однако, как уже говорилось во вставке 1, эти предположения могут быть спорными (рис. 2). Если мы используем мутации для разграничения клонов (рис. 2а), то существует три клона и, следовательно, три соответствующие популяции раковых клеток с отличительными характеристиками. Однако есть и другое разграничение клонов с помощью эпигенетики (рис. 2b), а их интеграция (рис. 2d) позволяет предположить, что существует существует более трех релевантных популяций раковых клеток.
Можно измерить степень внутриклоновой гомогенности и межклоновой гетерогенности. Это можно сделать для любого фенотипического или генотипического показателя, измеряя расстояние между любыми двумя клетками внутри и между клонами. Например, при оценке транскриптомного разнообразия внутри клональных линий с наследуемой молекулярной маркировкой (barcoded lineages) в трех мышиных моделях острого миелоидного лейкоза было показано, что клоны определенно не являются однородными, поскольку секвенирование РНК отдельных клеток чаще выявляет “размытые” распределения клеток в фенотипическом пространстве, а не плотные кластеры. Напротив, в другом исследовании на клетках меланомы человека была выявлена высокая внутриклональная однородность внутри маркированных клональных линий и выраженная межклональная гетерогенность между такими линиями. Для измерения клонального разнообразия также может быть использован геномный анализ отдельных клеток. В одном из анализов профилирование числа копий в двух случаях рака молочной железы выявило наличие лишь нескольких клонов, характеризующихся низкой внутриклональной вариабельностью и высокой степенью межклональных различий. Напротив, та же группа исследователей в двух других случаях рака молочной железы обнаружила чрезвычайно высокое геномное разнообразие точечных мутаций. От подсчета клонов вообще можно отказаться. Поскольку число клонов служит лишь косвенным показателем структуры и степени генетического разнообразия опухоли, его можно заменить другими способами описания этого разнообразия. Так, если эволюционные отношения между образцами удается реконструировать в виде дерева, то существует целый ряд характеристик такого дерева, которые могут быть более чувствительными и информативными показателями генетического разнообразия, чем простое количество клонов. Более того, некоторые из этих показателей позволяют судить о популяционной динамике и процессах отбора внутри опухоли.
Выводы
Несомненно, соматические клетки подвергаются эволюционным процессам, включая как генетический дрейф, так и естественный отбор. Они приобретают наследственные изменения, некоторые из которых влияют на их размножение и выживание. Факт способности раковых клеток к эволюции был осознан в 1950-х годах и изучается в течение XXI века. Однако вопрос о том, в какой степени насколько эволюционные процессы объясняют рак, остается открытым для дискуссий. Успех эволюционной теории в объяснении многих явлений рака, а также для разработки более эффективных мер вмешательства, ясно показывает полезность теории. Но также очевидно, что возникновению рака способствуют неэволюционные механизмы. Роль эволюционных и неэволюционных механизмов в развитии рака в этой области изучается в настоящее время. Важно отметить, что это невозможно сделать, если мы не будем четко определять границы между эволюционными и неэволюционными механизмами. Сегодня существует множество теорий и моделей рака и их интеграция представляет собой весьма сложную задачу. Неясно, какие из них совместимы или не совместимы с эволюционными теориями. В целом, другие теории рака, такие как теория раковых стволовых клеток, атавистическая теория и теория незаживающей раны, описывают биологические ограничения и возможности, в рамках которых происходит эволюция соматических клеток. Чтобы решить эту проблему, мы сосредоточились на границах эволюционных процессов, выделяя два вида границ: теоретические и фактические (рис. 5). Фактические границы эволюционной динамики рака выходят за рамки существующей теории, и эволюционная теория рака должна быть расширена, чтобы учесть фенотипическую пластичность, альтернативные способы наследования, горизонтальный перенос генов, слияние клеточных линий и более точные маркеры клонального разнообразия. Об этих явлениях и их относительной важности в раке предстоит узнать еще многое. Усовершенствованная эволюционная теория рака должна в конечном итоге привести к улучшению прогнозирования, прогноза и лечения рака.
