Ключевые признаки рака: следующее поколение

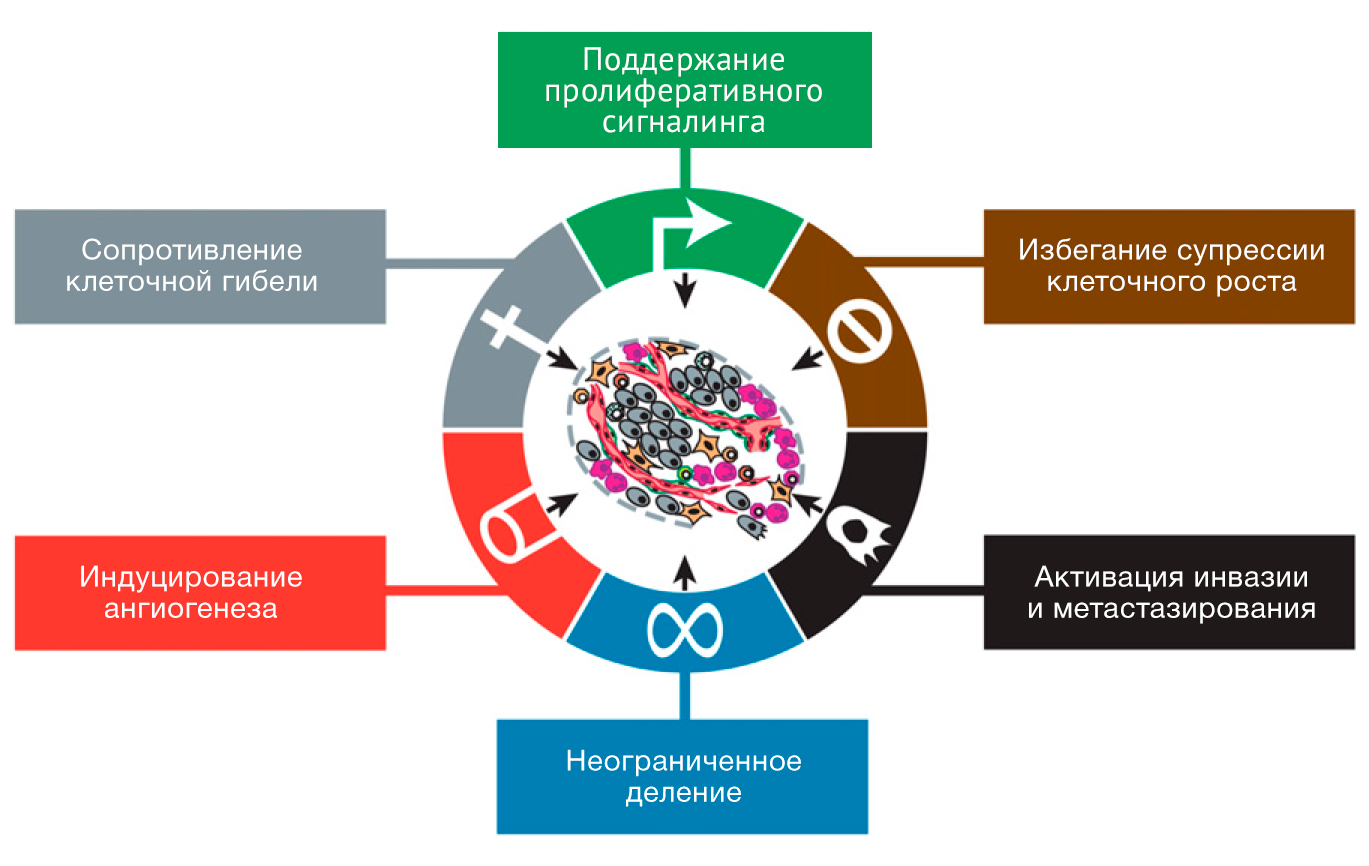
Существуют шесть характерных, или ключевых для рака признаков (особенностей, способностей, черт), приобретаемых им в ходе многоступенчатого процесса опухолевого развития. Эти признаки служат основой для понимания всей сложности неопластического заболевания. Они включают в себя: поддержание пролиферативного сигналинга, избегание супрессии (угнетения) клеточного роста, сопротивление клеточной гибели, неограниченное деление («клеточное бессмертие»), индуцирование ангиогенеза (прорастания новых сосудов), активация инвазии (проникновения в окружающие ткани) и метастазирования. В основе этих признаков лежит нестабильность генома, которая создаёт генетическое разнообразие, ускоряющее их приобретение, а также воспаление, которое усиливает их проявления. В результате достигнутого за последнее десятилетие прогресса к этому списку были добавлены еще два новых признака – перепрограммирование энергетического метаболизма и избегание уничтожения со стороны иммунной системы. Наряду с опухолевыми клетками неоплазии демонстрируют другой аспект сложности: они содержат пул мобилизованных якобы нормальных клеток, способствующих приобретению отличительных черт путем формирования «опухолевого микроокружения». Признание повсеместной применимости этих концепций будет оказывать всё большее влияние на развитие новых стратегий в лечении рака у человека.
ВВЕДЕНИЕ
Мы предположили, что шесть признаков рака вместе формируют ключевой организационный принцип, который обеспечивает логическую основу для понимания значительного разнообразия неопластических заболеваний (Hanahan and Weinberg, 2000). Подразумевалось, что, когда нормальные клетки постепенно развиваются до неопластического состояния, они приобретают набор этих отличительных признаков и что многоступенчатый процесс опухолевого патогенеза у человека может обосновываться необходимостью для ранних опухолевых клеток приобретать черты, ведущие к онкогенезу и в конечном итоге к малигнизации.
В качестве дополнительного утверждения мы отметили, что опухоли – нечто большее, чем просто ограниченное скопление пролиферирующих опухолевых клеток. Напротив, это сложные ткани, состоящие из многих различных клеточных типов, участвующих в гетеротипических взаимодействиях друг с другом. Мы описали мобилизованные здоровые клетки, которые формируют ассоциированную с опухолью строму, становясь активными участниками опухолеобразования; по существу, эти стромальные клетки способствуют развитию и проявлению некоторых отличительных признаков. В течение последующего десятилетия это представление утвердилось и расширилось; это дало всем понять, что биология опухолей более не может пониматься просто как перечисление признаков опухолевых клеток, но вместо этого должен учитываться вклад «опухолевого микроокружения» в процесс опухолегенеза.
В ходе появления заметного прогресса в исследованиях рака после этой публикации, новые наблюдения способствовали уточнению и видоизменению оригинальных формулировок отличительных признаков. Помимо этого, другие наблюдения подняли вопросы и подчеркнули механистические концепции, которые не являлись основной задачей нашей оригинальной разработки отличительных характеристик.
Мотивируясь этими разработками, мы теперь пересматриваем первоначальные отличительные черты с учётом новых, которые могут быть включены в вышеизложенный список, и расширяем функциональную роль и вклад мобилизируемых стромальных клеток в биологию опухоли.
КЛЮЧЕВЫЕ ПРИЗНАКИ: ДОСТИЖЕНИЯ
Шесть отличительных способностей рака – уникальные и взаимодополняющие признаки, которые активируют опухолевый рост и распространение метастазов – продолжают обеспечивать твердую основу для понимания биологии рака (Рисунок 1; см. Дополнительная информация для версий рисунков к презентациям, доступных к скачиванию). В первой части данного обзора мы обобщаем суть каждого отличительного признака так, как они были описаны в оригинальной версии 2000-ого г., дополняя их открытиями (выделены в подзаголовках курсивом), сделанными за последнее десятилетие, в понимании механизмов, лежащих в их основе. В последующих разделах мы рассмотрим новые разработки, которые расширяют наши границы понимания темы, описывая, в свою очередь, две важнейшие характеристики, играющие ключевую роль для приобретения всех шести отличительных признаков, а также два совершенно новых признака, устройство и сигнальные взаимодействия опухолевого микроокружения, которые принципиально важны для формирования ракового фенотипа; наконец, мы обсудим новый фронт терапевтического применения этих концепций.
Поддержание пролиферативного сигналинга
Пожалуй, наиболее фундаментальным признаком опухолевых клеток следует назвать их способность к поддержанию постоянной пролиферации. Нормальные ткани внимательно контролируют продукцию и высвобождение ростовых сигналов, которые дают указание вступать в клеточный цикл роста и деления, тем самым обеспечивая гомеостаз клетки и таким образом поддерживая нормальную тканевую архитектуру и правильное функционирование. Опухолевые клетки, нарушая регуляцию этих сигналов, сами становятся хозяевами своей судьбы. Активирующие сигналы передаются в значительной степени за счет факторов роста, связывающихся с рецепторами на клеточной поверхности, как правило, содержащими внутриклеточные тирозинкиназные домены. Эти рецепторы опосредуют передачу сигналов через разветвленные внутриклеточные сигнальные пути, которые регулируют развитие клетки посредством влияния на клеточный цикл, а также рост клетки (увеличение в размерах); зачастую эти сигналы влияют также и на другие клеточные свойства, такие как выживаемость клеток и энергетический метаболизм.
Примечательно, что сама сущность и источники пролиферативных сигналов, действующих внутри нормальных тканей, были плохо изучены ещё с десяток лет назад, и, в целом, всё остаётся по-прежнему. Более того, мы до сих пор знаем относительно мало о механизмах регуляции высвобождения этих митогенных (т.е. инициирующих митоз) сигналов. Понимание этих механизмов осложняется отчасти тем фактом, что факторы роста, обеспечивающие контроль за количеством клеток и их расположением внутри тканей, как ранее считалось, передаются временно и пространственно регулирующимся образом от одной клетки к её соседу; такая паракринная сигнализация сложна для экспериментального исследования. Кроме того, биодоступность факторов роста регулируется их связыванием в околоклеточном пространстве и внеклеточном матриксе, а также благодаря действию сложной сети протеаз, сульфатаз и, вероятно, других ферментов, которые высвобождают и активируют их, по-видимому, в очень специфичной и локализированной манере.
Митогенная сигнализация в опухолевых клетках, напротив, изучена гораздо лучше (Lemmon and Schlessinger, 2010; Witsch et al., 2010; Hynes and MacDonald, 2009; Perona, 2006). Опухолевые клетки могут приобретать способность к поддержанию своего пролиферативного сигналинга по некоторым альтернативным путям: они могут производить собственные факторы роста, на которые будут сами же и реагировать посредством экспрессии соответствующих рецепторов, получая в результате аутокринную пролиферативную стимуляцию. С другой стороны, опухолевые клетки могут посылать сигналы для стимулирования нормальных клеток в пределах опухоль-ассоциированной стромы, которые, в свою очередь, обеспечивают их различными факторами роста. Рецепторная сигнальная трансдукция также может быть нарушена вследствие повышения концентрации рецепторных белков, представленных на поверхности опухолевой клетки, что делает такие клетки гиперчувствительными к факторам роста, число которых было лимитировано другими путями; тот же итог может наблюдаться из-за структурных изменений в молекулах рецептора, что способствует лиганд-независимой активации.
Независимость от факторов роста также может проистекать из-за нерегулируемой (конститутивной) активации компонентов сигнальных путей, включающихся после активации рецептора; тем самым, устраняется необходимость стимулировать данные пути активацией лиганд-зависимых рецепторов. Учитывая, что ряд определенных нисходящих сигнальных путей расходится от лиганд-стимулированного рецептора, активация какого-либо из этих путей – например, отвечающего на переносчик Ras-сигнала, – может лишь повторить тот перечень инструкций по регуляции, который был передан от активированного рецептора.
Соматические мутации активируют дополнительные нисходящие сигнальные пути
Высокопроизводительное секвенирование ДНК (High-throughput DNA sequencing analyse) геномов опухолевых клеток выявило соматические мутации в некоторых опухолях человека, которые предопределяют нерегулируемую активацию сигнальных цепочек, обычно запускаемых активированными рецепторами факторов роста. Таким образом, теперь мы знаем, что ≈40% меланом человека содержат активирующие мутации, затрагивающие структуру В-Raf белка, в результате чего происходит нерегулируемая передача сигнала через Raf на путь активируемой митогенами протеинкиназы (МАР-киназы) (Davies and Samuels 2010). Сходным образом мутации в каталитической субъединице изоформ фосфоинозитид-3-киназы (PI3-киназы) обнаруживаются в некоторых типах опухолей, которые служат для гиперактивации сигнальной схемы PI3-киназы, в том числе её ключевого сигнального переносчика Akt/PKB (Jiang and Liu, 2009; Yuan and Cantley, 2008). Преимущества для опухолевой клетки в активировании восходящей (рецептор), вместо нисходящей (переносчик) сигнальной передачи до сих пор остаются неясными, как и функциональное влияние перекрёстных связей между несколькими путями, расходящимися от рецепторов к факторам роста.
Нарушения в механизмах отрицательной обратной связи, ослабляющие пролиферативный сигналинг
Недавние результаты некоторых исследований выявили важность петель отрицательной обратной связи, которые в норме действуют с эффектом ослабления различных типов сигнальной передачи и тем самым обеспечивают гомеостатическую регуляцию потока сигналов, проходящих через внутриклеточные схемы взаимодействий (Wertz and Dixit, 2010; Cabrita and Christofori, 2008; Amit et al., 2007; Mosesson et al., 2008). Дефекты в этих механизмах обратной связи способны усилить пролиферативный сигналинг. Типичный пример этого вида регуляции включает в себя опухолевый белок (онкопротеин) Ras: онкогенный эффект Ras-белка не вызывается гиперактивацей его сигнальных влияний; напротив, онкогенные мутации, затрагивающие гены ras, подрывают активность Ras-ГТФазы, действующей в качестве внутреннего механизма отрицательной обратной связи, который обычно обеспечивает непродолжительность активной передачи сигнала.
Аналогичные механизмы отрицательной обратной связи действуют на множество узлов в составе схем пролиферативной сигнальной трансдукции. Типичный пример: фосфатаза PTEN, противодействующая PI3-киназе посредством разрушения его продукта фосфатидилинозитол-(3,4,5)-фосфата (PIP3). Мутации потери функции (loss-of-function mutations) в PTEN усиливают PI3-киназный сигналинг и способствуют опухолеобразованию в различных экспериментальных моделях рака; в опухолях человека экспрессия PTEN зачастую бывает потеряна из-за метилирования промотора (Jiang and Liu, 2009; Yuan and Cantley, 2008).
Другой пример: mTOR-киназа, координатор клеточного роста и метаболизма, которая относится к сигнальному пути PI3-киназы и участвует в передаче сигнала как в восходящем, так и нисходящем направлениях. В схемах трансдукции некоторых опухолевых клеток активация mTOR приводит к ингибированию PI3K-сигналинга путем отрицательной обратной связи. Таким образом, когда mTOR в таких опухолевых клетках инактивирована лекарственными препаратами (например, лекарством рапамицин), связанная с этим потеря отрицательной обратной связи влечёт повышение активности PI3-киназы и его эффектора Akt/PKB, тем самым притупляя антипролиферативный эффект от ингибирования с помощью mTOR (Sudarsanam and Johnson, 2010; O’Reilly et al., 2006). Вполне вероятно, что нарушенные цепи отрицательной обратной связи в этом и других сигнальных путях являются широко распространенными среди опухолевых клеток и служат важным средством, благодаря которому эти клетки способны приобретать пролиферативную независимость. Более того, нарушение такого самозатухающего сигналинга может привести к развитию приобретенной устойчивости к препаратам, направленным на митогенную активацию.
Чрезмерный пролиферативный сигналинг ведёт к клеточному старению
Работы, посвященные механизму действия онкогенов, проведённые ранее, поддерживают представление о том, что постоянно возрастающая экспрессия таких генов и их белковых продуктов повлекут за собой, соответственно, повышенную пролиферацию опухолевых клеток и, следовательно, опухолевый рост. Более раннее исследование разрушило такое представление в том смысле, что сигнальный путь, чрезмерно активированный такими онкобелками, как RAS, MYC и RAF, может провоцировать обратный эффект со стороны клеток, а именно специфическую индукцию клеточного старения и/или апоптоза (Collado and Serrano, 2010; Evan and d’Adda di Fagagna, 2009; Lowe et al., 2004). Например, культивированные клетки, экспрессирующие высокие уровни онкобелка Ras, могут входить в непролиферативное, но жизнеспособное состояние – физиологическое старение; напротив, клетки, экспрессирующие этот белок в более низких количествах, способны предотвращать старение и переходить к пролиферации.
Клетки с морфологическими особенностями старения, включая увеличенную цитоплазму, отсутствие маркёров пролиферации и экспрессию индуцированного старением фермента бета-галактозидазы, присутствуют в большом количестве в тканях мышей генетических линий с повышенной экспрессией некоторых онкогенов (Collado and Serrano, 2010; Evan and d’Adda di Fagagna, 2009), а также представлены при некоторых типах меланом (Mooi and Peeper, 2006). Такие, на первый взгляд, парадоксальные, реакции, по-видимому, отражают состояние механизмов внутриклеточной защиты, направленных на элиминацию клеток, испытывающих чрезмерные уровни некоторых типов сигналинга. Кроме того, относительная интенсивность онкогенного сигналинга в опухолевых клетках может отражать баланс между максимальной митогенной стимуляцией и избеганием клеточных защитных механизмов, запрещающих пролиферацию. В противовес этому некоторые опухолевые клетки адаптируются к интенсивному онкогенному сигналингу посредством подавления его путей индуцирования старения или апоптоза.
Избегание супрессоров клеточного роста
Помимо одной из ключевых способностей опухолевых клеток, заключающейся в индуцировании и поддержании активности сигналов-стимуляторов роста, такие клетки могут нарушать функционирование мощных программ, ингибирующих клеточную пролиферацию; многие из этих программ зависят от определённых генов-онкосупрессоров. Целые дюжины онкосупрессоров, действующих в различных направлениях с общей целью ограничения клеточного роста и пролиферации, были идентифицированы по их характерному инактивированию в той или иной форме рака животных или человека; многие из подобных генов были определены как истинные (bona fide) онкосупрессоры в экспериментах на мышах (создание линий с мутациями потери функции и приобретения функции). Два классических онкосупрессора, кодирующие соответственно RB-белок (ассоциированный с ретинобластомой, белок ретинобластомы) и белок р53 (продукт гена ТР-53), действуют как центральные контрольные узлы в двух ключевых схемах клеточной регуляции, определяющих, стоит ли запускать в клетке программу пролиферации, или же активировать физиологическое старение и путь апоптоза.
Белок ретинобластомы собирает сигналы от различных вне- и внутриклеточных источников и решает: следует ли клетке пройти через цикл деления (Burkhart and Sage, 2008; Deshpande et al., 2005; Sherr and McCormick, 2002). Таким образом, опухолевые клетки с дефектами в функционировании пути RB-белка теряют критическую систему регуляции клеточного цикла, отсутствие которой вызывает неконтролируемую клеточную пролиферацию. Тогда как белок ретинобластомы проводит сигналы ингибирования роста, возникающие преимущественно вне клетки; ген ТР-53 получает данные от сенсоров стресса, функционирующих в пределах внутриклеточных рабочих систем: если степень повреждения генома выше допустимого порога, или же если уровни оксигенации, содержания глюкозы, нуклеотидного пула, сигналов-стимуляторов роста недостаточны, в таких случаях ген ТР53 способен вызвать остановку клеточного цикла до тех пор, пока эти условия не нормализуются. Напротив, при активации сигналов тревоги, свидетельствующих о чрезмерном и некорректируемом повреждении, ТР53 может запускать апоптоз. Следует заметить, что различные эффекты активированного ТР53 сложны и сильно зависят от ситуации, варьируя в разных клеточных типах; также эффекты отличаются в зависимости от суровости и длительности состояния клеточного стресса и повреждения генома.
Несмотря на то что два каноничных супрессора пролиферации – ТР53 и RB-белок – являются наиболее важными в регуляции клеточной пролиферации, различные данные свидетельствуют, что каждый из них действует как часть большого механизма, который предназначен для функциональной избыточности. К примеру, химерные мыши, которым по всему телу трансплантировали клетки с отсутствием функционального гена Rb, неожиданно оказываются свободны от пролиферативных отклонений, хотя ожидалось, что потеря функции RB станет причиной продолжительной активации клеточного деления; некоторые из получившихся кластеров клеток без Rb, или нуль-клеток (null cells), по всем правилам должны прогрессировать в неоплазии. Вместо этого такие нуль-клетки в подобных химерных мышах участвуют в морфогенезе относительно здоровых тканей; единственная неоплазия, которая наблюдалась, была опухолью гипофиза в конце жизни (Lipinski and Jacks, 1999). Сходным образом мыши «нулевые» по ТР53, развиваясь, демонстрируют преимущественно нормальный клеточный и тканевой гомеостаз, а отклонения, как и в первом случае, появляются на поздних сроках, это лейкемии и саркомы (Ghebranious and Donehower, 1998). Оба примера должны отражать функционирование избыточно действующих механизмов, которые вызывают неадекватную репликацию клеток, у которых отсутствуют эти супрессоры пролиферации.
Механизмы контактного торможения и его избегания
Четыре десятилетия исследований показали, что межклеточные контакты, образованные популяциями нормальных клеток и разведённые в двумерной культуре, подавляют дальнейшую клеточную пролиферацию, формируя слившийся монослой. Важно, что такое «контактное торможение» устраняется в культуре клеток многих типов рака, предполагая, что контактное торможение это in vitro-подобие механизма, действующее in vivo для обеспечения нормального гомеостаза тканей; оно подавлено при опухолеобразовании. До недавних пор механизм, объясняющий этот способ контроля роста, оставался неизвестным. Теперь, однако, эти механизмы начинают постепенно проясняться.
Один из механизмов включает продукт гена NF2, продолжительное время считавшийся супрессором опухоли из-за того, что его потеря ведёт к нейрофиброматозу. Мерлин (merlin), цитоплазматический продукт гена NF2, координирует контактное торможение через связывание молекул адгезии клеточной поверхности (например, Е-кадгерина) с трансмембранным рецептором тирозинкиназой (например, рецептор EGF – эпидермального фактора роста). Мерлин усиливает адгезивную способность кадгерин-опосредованного межклеточного связывания. Кроме того, благодаря изолированию рецепторов факторов роста, Мерлин ограничивает их способность к эффективной активации сигналов деления (Curto et al., 2007; Okada et al., 2005).
Второй механизм контактного торможения включает эпителиальный белок полярности LKB1, который участвует в организации структуры эпителия и в поддержании тканевой целостности. LKB1 может, к примеру, подавлять митогенные эффекты мощного онкогена Myc, когда последний активирован в эпителиальных структурах, находящихся в состоянии покоя; для сравнения: когда экспрессия LKB1 подавлена, то эпителиальная целостность бывает нарушена, и эпителиальные клетки становятся уязвимы к Myc-индуцированной опухолевой трансформации (Partanen et al., 2009; Hezel and Bardeesy, 2008). LKB1 также идентифицирован как ген-супрессор опухоли, который теряется в некоторых злокачественных опухолях (Shaw, 2009); возможно, его нормальная функция состоит в подавлении нефизиологической пролиферации. Пока остаётся неясным, как часто эти два механизма контактно опосредованного угнетения роста представлены в опухолевых клетках; вне сомнения, будут открыты и другие контактно-индуцированные барьерные механизмы, ограничивающие пролиферацию. Очевидно, подобные механизмы, позволяющие клеткам создавать и приобретать архитектурно сложную тканевую структуру, отражают важную роль угнетения и уравновешивания нефизиологических сигналов пролиферации.
Повреждение пути TGF-ß ведёт к малигнизации
TGF-ß наиболее известен по своим антипролиферативным эффектам, и попытки избегания опухолевыми клетками этих эффектов на данный момент оценены как нечто большее, чем просто угнетение его сигнального механизма (Ikushima and Miyazono, 2010; Massague´, 2008; Bierie and Moses, 2006). Во многих поздних опухолях TGF-ß-сигналинг меняет схему своей активности от угнетения клеточной пролиферации в сторону запуска особой клеточной программы, известной как эпителиально-мезенхимальный переход (ЭМП), который обуславливает у опухолевых клеток развитие признаков, связанных с высокой степенью малигнизации, что детально описано ниже.
Сопротивление клеточной гибели
Представление о том, что запрограммированная клеточная гибель путём апоптоза служит естественным барьером для развития рака, было установлено путём обобщения работ, проведённых за два последних десятилетия (Adams and Cory, 2007; Lowe et al., 2004: Evan and Littlewood, 1998). Изучение схемы сигнального пути, руководящего программой апоптоза, помогло обнаружить то, как апоптоз запускается в ответ на различные физиологические стрессы, испытываемые опухолевыми клетками в период опухолеобразования или в ответ на противоопухолевую терапию. Среди факторов, инициирующих апоптоз, особо можно выделить нарушения в трансдукции сигналов клетки, что может быть вызвано повышенной активностью онкогенного сигналинга, как было упомянуто ранее, а также повреждением ДНК в сочетании с гиперпролиферацией. Кроме того, в другом исследовании было показано, каким образом ослабляется апоптоз в тех опухолевых клетках, прогрессия которых перешла в стадию активной малигнизации и которые стали устойчивыми к терапии (Adams and Cory, 2007; Lowe et al., 2004).
Механизм апоптоза включает как позитивные регуляторы, так и негативные эффекторы (Adams and Cory, 2007). Регуляторные системы, в свою очередь, делятся на два главных контура: один принимает и перерабатывает внеклеточные сигналы, индуцирующие смерть клетки (внешняя программа апоптоза, включающая в себя, например, комплекс Fas-лиганд/Fas-рецептор), а другой воспринимает и интегрирует различные сигналы внутриклеточного происхождения (внутренняя программа). Кульминацией каждой из программ считается активация в норме “молчащих” протеаз (каспазы 8 и 9 соответственно), которые инициируют каскад протеолиза (расщепления белковых молекул клетки), включающий в себя эффекторные каспазы, ответственные за апоптозную фазу деградации, в течение которой клетка фрагментируется на части и затем поглощается соседними клетками и специализированными фагоцитами. Таким образом, внутренний путь апоптоза играет значительную роль в создании барьера против опухолевого патогенеза.
«Спусковой курок апоптоза» (“apoptotic trigger”), учитывающий сигналы регуляторов и эффекторов, контролируется противодействующими про- и антиапоптотическими членами семейства регуляторных белков Bcl-2 (Adams and Cory, 2007). Главный член этого семейства Bcl-2, а также другие сходные с ним белки (Bcl-x, Bcl-w, Mcl-1, A1), являются ингибиторами апоптоза, связываясь и тем самым инактивируя два проапоптотических белка (Вах и Bak); последние заякорены на внешней мембране митохондрий. Если Вах и Bak не подвергаются ингибированию здесь и сейчас, то они нарушают целостность наружной мембраны митохондрий, вызывая освобождение проапоптотических сигнальных белков, главным из которых является цитохром с. Свободный цитохром с в свою очередь активирует каскад каспаз, которые протеолитическим путём индуцируют множественные клеточные изменения в соответствии с программой апоптоза. Белки Вах и Bak имеют те же домены белок-белкового взаимодействия, именуемые ВН3-мотивами, что и антиапоптотические Bcl-2-подобные белки; эти мотивы определяют различные механизмы взаимодействия этих молекул. Действия подсемейства родственных белков, содержащих ВН3-участки, связаны с активностью различных сенсоров клеточных изменений; эти “ВН3-only” белки (т.е. содержащие только один домен ВН — ВН3) или нейтрализуют антиапоптотическое действие Bcl-2, или целенаправленно стимулируют проапоптотические белки этого семейства (Adams and Cory, 2007; Willis and Adams, 2005).
Несмотря на то, что условия, запускающие в клетке апоптоз, ещё предстоит изучить полнее, уже идентифицированы некоторые сенсоры, реагирующие на внутриклеточные нарушения и играющие ключевую роль в опухолевой прогрессии (Adams and Cory, 2007; Lowe et al., 2004). Наиболее примечателен сенсор повреждения ДНК, представляющий собой опухолевый супрессор ТР53 (Junttila and Evan, 2009); ТР53 индуцирует апоптоз посредством повышения экспрессии Noxa- и ВН3-only белков в ответ на нарушение структуры ДНК и другие хромосомные аномалии. С другой стороны, сниженная активность воздействия на клетки факторов выживания (например, недостаточный уровень интерлейкина-3 в лимфоцитах или инсулиноподобного фактора роста 1/2 [ИФР 1/2] в эпителиальных клетках) может запускать апоптоз посредством BH3-only белка Bim. В ещё одном случае, ведущем к клеточной гибели, большую роль играет гиперактивация сигнального пути некоторыми онкобелками, такими как Myc – он запускает апоптоз (в некоторой степени с помощью Bim и других BH3-only белков) при условии, что сможет пересилить активность антиапоптотических факторов (Junttila and Evan, 2009; Lowe et al., 2004).
Опухолевые клетки развивают различные стратегии по ограничению или избеганию апоптоза. Наиболее известным из таких методов является потеря ТР53 как опухолевого супрессора, что вычеркивает из апоптозиндуцирующего каскада такой важный сенсор клеточного повреждения. Кроме этого, опухоли способны добиваться подобного результата путём усиления экспрессии антиапоптотических регуляторов (Bcl-2, Bcl-xL) или факторов выживания (ИГФ 1/2), негативного воздействия на функционирование проапоптотических стимулов (Bax, Bim, Puma) или, наконец, путём ингибирования внешнего лиганд-индуцируемого пути клеточной смерти. Многообразие механизмов по избеганию апоптоза, вероятно, сказывается на разнообразие апоптозиндуцирующих факторов, с которыми сталкиваются популяции опухолевых клеток в течение своего развития по пути к малигнизации.
Структура апоптоза и стратегии опухолевых клеток по его избеганию подробно изучаются с начала последнего десятилетия. Из наиболее примечательных достижений с этих пор стоит упомянуть, что были открыты новые формы клеточной смерти, которые расширяют понятие «запрограммированной клеточной гибели» как барьера для рака.
Аутофагия содействует как выживаемости опухолевых клеток, так и их смерти
Аутофагия представляет собой важный физиологический ответ, который, наряду с апоптозом, в норме работает в клетках лишь на базальном уровне, но при некоторых ситуациях – например, клеточном дефиците питательных веществ (Levine and Kroemer, 2008; Mizushima, 2007) – может получать мощную стимуляцию. Программа аутофагии запускает процесс разрушения органелл клетки, таких как рибосомы и митохондрии, для того, чтобы получившиеся катаболиты были использованы клеткой для нужд биосинтеза и энергетического метаболизма. Внутриклеточные везикулы (пузырьки), аутофагосомы, будучи частью этой программы, окружают клеточные органеллы и после этого сливаются с лизосомами, где и происходит деградация. Таким образом производятся низкомолекулярные метаболиты, которые далее поддерживают выживание в стрессовых ситуациях с нехваткой питательных веществ, что характерно для опухолевых клеток.
Как и апоптоз, каскад аутофагии обладает как регуляторным, так и эффекторным (исполнительным) компонентами (Levine and Kroemer, 2008; Mizushima, 2007). Последний включает в себя белки, способствующие образованию аутофагосомы и её состыковке с лизосомами. Следует отметить, что недавние исследования выявили сферы пересечения между регуляторными механизмами, руководящими аутофагией, апоптозом и клеточным гомеостазом. Например, сигнальный путь, включающий PI3-киназу, AKT и mTOR-киназы, который стимулируется факторами выживания, выступающими как блокаторы апоптоза, схожим образом ингибирует аутофагию; если количество факторов выживания недостаточно, PI3K-сигнальный путь ингибируется, в результате чего аутофагия и/или апоптоз могут активироваться (Levine and Kroemer, 2008; Sinha and Levine, 2008; Mathew et al., 2007).
Другая взаимосвязь этих двух программ кроется в белке Beclin-1, который, согласно генетическим исследованиям, необходим для индукции аутофагии (Levine and Kroemer, 2008; Sinha and Levine, 2008; Mizushima, 2007). Beclin-1 является членом BH3-only-подсемейства белков-регуляторов апоптоза, и его ВН3-домен позволяет ему связываться с белками Bcl-2/Bcl-xL. Белки ВН3 способны замещать Beclin-1 в его связях с Bcl-2/Bcl-xL, позволяя свободному Beclin-1 запускать аутофагию, аналогично тому, как они могут высвобождать проапоптотические Вах и Bak для активации апоптоза. Таким образом, стрессовые белки ВН3 (Bid, Bad, Puma и др.) способны индуцировать апоптоз и/или аутофагию в зависимости от физиологического состояния клетки.
Мыши с инактивированными аллелями гена Beclin-1 или некоторых других компонентов системы аутофагии проявляют повышенную предрасположенность к раку (White and DiPaola, 2009: Levine and Kroemer, 2008). Эти результаты наводят на предположение, что индукция апоптоза может служить барьером для онкогенеза, который может проходить независимо или в сочетании с апоптозом. Следовательно, аутофагия представляет собой ещё один барьер, который необходимо обойти в процессе опухолевого развития.
Возможно, как бы это парадоксально не звучало, нехватка питательных элементов, радиотерапия и некоторые цитотоксичные препараты способны вызывать повышение уровня аутофагии, что для опухолевых клеток оказывает, по всей видимости, цитопротективный эффект, при этом смертельное воздействие этих стресс-индуцирующих факторов лишь ослабляется (White and DiPaola, 2009; Apel et al., 2009; Amaravadi and Thompson, 2007; Mathew et al., 2007). Более того, как было показано, опухолевые клетки, которые были подвержены сильным стрессовым воздействиям, сжимаются в размерах вследствие аутофагии до состояния обратимого покоя (White and DiPaola, 2009; Lu et al., 2008). Такая реакция может способствовать длительной выживаемости и даже возобновлению роста некоторых позднестадийных опухолей, против которых назначена терапия сильнодействующими агентами. Так, по аналогии с сигнальным путём белка TGF-b, который может проявлять себя как опухолевый супрессор на ранних стадиях опухолегенеза и позднее – на стадии стимуляции опухолевого роста (tumor promoting), аутофагия может оказывать противоречивое влияние на опухолевые клетки и, соответственно, опухолевую прогрессию (Apel et al., 2009; White and DiPaola, 2009). Важным направлением для дальнейших исследований станет подробное рассмотрение генетических и клеточных физиологических условий, которые определяют, где и когда аутофагии способствовать выживанию или, наоборот, гибели опухолевых клеток.
Некроз обладает провоспалительным и опухоль-стимулирующим эффектами
В отличие от апоптоза, при котором гибнущая клетка фрагментируется на практически невидимые тельца, поглощаемые вскоре соседними, некротические клетки набухают и лопаются, высвобождая своё содержимое в местное микроокружение. Несмотря на то что некроз исторически чаще рассматривался как смерть на организменном уровне, т.е. как форма общесистемного истощения, теперь положение дел принципиально меняется: клеточная гибель посредством некроза в некоторых аспектах совершенно очевидно находится под генетическим контролем; это не просто случайный ненаправленный процесс (Galluzzi and Kroemer, 2008; Zong and Thompson, 2006).
Что более важно, весьма вероятно, что некроз способствует высвобождению провоспалительных сигналов в тканевое микроокружение, в отличие от апоптоза и аутофагии, при которых такого явления не наблюдается. Как следствие, клетки, вступившие в некроз, могут привлекать клетки воспалительного инфильтрата иммунной системы (Grivennikov et al., 2010; White et al., 2010; Galluzzi and Kroemer, 2008), специальной функцией которых является установление степени повреждения ткани и удаление прилегающих некротических участков. Что касается неоплазии: различные факты указывают на то, что иммунные клетки воспалительных процессов способны стимулировать опухолевый рост, что даёт таким клеткам право активировать ангиогенез, пролиферацию опухолевых клеток и их инвазивность (см. ниже). Кроме того, некротические клетки могут высвобождать биоактивные регуляторные факторы, такие как интерлейкин-1a (IL-1a), способный направленно стимулировать пролиферацию клеток-соседей и ускорять неопластическую прогрессию, о чём уже было сказано (Grivennikov et al., 2010). Следовательно, клеточная гибель посредством некроза (казалось бы, полезная при уравновешивании опухолевой гиперпролиферации), в конечном итоге, может оказывать больше вреда, чем пользы. Соответственно, зарождающиеся неоплазии, а также потенциально инвазивные и способные к метастазированию опухоли могут получать преимущество от перенесения некоторой степени некроза, что сказывается на привлечении опухоль-стимулирующих клеток воспаления, которые несут ростовые факторы для данных новообразований.
Обретение клеточного бессмертия
К 2000-ому году было признано, что опухолевые клетки нуждаются в неограниченном репликативном потенциале, чтобы производить макроскопические опухоли. Такая способность резко контрастирует с поведением большинства нормальных клеточных линий организма, которые в состоянии пройти лишь через ограниченное число последовательных циклов деления. Это ограничение связано с двумя различными барьерами: клеточное старение, прогрессирующее вследствие работы предела Хейфлика (senescence) (типичный необратимый переход в непролиферативное, но жизнеспособное состояние), и энергетический кризис (crisis), ассоциированный с клеточной гибелью. Соответственно, при культивировании клеток повторяющиеся циклы деления приводят сначала к индуцированию старения, а потом – к кризису (для тех клеток, которые добились успеха в избегании предыдущего барьера), при котором большинство клеток умирает. В редких случаях клетки выходят из фазы кризиса и проявляют неограниченный потенциал к делению. Этот переход получил название «иммортализация» или клеточное «бессмертие» (immortalization) – признак, которым обладает большинство установленных клеточных линий в силу их способности к пролиферации в культуре в отсутствие свидетельств об их старении или энергетическом кризисе.
Согласно множеству данных, именно теломеры, предохраняющие концевые участки хромосом, обуславливают способность к неограниченному делению (Blasco, 2005; Shay and Wright, 2000). Теломеры, состоящие из многочисленных тандемных 6-нуклеотидных повторов, имеют постоянную тенденцию к укорочению у культивируемых клеток. В какой-то момент они перестают препятствовать слипанию концевых участков хромосомной ДНК, в результате чего образуются неустойчивые дицентрические хромосомы, и это угрожает жизнеспособности клеток. Кроме того, длина теломерной ДНК клетки определяет число последовательно сменяющихся клеточных поколений, через которое сможет пройти её потомство, прежде чем теломеры не будут разрушены и не потеряют свои протективные свойства.
Теломераза – специализированная ДНК-полимераза, которая прибавляет сегменты теломерных повторов к концам теломерной ДНК – практически полностью отсутствует в «смертных» клетках, но экспрессируется на функционально значимом уровне в подавляющем большинстве клеток (~90%), спонтанно приобретающих бессмертие, включая опухолевые клетки. Удлиняя теломерную ДНК, теломераза способна противодействовать прогрессирующему разрушению теломер, что и происходит в её отсутствие. Наличие теломеразной активности – будь то в клетках, спонтанно обретших бессмертие или же в специально сконструированных, экспрессирующих фермент, – коррелирует с устойчивостью к индуцированию как клеточного старения, так и энергетического кризиса, ведущего к апоптозу; в противовес этому, подавление теломеразной активности ведёт к укорачиванию теломер и к активации одного из этих барьеров для пролиферации.
Оба барьера – и феномен старения, и кризис/апоптоз – считаются ключевыми факторами противоопухолевой обороны, программы которых встроены в наши клетки и активируются в клетках, вступающих в неопластический процесс. Следовательно, большинство ранних неоплазий теряет свою способность к репликации и останавливается в развитии благодаря одному из данных барьеров. Считается, что потенциальное бессмертие некоторых клеток, которые в дальнейшем перерождаются в опухоли, проистекает из их способности сохранять теломерную ДНК такой длины, которая помогает избежать активации апоптоза. Это может происходить или благодаря повышению экспрессии теломеразы в клетке, или, в более редких случаях, посредством механизма, основанного на альтернативной рекомбинации. В результате, в настоящее время принято рассматривать укорочение теломер в качестве особого “часового механизма”, определяющего лимитированный потенциал деления нормальной клетки, а также той, что должна стать частью опухоли.
Работа по переоценке репликативного старения
Тогда как всё большее подтверждение находит взгляд на сохранение теломер как условие, необходимое для достижения неопластического состояния, концепция клеточного старения, ассоциированного с ограниченным числом делений, нуждается в уточнении и переформулировке. (В исследовании различий в структуре и функционировании теломер в мышиных клетках по сравнению с человеческими много усилий отводится изучению ролей теломер и теломеразы в репликативном клеточном старении). Недавние эксперименты показали, что индукция старения в некоторых культивируемых клетках может быть отложена или даже предотвращена благодаря применению улучшенных сред для культур клеток. Предполагается, что первичная культура, посев которой был проведён ранее, способна свободно пролиферировать до точки наступления энергетического кризиса и ассоциированной с этим индукцией апоптоза, что запускается при условии чрезмерного укорочения теломер (Ince et al., 2007; Passos et al., 2007; Zhang et al., 2004; Sherr and DePinho, 2000). В противовес этому, опыты на мышах с нокаутированной теломеразной активностью показывают, что укорачивание теломер может перенаправлять предраковые (предопухолевые) клетки в состояние клеточного старения, которое ведёт (наряду с апоптозом) к ослаблению опухолегенеза в мышах, генетически запрограммированных на развитие конкретного вида рака (Artandi and DePinho, 2010). Подобные мыши с отсутствием функционирующей теломеразы и достаточно сильно укороченными теломерами демонстрируют мультиорганную дисфункцию и аномалии, включающие в себя проявления и клеточного старения, и апоптоза; возможно, аналогичные им процессы встречаются и в культуре клеток (Artandi and DePinho, 2010; Feldser and Greider, 2007).
Следует отметить, что морфологически схожий с клеточным старением процесс, индуцируемый чрезмерной и неконтролируемой онкогенной сигнализацией, в настоящее время подробно описан в качестве механизма защиты от неоплазий; возможные взаимодействия такой формы старения с теломеразой и теломерами остаются неизученными. Таким образом, клеточное старение проявляется в качестве защитного барьера против неопластической экспансии, которая может быть вызвана различными аномалиями, связанными с делением, включая повышенный уровень онкогенной сигнализации и, вероятно, субкритичное укорочение теломер.
Отложенная активация теломеразы может как замедлять, так и ускорять неопластическую прогрессию
На данный момент существует свидетельство в пользу того, что клоны ранних опухолевых клеток зачастую испытывают кризисное состояние, вызванное потерей теломеразной активности, в течение многоступенчатой опухолевой прогрессии из-за их неспособности экспрессировать теломеразу на значимом уровне. Таким образом, укорачивающиеся теломеры наблюдались в предраковых новообразованиях благодаря флюоресцентной in situ гибридизации (fluorescence in situ hybridization, FISH), которая также выявляет слияния концевых участков хромосом, что сигнализирует о повреждении теломер и кризисном состоянии (Kawai et al., 2007; Hansel et al., 2006). Эти результаты также предполагают, что подобные клетки прошли через некоторое число последовательных делений, ассоциированных с укорочением теломер, в течение всего периода их развития от нормальной клетки-предшественницы. Следовательно, формирование некоторых неоплазий может быть прервано теломер-индуцируемым кризисом задолго до того, как они станут макроскопически обнаруживаемыми неопластическими образованиями.
В то же время, отсутствие ТР53-опосредованного контроля за целостностью генома может позволить ранним неоплазиям переносить стадию начальной эрозии теломер и сопровождающие её хромосомные циклы из разрыва, слияния и создания перемычки (цикл «разрыв-слияние-мостик», breakage-fusion-bridge, BRB). Повреждения генома, обусловленные этими циклами, включая делеции и амплификации участков хромосом, достоверно увеличивают частоту мутирования генома, в результате ускоряя приобретение мутантных онкогенов и генов опухолевых супрессоров. Осознание того, что дефекты в функционировании теломер способны, фактически, ускорять опухолевую прогрессию, пришло после публикации работы на мутантных мышах с нокаутированными р53 и теломеразой (Artandi and DePinho, 2010, 2000). Догадка о том, что эти два дефекта могут взаимозависимо усиливать опухолегенез, ещё не была по-настоящему подтверждена до того момента.
Косвенное подтверждение важности временного дефекта в функционировании теломер в способствовании злокачественной прогрессии проистекает, в частности, из сравнительных анализов предраковых и злокачественных очагов в молочной железе (Raynaud et al., 2010; Chin et al., 2004). Предраковые очаги не экспрессировали теломеразу на значительном уровне и отличались укорочением теломер и неклональными хромосомными аберрациями (аномалиями). В то же время, клинически выраженные карциномы демонстрировали теломеразную экспрессию соответственно с реконструкцией длины теломер и фиксацией (посредством клонального роста клеток) аномальных кариотипов, что, по-видимому, происходит уже после разрушения теломер, но до приобретения теломеразной активности. Из-за замедленной активации теломеразы происходит генерация опухоль-стимулирующих мутаций, в то время как его более поздняя активация стабилизирует геном с мутациями и предоставляет способность к неограниченному делению, что необходимо опухолевым клеткам для формирования клинически выраженных опухолей.
Новые функции теломеразы
Теломеразы были открыты благодаря их способности удлиннять и защищать теломерную ДНК, и практически все исследования этого фермента были основаны на той концепции, что его роль ограничивается этой критической для клеток функцией. Однако несколько ранее стало понятно, что также теломераза проявляет активность, ассоциированную с клеточной пролиферацией, причём это не связано с защитой теломер. Неканоничная роль теломеразы, а точнее её белковой субъединицы TERT, была обнаружена в исследованиях на мышах и культурах клеток; в некоторых случаях новые функции были продемонстрированы в условиях, при которых ферментативная активность теломеразы была ингибирована (Cong and Shay, 2008). Среди растущего списка новых функций TERT/теломеразы можно выделить способность усиливать сигнальную трансдукцию Wnt-пути, участвуя в роли кофактора β-катенина/комплекса транскрипционного фактора LEF (Park et al., 2009). К другим приписываемым эффектам, не связанным с защитой теломер, относят стимуляцию клеточной пролиферации и/или устойчивость к апоптозу (Kang et al., 2004), вовлечение в репарацию ДНК (Masutomi et al., 2005) и активность РНК-зависимой РНК-полимеразы (Maida et al., 2009). В соответствии с таким расширенным кругом функций, TERT может быть обнаружен связанным с хроматином в разных участках вдоль хромосом, а не только у теломер (Park et al., 2009; Masutomi et al., 2005). Так, можно оценивать защиту теломер от разрушения как наиболее ценную из функций, выполняемых TERT. Вклад этих дополнительных функций теломеразы по отношению к опухолегенезу ещё предстоит оценить.
Индуцирование ангиогенеза
Как и нормальные ткани, опухоли нуждаются в средствах к собственному существованию в виде питательных веществ и кислорода, как и в возможности выведения метаболических отходов и углекислого газа. Ассоциированные с опухолью новообразованные сосуды, сформированные в результате ангиогенеза, помогают справиться с этими потребностями. В период эмбриогенеза развитие сосудистой системы включает в себя появление новых эндотелиальных клеток и их слияние в трубки (васкулогенез) наряду с прорастанием (ангиогенез) новых сосудов. С течением морфогенеза нормальная сосудистая сеть переходит в состояние покоя. У взрослых, будучи частью таких физиологических процессов, как заживление ран или репродуктивный цикл у женщин, ангиогенез активируется, но только временно. В противовес этому, в период опухолевой прогрессии «переключатель ангиогенеза» почти всё время активирован и остаётся в том же режиме, в результате чего наблюдается безостановочное прорастание новых сосудов, что способствует неопластическому росту (Hanahan and Folkman, 1996).
Существуют убедительные доказательства того, что переключатель ангиогенеза регулируется противодействующими факторами, которые в итоге либо вызывают ангиогенез, либо его ингибируют (Baeriswyl and Christofori, 2009; Bergers and Benjamin, 2003). Некоторые из этих регуляторов ангиогенеза являются сигнализирующими белками, которые связываются со стимулирующими или ингибирующими поверхностными рецепторами, расположенными на сосудистых эндотелиальных клетках. Наиболее известными предшественниками стимуляторов и ингибиторов ангиогенеза считаются сосудистый эндотелиальный фактор роста-А (vascular endothelial growth factor-A, VEGF-A) и тромбоспондин-1 (thrombospondin-1, TSP-1), соответственно.
Ген белка VEGF-A кодирует лиганды, которые вовлечены в регуляцию прорастания новых кровеносных сосудов в периоды эмбрионального и постнатального развитий, а также участвуют в гомеостатическом выживании (homeostatic survival) эндотелиальных клеток, в физиологических и патологических ситуациях во взрослом организме. Сигнальная трансдукция VEGF проходит посредством трёх тирозин-киназных рецепторов (VEGFR-1-3) и регулируется на нескольких уровнях, что отражает её сложность и многомерность. Таким образом, экспрессия гена VEGF может усиливаться как гипоксией, так онкогенной сигнализацией (Ferrara, 2009; Mac Gabhann and Popel, 2008; Carmeliet, 2005). Кроме того, лиганды VEGF могут накапливаться во внеклеточном матриксе в покоящейся форме и активироваться внеклеточными протеазами, разрушающими матрикс (например, MMP-9; Kessenbrock et al., 2010). Также и другие проангиогенные сигналы, такие как члены семейства факторов роста фибробластов (fibroblast growth factor, FGF), вовлечены в поддержание опухолевого ангиогенеза, когда их экспрессия находится на повышенном уровне длительное время (Baeriswyl and Christofori, 2009). TSP-1, ключевой противодействующий ангиогенному «переключателю» фактор, также связывается с трансмембранными рецепторами, расположенными на эндотелиальных клетках и посредством этого провоцирует супрессирующие сигналы, которые способны противодействовать проангиогенным стимулам (Kazerounian et al., 2008). Кровеносные сосуды, образованные в опухолях из-за длительно активированного ангиогенеза и хаотичной смеси проангиогенных сигналов, обычно аномальны: опухолевое новообразование сосудов отмечается преждевременным прорастанием капилляров, запутанным и чрезмерным ветвлением, искривлёнными и увеличенными сосудами, беспорядочным потоком крови, мелкоточечными геморрагиями (microhemorrhaging), негерметичностью и ненормальными уровнями клеточной пролиферации и апоптоза эндотелиоцитов (Nagy et al., 2010; Baluk et al., 2005).
Ангиогенез индуцируется на удивление рано в процессе многоступенчатого развития инвазивной опухоли как на животных моделях, так и у человека. Гистологические анализы предраковых, неинвазивных очагов, в числе которых дисплазии и карциномы in situ, возникающие в различных органах, продемонстрировали раннюю активацию «переключателя» (Raica et al., 2009; Hanahan and Folkman, 1996). Исторически ангиогенез считался значимым лишь в период быстрого макроскопического роста опухолевых клеток, однако новые данные говорят о том, что ангиогенез также способствует неопластической прогрессии в её микроскопической предраковой фазе; в конечном счёте, такой признак, как способность индуцировать ангиогенез формируется в качестве одного из ключевых признаков рака.
В течение последнего десятилетия наблюдалось немало удивительных открытий в ходе изучения ангиогенеза. Среди такого большого объёма новых знаний мы делаем акцент на особой актуальности данной тематики в физиологии опухолевого роста.
Регуляция ангиогенного «переключателя»
После механизма активации ангиогенеза разные типы опухолей начинают использовать различные особенности процесса неоваскуляризации. Некоторые опухоли, в том числе такие агрессивные виды, как рак поджелудочной железы, слабо васкуляризированы и имеют участки, состоящие только из стромы и почти совершенно лишённые сосудов, они, возможно, могут даже проявлять антиангиогенные свойства (Olive et al., 2009). Многие другие опухоли, включая нейроэндокринные карциномы почек и поджелудочной железы, проявляют высокую ангиогенную активность и, соответственно, хорошо васкуляризированы (Zee et al., 2010; Turner et al., 2003).
В совокупности эти наблюдения предусматривают, что первичная активация ангиогенеза в период опухолевого развития сопровождается переменной интенсивностью продолжающейся неоваскуляризации, которая контролируется сложным биологическим механизмом, в котором участвуют как опухолевые клетки, так и ассоциированное с ними стромальное микроокружение (Baeriswyl and Christofori, 2009; Bergers and Benjamin, 2003). Следует отметить, что механизм «переключения» может варьировать, хотя в конечном счёте всё сходится на универсальном индуктивном сигнале (например, VEGF). В некоторых опухолях доминантные онкогены, действующие в опухолевых клетках, такие как Ras и Myc, способны усиливать экспрессию факторов ангиогенеза, тогда как в других клетках подобные сигналы образуются непрямым путём клетками воспаления, что описано ниже. Прямая активация ангиогенеза онкогенами, под контролем которых также находится пролиферативная сигнальная трансдукция, иллюстрирует важный принцип, который заключается в том, что ключевые признаки рака могут управляться некоторыми трансформирующими агентами.
Ингибиторы эндогенного ангиогенеза как естественные барьеры против опухолевого ангиогенеза
Исследования 1990-х гг. выявили, что TSP-1, также как и фрагменты плазмина (ангиостатин) и коллагена 18 (эндостатин), способен действовать в качестве эндогенного ингибитора ангиогенеза (Ribatti, 2009; Kazerounian, et al., 2008; Folkman, 2006, 2002; Nyberg et al., 2005). Также за последнее десятилетие была открыта дюжина других подобных молекул (Ribatti, 2009; Folkman, 2006; Nyberg et al., 2005). Большинство из них являются по своей природе белками, и многие активируются частичным протеолизом тех структурных белков клеток, которые сами по себе не выполняют роль регуляторов ангиогенеза. Некоторые из этих эндогенных ингибиторов ангиогенеза могут быть обнаружены в циркулирующей крови здоровых людей и мышей. Существуют работы, в которых гены, кодирующие эти белки-ингибиторы, были элиминированы из зародышевых мышиных линий без каких-либо неблагоприятных физиологических последствий; однако как следствие наблюдалось усиление роста аутохтонных и имплантированных опухолей (Ribatti, 2009; Nyberg et al., 2005). В то же время, если уровень циркулирующего в крови ингибитора по генетическим причинам повышен (к примеру, из-за их гиперэкспрессии в трансгенных мышах или в ксенотрансплантированных опухолях), темпы опухолевого роста снижаются (Ribatti, 2009; Nyberg et al., 2005); примечательно, что заживление ран и отложение жира также зависит от баланса экспрессии подобных генов (Cao, 2010; Seppinen et al., 2008). Полученные данные свидетельствуют о том, что такие эндогенные ингибиторы ангиогенеза в нормальных условиях действуют как физиологические регуляторы, модулирующие кратковременный ангиогенез в период реорганизации ткани и заживления ран; также они могут выступать в роли внутренних барьеров против индуцирования и/или сохранения ангиогенеза на определенном уровне в ранних опухолях.
Перициты как важные составляющие новообразованных сосудов
Перициты долгое время считались вспомогательными клетками, плотно примыкающими к внешней поверхности эндотелиальных трубок в нормальных тканевых сосудах, где они обеспечивают необходимую механическую и физиологическую поддержку для эндотелиоцитов. До недавнего времени создавалось впечатление, что сосуды опухолей, напротив, лишены этих вспомогательных клеток. Однако более внимательные микроскопические исследования показали, что перициты ассоциированы с сосудами большинства, если не всех, опухолей (Raza et al., 2010; Bergers and Song, 2005). Что более важно, исследования свидетельствуют о том, что перициты необходимы для сохранения и обновления функциональной сосудистой сети опухолей (functional tumor neovasculature).
Ряд образующихся в костном мозге клеток способствуют опухолевому ангиогенезу
В настоящее время известно, что совокупность клеточных типов, берущих начало в костном мозге, играют ключевую роль в патологическом ангиогенезе (Qian and Pollard, 2010; Zumsteg and Christofori, 2009; Murdoch et al., 2008; De Palma et al., 2007). Сюда включены клетки врождённого иммунитета – в частности, макрофаги, нейтрофилы, тучные клетки и миелоидные предшественники, – которые инфильтрируют в предраковые очаги и в прогрессирующие опухоли, собираются по краям таких очагов; клетки воспаления вокруг опухоли помогают активировать ангиогенез в ткани, прежде находящейся в состоянии покоя, и поддерживать текущий ангиогенез, ассоциированный с опухолевым ростом, в том числе для облегчения местной инвазии, как замечено далее. Кроме того, они могут помочь защитить сосуды от воздействия препаратов, нацеленных на сигнальную трансдукцию эндотелиальных клеток (Ferrara, 2010). Помимо всего прочего, некоторые типы образованных в костном мозге «сосудистых прогениторных клеток» были замечены в ряде случаев мигрировавшими в неопластические очаги, после чего включённые в сосудистую сеть, как перициты или эндотелиоциты (Patenaude et al., 2010; Kovacic and Boehm, 2009; Lamagna and Bergers, 2006).
Активация инвазии и метастазирования
В 2000-ом г. механизмы, лежащие в основе инвазии и метастазирования, по большей мере были неизвестны. Было понятно, что карциномы, возникающие из эпителиальной ткани, прогрессируют до более высокой степени злокачественности, что отражается в местной инвазии и удалённом метастазировании, а у ассоциированных раковых клеток обычно наблюдается изменение их формы и нарушения в связывании с другими клетками и с внеклеточным матриксом (ВКМ). Лучше всего описанным повреждением (alteration) тогда являлось потеря клетками карциномы Е-кадгерина, ключевой межклеточной молекулы адгезии. Формируя адгезионное соединение со смежными эпителиальными клетками, Е-кадгерин помогает объединить пласты эпителиоцитов и сохранить клетки в этих пластах в состоянии покоя. Усиленная экспрессия Е-кадгерина, как было установлено, является фактором-антагонистом инвазии и метастазирования, тогда как ослабление его экспрессии, напротив, потенцирует такой фенотип. Часто наблюдаемое ингибирование или инактивация Е-кадгерина случайной мутацией в карциномах человека обеспечило твёрдое подтверждение его роли в качестве ключевого супрессора данного признака рака (Berx and van Roy, 2009; Cavallaro and Christofori, 2004).
Кроме этого, экспрессия генов, кодирующих другие адгезионные молекулы типов «клетка-клетка» и «клетка-ВКМ», нарушена в некоторых чрезвычайно агрессивных видах карцином, вместе с тем обычно происходит ингибирование цитостаза (остановки клеточного деления). С другой стороны, в здоровом организме адгезионные молекулы участвуют в клеточной миграции в эмбриогенезе и при воспалении, в период которых их экспрессия зачастую повышена. Например, N-кадгерин, который в норме экспрессируется в мигрирующих нейронах и мезенхимальных клетках в период органогенеза, усиленно продуцируется во многих инвазивных формах клеток карциномы. Помимо гиперэкспресии или потери подобных связывающих белков, главные регуляторы инвазии и метастазирования были неизвестны или, если таковые находились под подозрением, не были подтверждены в ходе исследований (Cavallaro and Christofori, 2004).
Многоступенчатый процесс инвазии и метастазирования был разбит на последовательность дискретных шагов, зачастую именуемую каскадом инвазии и метастазирования (invasion-metastasis cascade) (Talmadge and Fidler, 2010; Fidler, 2003). Он отображает цепь цитологических изменений, начиная с местной инвазии, далее идёт интравазация опухолевых клеток (проникновение в прилегающие кровеносные или лимфатические сосуды), передвижение опухолевых клеток через лимфатическую и гематогенную системы, после чего – переход клеток из просвета таких сосудов в паренхиму отдалённых тканей (экстравазация), формирование небольших узелков опухолевых клеток (микрометастазы) и, в конце концов, рост очагов микрометастатических поражений в макроскопические опухоли – этот последний этап называется «колонизацией» (colonization).
Исследование этого признака рака (способности к инвазии и метастазированию) стремительно ускорилось за последнюю декаду, во многом благодаря применению нового оборудования и экспериментальных моделей, а также открытию и изучению ключевых регуляторных генов. Несмотря на обилие вопросов без ответов, уже достигнут значительный прогресс в очерчивании важных особенностей одной из этих ключевых способностей рака. Кое-что из этого рассмотрено далее.
Программа ЭМП напрямую регулирует инвазию и метастазирование
Регуляторная программа развития, именуемая «эпителиально-мезенхимальный переход» (ЭМП) – это то, благодаря чему трансформированные эпителиальные клетки способны приобретать способность к инвазии, противостоянию программе апоптоза и диссеминированию (Klymkowsky and Savagner, 2009; Polyak and Weinberg, 2009; Thiery et al., 2009; Yilmaz and Christofori, 2009; Barrallo-Gimeno and Nieto, 2005).
В дополнение к процессу, вовлечённому в различные этапы эмбрионального морфогенеза и заживления ран, клетки карциномы способны параллельно приобретать некоторые свойства, активирующие инвазию и метастазирование. Такая многоцелевая ЭМП-программа может находиться в активном состоянии как временно, так и постоянно, причём в разной степени, за счёт клеток карциномы в период инвазии и метастазирования.
Ряд транскрипционных факторов с плейотропным эффектом, включая Snail, Slug, Twist и Zeb1/2, контролируют ЭМП и процессы миграции в период эмбриогенеза; большинство из них первоначально было выявлено в работах по генетике развития. Эти транскрипционные регуляторы экспрессируются в различных сочетаниях во множестве разновидностей злокачественных опухолей и, судя по результатам экспериментальных моделей формирования карцином, являются важными участниками выполнения плана инвазии; некоторые из них, подверженные эктопической гиперэкспрессии, вызывают метастазирование (Micalizzi et al., 2010; Taube et al., 2010; Schmalhofer et al., 2009; Yang and Weinberg, 2008). Цитологические особенности, индуцированные подобными транскрипционными факторами, включают: потерю адгезионных контактов и, как следствие, трансформация с полигональной (эпителиальной) морфологии на веретенообразную (фибробластоподобную); экспрессию матрикс-деградирующих ферментов; повышенную подвижность и возросшую устойчивость к апоптозу – все эти признаки вовлечены в процессы инвазии и метастазирования. Некоторые из этих транскрипционных факторов могут напрямую ослаблять экспрессию гена Е-кадгерина, вследствие чего неопластические эпителиальные клетки лишаются ключевого супрессора подвижности и инвазивной способности (Peinado et al., 2004).
Имеющиеся данные демонстрируют, что эти транскрипционные факторы участвуют во взаиморегуляции, перекрывая сайты целевых генов. До сих пор не установлено каких-либо принципов или правил, которые описывали бы их взаимодействие и условия, руководящие их экспрессией. Данные с позиций генетики развития указывают на то, что специфические сигналы, полученные от клеток-соседей в зародышевом организме, участвуют в активации экспрессии этих транскрипционных факторов в тех клетках, которым предначертано пережить ЭМП (Micalizzi et al., 2010); по аналогии с этим, накапливающиеся факты свидетельствуют, что разнотипные взаимодействия опухолевых клеток со смежными ассоциированными с опухолью клетками стромы могут индуцировать экспрессию фенотипов перерождённых клеток, известные по манипулированию ими со стороны данных транскрипционных регуляторов (Karnoub and Weinberg, 2006–2007; Brabletz et al., 2001). Более того, опухолевые клетки, локализованные у границ инвазии некоторых карцином, могут претерпевать ЭМП, то есть эти опухолевые клетки подчинены стимулам от микроокружения, которые отличаются от тех, что получены опухолевыми клетками, расположенными в центре этих очагов (Hlubek et al., 2007).
Несмотря на то что фактов до сих пор недостаточно, по-видимому, транскрипционные факторы, индуцирующие ЭМП, способны контролировать большинство стадий каскада инвазии-метастазирования за исключением финального этапа колонизации. До сих пор известно не так много о различных проявлениях и временной устойчивости мезенхимальной фазы, образованной посредством ЭМП. Хотя экспрессия индуцирующих ЭМП транскрипционных факторов наблюдалась лишь в некоторых неэпителиальных видах опухолей, таких как саркомы и опухоли нейроэктодермы, их роли в создании злокачественных признаков в таких опухолях в настоящее время раскрыты очень плохо. Вдобавок, ещё остаётся определить, будут ли инвазивные клетки карциномы обязательно приобретать свою способность посредством активации частей программы ЭМП, или же альтернативные регуляторные программы также могут активировать эту способность.
Разнотипный вклад стромальных клеток в процессы инвазии и метастазирования
Всё более очевидным становится факт того, что взаимовлияние опухолевых клеток и клеток неопластической стромы влечёт за собой появление способности к инвазивному росту и метастазированию (Egeblad et al., 2010; Qian and Pollard, 2010; Joyce and Pollard, 2009; Kalluri and Zeisberg, 2006). Подобная сигнальная передача может негативно воздействовать на клетки карциномы и нарушать их ключевые способности, упомянутые ранее. К примеру, мезенхимальные стволовые клетки (МСК), находящиеся в опухолевой строме, как было показано, секретируют CCL5/RANTES в ответ на сигналы, вырабатываемые опухолевыми клетками; далее CCL5 реципрокно действует на опухолевые клетки, стимулируя их инвазивное поведение (Karnoub et al., 2007).
Макрофаги на периферии опухоли могут вызывать местную инвазию, поставляя матрикс-деградирующие ферменты, такие как металлопротеиназы и цистеин-катепсиновые протеазы (Kessenbrock et al., 2010; Joyce and Pollard, 2009; Palermo and Joyce, 2008; Mohamed and Sloane, 2006); в одной модели макрофаги, стимулирующие инвазию, были активированы интерлейкином-4 (ИЛ-4), образованным опухолевыми клетками (Gocheva et al., 2010). А в экспериментальной модели метастазирующего рака груди ассоциированные с опухолью макрофаги (TAMs) снабжали опухолевые клетки эпидермальным фактором роста (ЭФР, EGF), пока опухолевые клетки реципрокно стимулировали макрофагов посредством CSF-1; их согласованные взаимодействия способствовали интравазации опухолевых клеток в сосудистую систему и их метастатическому диссеминированию (Qian and Pollard, 2010; Wyckoff et al., 2007).
Подобные наблюдения дают понять, что фенотипы низкодифференцированного рака не возникают в строго автономной манере, а также что их проявление не может быть понято исключительно посредством анализа геномов опухолевых клеток. Одним из важных до сих пор неподтверждённых умозаключений является то, что способность преодолевать большинство этапов каскада инвазии-метастазирования может обретаться некоторыми опухолями даже в отсутствие потребности в претерпевании ряда мутаций для их первичной опухолевой трансформации.
Пластичность в программе инвазивного роста
Роль специфических сигналов в индукции способности к инвазивному росту (часто посредством ЭМП) подразумевает вероятность обратимости, так как опухолевые клетки, диссеминированные от первичной опухоли к более отдалённым тканевым участкам, могут больше не получать выгоды от активированной стромы и сигналов, индуцирующих инвазию/ЭМП, влияние которых они испытывали, пока находились в первичной опухоли; в отсутствие непрерывного воздействия этих сигналов клетки карциномы могут вернуться к своему неинвазивному состоянию. Таким образом, клетки карциномы, претерпевшие ЭМП в период начальной инвазии и диссеминации, способны проходить через противоположный процесс – мезенхимально-эпителиальный переход (МЭП, MET). Такая пластичность может способствовать формированию новых опухолевых колоний клеток карциномы, гистопатологические характеристики которых схожи с таковыми в первичной опухоли, которая никогда не претерпевала ЭМП (Hugo et al., 2007). Более того, идея о том, что опухолевые клетки запросто проходят через полную программу ЭМП, слишком упрощённа; вместо этого во многих случаях опухолевые клетки способны вовлекаться в программу ЭМП лишь частично, в результате чего они приобретают новые, мезенхимальные признаки, продолжая экспрессировать остатки эпителиального фенотипа.
Различные формы инвазии могут лежать в основе различных типов рака
Программа ЭМП регулирует частный тип инвазивной способности, именуемый «мезенхимальной». Кроме этого, две другие модели инвазии были обнаружены в процессе изучения инвазии опухолевых клеток (Friedl and Wolf, 2008, 2010). «Коллективная миграция» вовлекает узелки раковых клеток, массивно врастающих в близлежащие ткани, что характерно, например, для плоскоклеточного рака; примечательно, что подобные виды рака метастазируют лишь изредка: предполагается, что такая форма инвазии лишает некоторых функциональных свойств, способствующих метастазированию. Менее изученным является существование «амебоидной» формы инвазии (Madsen and Sahai, 2010; Sabeh et al., 2009), при которой отдельные опухолевые клетки демонстрируют морфологическую пластичность, что способствует их скольжению в толще интерстиция внеклеточного матрикса вместо того, чтобы самим «прочищать» себе дорогу; так происходит как при мезенхимальной, так и при коллективной формах инвазии. До сих пор не известно, прибегают ли опухолевые клетки, участвующие в коллективно-амебоидной инвазии, к компонентам программы ЭМП, или же совершенно различные клеточные программы ответственны за регуляцию этих альтернативных программ инвазии.
Другая активно развивающаяся концепция, упомянутая ранее, включает изучение эффекта, оказываемого на инвазию опухолей, со стороны клеток воспаления, которые собираются у их границ и продуцируют внеклеточные ферменты, разрушающие матрикс и другие факторы, активирующие инвазивный рост (Kessenbrock et al., 2010; Qian and Pollard, 2010; Joyce and Pollard, 2009); эти явления могут устранять потребность опухолевых клеток в синтезе данных белков посредством активации программы ЭМП. Таким образом, опухолевые клетки могут секретировать хемоаттрактанты, рекрутирующие проинвазивные клетки воспаления вместо продуцирования матрикс-деградирующих ферментов ими самими.
Обескураживающая сложность метастатической колонизации
Процесс метастазирования можно разбить на две большие фазы: физическая диссеминация опухолевых клеток от первичной опухоли к отдалённым тканям и адаптация этих клеток к чужеродному тканевому микроокружению, что является результатом успешной колонизации (например, прогрессия микрометастазов в макроскопические опухоли). Множественные этапы диссеминации могут показаться сферой влияния ЭМП и схожих по действию программ миграции. Однако колонизация не связана напрямую с физической диссеминацией, так как было показано, что у многих пациентов наблюдалось наличие огромного числа микрометастаз, успешно диссеминированных, но не развившихся до состояния макроскопических метастаирующих опухолей (Talmadge and Fidler, 2010; McGowan et al., 2009; Aguirre-Ghiso, 2007; Townson and Chambers, 2006; Fidler, 2003).
В некоторых видах рака первичная опухоль может высвобождать факторы системной супрессии, которые приводят подобные микрометастазы в состояние покоя, что было клинически показано на примере скачкообразного роста и метастазирования новообразований вскоре после резекции первичной опухоли (Demicheli et al., 2008; Folkman, 2002). Тем не менее, в других видах, таких как рак груди и меланома, макроскопически выраженные метастазы могут возникать через десятилетия после хирургического удаления или уничтожения фармпрепаратами первичной опухоли; эти опухолевые неоплазии фактически отражают покоящиеся микрометастазы, которые смогли решить после длительных проб и ошибок сложную проблему колонизации тканей (Barkan, et al., 2010; Aguirre-Ghiso, 2007; Townson and Chambers, 2006).
Кто-то может предположить, что микрометастазы могут быть лишены остальных ключевых признаков, необходимых для стремительного роста, таких как способность активировать ангиогенез; более того, неспособность некоторых экспериментально созданных покоящихся микрометастаз формировать макроскопически выраженные опухоли приписывается их неудачам в попытках запустить ангиогенез (Naumov et al., 2008; Aguirre-Ghiso, 2007). Помимо прочего, недавние эксперименты показали, что дефицит питательных веществ может индуцировать интенсивную аутофагию, заставляющую опухолевые клетки уменьшиться в размерах и перейти в состояние обратимого покоя; подобные клетки способны выйти из этого состояния и продолжить активный рост и пролиферацию при изменении тканевого микроокружения, например, при появлении доступа к питательным веществам (Kenific et al., 2010; Lu et al., 2008). Другие механизмы микрометастатического покоя могут включать антиростовые сигналы, задействованные во внеклеточном матриксе нормальной ткани (Barkan et al., 2010) и при действиях по супрессии опухолей со стороны иммунной системы (Teng et al., 2008; Aguirre-Ghiso, 2007).
Большинство диссеминированных опухолевых клеток, по-видимому, слабо адаптированы (по крайней мере, сначала) к новому микроокружению, в котором они очутились. Следовательно, каждый вид диссеминированной опухоли нуждается в выработке собственных временных решений проблемы успешного прорастания в микроокружении той или иной чужеродной ткани (Gupta et al., 2005). Для этих адаптаций могут потребоваться сотни различных программ по колонизации, каждая из которых зависит от вида диссеминирующей опухолевой клетки и происхождения тканевого микроокружения, в котором проходит колонизация. Однако, как упоминается далее, некоторые микроокружения могут сами по себе быть предопределённо благоприятными для диссеминации опухолевых клеток (Peinado et al., 2011; Talmadge and Fidler, 2010).
Метастатическая диссеминация долгое время считалась последним этапом в многоступенчатом процессе первичной опухолевой прогрессии, и, по-видимому, для многих опухолей это действительно так, как и показано посредством недавних работ по секвенированию генома, которые представляют генетические свидетельства клональной эволюции аденокарциномы протоков поджелудочной железы в направлении метастазирования (Campbell et al., 2010; Luebeck, 2010; Yachida et al., 2010). С другой стороны, недавно стало известно, что клетки могут диссеминировать очень рано, распространяясь от будто бы неинвазивных предраковых очагов как у человека, так и у мышей (Coghlin and Murray, 2010; Klein, 2009). Кроме этого, микрометастазы могут формироваться от первичных опухолей, которые не обязательно являются инвазивными, но имеют новообразованную сосудистую сеть (Gerhardt and Semb, 2008). Несмотря на то что опухолевые клетки могут явным образом диссеминировать от подобных пренеопластических очагов и прорастать в костном мозге и в других тканях, их способность колонизировать эти участки и развиваться в патологически значимые микрометастазы пока не подтверждена. На настоящий момент мы рассматриваем это раннее метастатическое диссеминирование в качестве наглядного феномена у мышей и человека, клиническая значимость которых пока не установлена.
Даже если исключить вопрос о хронометраже их диссеминирования, остаётся неясным, когда и где опухолевые клетки развивают способность колонизировать чужеродные ткани как макроскопические опухоли. Эта способность может возникать в течение формирования первичной опухоли как результат индивидуального пути развития опухоли, предшествующего любой диссеминации, так что первичные опухолевые клетки, вступающие в циркуляцию, по счастью, наделены способностью колонизировать некоторые отдаленные участки тканей (Talmadge and Fidler, 2010). Кроме того, способность колонизировать специфические ткани может развиваться исключительно в ответ на специфическое влияние на уже диссеминированную опухоль в целях адаптации к росту в чужеродном тканевом микроокружении.
Имея такую развитую тканеспецифическую колонизирующую способность, в дальнейшем клетки метастазирующей колонии могут диссеминировать не только на новые участки в организме, но также и обратно, к первичному очагу. Следовательно, программы по тканеспецифической колонизации, которые особо выражены среди клеток первичных опухолей, могут происходить не из классической опухолевой прогрессии, проходящей в первичном очаге, а из тех эмигрантных форм, которые вернулись обратно (Kim et al., 2009). Такая повторная колонизация согласуется с итогами вышеупомянутых работ по изучению метастазов рака поджелудочной железы человека (Campbell et al., 2010; Luebeck, 2010; Yachida et al., 2010). Другими словами, фенотипы и программы базовой генной экспрессии популяций опухолевых клеток (а также опухолевых стволовых клеток, упомянутых ниже) в пределах первичных опухолей могут быть существенно модифицированы под влиянием обратной миграции их потомков, полученных в ходе метастазирования.
Безусловно в таком процессе самораспространения следующее: поддерживающая строма, возникающая в первичной опухоли и ведущая к приобретению ею признаков злокачественности, может служить благоприятным участком для колонизации циркулирующими опухолевыми клетками, исходящими из очагов метастазирования.
Прояснение вопроса о регуляторных программах, которые активируют колонизацию, является важным пунктом для дальнейших исследований. Значительный прогресс, тем не менее, уже достигнут, в частности, в определении кластеров генов («маркёры метастаза»), которые коррелируют с образованием макроскопических метастаз в специфических тканях и способствуют этому (Coghlin and Murray, 2010; Bos et al., 2009; Olson et al., 2009; Nguyen et al., 2009; Gupta et al., 2005). Эта задача трудноразрешима, принимая во внимание несомненное многообразие различных программ_ по колонизации, упомянутых выше. Более того, маловероятно, что колонизация зависит исключительно от клеточно-независимых процессов. Напротив, она определённо нуждается в формировании доступного микроокружения опухоли, образованного из вспомогательных клеток стромы. По этим причинам процесс колонизации, вероятно, включает в себя огромное множество клеточных программ, которые суммарно значительно сложнее и разнообразнее, чем предшествующие этапы диссеминирования путём метастазирования.
Кодирование ключевых способностей внутриклеточными схемами
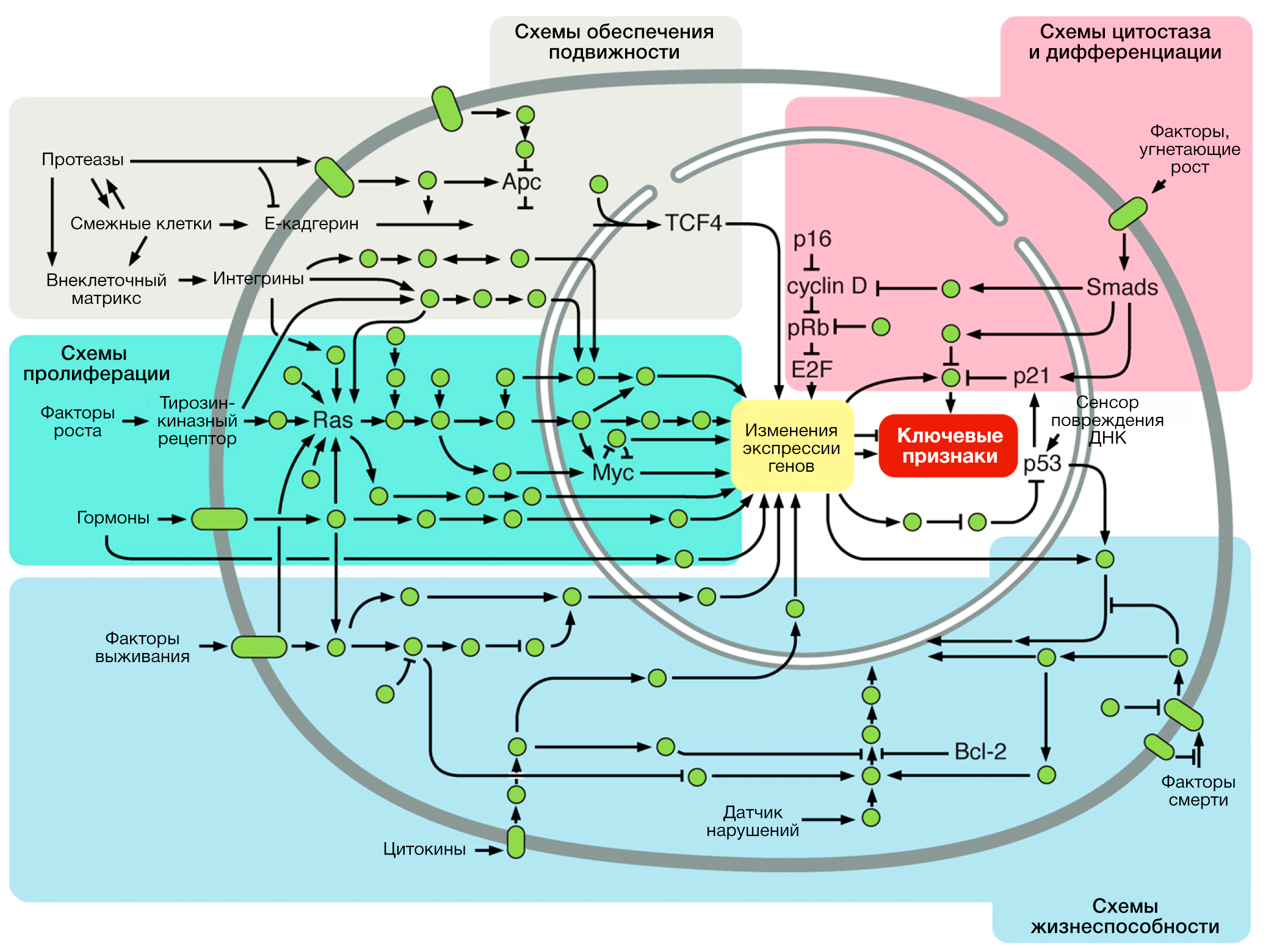
В 2000-ом г. мы ввели метафору, в которой множество сигнальных молекул, влияющих на опухолевые клетки, действуют как узлы или ветви детальных интегрированных схем взаимодействия, которые являются измененными производными схем, работающих в нормальных клетках. Последующая декада утвердила оригинальное описание этих схем и расширила каталог сигналов и взаимосвязей их сигнальных путей. Достаточно сложно, если в принципе реально, графически отобразить эту схему всесторонне и связно, что было задачей в 2000-ом.
Сейчас мы предлагаем отображение этой схемы, совмещённой с отдельными признаками рака. Таким образом, внутриклеточная интегрированная схема может быть разделена на различные подсхемы, каждая из которых специализирована на поддержку отдельной клеточной особенности здоровых клеток и репрограммирована в целях осуществления ключевой способности опухолевых клеток (Рисунок 2). Лишь небольшая часть ключевых признаков отображена на Рисунке 2, так как схемы их контроля и регуляции остаются плохо изученными или потому, что они в значительной мере перекрываются с теми, что отображены здесь.
Дополнительный параметр сложности – взаимосвязи и взаимовлияния между отдельными подсхемами. К примеру, некоторые онкогенные события могут влиять на множество признаков, что проиллюстрировано различными эффектами важнейших онкогенов, таких как мутировавший RAS и MYC с усиленной экспрессией, занятые во многих ключевых способностях (поддержание пролиферативного сигналинга, перестройка энергетического метаболизма, индуцирование ангиогенеза, активация инвазии, сопротивление клеточной гибели). Мы рассчитываем, что трактовка этой интегрированной схемы в будущем будет включать также те подсхемы и признаки рака, что здесь не представлены.
ФАКТОРЫ ВОЗНИКНОВЕНИЯ И ПРОЯВЛЯЮЩИЕСЯ ПРИЗНАКИ РАКА
Мы определили ключевые признаки рака как приобретенные функциональные способности, которые помогают опухолевым клеткам выжить, пролиферировать и диссеминировать; эти функции приобретаются в различных видах опухолей разными механизмами и в неодинаковый период в течение многоступенчатого опухолегенеза. Их приобретение возможно благодаря двум факторам (факторы возникновения рака, enabling characteristics). Наиболее важным является достижение нестабильности генома в опухолевых клетках, благодаря чему наблюдается генерация случайных мутаций, включая хромосомные перестройки; к ним относятся генетические изменения, которые могут управлять отличительными способностями. Второй фактор включает воспалительный процесс предраковых и по-настоящему злокачественных очагов, запускающийся клетками иммунной системы, часть из которых ускоряют опухолевую прогрессию посредством разнообразных механизмов.
В то же время и другие особенности опухолевых клеток были предложены в качестве функционально важных для развития рака и потому могут быть добавлены к списку ключевых признаков (Negrini et al., 2010; Luo et al., 2009; Colotta et al., 2009). Двое из этих качеств особенно веские. Первое включает в себя масштабное перепрограммирование клеточного энергетического метаболизма в целях поддержания продолжающегося клеточного роста и пролиферации, заменяя ту программу метаболизма, которая действует в большинстве нормальных тканей и активизирует физиологические процессы в соответствующих клетках. Второе качество представляет собой активное избегание опухолевыми клетками атаки и элиминирования со стороны иммунной системы; эта способность актуализирует двойную роль иммунной системы, которая как противостоит, так и усиливает развитие и прогрессию опухолей. Обе эти способности могут способствовать развитию и прогрессии многих форм рака и поэтому их можно считать проявляющимися признаками (emerging hallmarks) рака. Эти факторы возникновения рака и его проявляющиеся в ходе прогрессии признаки, изображенные на Рисунке 3, обсуждаются далее по отдельности.
Фактор возникновения рака: геномная нестабильность и мутирование
Приобретение множества признаков, перечисленных выше, во многом зависит от последовательности повреждений геномов неопластических клеток. Некоторые мутантные генотипы обеспечивают селективное преимущество субклонам клеток, активируя их рост и предоставляя господство в местном тканевом микроокружении. Следовательно, многоступенчатая опухолевая прогрессия может быть описана как последовательность клональных делений, каждое из которых запускается случайным приобретением рилизирующего мутантного генотипа. Поскольку наследственные фенотипы (например, инактивация генов-супрессоров опухолей) также могут приобретаться посредством эпигенетических механизмов, таких как метилирование ДНК и модификация гистонов (Berdasco and Esteller, 2010; Esteller, 2007; Jones and Baylin, 2007), некоторые циклы размножения клонов опухолей могут запускаться немутационными изменениями, влияющими на регуляцию и экспрессию генов.
Примечательная способность систем защиты генома обнаруживать и устранять дефекты в ДНК, которые обеспечивают высокую частоту случайных мутаций, обычно подавлена в каждом поколении клеток. В ходе приобретения ряда мутантных генов, необходимых для контроля за опухолегенезом, в опухолевых клетках зачастую наблюдается увеличение частоты мутирования (Negrini et al., 2010; Salk et al., 2010). Такая мутабельность достигается посредством повышения чувствительности к мутагенным агентам, путём поломки одного или нескольких компонентов механизма защиты генома, или всех факторов вместе. Кроме того, накопление мутаций может быть ускорено нарушениями в системах надзора за целостностью генома, запускающими апоптоз или ускоряющими старение (senescence) в повреждённых клетках (Jackson and Bartek, 2009; Kastan, 2008; Sigal and Rotter, 2000). Ключевую роль в этом процессе играет TP53, за что его именуют «стражем генома» (Lane, 1992).
Разнообразные дефекты, поражающие широкий круг компонентов механизма защиты ДНК, – зачастую называемых «хранителями» (caretakers) генома (Kinzler and Vogelstein, 1997) – также были обнаружены. Список дефектов в этих генах-«хранителях» включает в себя те, продукты которых участвуют в: (1) обнаружении повреждения ДНК и активации механизма репарации, (2) репарации повреждённой ДНК напрямую и (3) подавлении или приостановлении воздействия мутагенных молекул до того, как они повредят ДНК (Negrini et al., 2010; Ciccia and Elledge, 2010; Jackson and Bartek, 2009; Kastan, 2008; Harper and Elledge, 2007; Friedberg et al., 2006). C точки зрения генетики, эти гены ведут себя во многом сходно с генами-супрессорами опухолей, так как их функции могут утрачиваться по ходу опухолевой прогрессии, что обусловлено инактивирующими мутациями или эпигенетической репрессией. Мутантные копии многих из этих генов-«хранителей» были введены в зародышевую линию мышей и в результате получили, как и предсказывалось, повышенную заболеваемость раком, в подтверждение их потенциального участия в развитии рака у человека (Barnes and Lindahl, 2004).
В то десятилетие, в начале которого мы впервые перечислили характерные черты рака, обнаружилась другая важная причина геномной нестабильности опухолей: как описано ранее, потеря теломерной ДНК во многих опухолях рождает нестабильность в хромосомном наборе и, соответственно, амплификацию и делецию хромосомных сегментов (Artandi and DePinho, 2010). С этой точки зрения, теломераза – нечто большее, чем инициатор способности к неограниченному делению, и её также следует включить в список ключевых «хранителей», ответственных за сохранение целостности генома.
Молекулярно-генетический анализ опухолевых клеток обеспечил нас наиболее убедительными доказательствами о мутациях, ведущих к нарушению функций, и о продолжающейся нестабильности генома в период опухолевой прогрессии. Один из видов анализа – сравнительная геномная гибридизация (СГГ, CGH) – обнаруживает количество случаев обретения и потери копий генов во всём клеточном геноме; во многих опухолях множественные геномные нарушения, выявленные благодаря СГГ, вызывают потерю контроля над целостностью генома. Важно отметить, что повторение специфических нарушений (амплификации и делеции) в отдельных участках генома свидетельствует о том, что подобные участки, вероятно, скрывают гены, повреждение которых ведёт к неопластической прогрессии (Korkola and Gray, 2010).
В последние годы, с возникновением эффективных и экономичных технологий по секвенированию ДНК, стали возможны высокочувствительные анализы. Ранние работы выявили широкий круг паттернов мутаций в ДНК в различных типах опухолей (см. http://cancergenome.nih.gov/). В недалёком будущем, секвенирование целых геномов опухолевых клеток обещает пролить свет на распространение, на первый взгляд, случайных мутаций, рассеянных по геному опухолевых клеток. Таким образом, повторяющиеся генетические повреждения могут указывать на прямую роль отдельных мутаций в патогенезе опухолей.
Несмотря на то что особенности повреждения генома неодинаковы в различных видах опухолей, огромное множество дефектов репарации, которые уже были обнаружены в опухолях человека, вместе с многочисленными свидетельствами масштабной дестабилизации числа копий генов и нуклеотидных последовательностей, склоняют нас к тому, что нестабильность генома присуща многим опухолевым клеткам человека. Это, в свою очередь, ведёт к выводу о том, что дефекты репарации и защиты генома избирательно благоприятны и, вследствие этого, играют важную роль в опухолевой прогрессии, хотя бы потому, что они ускоряют частоту того, что развивающиеся предраковые клетки накапливают нужные генотипы. Соответственно, нестабильность генома является фактором формирования рака, который причинно-следственно связан с обретением его ключевых способностей.
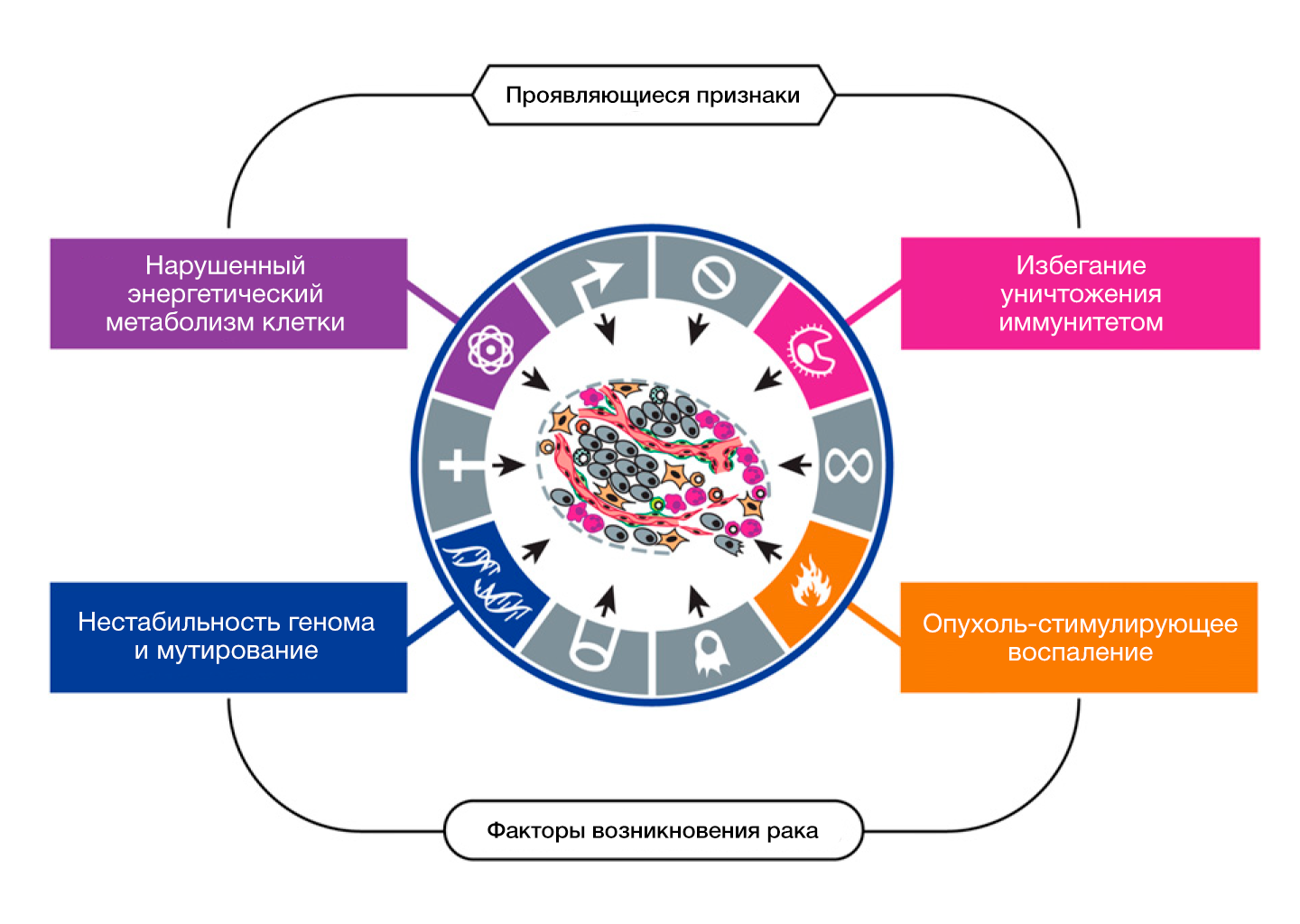
Фактор возникновения рака: стимулирующее опухоль воспаление
Патологи давно выяснили, что некоторые опухоли сильно инфильтрированы клетками как врожденного, так и приобретенного иммунитета, из-за чего зеркальные условия для воспаления возникают и в нормальных тканях (Dvorak, 1986). C появлением лучших маркёров для достоверной идентификации разных типов клеток иммунной системы, теперь стало известно, что практически в каждом очаге неоплазии имеются иммунные клетки, которые представлены в слоях от настолько тонкого инфильтрата, что там их можно обнаружить лишь клеточно-специфичными антителами, до значимого воспаления, различимого даже по стандартным техникам по гистохимическому окрашиванию (Page` s et al., 2010). В силу исторических обстоятельств, подобные случаи иммунного ответа считались отражением попытки иммунной системы уничтожить опухоли, и в принципе существует нарастающее число свидетельств противоопухолевых эффектов ко многим видам опухолей с сопутствующим воздействием на опухоли по избеганию иммунного разрушения, о чём сказано ниже.
К 2000-ому г. уже были сведения о том, что ассоциированный с опухолью иммунный ответ имеет неожиданный, парадоксальный эффект усиления опухолегенеза и прогрессии, что, в сущности, способствует приобретению ранними неоплазиями ключевых признаков рака. В последующее десятилетие исследование взаимодействий между воспалением и патогенезом опухоли переживало расцвет, благодаря которому получилось осознать те важные опухоль-стимулирующие эффекты иммунных клеток (по большей мере врожденного иммунитета), которые они оказывают на неопластическую прогрессию (DeNardo et al., 2010; Grivennikov et al., 2010; Qian and Pollard, 2010; Colotta et al., 2009). Воспаление может обеспечивать биоактивными молекулами опухолевое микроокружение, включая факторы роста, которые поддерживают пролиферацию; факторы выживания, препятствующие гибели клеток; проангиогенные факторы и внеклеточные модифицирующие матрикс ферменты, которые способствуют ангиогенезу, инвазии и метастазированию; а также индукционные сигналы, ведущие к активации ЭМП и другим программам (DeNardo et al., 2010; Grivennikov et al., 2010; Qian and Pollard, 2010; Karnoub and Weinberg, 2006–2007).
Важно отметить, что воспаление в некоторых случаях выявляется на ранних этапах неопластической прогрессии и, как было показано, способно ускорять развитие ранних неоплазий до выраженного рака (Qian and Pollard, 2010; de Visser et al., 2006). Помимо этого, клетки воспаления могут высвобождать химические вещества, активные формы кислорода, являющиеся сильными мутагенами для соседних опухолевых клеток, что ускоряет их генетическую эволюцию по направлению к малигнизации (Grivennikov et al., 2010). Соответственно, воспаление может считаться фактором возникновения и формирования рака по его роли в приобретении главных отличительных способностей. Клетки, ответственные за это, описаны ниже в разделе об опухолевом микроокружении.
Проявляющийся признак: репрограммирование энергетического метаболизма
Длительная и зачастую неконтролируемая пролиферация клеток, отражающая сущность неопластического заболевания, включает в себя не только поврежденную систему контроля за пролиферацией клеток, но также и соответствующие корректировки в энергетическом метаболизме с ориентировкой на то, чтобы ускорять процессы роста и деления. В аэробных условиях нормальные клетки окисляют глюкозу сначала посредством гликолиза до пирувата в цитозоле, а затем – до оксида углерода (IV) в митохондриях; при анаэробных условиях большее внимание уделяется гликолизу, и лишь относительно малая доля пирувата поступает в потребляющую кислород митохондрию. Первым, кто обнаружил аномальные черты энергетического метаболизма в опухолевых клетках, был Отто Варбург (Warburg, 1930, 1956a, 1956b): даже в присутствии кислорода опухолевые клетки способны репрограммировать свой метаболизм глюкозы, и в результате образование энергии со сведением их энергетического метаболизма, в основном, к гликолизу получило название «аэробного гликолиза».
Существование метаболического «переключателя» в опухолевых клетках было доказано в последующую декаду. Подобное редактирование энергетического метаболизма на вид нелогично, так как опухолевые клетки должны компенсировать 18-кратное снижение эффективности образования АТФ посредством гликолиза относительно окислительного фосфорилирования в митохондриях. Они возмещают это, в частности, повышением активности переносчиков глюкозы, в особенности GLUT1, который существенно увеличивает импорт глюкозы в цитоплазму (Jones and Thompson, 2009; DeBerardinis et al., 2008; Hsu and Sabatini, 2008). Более того, заметно повышенные связывание и утилизация глюкозы наблюдались во многих видах опухолей человека посредством неинвазивного визуализирования связывания глюкозы при помощи позитронной эмиссионной томографии (ПЭТ) с радиоактивным аналогом глюкозы (18F-fluorodeoxyglucose, FDG) в качестве репортера.
Гликолитический путь, как было показано, ассоциирован с активированными онкогенами (например, RAS, MYC) и мутантными опухолевыми супрессорами (такими как TP53) (DeBerardinis et al., 2008; Jones and Thompson, 2009), чьи повреждения в опухолевых клетках были в первую очередь отобраны за их преимущества в придании таких отличительных качеств, как усиление клеточной пролиферации, избегание цитостатического контроля и подавление апоптоза. Эта опора на гликолиз далее может усиливаться в условиях гипоксии, действующих на многие опухоли: системы ответа на гипоксию действуют плейотропно, повышая активность переносчиков глюкозы и множественных ферментов гликолитического пути (Semenza, 2010a; Jones and Thompson, 2009; DeBerardinis et al., 2008). Таким образом, и онкопротеин Ras, и гипоксия могут независимо увеличивать (повышать) концентрацию транскрипционных факторов HIF1α и HIF2α, которые в свою очередь усиливают гликолиз (Semenza, 2010a, 2010b; Kroemer and Pouyssegur, 2008).
Разумное объяснение для существования гликолитического «переключателя» в опухолевых клетках расплывчато, принимая во внимание относительно малую эффективность образования АТФ посредством гликолиза по сравнению с окислительным фосфорилированием. Согласно одной давно забытой (Potter, 1958), но недавно возрождённой и дополненной гипотезе (Vander Heiden et al., 2009), усиленный гликолиз переводит многообразие промежуточных метаболитов гликолиза в различные биосинтетические пути, включая те, что ведут к образованию нуклеозид и аминокислот; это способствует, в свою очередь, биосинтезу макромолекул и органелл, необходимых для сборки новых клеток. Более того, метаболизм, схожий с эффектом Варбурга, вероятно, существует во многих быстро делящихся эмбриональных тканях, что снова указывает на роль в широкомасштабных программах биосинтеза, необходимых для активной пролиферации.
Примечательно, что некоторые опухоли, как было выявлено, содержат две субпопуляции опухолевых клеток, различных по своим путям по образованию энергии. Одна субпопуляция состоит из глюкозо-зависимых (ассоциированных с эффектом Варбурга) клеток, секретирующих лактат, тогда как клетки второй субпопуляции преимущественно импортируют и утилизируют лактат, образованный их соседями в качестве их основного источника энергии, задействуя для этого часть цикла Кребса (Kennedy and Dewhirst, 2010; Feron, 2009; Semenza, 2008). Эти две популяции, как было доказано, действуют согласно принципам симбиоза: «гипоксические» опухолевые клетки зависимы от глюкозы в качестве топлива и секретируют лактат в качестве отходов, который важен и предпочтительно используется как топливо их в большей степени «окисляющими» собратьями. Несмотря на то, что этому провокационному режиму внутриопухолевого симбиоза ещё предстоит распространиться, кооперация между лактат-секретирующими и лактат-утилизирующими клетками, направленная на снабжение опухолевого роста, ещё не является само по себе созданием опухоли, но в некоторой степени отображает нормальный физиологический механизм, при этом один работает в мышцах (Kennedy and Dewhirst, 2010; Feron, 2009; Semenza, 2008). Помимо этого, становится ясно, что оксигенация, варьирующая от нормоксии до гипоксии, не обязательно статична в опухолях, но, вместо этого, иногда колеблется, в том числе и в зависимости от участка опухоли (Hardee et al., 2009) – вероятно, как результат нестабильности и хаотической организации опухолевой новообразованной сосудистой сети.
Нарушенный энергетический метаболизм также распространён в опухолевых клетках, как и многие другие ассоциированные с опухолью черты, признанные в качестве ключевых признаков рака. Это понимание восходит к вопросу о том, является ли ослабленный контроль за клеточным энергетическим метаболизмом таким же фундаментальным признаком опухолевых клеток, как и шесть остальных ключевых особенностей. В действительности, перенацеливание энергетического метаболизма в основном регулируется белками, вовлеченными в репрограммирование главных признаков рака. С этой точки зрения, аэробный гликолиз можно считать всего лишь другим фенотипом, программированным онкогенами, индуцирующими пролиферацию.
Примечательно, что активирующие мутации («мутации приобретения функции») в ферменте изоцитрат-дегидрогеназе ½ (ИДГ, IDH) выявлены в глиомах и других опухолях человека (Yen et al., 2010). И хотя эти мутации могут оказаться клонально отобранными за их способность повреждать энергетический метаболизм, существуют данные, связывающие их активность с повышенным окислением и стабильностью транскрипционных факторов HIF-1 (Reitman and Yan, 2010), что может, в свою очередь, повлиять на геномную стабильность и ангиогенез/инвазию, соответственно; таким образом, сглаживая линии фенотипической демаркации. В настоящее время, вследствие этого, определение репрограммированного энергетического метаболизма в качестве проявляющегося признака кажется наиболее подходящим для того, чтобы обозначить как доказанную важность этого явления, так и нерешённые задачи, связанные с его функциональной независимостью от остальных ключевых особенностей.
Проявляющийся признак: избегание разрушения иммунной системой
Второй, до сих пор нерешённый вопрос, связанный с формированием опухоли – роль иммунной системы в противодействии или ликвидации формирования и прогрессии ранней неоплазии, опухолей на поздних стадиях и микрометастаз. Устоявшаяся теория иммунного контроля предполагает, что клетки и ткани постоянно подвергаются мониторингу со стороны «дежурной» иммунной системы, такой контроль ответственен за распознавание и элиминацию подавляющего большинства ранних опухолевых клеток и, как следствие, зарождающихся опухолей. Следуя этой логике, проявляющиеся солидные опухоли каким-то образом справились с задачей избегания опознавания иммунной системой или оказались способны ограничивать размах иммунного киллинга и тем самым избегать ликвидирования.
Дефективный иммунологический мониторинг опухолей, по-видимому, связан с внушительным ростом некоторых опухолей у людей с ослабленным иммунитетом (Vajdic and van Leeuwen, 2009). Однако, большую их часть составляют опухоли, индуцированные вирусом, что наталкивает на мысль о том, что львиная доля контроля за этим классом опухолей в норме зависит от снижения вирусной обсеменённости инфицированных индивидуумов, в частности, посредством элиминирования инфицированных вирусом клеток. Эти наблюдения проливают немного света на возможную роль иммунной системы в ограничении формирования более 80% опухолей невирусной этиологии. В последние годы, однако, накапливаются свидетельства работ как по генному модифицированию мышей, так и по клинической эпидемиологии в пользу того, что иммунная система действует в качестве значимого барьера против образования и прогрессии опухолей, как минимум, в некоторых формах неиндуцированного вирусом рака.
Когда мыши с недостаточностью по ряду компонентов иммунной системы, полученные методами генной инженерии, были оценены по развитию карциноген-индуцированных опухолей, выявилось, что опухоли возникали чаще и/или росли быстрее в группе мышей с иммунодефицитом относительно контрольной группы со здоровым иммунитетом. В частности, неполноценность развития или функционирования CD8+-цитотоксических Т-лимфоцитов (ЦТЛ, CTLs), CD4+ Тh1-хелперных Т-клеток или естественных киллеров (ЕК, NK) вела к значительному повышению количества ранних опухолей; более того, мыши с комбинированным иммунодефицитом по Т-клеткам и NK-клеткам были даже более восприимчивы к развитию рака. Результаты показывают, что как минимум в некоторых экспериментальных моделях и врождённая, и приобретённая составляющие иммунитета способствуют, что немаловажно, поддержанию иммунного надзора и, как следствие, ликвидации опухоли (Teng et al., 2008; Kim et al., 2007).
Кроме этого, эксперименты по трансплантации продемонстрировали, что опухолевые клетки, изначально возникающие в мышах с иммунодефицитом, зачастую неэффективны в инициировании вторичных опухолей в организмах с сингенным нормальным иммунитетом, тогда как опухолевые клетки от неоплазий, возникающих в здоровых мышах, одинаково эффективны в активации трансплантированных опухолей в обоих типах организмов-хозяев (Teng et al., 2008; Kim et al., 2007). Подобное поведение объясняется тем, что клоны высоко иммуногенной опухолевой клетки обычно элиминируются в организме со здоровым иммунитетом – процесс, называемый «иммуноредактированием» (immunoediting), – оставляя позади лишь слабо иммуногенные варианты для роста и образования солидных опухолей; подобные слабо иммуногенные опухоли могут далее колонизировать как организмы со здоровым иммунитетом, так и с иммунодефицитом. Наоборот, возникая в организме с иммунодефицитом, иммуногенные опухолевые клетки не подвергаются слективному уничтожению и могут, напротив, процветать среди своих слабо иммуногенных «двойников». Когда клетки от подобных не-редактированных опухолей последовательно трансплантируются в сингенного реципиента, иммуногенные опухолевые клетки отвергаются при их первом столкновении с компетентной иммунной системой их вторичного хозяина (Smyth et al., 2006). (Нерешённым, в частности, в этих экспериментах остаётся вопрос о том, склонны ли химические карциногены, индуцирующие подобные опухоли, способствовать образованию опухолевых клеток с исключительно иммуногенными свойствами.)
Данные клинической эпидемиологии также свидетельствуют о существовании противоопухолевых иммунных ответов в некоторых формах рака у людей (Bindea et al., 2010; Ferrone and Dranoff, 2010; Nelson, 2008). К примеру, пациенты с опухолями кишки и яичников, сильно инфильтрированных ЦТЛ и ЕК-клетками, имеют лучший прогноз чем те, у которых отсутствует подобная масса киллерных лимфоцитов (Page` s et al., 2010; Nelson, 2008); доводы в пользу других опухолей многообещающие, но менее веские, это – объект для дальнейших исследований. Помимо этого, было показано, что в некоторых трансплантных органах с иммуносупрессией развиваются опухоли от донора, что объясняется существованием соответствующих опухолевых клеток в организме донора под строгим иммунным надзором, в состоянии покоя (Strauss and Thomas, 2010).
До сих пор эпидемиология пациентов с хронической иммуносупрессией не показала достоверного увеличения заболеваемости основными формами невирусного рака, о чём упоминалось выше. Это может быть аргументом против необходимости иммунного контроля в качестве эффективной преграды для опухолегенеза и опухолевой прогрессии. Стоит, однако, заметить, что пациенты с иммуносупрессией на фоне ВИЧ или фармпрепаратов преимущественно иммунодефицитны по пулам Т- и В-клеток и, таким образом, не являются мультикомпонентно дефицитными, каковыми были генноинженерные мутантные мыши, у которых отсутствовали ЕК и ЦТЛ; такая ситуация оставляет открытым возможность того, что такие пациенты всё ещё сохраняют остаточную способность к иммунной защите против рака, что происходит благодаря естественным киллерам и другим клеткам врожденного иммунитета.
В действительности, вышеописанные рассуждения иммунологии опухолей упрощают иммунологические взаимодействия «опухоль-хозяин», учитывая, что высоко иммуногенные опухолевые клетки могут успешно избегать уничтожения иммунной системой. Например, опухолевые клетки могут сковывать инфильтрирующие ЦТЛ и ЕК-клетки, секретируя TGF-β или другие иммуносупрессорные факторы (Yang et al., 2010; Shields et al., 2010). Более тонкие механизмы действуют посредством рекрутинга воспалительных клеток, обладающих активными иммуносупрессирующими свойствами, включая Т-регуляторные клетки (T-рег, T-regs) и миелоидные супрессорные клетки (МСК, MDSCs). Оба могут подавлять действия цитотоксических лимфоцитов (Mougiakakos et al., 2010; Ostrand-Rosenberg and Sinha, 2009).
В свете этих обстоятельств и по-прежнему слаборазвитых демонстраций противоопухолевого иммунитета как существенного барьера против формирования опухоли и её прогрессии у человека, мы представляем особенность, состоящую в избегании иммунного ответа, в качестве ещё одного формирующегося признака рака.
ОПУХОЛЕВОЕ МИКРООКРУЖЕНИЕ
За последнее десятилетие в опухолях стали всё чаще признавать элементы, сложность устройства которых сравнима и даже может превышать таковую нормальных здоровых тканей. С этой точки зрения биологию опухоли можно понять посредством изучения отдельных специализированных клеточных типов внутри неё (Рисунок 4, верх.) так же, как и «опухолевое микроокружение», которое создаётся ими в течение многоступенчатого процесса опухолегенеза (Рисунок 4, ниж.). Такая картина контрастирует с более ранним, редукционистским взглядом на опухоль как на нечто, представляющее собой не более чем скопление относительно гомогенных опухолевых клеток, вся биология которых может быть изучена на выяснении клеточно-независимых свойств этих клеток. Мы перечисляем здесь ряд клеточных типов, которые, как стало известно, могут служить ключом к биологии многих опухолей, и обсуждаем регуляторный сигнальный путь, контролирующий их индивидуальные и коллективные функции. Большинство из этих наблюдений восходят к изучению карцином, в которых неопластические эпителиальные клетки соcтавляют нишу (паренхиму), которая сама по себе совершенна отлична от опухолевой стромы, формируемой мезенхимальными клетками.
Опухолевые клетки и опухолевые стволовые клетки
Опухолевые клетки являются фундаментом заболевания; они дают начало опухолям и запускают опухолевую прогрессию, заключая в себе мутации онкогенов и опухолевых супрессоров, что определяет рак как генетическое заболевание. Традиционно опухолевые клетки в составе неоплазий описывались как умеренно гомогенные клеточные популяции до относительно поздней стадии опухолевой прогрессии, когда гиперпролиферация, комбинированная с повышенной нестабильностью генома, ведёт к образованию различных клональных субпопуляций. Многие человеческие опухоли разнородны с точки зрения гистопатологии, что отражает подобную клональную гетерогенность, и содержат области, разграниченные различными стадиями дифференцировки, пролиферации, васкуляризированности, воспаления и/или инвазивности. В последние годы, однако, накопились данные о наличии новых параметров внутриопухолевых неоднородностей и о существовании до сих пор не оцененного по праву субкласса неопластических клеток в опухолях, именуемых опухолевыми стволовыми клетками (ОСК, CSCs).
Несмотря на то, что данные до сих пор недостаточно полны, уже есть основания считать, что ОСК являются составной частью многих, если не большинства, опухолей, хоть и представлены в них в сильно варьирующих количествах. ОСК определяются с практической точки зрения по своей способности инициировать рост новых опухолей после их пересева мышам-реципиентам (Cho and Clarke, 2008; Lobo et al., 2007). Такое функциональное определение зачастую дополняется экспрессией ОСК маркёров, которые также присутствуют у нормальных стволовых клеток в ткани-первоисточнике (Al-Hajj et al., 2003).
C самого начала ОСК были открыты как участники патогенеза гематопоэических злокачественных образований (Reya et al., 2001; Bonnet and Dick, 1997) и затем, годы спустя, были идентифицированы в солидных опухолях, в частности в карциномах груди и нейроэктодермальных опухолях (Gilbertson and Rich, 2007; Al-Hajj et al., 2003). Разделение опухолевых клеток на основе отображённых на клеточной поверхности маркёров приводит к образованию субпопуляции неопластических клеток с усиленной способностью (относительно большинства представителей популяции) давать начало новым опухолям после имплантации в иммунодефицитных мышах. Эти опухоль-инициирующие клетки делят транскрипционный профиль (т.е. пул генов в состоянии транскрипции) с некоторыми нормальными тканевыми популяциями стволовых клеток, что является поводом для названия их стволово-подобными (stem-like).
Предшественники ОСК в солидных опухолях ещё не определены и, в действительности, могут отличаться в разных типах опухолей. В некоторых опухолях нормальные тканевые стволовые клетки могут служить теми источниками, которые, проходя онкогенную трансформацию, образуют ОСК; в других, частично дифференцированные делящиеся прогениторные клетки могут испытывать начальную онкогенную трансформацию, впоследствии принимая более стволово-подобный характер. Как только первичная опухоль сформировалась однажды, ОСК, как и подобные ей нормальные стволовые клетки, могут самообновляться или способствовать образованию более дифференцированных форм; в случае неопластических ОСК, эти клетки-потомки формируют большое количество новых опухолей. Остается выяснить, какие типы малигнизирующихся неопластических стволовых клеток формируются в ходе внедрения и последовательной многоступенчатой прогрессии опухолей, в конечном итоге образующих ОСС, которые и описываются в полностью развитых опухолях.
Недавние работы связали между собой появление черт ОСК с программой трансдифференцировки ЭМП, описанной выше (Singh and Settleman, 2010; Mani et al., 2008; Morel et al., 2008). Активация этой программы в некоторых модельных системах может индуцировать многие определяющие особенности стволовых клеток, включая способность к самообновлению и антигенный фенотип, проявляющийся как в нормальных, так и опухолевых стволовых клетках. Это соответствие ведёт к тому, что программа ЭМП не только способна индуцировать диссеминирование опухолевых клеток от первичной опухоли, но может также присваивать таким клеткам способность к самообновлению, что является ключевой для их последовательной клональной экспансии в участках диссеминации (Brabletz et al., 2005). Обобщая — эта связь порождает важное гипотетическое следствие: разнородные сигналы, запускающие ЭМП, подобные тем, которые высвобождаются активированной, воспалительной стромой, также могут быть важны в создании и сохранении ОСК.
Всё большее число человеческих опухолей, как выясняется, содержит субпопуляции с характеристиками ОСК, определяемые по их опухоль-индуцирующей способности после ксенотрансплантации в мышей. Тем не менее, вопрос о значительности ОСК как отдельного фенотипического подкласса неопластических клеток остаётся дискуссионным, так же как и их малочисленность в составе опухолей (Boiko et al., 2010; Gupta et al., 2009; Quintana et al., 2008). В действительности, вероятно, что фенотипическая пластичность, наблюдаемая в опухолях, может вести к взаимопревращению в обоих направлениях между ОСК и не-ОСК, что сказывается на динамической вариации в относительной распространенности ОСК. Подобная пластичность может усложнять точное измерение их масштабности. Аналогичная пластичность уже принимает участие в программе ЭМП, которая может быть обратимой (Thiery and Sleeman, 2006).
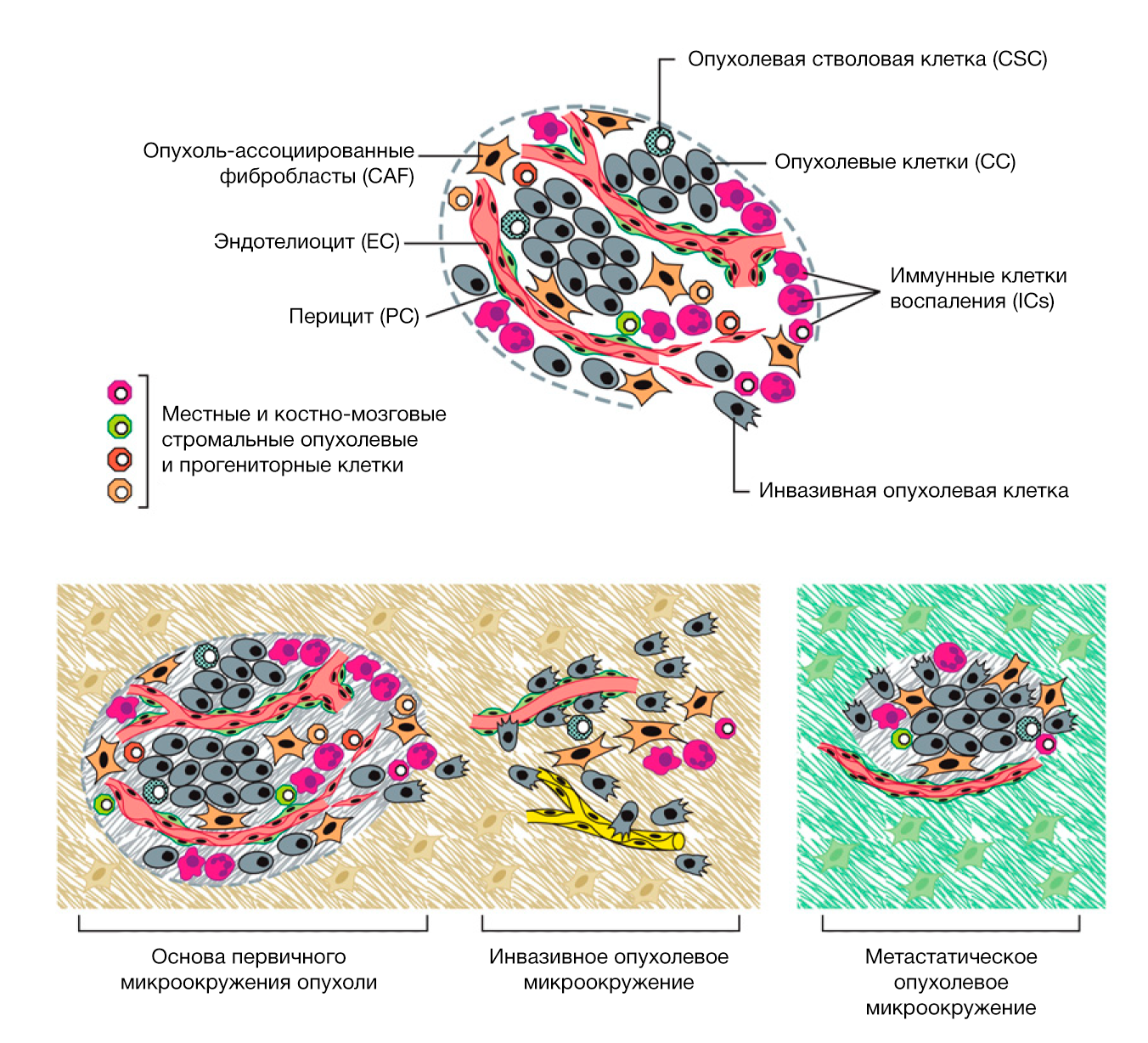
(Снизу) Разнообразие микроокружений в опухолях. Множество стромальных клеток создают последовательность из различных видов опухолевых микроокружений, которые меняются в ходе инвазии опухолями здоровых тканей, а также при их прорастании и колонизации других тканей. Плотность, гистологическая организация и фенотипические особенности стромальных клеточных типов, а также внеклеточного матрикса (на заднем фоне), развиваются в ходе прогрессии, вследствие чего имеют место первичный, инвазивный и позже — метастатический рост. Нормальные клетки, лежащие по окружности первичных и метастатических участков, отображены лишь схематично; они, вероятно, влияют на характер различных видов неопластических микроокружений. (Не показаны предраковые этапы опухолегенеза, которые также имеют различные типы микроокружений.)
Несмотря на эти сложности, доказано, что эта новая мера опухолевой гетерогенности является важным подспорьем для успешной терапии рака. Всё больше подтверждений находит идея о том, что клетки, обладающие свойствами ОСК, более устойчивы к различным широко применяемым химиотерапиям (Singh and Settleman, 2010; Creighton et al., 2009; Buck et al., 2007). Наличие такой выносливости может помочь объяснить практически неминуемый рецидив заболевания на фоне успешной циторедукции солидных опухолей радиационным излучением и разными формами химиотерапии. В действительности, ОСК могут лежать в основе некоторых форм наблюдаемых покоящихся опухолей, благодаря чему латентные опухолевые клетки персистируют годами и даже десятилетиями после хирургической резекции или радио/химиотерапии, чтобы однажды внезапно проявиться и инициировать смертельно опасное заболевание. Следовательно, ОСК могут представлять собой двойную угрозу, так как они более устойчивы к терапевтическому уничтожению и, в то же время, наделены способностью возрождать опухоль после того, как она когда-то была излечена.
Фенотипическая пластичность, подозреваемая в ОСК, может также активировать формирование функционально обособленных субпопуляций внутри опухоли, которые поддерживают опухолевый рост по различным направлениям. Например, ЭМП может трансформировать клетки эпителиальной карциномы в мезенхимальные, фибробласт-подобные опухолевые клетки, которые могут сочетать свойства опухоль-ассоциированных фибробластов (ОАФ, CAFs) в некоторых опухолях. Примечательно, что в нескольких недавних работах была задокументирована способность клеток глиобластомы (или, возможно, их ОСК-субпопуляций) трансдифференцировать в клетки подобные эндотелию, которые могут замещать эндотелиальные клетки организма-хозяина, формируя опухолевую новообразованную сосудистую сеть (Soda et al., 2011; El Hallani et al., 2010; Ricci-Vitiani et al., 2010; Wang et al., 2010). Подобные этим, наблюдения показывают, что некоторые опухоли могут приобретать стромальную подложку посредством процесса, при котором их собственные опухолевые клетки подвергаются различным типам метаморфоза для образования клеточных типов стромы вместо опоры на рекрутированные клетки хозяина для обеспечения их функций.
Открытия ОСК и биологической пластичности в опухолях демонстрируют, что единичная генетически однородная популяция клеток в составе опухоли может, тем не менее, быть фенотипически гетерогенной в связи с нахождением клеток на различных стадиях дифференцировки. Однако, в равной степени важным источником фенотипической изменчивости может быть также и генетическая гетерогенность опухоли, которая усиливается с течением опухолевой прогрессии. Таким образом, повышенная генетическая нестабильность, проявляющаяся на поздних стадиях опухолевой прогрессии, может вести к выраженному генетическому многообразию, что включает процесс отбора по Дарвину; в результате образуются генетически различные субпопуляции, причём настолько быстро, что они не успевают элиминироваться.
Подобное умозаключение подтверждается тщательным анализом последовательностей геномов опухолевых клеток, что стало возможным благодаря большому прогрессу в ДНК- (и РНК-) секвенировании. Таким образом, секвенирование геномов опухолевых клеток, вырезанных из разных участков одной и той же опухоли (Yachida et al., 2010), показало наличие явной внутриопухолевой генетической гетерогенности. Некоторые из элементов генетического многообразия могут быть отражены в их гистологической неоднородности внутри опухоли. Напротив, это генетическое многообразие может индуцировать функциональную специализацию, что ведёт к образованию субпопуляций опухолевых клеток, которые, определяя дополнительные способности, могут вносить свой вклад в общий процесс по ускорению опухолевого роста.
Эндотелиальные клетки
Многие элементы клеточной гетерогенности опухолей найдены в их стромальных пространствах. Важнейшими среди компонентов стромы являются клетки, формирующие опухолевую сосудистую сеть. Механизмы развития, дифференцировки и гомеостаза эндотелиальных клеток, составляющих артерии, вены и капилляры, были достаточно хорошо изучены уже в 2000-ом году. Таковым же было представление об «ангиогенном переключателе», активирующем покоящиеся эндотелиальные клетки, заставляя их вступать в клеточную программу конструирования новых кровеносных сосудов (см. выше). За последнее десятилетие сеть взаимосвязанных сигнальных путей, в которых участвуют лиганды рецепторов сигнальной трансдукции, представленных эндотелиальными клетками (например, Notch, Neuropilin, Robo и Eph-A/B), были добавлены к списку таких уже признанных сигналов, как VEGF, ангиопоэтин, FGF (фактор роста фибробластов). Эти по-иному охарактеризованные пути участвуют в эмбриональном и опухолевом ангиогенезах и иллюстрируют сложность регуляции фенотипов клеток эндотелия (Pasquale, 2010; Ahmed and Bicknell, 2009; Dejana et al., 2009; Carmeliet and Jain, 2000).
Другим направлением в исследовании является обнаружение отдельных профилей генной экспрессии ассоциированных с опухолью эндотелиальных клеток и идентифицирование маркёров клеточной поверхности на люминальной (обращённой к просвету сосуда) стороне нормальных и опухолевых эндотелиальных клеток (Nagy et al., 2010; Ruoslahti et al., 2010; Ruoslahti, 2002). Различия во внутриклеточной передаче сигналов (на профилях транскриптомов) и в сосудистых «ZIP-кодах», вероятно, окажутся важными для понимания перехода нормальных эндотелиальных клеток в опухолевые. Это знание может вести, в свою очередь, к возможностям развития новых стратегий лечения, использующих эти различия в целях избирательного поражения опухоль-ассоциированных клеток эндотелия.
Тесно связаны с эндотелиальными клетками системного кровообращения те, что формируют лимфатические сосуды (Tammela and Alitalo, 2010). Их роль в опухоль-ассоциированной строме, в частности, в поддержке опухолевого роста, плохо изучена. В действительности, из-за высокого давления в интерстриции солидных опухолей внутриопухолевые лимфатические сосуды обычно сжимаются и не функционируют; напротив, однако, зачастую есть рабочие активно растущие («лимфоангиогенные») лимфатические сосуды на перифериях опухолей и в смежных здоровых тканях, в которые произошла инвазия опухолевых клеток. Эти лимфопротоки, вероятно, служат в качестве каналов для распространения метастаз в дренирующих лимфатических сосудах, что наблюдается во множестве типов опухолей.
Перициты
Как упомянуто ранее, перициты представляют специализированный мезенхимальный клеточный тип (относящийся к гладким мышечным клеткам) с пальцеподобными выступами, обхватывающими эндотелиальную трубку кровеносного сосуда. В нормальных тканях перициты известны своей функцией по обеспечению паракринных сигналов поддержки для нормального покоящегося эндотелия. К примеру, Ang-1, секретирующийся перицитами, передаёт стабилизирующий сигнал антипролиферации на поверхность эндотелиальных клеток; некоторые перициты также образуют VEGF в малых количествах, который обладает трофической функцией в гомеостазе эндотелия (Gaengel et al., 2009; Bergers and Song, 2005). Перициты также взаимодействуют с эндотелиальными клетками для синтеза сосудистой базальной мембраны, фиксирующей как перициты, так и клетки эндотелия и помогающей сосудистым стенкам в сопротивлении гидростатическому давлению или потоку крови.
Мобилизация и ассоциация перицитов генетическим или фармакологическим путями выявили функциональную важность этих клеток в поддержке опухолевого эндотелия (Pietras and Ostman, 2010; Gaengel et al., 2009; Bergers and Song, 2005). К примеру, фармакологическое ингибирование сигнальной передачи через рецептор PDGF, экспрессируемый опухолевыми перицитами и костно-мозговыми предшественниками перицитов, ведёт к снижению способности перицитов покрывать сосуды опухолей, что, в свою очередь, дестабилизирует целостность и функцию сосудов (Pietras and Ostman, 2010; Raza et al., 2010; Gaengel et al., 2009); примечательно, в то же время, что перициты нормальных сосудов не склонны к подобному фармакологическому разрушению, что демонстрирует ещё один пример различий в регуляции нормальных покоящихся и опухолевых сосудистых сетей. Одна интригующая гипотеза, ждущая подтверждения, гласит, что опухоли с бедной площадью перекрытия перицитами их сосудов могут сильнее способствовать интравазации опухолевых клеток в систему циркуляции, индуцируя последовательную гематогенную диссеминацию.
Иммунные клетки воспаления
Как отмечалось выше, инфильтрирующие клетки иммунной системы всё чаще признаются незначительными компонентами опухолей. Эти воспалительные клетки действуют по альтернативным направлениям: как угнетающие, так и ускоряющие опухолевый рост лейкоциты могут присутствовать, в различных соотношениях, в большинстве (если не всех) очагов неоплазий. Несмотря на то, что наличие угнетающих опухоли ЦТЛ и ЕК-клеток не вызывает удивления, распространение в очагах иммунных клеток, усиливающих отличительные способности рака, стало по большей мере неожиданным. Данные о том, что инфильтрация неопластических тканей клетками иммунной системы, как это ни странно, потенцирует опухолевую прогрессию, стали накапливаться в поздние 1990-е. Эти работы отсылают обратно, к связи участков хронического воспаления с формированием опухоли, а также к такому наблюдению, что опухоли могут быть описаны как раны, которые никогда не заживают (Scha¨ fer and Werner, 2008: Dvorak, 1986). В процессе нормального заживления ран и борьбы с инфекциями иммунные клетки воспаления возникают и вскоре исчезают, в отличие от их персистирования в участках хронического воспаления, где их присутствие связано с различными тканевыми патологиями, включая фиброз, нарушенный ангиогенез и неоплазию (Grivennikov et al., 2010; Karin et al., 2006).
За последнее десятилетие, манипуляции генов, вовлеченных в определение эффекторных функций различных иммунных клеточных типов, вместе с фармакологическими ингибиторами подобных клеток или их функций, было показано, что они играют разнообразные и ключевые роли в процессе ускорения опухолегенеза. Реестр опухоль-стимулирующих воспалительных клеток в настоящее время включает также подтипы макрофагов, тучные клетки и нейтрофилы, наряду с Т- и В-лимфоцитами (Coffelt et al., 2010; DeNardo et al., 2010; Egeblad et al., 2010; Johansson et al., 2008; Murdoch et al., 2008; DePalma et al., 2007). Подобные исследования послужили толчком к созданию постоянно пополняемого списка сигнальных молекул, высвобождаемых клетками воспаления, которые служат эффекторами их действий по стимуляции опухолей. Сюда входят опухолевый фактор роста EGF, ангиогенный фактор роста VEGF, другие проангиогенные факторы наподобие FGF2, хемокины и цитокины, которые потенцируют воспаление; помимо этого, данные клетки могут образовывать проангиогенные и/или проинвазивные ферменты деградации матрикса, включая ММР-9 и другие матриксные металлопротеиназы, цистеиновые катепсин-протеазы и гепараназы (Qian and Pollard, 2010; Murdoch et al., 2008). В соответствии с их экспрессией этих различных эффекторов, опухоль-инфильтрирующие воспалительные клетки, как было показано, индуцируют и помогают поддерживать опухолевый ангиогенез, стимулируют пролиферацию опухолевых клеток, способствуют, благодаря их присутствию в краевых зонах опухолей, тканевой инвазии и усиливают диссеминирование путём метастазирования и заякоривание опухолевых клеток на новом месте (Coffelt et al., 2010; Egeblad et al., 2010; Qian and Pollard, 2010; Mantovani, 2010; Joyce and Pollard, 2009; Mantovani et al., 2008; Murdoch et al., 2008; DePalma et al., 2007).
Вдобавок к полностью дифференцированным иммунным клеткам, представленным в опухолевой строме, множество частично дифференцированных миелоидных прогениторов также были опознаны в опухолях (Murdoch et al., 2008). Такие клетки являются посредниками между циркулирующими клетками предшественника из костного мозга и дифференцированными иммунными клетками, обычно находящимися в нормальных и воспаленных тканях. Важно отметить, что эти прогениторы, как и их более дифференцированные потомки, имеют явную опухоль-стимулирующую активность. Было продемонстрировано, что один из классов опухоль-инфильтрирующих миелоидных клеток (определяемых по коэкспрессии маркёра макрофагов CD11b и нейтрофилов – Gr1) угнетает активность ЦТЛ и ЕК, они были независимо идентифицированы как МСК (MDSСs) (Qian and Pollard, 2010; Ostrand-Rosenberg and Sinha, 2009). Эта особенность повышает вероятность того, что мобилизация некоторых миелоидных клеток может быть вдвойне выгодной для развивающихся опухолей, так как она ведёт к прямой стимуляции ангиогенеза и опухолевой прогрессии, в то же время предоставляя пути по избеганию уничтожения иммунитетом.
Такое, на первый взгляд, нелогичное сосуществование стимулирующих и угнетающих опухоли иммунных клеток может быть объяснено, если рассмотреть роли иммунной системы: с одной стороны, иммунная система избирательно определяет и уничтожает инфекционные агенты посредством адаптивного иммунного ответа при поддержке клеток врождённого иммунитета; с другой стороны, врождённая иммунная система участвует в заживлении ран и очищении ткани от мертвых клеток и клеточных отходов. Эти специализированные задачи выполняются различными подклассами клеток воспаления, а именно классом классических макрофагов и нейтрофилов (вовлеченные в поддержку приобретенного иммунитета) и подклассами «альтернативно активированных» макрофагов, нейтрофилов и миелоидных прогениторов, участвующих в заживлении ран и тканевой очистке (Egeblad et al., 2010; Mantovani, 2010; Qian and Pollard, 2010; Johansson et al., 2008). Поздние подтипы иммунных клеток являются одними из основных источников ангиогенных, эпителиальных и стромальных факторов роста, а также ферментов, способствующих перестройке матрикса, которые нужны для заживления ран, и это те клетки, что мобилизуются и разрушают элементы, поддерживая неопластическую прогрессию. Сходным образом подклассы В- и Т-лимфоцитов могут способствовать мобилизации, активации и распространению подобных ранозаживляющих и опухоль-стимулирующих макрофагов и нейтрофилов (DeNardo et al., 2010; Egeblad et al., 2010; Biswas and Mantovani, 2010). Разумеется, другие подклассы В- и Т-лимфоцитов и клеточные типы врожденного иммунитета могут производить явно выраженный ответ по ликвидации опухоли. Равновесие между конфликтующими воспалительными ответами в опухолях, вероятно, играет важную роль в прогнозировании и, вполне возможно, в терапии, назначаемой в целях перенаправления этих клеток по пути опухолевой деструкции.
Ассоциированные с опухолью фибробласты
Фибробласты найдены в различных соотношениях во всём многообразии карцином, представляя собой во многом доминирущую популяцию клеток опухолевой стромы. Понятие «ассоциированный с опухолью фибробласт» относится, как минимум, к двум отдельным клеточным типам: (1) клетки наподобие фибробластов, создающие структурную основу для большинства нормальных эпителиальных тканей и (2) миофибробласты, биологические роли и свойства которых различаются от тех тканевых фибробластов. Миофибробласты можно идентифицировать по их экспрессии α-гладкомышечного актина (ГМА, SMA). Они редки в большинстве здоровых тканей эпителия, хотя некоторые органы, такие как печень и поджелудочная железа, содержат заметные количества экспрессирующих α-ГМА клеток. Миофибробласты временно изобилуют в ранах, а также найдены в участках хронического воспаления. Несмотря на полезную для тканей функцию восстановления, миофибробласты играют противоречивую роль в хроническом воспалении, способствуя патологическому фиброзу, который наблюдается в таких органах, как лёгкие, почки и печень.
Мобилизированные миофибробласты являются перепрограммированными вариантами нормальных тканевых фибробластов, усиливающих, как было показано, опухолевые фенотипы, такие как пролиферацию опухолевых клеток, ангиогенез, инвазивность и метастазирование; их опухоль-стимулирующие действия были во многом определены посредством трансплантации ассоциированных с опухолью фибробластов вперемешку с опухолевыми клетками в мышей, а ещё ранее – генетическим и фармакологическим нарушением их функций в предрасположенных к опухолеобразованию мышах (Dirat et al., 2010; Pietras and Ostman, 2010; Ra¨ sa¨ nen and Vaheri, 2010; Shimoda et al., 2010; Kalluri and Zeisberg, 2006; Bhowmick et al., 2004). Благодаря секреции множества внеклеточных компонентов матрикса, ассоциированные с опухолью фибробласты вовлечены в формирование десмопластической стромы, которая характерна для многих прогрессивных карцином. Полный спектр ролей обоих подтипов ассоциированных с опухолью фибробластов в патогенезе опухоли ещё предстоит определить.
Стволовые и прогениторные клетки опухолевой стромы
Различные клеточные типы стромы, формирующие микроокружение опухоли, могут быть мобилизованы из смежной нормальной ткани – наиболее вероятный резервуар таких клеточных типов. Однако, в последние годы ключевым источником опухолевых стромальных клеток стал считаться костный мозг (Bergfeld and DeClerck, 2010; Fang and Salven, 2011; Giaccia and Schipani, 2010; Patenaude et al., 2010; Lamagna and Bergers, 2006). Зафиксировано явление перемещения мезенхимальных стволовых и прогениторных клеток в опухоли из костного мозга, где они способны дифференцироваться во множество хорошо изученных стромальных клеточных типов. Некоторые из этих ранних представителей могут также находиться в недифференцированном или частично дифференцированном состояниях, проявляя те функции, которые отсутствуют у их более дифференцированных предшественников.
Костномозговые источники стромальных клеточных типов были выявлены при помощи мышей с опухолями, в которых клетки костного мозга и, соответственно, их диссеминированных потомков, были избирательно ассоциированные с такими метками, как зелёный флуоресцирующий белок (GFP). Наряду с тем, что иммунные клетки воспаления уже давно известны как производные красного костного мозга, в последние годы на различных мышиных моделях рака были описаны прогениторы перицитов и различных подтипов ассоциированных с опухолью фибробластов, также происходящих из костного мозга (Bergfeld and DeClerck, 2010; Fang and Salven, 2011; Giaccia and Schipani, 2010; Lamagna and Bergers, 2006); существование и функциональная важность эндотелиальных прогениторов и их роль в опухолевом ангиогенезе на данный момент ещё не рассмотрены (Fang and Salven, 2011; Patenaude et al., 2010). Взятые вместе, эти различные данные свидетельствуют, что опухоль-ассоциированные стромальные клетки могут поддерживать растущие опухоли посредством пролиферации предшественников клеток стромы, дифференцировки in situ местных стволовых/прогениторных клеток, происходящих из соседних здоровых тканей или же через мобилизацию стволовых/прогениторных клеток красного костного мозга.
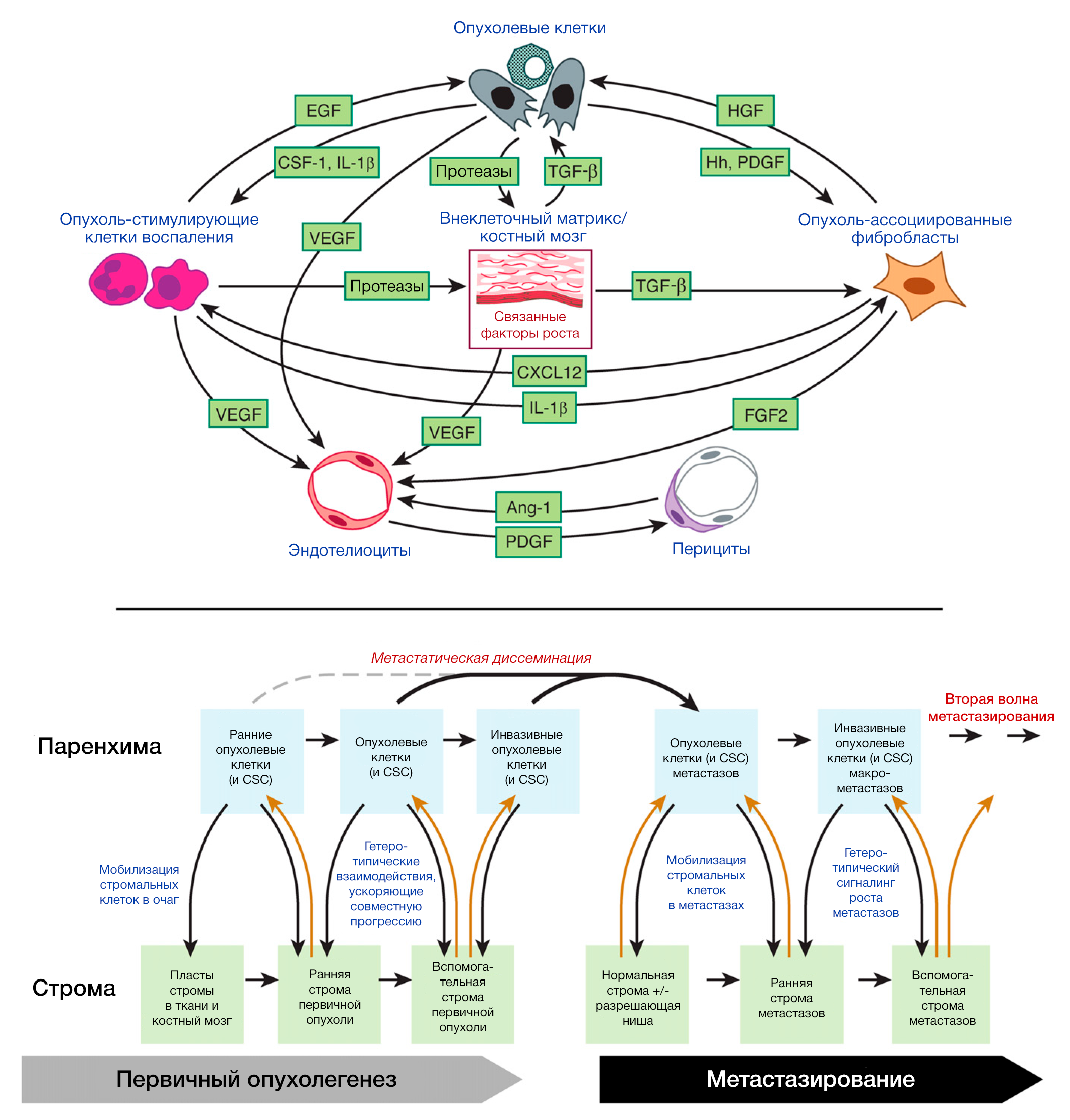
(Снизу) Внутриклеточный сигнальный путь, отображенный на верхней панели, в пределах опухолевого микроокружения не статичен, а меняется в ходе опухолевой прогрессии в результате реципрокных сигнальных взаимодействий между опухолевыми клетками паренхимы и стромальными клетками, которые обеспечивают развитие всё более агрессивного фенотипа, лежащего в основе роста, инвазивности и метастазирования. Важно отметить, что склонность к образованию очагов метастазов может проявиться рано, на что влияет программа дифференцировки нормальной клетки-предшественницы или первоначальные очаги онкогенеза. Некоторые участки органа (иногда относимые к «плодородным почвам» (‘‘fertile soil’’) или «метастатическим нишам») могут быть особенно благоприятными для прорастания метастазов и колонизации некоторыми типами опухолевых клеток благодаря локальным особенностям, которые в равной степени присущи как здоровым тканям, так и индуцированным на расстоянии системными влияниями первичных опухолей. Опухолевые стволовые клетки могут быть по-разному вовлечены в некоторые (или даже во все) различные этапы первичного опухолегенеза и метастазирования.
Гетеротипическая сигнальная трансдукция регулирует клетки опухолевого микроокружения
Описания внутриклеточных схем, управляющих биологией опухолевых клеток (например, Рисунок 2) нуждаются в дополнении схожими диаграммами, обозначающими сложные взаимодействия между неопластическими и стромальными клетками в составе опухоли и динамичным внеклеточным матриксом, который согласованно сооружается и перестраивается ими (Egeblad et al., 2010; Kessenbrock et al., 2010; Pietras and Ostman, 2010; Polyak et al., 2009). В достаточной степени полное графическое описание сети сигнальных взаимодействий микроокружения нуждается в более подробном изучении, как предстоит определить и большую часть сигнальных молекул и путей. А на данный момент мы представляем небольшую долю подобных взаимодействий на Рисунке 5 (верх.). Эти некоторые хорошо установленные примеры служат образцом сигнальной сети той сложной системы, которая важна для патогенеза опухоли.
Другой аспект проявления сложности не отображен на этой простой схеме: и неопластические, и стромальные клетки вокруг них изменяются в ходе многоэтапной трансформации нормальных тканей в очень развитую злокачественную опухоль. Эта гистопатологическая прогрессия должна отражать изменения в гетеротипической сигнальной трансдукции между опухолевой паренхимой и стромой.
Такая поэтапная прогрессия, вероятно, зависит от реципрокных взаимодействий между неопластическими клетками и обслуживающими клетками стромы, как описано на Рисунке 5 (ниж.). Таким образом, ранние неоплазии начинают взаимодействие посредством мобилизации и активации стромальных клеточных типов, которые собираются в начальной, предопухолевой строме, которая, в свою очередь, реагирует реципрокно, усиливая неопластические фенотипы соседних опухолевых клеток. Последние, способные далее развиваться по пути генетических изменений, снова посылают сигналы обратно к строме, продолжая перепрограммирование нормальных стромальных клеток во славу зарождающейся опухоли; в конечном счете сигналы, исходящие из опухолевой стромы, активируют опухолевые клетки и способствуют их инвазии в нормальные, смежные с ними ткани и диссеминации.
Эта модель реципрокного гетеротипического сигналинга должна быть расширена до финального этапа многоступенчатой опухолевой прогрессии – метастазирования (Рисунок 5, справа снизу). Циркулирующие опухолевые клетки, высвобождаемые из первичной опухоли, покидают микроокружение, образованное поддерживающей стромой таких опухолей. Однако до момента проникновения в отдалённые органы эти опухолевые клетки встречают наивное, полностью нормальное тканевое микроокружение. Следовательно, многие гетеротипические сигналы, формирующие их фенотип, пока они находились в составе первичной опухоли, могут отсутствовать в участках диссеминирования, что создает барьер для роста осевших опухолевых клеток. Таким образом, последовательность реципрокных взаимодействий опухолевых и стромальных клеток, которая определяла многоступенчатую прогрессию в первичной опухоли, теперь должна быть повторена заново в других тканях, участки которых были колонизированы диссеминированными опухолевыми клетками.
Несмотря на то, что такая логика применима лишь к некоторым метастазам, в других случаях, о чем упомянуто ранее, некоторые тканевые микросреды могут по множеству причин уже выполнять роль подложки для только-только осевших опухолевых клеток; подобные «разрешающие» участки были отнесены к «метастатическим нишам» (Peinado et al., 2011; Coghlin and Murray, 2010). В этом контексте термин представляет собой представление о том, что опухолевые клетки, осевшие в подобных участках, могут не нуждаться в инициации со стороны стромы, так как она уже существовала до этого хотя бы частично. Такая разрешающая способность может быть свойственна участку ткани (Talmadge and Fidler, 2010) или индуцирована заранее циркулирующими факторами, высвобождаемыми первичной опухолью (Peinado et al., 2011). Наиболее хорошо описанными компонентами индуцированных преметастатических ниш являются опухоль-стимулирующие клетки воспаления, хотя другие клеточные типы и ЭМП могут также играть важную роль в различных условиях метастазирования.
Вероятность того, что сигнальные взаимодействия между опухолевыми клетками и их стромой развиваются в ходе всего многоуровневого опухолегенеза, явно осложняет цель как можно более полного описания механизмов патогенеза рака. К примеру, это озадачивает системных биологов, которые пытаются обозначить главные регуляторы сетей, контролирующих малигнизацию. Более того, кажется вероятным, что понимание этого динамического многообразия станет ключевым для развития новых стратегий лечения, созданных в целях (для) успешного нацеливания и уничтожения как первичных опухолей, так и метастазов.
ПРИЦЕЛЬНАЯ ТЕРАПИЯ
Введение адресной терапии для лечения опухолей у человека стало одной из главных задач последних трех десятилетий значительного прогресса в исследовании механизмов патогенеза рака. Мы не собираемся перечислять здесь мириады стратегий лечения, которые находятся на стадии проработки или недавно были введены в клиническую практику. Вместо этого мы обсуждаем, каким образом описание отличительных принципов является инициатором оказания влияния на развитие терапии в настоящем и в нарастающих темпах – в будущем.
Быстро развивающееся медицинское оснащение прицельной (таргетной, англ. targeted therapy) терапии может быть классифицировано в соответствии с её эффектами на один или более ключевых признаков рака, как показано на примерах, представленных на Рисунке 6. В действительности, наблюдаемая эффективность этих препаратов отражает, в каждом случае, подтверждение отдельной особенности: если признак по-настоящему важен для биологии опухолей, следовательно, его угнетение должно ухудшить опухолевый рост и прогрессию.
Заметим, что большинство препаратов, нацеленных на отличительные черты рака и созданные на настоящий момент, были сознательно направлены на специфические молекулярные мишени, вовлеченные в определенный путь активации того или иного признака. Такая специфичность действия считается необходимой, так как при избирательной ингибиторной активности организму наносится относительно меньше побочных эффектов, что в результате определяет меньшую токсичность. В сущности, итоговая клиническая реакция временна и не исключены рецидивы.
Одна из интерпретаций этого, при поддержке многих экспериментальных доказательств, состоит в том, что каждая из ключевых особенностей регулируется несколько избыточными сигнальными путями. Следовательно, терапевтический агент, ингибирующий один важный путь сигнальной трансдукции в опухоли, не останавливает развитие признака полностью, позволяя некоторым опухолевым клеткам выживать с остаточными характеристиками до тех пор, пока они или их потомки случайно не адаптируются к избирательному действию со стороны применяемой терапии. Такая адаптация, которая может быть обусловлена мутацией, эпигенетическим перепрограммированием или преобразованием стромального микроокружения, способна восстановить эту функциональную способность рака, способствуя возобновленному опухолевому росту и клиническому рецидиву. Учитывая, что количество параллельных сигнальных путей, поддерживающих данный признак, должно быть ограниченным, становится возможным нацеливание на все эти пути терапевтических агентов, посредством чего можно достичь предупреждения развития приобретенной устойчивости.
В ответ на терапию опухолевые клетки могут также понизить свою зависимость от конкретных признаков, становясь более зависимыми от других; это представляет собой несколько другу форму приобретенной лекарственной устойчивости. Эта концепция потверждается недавними открытиями неожиданных реакций на антиангиогенную терапию. Некоторые предвидели, что эффективное угнетение ангиогенеза будет удерживать опухоли в покоящемся состоянии и, возможно, даже способно запустить их ликвидацию и рассасывание (Folkman and Kalluri, 2004). С другой стороны, клинические реакции при антиангиогенной терапии лишь временны (Azam et al., 2010; Ebos et al., 2009; Bergers and Hanahan, 2008).
В некоторых доклинических моделях, где потенциальные ингибиторы ангиогенеза успешно справлялись с угнетением этого отличительного признака, опухоли адаптируются и переключаются с зависимости от непрерывного ангиогенеза на усиление проявления вместо этого других признаков – инвазивности и метастазирования (Azam et al., 2010: Ebos et al., 2009; Bergers and Hanahan, 2008). Изначально находящиеся в условиях гипоксии опухолевые клетки инвазируют соседние ткани и обеспечиваются, таким образом, нормальным сосудистым кровоснабжением. Начальная клиническая валидация этой приобретенной устойчивости выражена в усиленной инвазионной способности и местном метастазировании, что наблюдается при лечении человеческой глиобластомы антиангиогенными препаратами (Ellis and Reardon, 2009; Norden et al., 2009; Verhoeff et al., 2009). Пригодность этих очагов для других видов злокачественных опухолей человека еще предстоит установить.
Аналогичное адаптивное переключение в зависимости от других отличительных особенностей может также ограничивать эффективность сходных методов терапий, нацеленных на конкретные признаки рака. К примеру, применение препаратов, индуцирующих апоптоз, может способствовать гиперактивации митогенной сигнальной передачи в опухолевых клетках, помогая им восполнить начальные потери, вызванные подобным лечением. Подобные оценки предполагают, что для создания препаратов и протоколов лечения необходимо учитывать представления о функционально дискретных отличительных признаках и множественных биохимических путях, вовлеченных в поддержку каждого из них. При этом, в частности, мы можем предположить, что избирательное нацеливание одновременно на главные ключевые характеристики и развивающиеся признаки (Рисунок 6) в алгоритмических сочетаниях повлияет на формирование более эффективной и долговременной терапии против рака.
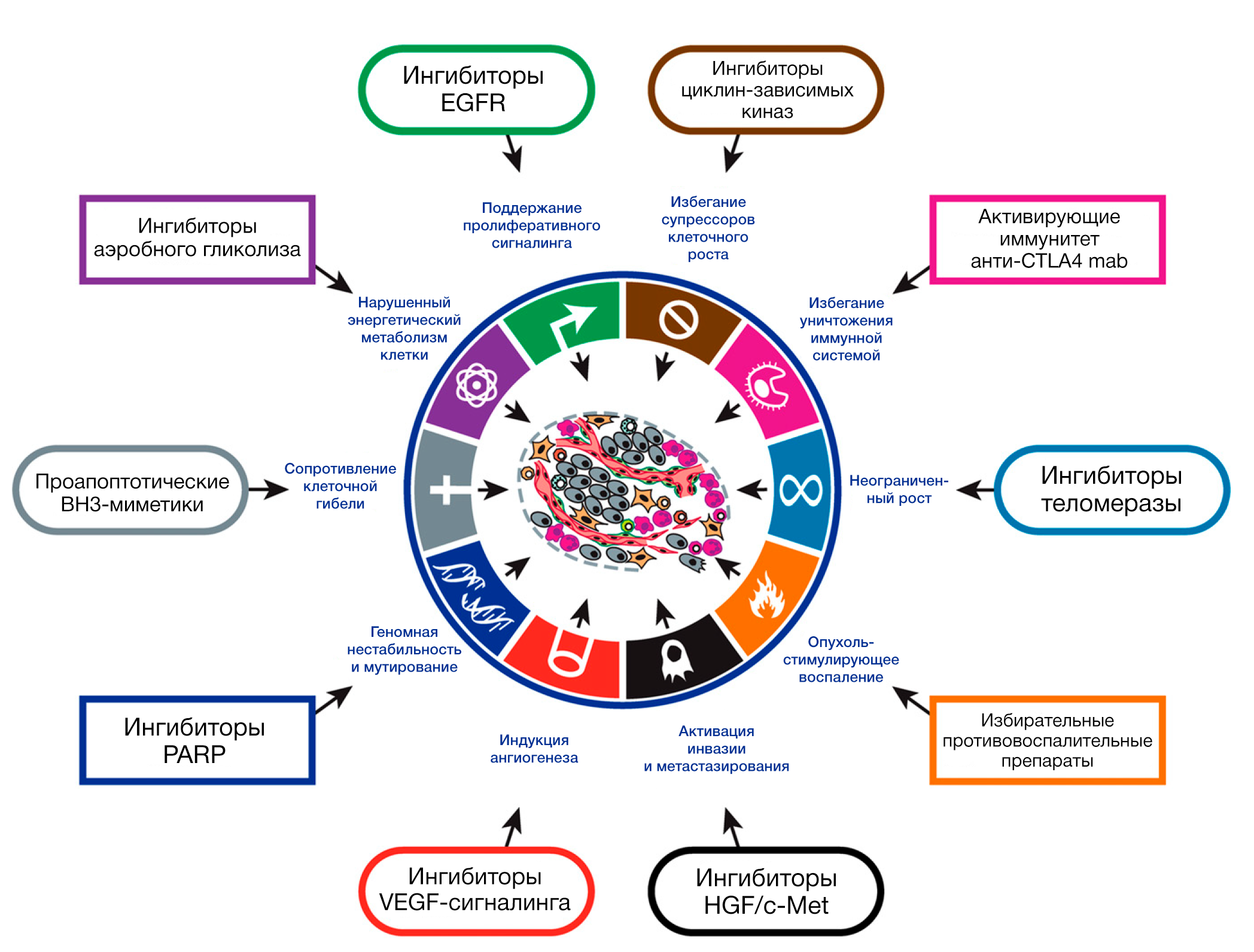
ВЫВОДЫ И ВЗГЛЯД В БУДУЩЕЕ
В этой работе мы постарались пересмотреть, улучшить и дополнить представления о ключевых признаках рака, что стало бы полезным каркасом для понимания сложной биологии рака.
Шесть принятых особенностей – признаков рака – выдержали испытание временем, являясь общими составляющими для большинства видов рака. Дальнейшее совершенствование этих ключевых организационных принципов, без сомнения, придёт в обозримом будущем, что ознаменует продолжение прогресса в их изучении в последнем десятилетии.
Заглядывая вперед, мы представляем себе значительные успехи в ходе последующего десятилетия в нашем понимании процессов инвазии и метастазирования. Также будет прояснена роль аэробного гликолиза в злокачественных образованиях, включая разрешение вопроса о том, является ли такое перепрограммирование метаболизма отдельным признаком, отдельным от такого важного, как длительно поддерживаемая пролиферация. Также неясно, абсолютно ли все опухоли должны «обмануть» систему иммунного надзора для своей прогрессии, или же лишь часть наиболее иммуногенных представителей; этот аспект тоже так или иначе будет исследован.
В настоящее время остальные области изучаются достаточно быстрыми темпами. В последние годы были детально описаны молекулярные механизмы, контролирующие транскрипцию посредством модификации хроматина; существуют сведения, согласно которым в конфигурации хроматина происходят специфические переключения в ходе приобретения некоторых отличительных признаков (Berdasco and Esteller, 2010). Функционально значимые эпигенетические нарушения, вероятно, свойственны не только опухолевым клеткам, но и измененным клеткам опухоль-ассоциированной стромы. На данный момент неясно, сможет ли освещение этих эпигенетических механизмов переменить наше общее представление о том, которые из отличительных признаков приобретаются или просто добавляют новую деталь к схеме регуляции, которая уже известным образом направляет их.
Подобным образом, открытие сотен различных регуляторных микроРНК уже оказало сильное влияние на наше понимание механизмов генетического контроля, действующих в норме и при патологии. Сейчас описаны дюжины молекул микроРНК в различных опухолевых фенотипах (Garzon et al., 2010), и пока это лишь малая часть реальной сложности, так как известно, что в наших клетках функционируют сотни микроРНК, нарушенная экспрессия которых в разных формах рака остаётся под завесами тайны. И снова, мы не знаем, сможет ли прогресс в будущем изменить наше представление о патогенетических механизмах рака или же добавить какие-то детали к общей картине сложных регуляторных схем, которые уже описаны.
Подводя итог – диаграммы гетеротипических взаимодействий между множеством разных клеточных типов, которые собираются и вместе образуют различные формы и прогрессивно малигнизирующиеся стадии рака, в настоящее время неполны. В следующее десятилетие, мы предполагаем, что сигнальная схема, описывающая взаимодействие между различными клетками в составе опухолей, будет прочерчена в более детализированной и ясной форме, по сравнению с нашими настоящими знаниями. И, как и раньше (Hanahan and Weinberg, 2000), мы продолжаем смотреть на исследования рака как на крайне логичную науку, в которой мириады фенотипических сложностей – это проявления малой части лежащих в их основе ключевых организационных принципов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Дополнительная информация включает в себя шесть схем, которые можно загрузить для презентаций и можно найти вместе с этой статьей в онлайн-доступе на doi:10.1016/j.cell. 2011.02.013.
БЛАГОДАРНОСТИ
Мы благодарим Terry Schoop (OFC Graphics, Kensington, CA, USA) за активную помощь в подготовке рисунков. Также мы благодарим Gerard Evan (Cambridge, UK), Erwin Wagner (Madrid, ESP), and Zena Werb (San Francisco, USA) за ценные комментарии и предложения. D.H. и R.A.W. – профессора Американского общества по исследованию рака. Исследование в лабораториях авторов было поддержано Национальным институтом рака Соединенных Штатов. Из-за ограничений на место в манускрипте многие первые и исторические публикации не были процитированы, в частности в тех случаях, где доступны тематические обзоры.
