Кариес зубов

Абстракт | Кариес зубов — многофакторное динамическое заболевание, развивающееся при участии зубной биопленки и в присутствии сахаров, следствием которого является циклическая деминерализация и реминерализация твердых тканей зуба. Кариес как молочных, так и постоянных зубов может начаться в любом возрасте, при этом изначально поражается коронка, а по мере уменьшения десен — и обнаженная часть корня. Начало и развитие кариеса зависит от тонкого равновесия между действием патологических и защитных факторов. Взаимодействие между факторами лежит в основе выделения категорий риска по кариесу, что позволяет применять персонализированный подход к лечению. Кариес зубов — предотвратимое заболевание с неравномерно распределенной превалентностью, которое значительно влияет как на экономические аспекты здравоохранения, так и на качество жизни пациентов. Ежедневное использование зубной пасты с содержанием фтора считается главной причиной общего спада заболеваемости кариесом по всему миру за последние десятилетия. Цель данной статьи — рассказать о проблеме кариеса и современных, прогрессивных, комплексных, долгосрочных, ориентированных на пациента зубосохраняющих способах его лечения и профилактики, не забыв и о тех временах, когда основным методом лечения было оперативное восстановление утраченных тканей.
Введение
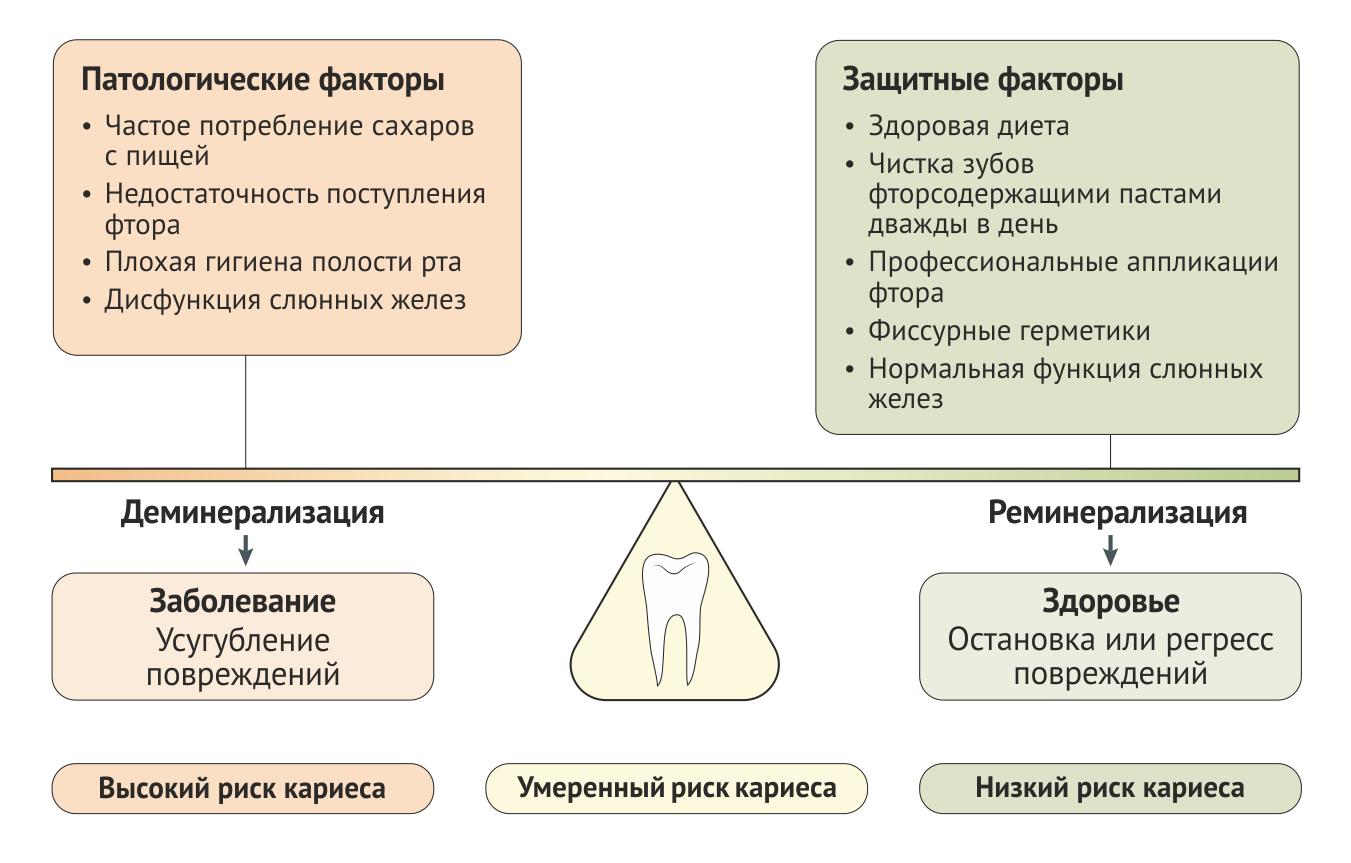
Кариес возникает в ходе взаимодействия поверхности зуба, сформированной на ней микробной биопленки (Рис. 1), и сахаров; кроме того, влияние оказывают также генетические факторы и слюна [1]. Динамический кариозный процесс состоит из быстро сменяющихся периодов деминерализации и реминерализации зуба, которые при условии достаточно длительного воздействия приводят к развитию специфических кариозных дефектов в определенных предрасположенных участках зуба. Защитные факторы способствуют реминерализации и приостановке развития поражения, в то время как патологические факторы смещают равновесие в сторону прогрессирования заболевания (Рис. 2). Многие эксперты считают ежедневную чистку зубов с использованием фторсодержащих зубных паст основной причиной общего падения заболеваемости кариесом по всему миру. Принцип действия таких зубных паст заключается в сдвиге равновесия биопленки в полости рта в сторону здоровья.
Размер кариозного поражения не коррелирует с наличием боли или неприятных ощущений. Тем не менее, сильная зубная боль может приводить к потере трудоспособности, а инфекция и сепсис, связанные с достигающими пульпы полостями, могут в отдельных случаях привести к серьезным системным последствиям: потере зуба, генерализованной инфекции, летальным осложнениям анестезии.
Кариес традиционно диагностируют в ходе тщательного визуального осмотра чистых зубов. Несмотря на то, что заостренные стоматологические зонды все еще используются в практике, получаемые с их помощью данные не очень ценны, при этом такой зонд может повредить твердые ткани зуба. Дентальные рентгенограммы и другие вспомогательные диагностические методы применяют для обнаружения недоступных визуальной оценке поражений, в частности, локализованных на апроксимальных поверхностях зубов (контактирующих поверхностях двух рядом стоящих зубов).
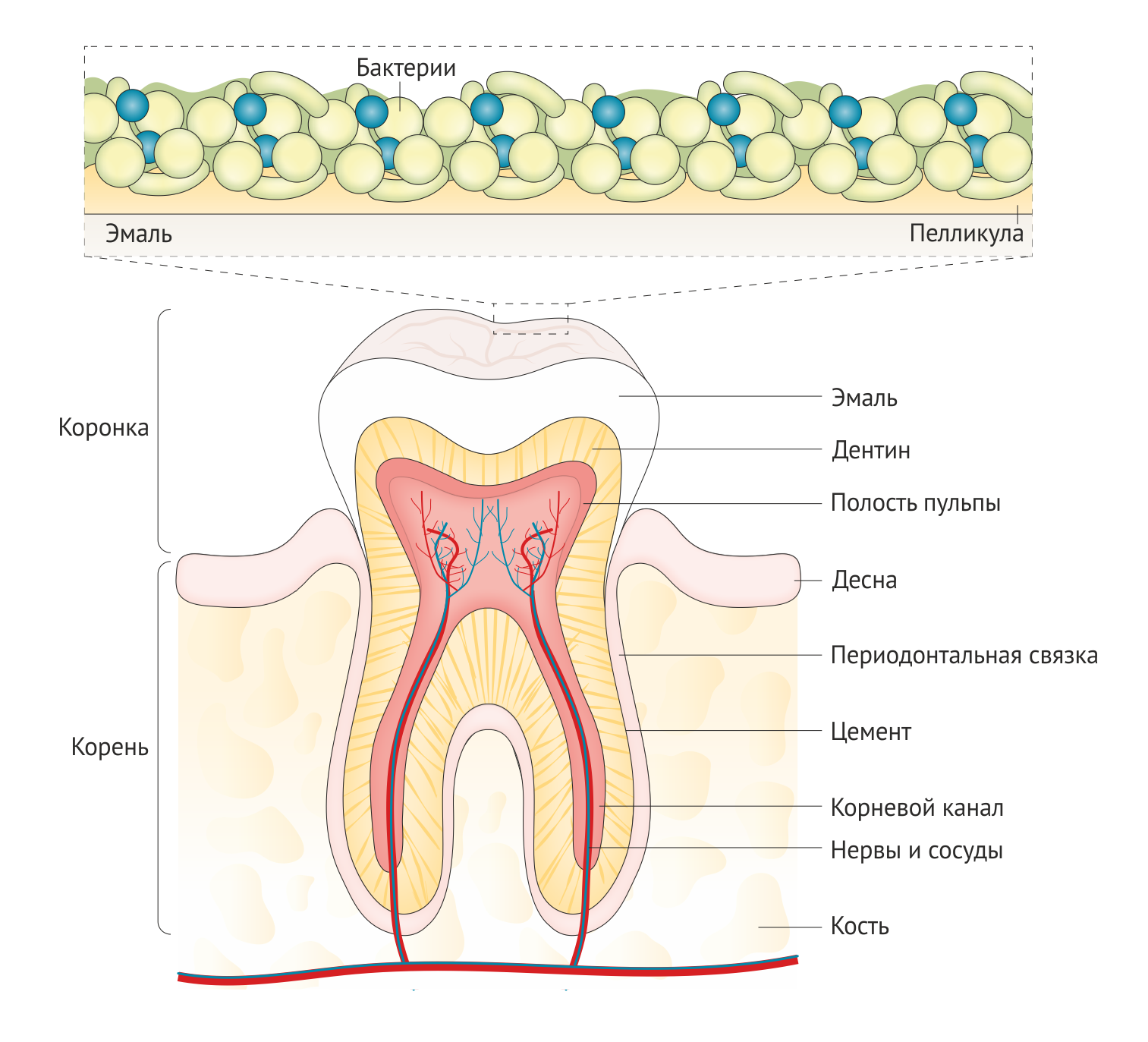
Хотя из-за разрушительного влияния кариеса может показаться, что зубы очень уязвимы к этому заболеванию, с точки зрения эволюционной биологии зубы человека являются высокоценной системой органов, отвечающей за захватывание и первичную обработку пищи, а также выполняющей ряд дополнительных функций: защита, сексуальное привлечение и фонетическая артикуляция [2]. Наружная поверхность коронки зуба состоит из эмали — наиболее твердой ткани организма (Рис. 1), а секретируемая в течение всего дня слюна поддерживает ее целостность. Эволюция современной морфологии зубов зависела преимущественно от пищевых предпочтений наших предков, менявшихся с течением времени [2]. Интересно, что диета с большим содержанием сахаров преимущественно состоит из мягких или жидких продуктов; для поглощения такой пищи зубы не требуются, чем можно объяснить возможность быстрой потери зубов.
Целью данной статьи является предоставление всестороннего обзора кариеса зубов как в качестве сложного многофакторного заболевания, так и в качестве динамически изменяющегося патологического процесса. В данной статье описаны все аспекты кариеса: эпидемиология, патофизиология, диагностика, оценка рисков и подбор лечения, оценка качества жизни пациентов. Аспекты общественного здравоохранения также играют важную роль, но они не рассматриваются в целях снижения объема статьи. С помощью современных исследований удается найти наиболее биологически обоснованные подходы к планированию и осуществлению профилактики и лечения кариеса как на популяционном, так и на индивидуальном уровнях. Из данных соображений следует изменение науки, практической сферы и политических решений в сторону оптимизации лечения пациентов.
Эпидемиология
Эпидемиологические исследования кариеса проводились в течение многих десятилетий, и может создаться впечатление, что по этой проблеме накоплено огромное количество глобальных сопоставимых данных. Тем не менее, для оценки и планирования государственной политики в этой сфере необходимы эпидемиологические данные, отвечающие следующим критериям: современные, точные и доступные для анализа данные в ключевых возрастных группах по превалентности (распространенность, общее число больных за промежуток времени) и инцидентности (заболеваемость, количество новых случаев), а также тренды заболеваемости. Вдобавок необходима информация касательно различий заболеваемости между странами и внутри них, различия заболеваемости среди групп внутри популяций. Данных, отвечающих таким критериям, сегодня не так уж много. Несмотря на заявления ВОЗ о высокой социальной значимости кариеса в развитых странах, это заболевание широко не изучается. В таких странах кариес зубов поражает 60–90 % детей и абсолютное большинство взрослых [3]. Хотя кариес ранее считался детским заболеванием, на самом деле он продолжается и в зрелости [4]. Кариес оказывает неоднородное влияние на качество жизни взрослых и детей в разных странах [5].
Кариес зубов считается самым распространенным хроническим заболеванием детского возраста, а в последнее время его распространенность увеличилась среди детей в возрасте 2–5 лет по всему миру, что позволяет выделить эту возрастную группу как приоритетную [6–8]. Согласно данным переписи 2007 года распространенность кариеса молочных зубов среди детей из Соединенных Штатов в возрасте 2–5 лет возросла с 24 % до 28 % между 1988–1994 и 1999–2004, кариес выявлялся чаще у детей из малообеспеченных семей и у представителей этнических меньшинств [9]. По результатам национального обследования состояния здоровья и питания (National Health and Nutrition Examination Survey, NHANES) с 2011 по 2012 год, в США примерно у 23 % детей в возрасте 2–5 лет был выявлен кариес молочных зубов. К тому же, согласно этим же данным, примерно у 10 % детей в возрасте 2–5 лет выявлялся нелеченый кариес. Распространенность кариеса зубов неоднородна в разных регионах США. В недавнем исследовании с использованием данных NHANES 1999–2004 годов было выявлено, что вероятность заболевания кариесом выше среднестатистической по США у детей из округа Лос-Анджелес, занимающего одну из наибольших территорий в Штатах. Почти 40 % дошкольников, проживающих в округе Лос-Анджелес, имели кариес молочных зубов, по сравнению с 28 % детей того же возраста в Соединенных Штатах в целом. У детей из Лос-Анджелеса состояние полости рта было хуже, чем у детей из других регионов Соединенных Штатов с 1999 по 2004 года, при этом хуже всего оно было у представителей этнических меньшинств [10]. Кариес в раннем детстве (КРД) — крайне тяжелая форма кариеса у детей, — это часто встречаемое, опосредованное бактериальной флорой и мультифакториальное заболевание, характеризующееся заметной потерей твердых тканей зубов у детей младше 6 лет; некоторые исследователи считают, что оно может передаваться от опекунов (Здесь и далее речь идет в первую очередь о родителях, но не только о них. — прим. ред.) их детям, но полностью поддается профилактике.
Репрезентативные международные данные по КРД фрагментарны, поскольку большинство стран ведет статистику по кариесу только с возраста 5 или 6 лет. Традиционно низкая распространенность кариеса наблюдается в развивающихся странах, в развитых странах она выше [3]. Данная географическая ситуация усложнилась в связи со скоростью экономического развития и резкими изменениями привычек и питания в большинстве стран. Половые и этнические различия оказывают незначительное влияние на риск и течение кариеса в сравнении с потреблением сахара, образом жизни и экономическими различиями.
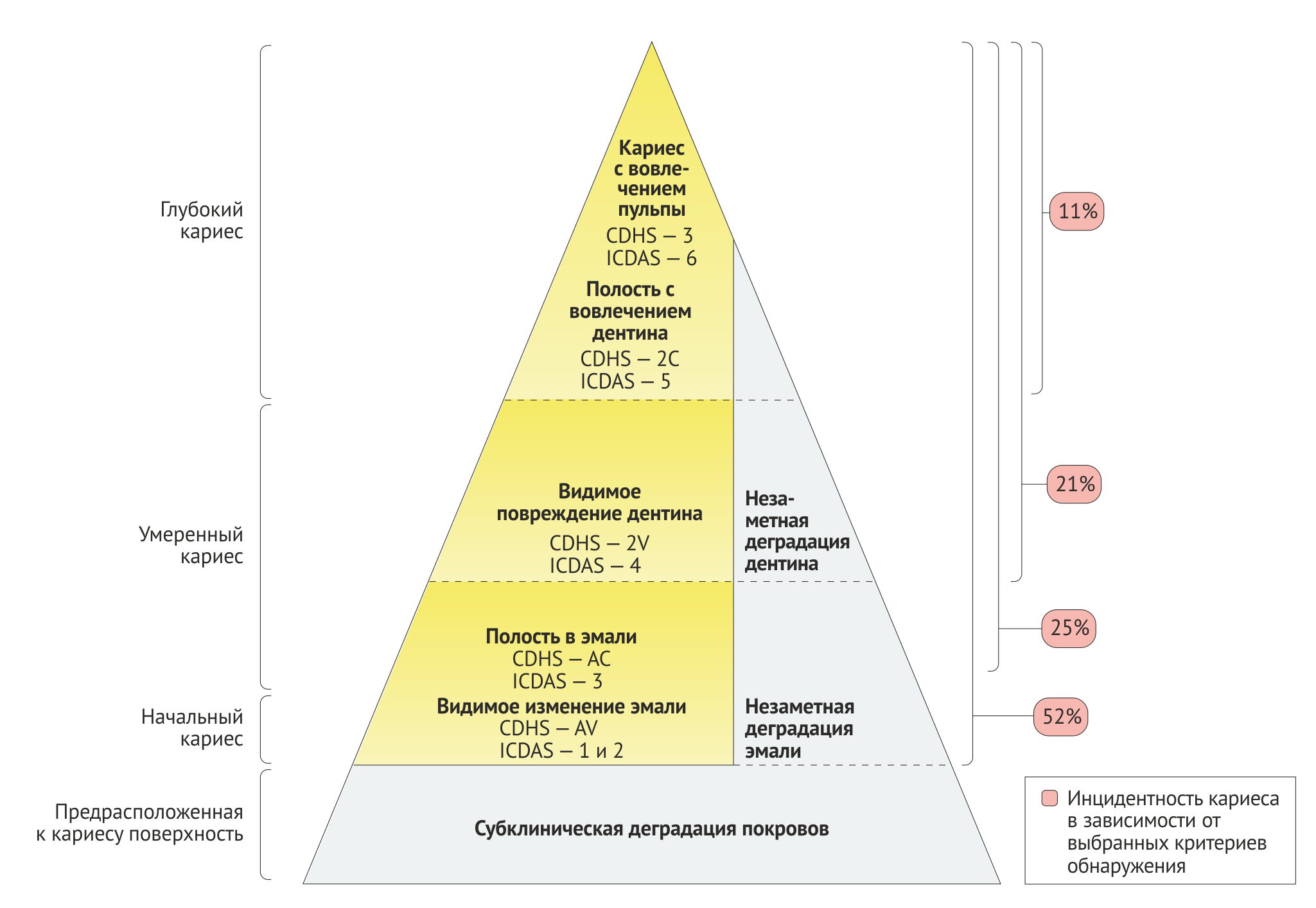
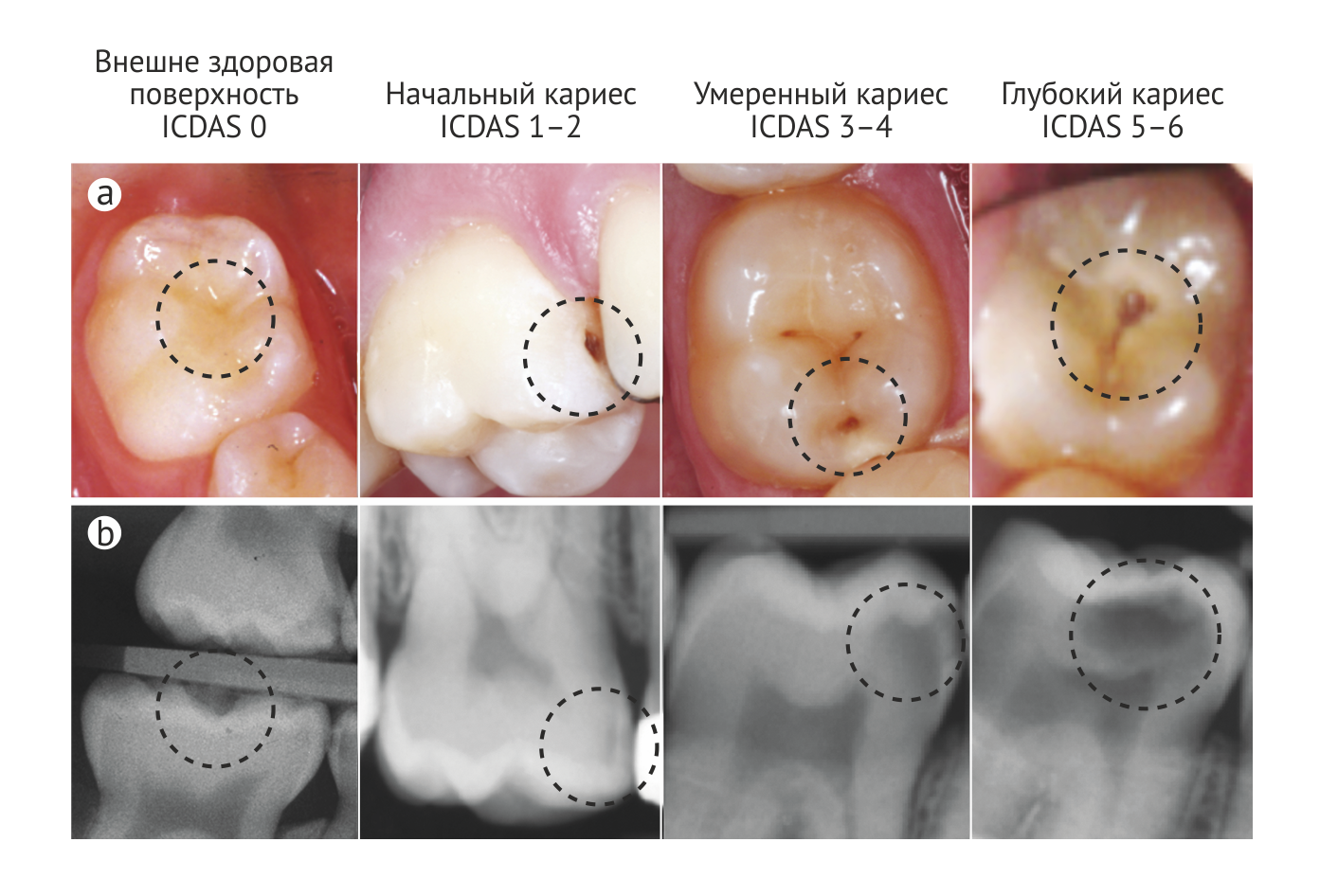
Для измерений в эпидемиологических исследованиях традиционно используют индекс КПУ (кариозные, пломбированные, удаленные зубы/поверхности), представляющий собой подсчет числа либо пораженных зубов (КПУз), либо пораженных поверхностей (КПУп) у конкретного индивида. Значение КПУз для индивида или группы отражает течение их заболевания (как прошлые, так и настоящие случаи). Индекс может использоваться в сочетании с различными порогами обнаружения кариеса, что влияет как на среднее значение КПУз, так и на долю больных [11–13]. В зависимости от используемого порога обнаружения соотношение больных кариесом в возрасте 15 лет варьирует от 11 % до 52 % [14] (Рис. 3).
По всему миру предпринимаются меры по улучшению понимания эпидемиологии кариеса путем усовершенствования методов диагностики и их оптимизации для использования в эпидемиологической сфере с сохранением их совместимости с системами, используемыми в стоматологической практике. В настоящее время при изучении эпидемиологии кариеса во многих странах [15] наравне с наиболее современными упрощенными кодировками [16] пользуются также «эпи-модификациями» (Модификациями, призванными облегчить использование классификации в эпидемиологических исследованиях. — прим. ред.) Международной системы определения кариеса зубов (International Caries Detection and Assessment System, ICDAS) (Ссылка 12) (Рис. 3) и критериями ВОЗ [13]. В наиболее близкой к клинической практике упрощенной кодировке ICDAS выделяют внешне здоровую поверхность и три стадии кариеса (в отличие от внешне здоровой поверхности и шести стадий кариеса в полной классификации ICDAS). Также возможно совместное использование клинических и рентгенографических данных для более точного выявления распространенности кариеса [17]. Текущая работа нескольких европейских организаций продемонстрировала, что имеющиеся национальные данные по значению КПУз у детей в возрасте 12 лет несопоставимы между странами Европы [15]. Это открытие обращает внимание на главную проблему эпидемиологических исследований кариеса: на первый взгляд сопоставимые данные оказываются совершенно несравнимы, так как собраны в разных странах, в разное время, специалистами с разными уровнями подготовки, использующими различные критерии для обнаружения кариеса.
После внесения пунктов, касающихся здоровья полости рта, в текущее исследование глобальной заболеваемости [18] была выявлена высокая распространенность заболеваний полости рта: они встречаются примерно у 3,9 миллиарда людей по всему миру. Используемые в этом крупном исследовании методы оценки кариеса чрезвычайно полезны, так как они позволяют сравнить заболеваемость кариесом и другими болезнями; кроме того, в них не используется индекс КПУ (который применялся по всему миру на протяжении последних 60 лет). Согласно данным этого исследования, самым распространенным состоянием из всех оказался нелеченый кариес постоянных зубов: его распространенность по всему миру достигла 35 % во всех возрастных группах, заболеванию подвержены 2,4 миллиарда людей. Обратите внимание, что оценивались постоянные зубы как у детей, так и у взрослых. Нелеченый кариес молочных зубов занимает 10 место по распространенности, заболеванию подвержен 621 миллион детей по всему миру.
Патофизиология
В настоящее время механизмы, лежащие в основе развития кариеса зубов, хорошо изучены и рассматриваются в первую очередь с точки зрения происходящих в твердых тканях процессов (поскольку заболевание поражает кальцифицированные ткани зуба), а затем со стороны микробиологических аспектов (поскольку изменения состава биопленки являются пусковым механизмом кариозного процесса) (Рис. 1). Тем не менее, из-за мультифакториальной природы заболевания эти факторы тесно взаимосвязаны. Контактирующие со средой полости рта твердые ткани зуба (коронки и, при рецессии десны, корни зуба) являются мишенями для кариозного процесса, и все поверхности зубов восприимчивы к кариесу в течение всей жизни индивида. Тем не менее, кариес не возникнет в отсутствие кариесогенной (то есть, патогенной) зубной биопленки и частого употребления в пищу углеводов, в основном свободных сахаров [19, 20], поэтому кариес следует считать диетарно-микробным заболеванием [21]. В современную концепцию кариеса также включены понятия о действии поведенческих, социальных и психологических, а также биологических факторов [22–24]. Важность фтора в корректировании выраженности заболевания невозможно переоценить [25] (Вставка 1). Возможно, кариес зубов можно наиболее точно описать как опосредованное биопленкой заболевание, главным образом вызванное поведением, включающим в себя частое потребление ферментируемых углеводов (сахара, такие как глюкоза, фруктоза, сахароза и мальтоза) и неудовлетворительную гигиену полости рта в сочетании с недостаточным потреблением фтора.
Деминерализация и реминерализация
Обычно кариес начинается на поверхности эмали или несколько под ней (первоначально деминерализуется подповерхностный слой) и является результатом разрушения кристальной структуры зуба органическими кислотами, которые производятся в ходе метаболизма ферментируемых углеводов бактериями биопленки. Хотя микроорганизмами зубной биопленки и синтезируется широкий диапазон органических кислот, преобладающим конечным продуктом метаболизма сахаров является молочная кислота [26], которая считается главной кариесогенной кислотой. По мере накопления кислот в жидкой фазе биопленки уровень pH снижается до состояния, при котором пограничный слой между эмалью и биопленкой становится ненасыщенным, и кислота частично деминерализирует поверхностный слой зуба [27]. Потеря минералов приводит к повышению пористости, расширению пространств между эмалевыми призмами и размягчению поверхности, что облегчает диффузию кислот глубже в зуб, приводя к более глубокой деминерализации. Накопление продуктов реакции, главным образом кальция и фосфатов, может частично защитить зуб от деминерализации благодаря насыщению пограничного слоя биопленки. Кроме того, присутствие фтора может подавлять деминерализацию поверхностного слоя [28]. После устранения сахаров из полости рта путем проглатывания или растворения в слюне кислоты биопленки могут нейтрализоваться благодаря буферным свойствам слюны. Значение pH жидкой фазы биопленки возвращается к нейтральному, она становится в достаточной мере насыщена кальцием, фосфатами и ионами фтора, чтобы процессы деминерализации приостановились и запустились противоположные — процессы реминерализации. Благодаря динамической природе кариозного процесса очень ранние (субклинические) стадии кариеса могут быть остановлены или даже обращены вспять, особенно в присутствии фторидов.
По мере прогрессирования деминерализации в наиболее неблагоприятных условиях оказываются подповерхностные участки эмали (или дентина, если речь идет о кариесе корня), что и определяет дальнейшее формирование в этих отделах кариозного дефекта. При достаточной потере минеральных соединений поражение приобретает форму белого пятна. Это важная с клинической точки зрения стадия кариозного процесса, поскольку поражение можно остановить или подвергнуть обратному развитию, влияя на причинные факторы или применяя профилактические меры. Тем не менее, восстановительные процессы, как правило, происходят только в поверхностном слое.
На данной стадии развития, начальной стадии кариеса (коды ICDAS 1 и 2), твердые ткани уже значительно деминерализованы. С изменением местных условий, привычек питания и использованием фторидов возможно: остановить патологический процесс, однако патологический очаг останется видимым в связи с изменениями оптических свойств эмали; полностью обратить изменения при проведении глубокой реминерализации, благодаря которой получится внешне здоровая поверхность; либо позволить процессу прогрессировать до более выраженной степени разрушения.
При дальнейшем прогрессировании кариозного процесса пористость поверхности возрастает, образуются микрополости в эмали (код ICDAS 3). В случае кариеса корня происходит нарастающее размягчение поверхностного слоя дентина. При кариесе коронки зуба со временем возможен провал поверхностного слоя очага поражения с образованием видимой полости (коды ICDAS 5 и 6). Даже при такой степени тяжести кариеса оптимальные условия могут остановить дальнейшее развитие дефекта, но полость с биопленкой останется. Оперативные вмешательства показаны при достижении необратимых стадий кариеса, особенно если такое поражение сопровождается выраженными клиническими проявлениями или значительно нарушает функциональные или эстетические аспекты зубного ряда. При дальнейшем развитии кариозного процесса со временем будет затронута пульпа зуба, что обусловит необходимость денервации и цементирования корневых каналов или удаления зуба.
Минеральный гомеостаз зубных поверхностей является ключом к здоровью зубов. Поскольку зубы постоянно подвергаются действиям кислот, будь то кислоты биопленки или пищевые кислоты, способность к спонтанной реминерализации абсолютно необходима для поддержания целостности зуба. Слюна незаменима для сохранения здоровья зубов — она содержит необходимые для реминерализации вещества. Низкая концентрация фтора способствует кариесу, что объясняет высокую эффективность различных лекарственных форм фтора в борьбе с кариесом зубов [28]. (Вставка 1).
Кариес зубов — это динамический патологический процесс, состоящий из сменяющих друг друга в течение дня циклов деминерализации и реминерализации [27, 29]. Зубы наиболее подвержены кариесу при прорезывании и со временем становятся все более устойчивы к воздействию кислот. С клинической точки зрения это означает, что следует уделять больше внимания наблюдению за кариозным процессом и применению профилактических мер в периоды прорезывания зубов.
Микробиология и зубные биопленки
Микрофлора полости рта в норме. Ротовая полость, подобно другим поверхностям организма, с рождения колонизирована огромным количеством разнообразных микроорганизмов — это микрофлора полости рта [30]. Наиболее распространенной группой микроорганизмов являются бактерии, однако также там могут присутствовать грибы, вирусы, микоплазмы, простейшие и археи. Микрофлора полости рта находится в симбиотических и мутуалистических взаимоотношениях с организмом-хозяином. Резидентная микрофлора полости рта существует в теплой, богатой питательными веществами среде и «в благодарность» за такие условия мешает попыткам чужеродных бактерий обосноваться во рту, участвует в формировании местного неспецифического иммунитета и взаимодействует с организмом-хозяином, ослабляя избыточные провоспалительные реакции на бактерий-комменсалов [31]. Слюна играет важную роль в поддержании благоприятного состава микрофлоры, обеспечивая нейтральное значение pH в полости рта (являющееся оптимальным для роста и метаболизма большинства представителей микрофлоры полости рта), а также поставляя белки и гликопротеины в качестве питательных веществ.
Зубные биопленки. Микрофлора полости рта формируется на поверхностях в виде структурно и функционально организованных сообществ различных видов бактерий, называемых зубным налетом [32, 33]. Несмотря на свои различия, все виды бактерий в составе биопленки взаимодействуют друг с другом. Зубной налет является примером биопленки, формирование которой происходит в несколько стадий [34]. Поверхность зуба покрыта создающей благоприятные условия пленкой из белков и гликопротеинов (приобретенной пелликулой), в состав которой помимо основного компонента — слюны, — входят также продукты жизнедеятельности бактерий, десневая жидкость, кровь и остатки пищи (Рис. 1). Приобретенная пелликула служит местом прикрепления ранних бактериальных колоний, которые дадут начало биопленке, к поверхности зуба и играет роль препятствующего диффузии кислот барьера [36].
Бактерии удерживаются рядом с поверхностью зуба слабо и непостоянно действующими на больших расстояниях силами ван-дер-Ваальса (без участия ковалентных и ионных связей) между наружной оболочкой бактерий и пленкой. Прикрепление становится более сильным и постоянным при возникновении взаимодействий между бактериальными белками-адгезинами и комплементарными рецепторами в составе пленки [32]. Вторично колонизирующие виды прикрепляются к ранним колонизаторам (со-адгезия), сложность биопленки повышается. Биопленка созревает, и при этом возникают многочисленные синергетические и антагонистические взаимодействия между микроорганизмами [37]. Формируется матрица, состоящая из бактериальных экзополимеров (полимеров, секретируемых во внешнюю среду), в том числе полисахаридов, образованных в ходе метаболизма сахаров, и ДНК; матрица удерживает биопленку на поверхности и влияет на проникновение и движение молекул в пределах биопленки [37, 38]. Биопленка защищает бактерии от противомикробных агентов. Состав данных биопленок различается на разных поверхностях зуба, что обусловлено незначительными различиями в условиях местной среды.
Микробная этиология кариеса зубов. Динамический мутуализм между микрофлорой и хозяином может быть нарушен вследствие изменения образа жизни или условий в полости рта, что предрасполагает определенные участки поверхности зубов к повреждению. К факторам риска кариеса относят частое употребление в пищу ферментируемых углеводов (в особенности сахарозы) и/или сниженный клиренс слюны [40]. В ходе многочисленных кросс-секционных и лонгитюдных эпидемиологических исследований выявлялось резкое изменение в балансе микрофлоры в очагах кариеса по сравнению со здоровыми поверхностями. В ходе ранних исследований в области кариозных поражений была выявлена более высокая по сравнению со здоровой эмалью доля Streptococcus mutans и Streptococcus sobrinus, а из наиболее глубоких поражений выделяли лактобактерии [40]. Данные наблюдения привели к предположению, что кариес вызывается лишь некоторыми микроорганизмами из большого разнообразия входящих в состав биопленки («гипотеза специфического налета») [41]. Тем не менее, по мере проведения дальнейших эпидемиологических исследований было установлено, что кариес может наблюдаться и при отсутствии данных бактерий, в то время как они могут мирно существовать на здоровых участках.
Последующие лабораторные исследования подтвердили, что другие бактерии зубных биопленок также способны закислять среду в присутствии сахаров. Есть и бактерии-антагонисты кариесогенных, способные уменьшать потенциально разрушительный эффект молочной кислоты, используя ее в качестве источника питания, преобразуя ее в более слабые кислоты, или образуя основания в ходе метаболизма аргинина и мочевины. Данные результаты поддерживают «гипотезу неспецифического налета», согласно которой развитие кариеса зависит от совокупной метаболической активности биопленки [41]. В более свежих исследованиях, использующих классические микробиологические и молекулярные методы, была обнаружена связь между кариесом и другими группами кислотопродуцирующих и кислотоустойчивых бактерий, включая Bifidobacterium spp., Actinomyces spp., Propionibacterium spp., Scardovia wiggsiae.
Впоследствии были предложены альтернативные описывающие патогенез кариеса концепции, основанные на микроэкологических принципах [42,43]; эти «гипотезы экологической бляшки (налета)» в настоящее время считаются наиболее полными с точки зрения микробной этиологии кариеса (Рис. 4). Оригинальная «гипотеза экологической бляшки» говорит об определенной функции бактерий (включающей в себя быструю продукцию кислот и ацидофильность), не привязывая эту функцию к конкретным видам, и делает акцент на необходимости возникновения кариесогенных условий (к ним относятся диета с высоким содержанием сахаров и/или низкий клиренс слюны). Согласно такой концепции, кариесогенные микроорганизмы могут присутствовать на здоровой эмали, однако их активность при этом значительно ниже минимально необходимой для появления дефекта [42]. Кариес является следствием неблагоприятного сдвига равновесия резидентной микрофлоры, вызванного изменениями среды на поверхности зубов. Регулярный контакт налета с ферментируемыми сахарами пищи приводит к постоянному снижению pH биопленки, которое способствует росту кислотоустойчивых бактерий, а также ингибирует полезные микроорганизмы, растущие преимущественно при нейтральном значении pH. Естественным следствием этой теории является представление о возможности контроля кариозного процесса, причем осуществляться такой контроль может не только путем непосредственного ингибирования кариесогенных бактерий, но и при воздействии на факторы неблагоприятного сдвига равновесия микрофлоры (то есть при снижении количества и частоты потребления сахаров для предотвращения закисления среды, либо при использовании в пищу закусок с другими подсластителями, неспособными метаболизироваться кариесогенной флорой) [42]. Недавно «гипотеза экологической бляшки» получила дальнейшее развитие в виде «расширенной экологической гипотезы кариеса», и в своем настоящем состоянии отражает способность некоторых бактерий полости рта адаптироваться к неблагоприятной кислой среде во время регулярного и длительного воздействия низкого pH (Ссылка 43). Закисление налета служит главным фактором отбора кислотопродуцирующего и кислотоустойчивого сообщества, развитие которого повышает риск кариеса [43].
Таким образом, кариес зубов является не классическим инфекционным заболеванием, а следствием сдвига экологического равновесия нормальной микрофлоры полости рта, вызванным изменением образа жизни и изменениями среды полости рта. Новые способы профилактики кариеса разрабатываются с учетом данных принципов.
Фтор образует различные соединения: в первую очередь фторид натрия (NaF), кислые фторид-фосфаты (APF) и фторид олова (SnF2). Зубная паста со фтором является наиболее широко используемой формой доставки фторидов по всему миру. Эффективность паст со фтором в качестве агента против кариеса была показана в многочисленных клинических исследованиях. Наиболее эффективен фтор при частом использовании в небольших количествах.
Местное применение фтора в больших концентрациях (>2,500 частей на миллион) создает движущую силу для пенетрации прилегающей к поверхности зуба биопленки и доставки фтора к поверхности зуба и, что наиболее важно, концентрирует его в зарождающихся поражениях. В такой концентрации фтор снижает скорость деминерализации эмали и повышает скорость ее реминерализации. Существует также взаимосвязь между концентрацией фтора и более продолжительным его сохранением в полости рта. Высокая концентрация фтора необходима для формирования резервуаров фтора (CaF2-подобных отложений) на поверхности зуба и в зубном налете. Сверхвысокая концентрация фтора может оказывать слабое бактерицидное действие, но для этого требуются регулярные частые аппликации профессионально наносимых препаратов с высокой концентрацией фтора, что непрактично.
Среда и кариес зубов
Хотя формирование биопленки является естественным процессом и необходимым этапом развития кариеса, присутствие биопленки само по себе не говорит о наличии заболевания. Только после сложного взаимодействия факторов со стороны организма-хозяина — включая поверхность зуба, приобретенную пелликулу, слюну и свободные сахара пищи, — зубная биопленка может со временем привести к проявлению заболевания.Существующие на поверхности каждого зуба уникальные условия среды объясняют высоколокализованную и сложную природу кариозного процесса. Кариес может возникнуть на апроксимальной поверхности одного зуба, совершенно не затронув соседний, при том что сомнений в наличии биопленки на обоих зубах нет [27]. К специфическим условиям течения кариеса относят следующие: изменяющие растворимость кислот (например, состав и структура твердых тканей зуба, воздействие фтора на зубы до и после прорезывания и возраст зуба после прорезывания) и те, которые влияют на толщину и патогенность биопленки, создавая участки застоя налета (например, морфология зуба, форма зубной дуги, прикус) [36, 37]. Пороки развития (например, гипоплазия, истончение эмали) могут привести к снижению устойчивости эмали и нарушению поверхностной структуры, в связи с чем создаются участки застоя налета и повышается риск развития кариеса постоянных зубов [44]. Подверженность кариесу также зависит от расположения зубов по отношению к отверстиям выводных протоков слюнных желез, вязкости слюны и слюнного клиренса в определенных участках зубов. Стоматологические аппараты (например, ортодонтические аппараты и протезы) и некачественные пломбы также повышают подверженность кариесу отдельных зубов, создавая участки застоя, способствующие формированию биопленки [27].
Диагностика, скрининг и профилактика
Диагностика, оценка рисков, скрининг и профилактика абсолютно необходимы для понимания и успешного контроля кариеса зубов как на индивидуальном, так и на популяционном уровнях. Во многих странах «скринингом» называют специфическое понятие общественного здравоохранения, имеющее мало общего с клинической практикой, но эта тема не входит в сферу охвата данной статьи. Авторы говорят о тех действиях, которые предпринимаются на уровне отдельного пациента, когда огромное количество пациентов ежедневно взаимодействуют со стоматологами по всему миру. Следует отдельно отметить, что для профилактики и контроля кариеса требуется оптимизация и организация вмешательств как на уровне здравоохранения, так и на индивидуальном уровне.
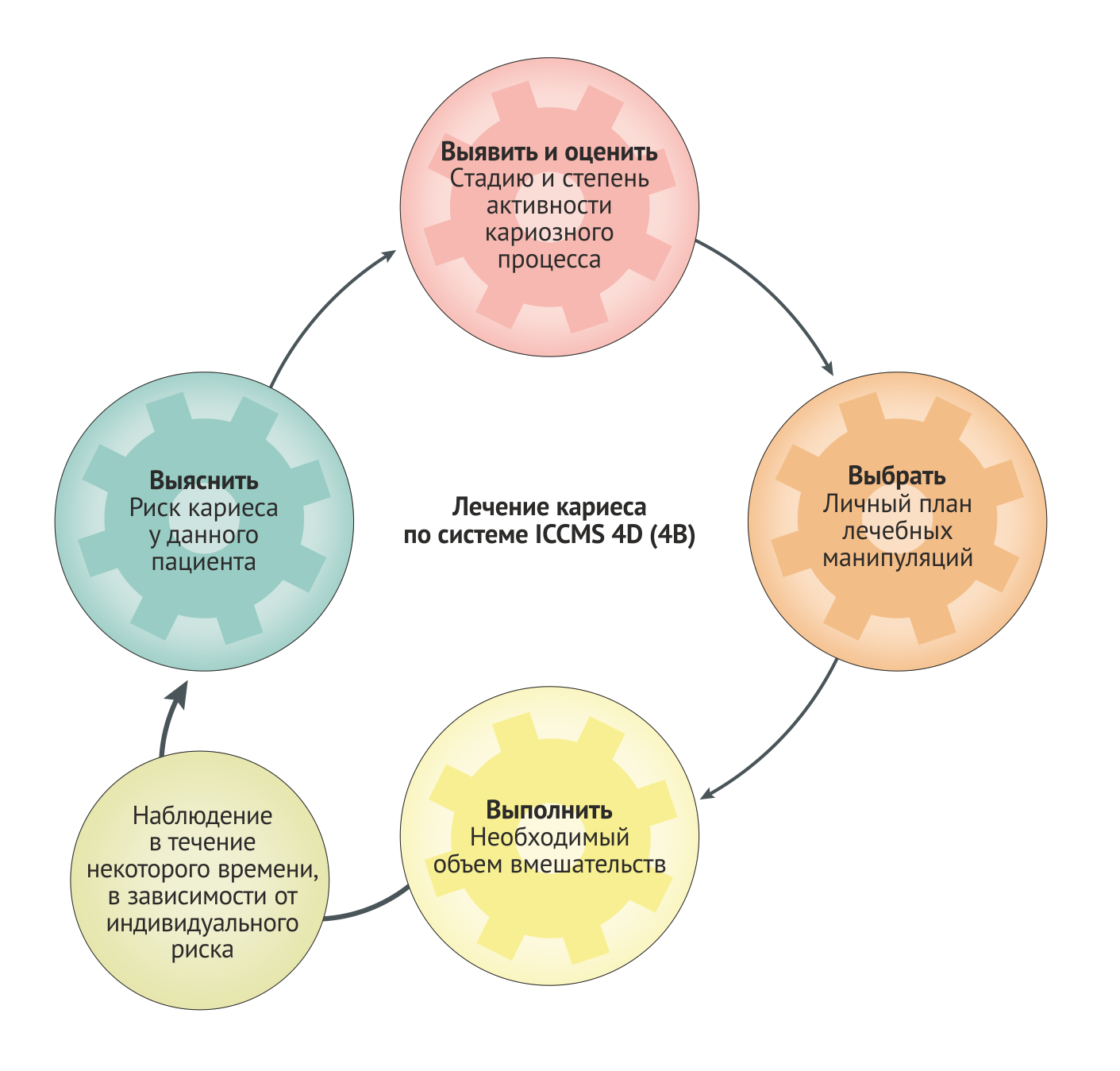
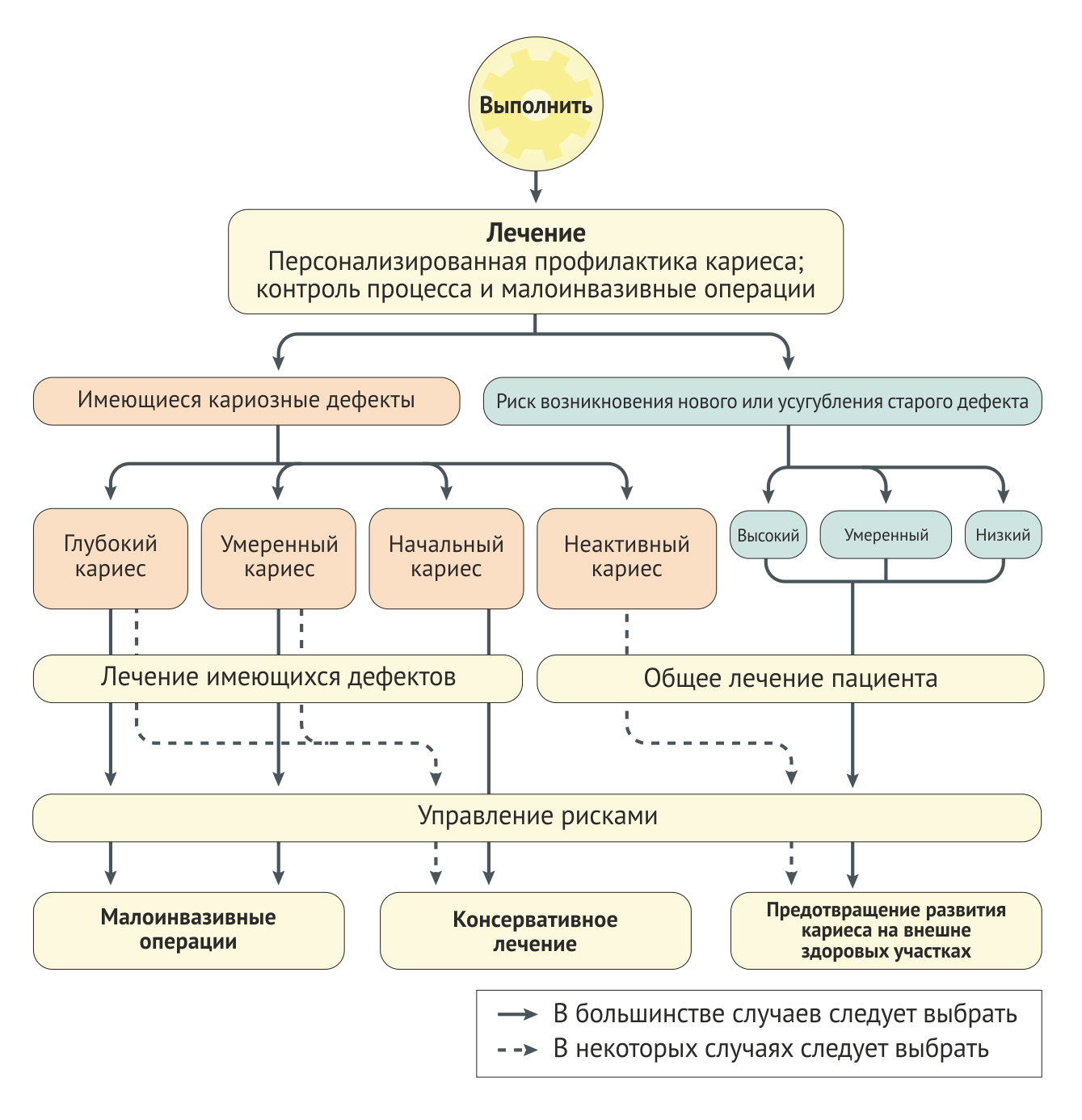
В ходе посвященных теме кариеса встреч Международная Федерация Стоматологов (FDI) [1, 45] провела обзор существующих систем классификации и оценки риска кариеса [46]. Несмотря на отличную работу, проведенную в некоторых странах в сфере создания систем оценки (Вставка 2), не хватает простой в обращении, международно применимой, основанной на доказательствах, целостной классификации, не говоря уже о классификации, принятой в условиях всеобщего консенсуса. Таким образом, принимая факт существования большого количества других систем для осуществления конкретных клинических задач, необходимых для лечения кариеса, авторы используют Международную систему классификации и лечения кариеса (ICCMS™ (Ссылки 47–50)) в качестве единой системы для наглядного представления ключевых моментов (Рис. 5). В ICCMS™ учитываются как общие, так и местные факторы риска кариеса, а само повреждение оценивается с учетом его глубины и активности. В выборе тактики задействованы и оценка риска, и клиническая оценка. Данная информация используется для создания персонализированного плана лечения, осуществляемого с упором на зубосохраняющую тактику, профилактику и контроль кариеса, в совокупности с основанным на рисках плане дальнейшего наблюдения (повторных посещений с целью профилактики) [47-50]. Четыре ключевых элемента системы «Лечения кариеса ICCMS™ 4D» (В нашей адаптации «4В», пояснение в подписи к рисунку. — прим. ред.) делают возможными комплексную оценку и составление персонализированного плана лечения кариеса (Рис. 5).

Профилактика
Общественное здравоохранение. Целью профилактики кариеса зубов является сохранение здоровой структуры зубов, предотвращение деминерализации эмали и стимуляция естественной регенерации [46]. На популяционном уровне необходимы пропаганда здорового образа жизни и влияние на социальные составляющие факторов риска. Это возможно посредством государственной политики здравоохранения, законодательства, регламентирования и общественных мер профилактики [51, 52]. Профилактические меры могут быть направлены на популяцию в целом (например, фторирование воды или налог на сахар) или на группы высокого риска, что более финансово эффективно. Информация о взаимоотношениях фтора и кариеса приведена во Вставке 1, дополнительная информация об использовании фтора для профилактики кариеса приведена во Вставке 3. К популяционным факторам риска кариеса относятся низкий доход, ограниченный доступ к стоматологической помощи, низкое потребление фтора и низкая стоматологическая осведомленность. В настоящее время ведутся исследования по поиску наилучших способов выявления индивидов с высоким риском развития кариеса. Программы профилактики кариеса могут быть направлены на группы с особыми медицинскими нуждами: лиц с нарушениями иммунитета (например, ВИЧ-инфицированных, больных лейкемией), пороками развития или когнитивными нарушениями, затрудняющими осуществление гигиены полости рта, генетическими расстройствами, связанными с состоянием полости рта (например, расщелинами неба или губы, эктодермальной дисплазией), дисфункцией слюнных желез при синдроме Шегрена, сахарным диабетом, а также вынужденных принимать препараты, побочным действием которых является гипосаливация.
Поскольку кариес зубов — это многофакторное заболевание, сочетанные вмешательства могут быть эффективнее одиночных. План действий ВОЗ по обеспечению здоровья полости рта указывает на необходимость сочетания популяризации профилактики кариеса с популяризацией профилактики других внутренних болезней, имеющих общие с кариесом факторы риска [53]. Электронные медицинские карты, мобильные устройства и социальные ресурсы могут способствовать этому в будущем [54]. У международной общественной благотворительной организации здравоохранения «Альянс за будущее без кариеса» (ACFF) есть отделения по всему миру, рассказывающие о плане действий и ресурсах, необходимых для предотвращения возникновения и прогрессирования кариеса. К методам работы организации относятся повышение общественной осведомленности и изменение общественного поведения в сторону улучшения гигиены полости рта и снижения потребления сахара, оказание содействия исследованиям и внедрение наиболее эффективных методов лечения [55, 56].
Вода из большинства природных источников содержит определенное количество фтора. Дополнительное фторирование — это экономически эффективный метод коррекции содержания фтора в воде из коммунальных систем водоснабжения. Помимо экономической эффективности он также характеризуется хорошо заметным влиянием на все возрастные группы, отвечает требованиям общественного здравоохранения [57] (Вставки 1, 3). По мнению Службы общественного здравоохранения США, наилучший баланс между профилактикой кариеса и риском флюороза достигается при концентрации фтора 0,7 мг/л [58]. Данный подход способствует сохранению бюджетных средств [59]. ВОЗ рекомендует более высокие концентрации (1,5 мг/л), но отмечает, что при утверждении государственных стандартов необходимо учитывать ожидаемый объем потребления воды и получение фтора из других источников [60].
Другим часто используемым популяционным методом профилактики кариеса является фторирование соли, как правило, в сочетании с йодированием. Оно применяется в основном в Европе, Центральной и Южной Америках, где содержание фтора в питьевой воде относительно низкое, коммунальное фторирование воды не всегда возможно, а другие способы потребления фтора также применяются реже [61]. Концентрация фтора в соли обычно составляет 250–300 частей на миллион (ppm — parts per million). Это наименее дорогостоящий метод профилактики кариеса [62]. В некоторых странах, например, Венгрии и Великобритании, существуют программы фторирования молока [63, 64].
Фиссурные герметики представляют собой материалы на основе смолы, которые стоматолог может наложить на ямки и фиссуры окклюзионных поверхностей зубов с целью предотвращения кариеса или остановки прогрессирования начального кариозного поражения до образования полости [65]. Наложение не требует местного обезболивания, герметики можно применять в школах, используя портативное оборудование. Программы применения герметиков — высокоэффективная общественная профилактика кариеса, особенно они эффективны в отношении детей с высоким риском кариеса или детей из бедных семей [67]. В Соединенных Штатах массовые программы использования герметиков применяются в школах, в которых большое количество детей участвуют в программах бесплатного или дешевого питания (Косвенный маркер низкого дохода. — прим. ред.) [68].
Несмотря на то, что стратегии профилактики должны быть экономически эффективными и способствовать сохранению бюджетных средств, программы профилактики предполагают значительные первоначальные издержки, экономия происходит за счет предотвращения заболеваний и отсутствия необходимости их длительного и дорогостоящего лечения. Учитываются также влияние зубной боли и инфекций на качество жизни. Экономическая оценка стратегий профилактики зависит от многих факторов, в том числе распространенности кариеса, затрат на персонал и материалы, эффективности вмешательств и наблюдаемого временного промежутка. Примеры результатов, полученных на двух различных популяциях [70, 71] приведены во Вставке 4.
- Протоколы оценки риска — например, кариограмма или управление кариесом путем оценки риска
- Классификации для фундаментальных исследований — например, критерии Nyvad для оценки активности кариеса
- Эпидемиологические классификаторы кариеса — такие как критерии ВОЗ, обнаружение и оценка кариеса (ICDAS) и классификация оценки лечения кариеса (CAST)
- Хирургические стоматологические классификации — например, классификация Блека (начало XX века), система классификации кариеса Американской стоматологической ассоциации (включает ICDAS), система классификации Mount-Hume и система классификации локализация-стадия (SI/STA)
Уровень отдельного пациента. Многие методы популяционной профилактики кариеса применимы также и на уровне стоматологического кабинета или поликлиники. При назначении индивидуальной профилактики кариеса стоматологи могут опираться на разнообразные клинические рекомендации [73, 74], Кокрейновские систематические обзоры [75], рекомендации ВОЗ по потреблению сахара [76], использовать разнообразные инструменты [72]. Ядром такой профилактики является рекомендация по снижению потребления сахара (что, помимо кариеса, уменьшает также риск ожирения и диабета II типа), а также рекомендации по использованию фторсодержащих зубных паст, при необходимости — использование фиссурных герметиков и более интенсивные профилактические вмешательства.
Диагностика
Оценка риска. В соответствии с ICCMS™ первым элементом диагностики кариеса является оценка риска кариеса путем сбора полноценного анамнеза. При сборе анамнеза необходимо обратить особое внимание на факторы риска развития кариеса. К таковым могут относится отдельные факты из медицинского и социального анамнеза (например, где родился и рос пациент, текущее место проживания, уровень образования и место работы). Наконец, у пациента узнают условия питания, в частности, количество и частоту потребляемого сахара, количество перекусов и тип используемой зубной пасты: всю информацию, необходимую для оценки риска кариеса у этого пациента [77].
Возможно применение большого многообразия совместимых с системой ICCMS™ инструментов для оценки рисков. Одним из таких инструментов является кариограмма [78], имеющая под собой больше доказательной базы, чем многие альтернативные системы; в исследованиях показана ее умеренная точность у детей и молодых взрослых [79]. Другие варианты: опросник «Лечение и оценка рисков кариеса» (Caries Managment by Risk Assesment, CAMBRA) и другие универсальные опросники по факторам риска. В полноценной кариограмме используются девять предикторов: КПУ(з), сопутствующие заболевания, содержание диеты, частота приема пищи, количество налета, количество S. mutans, использование фтора, объем секреции слюны и ее буферная емкость. Низкая оценка (0 или 1) отражает то, что определенный предиктор вносит вклад в низкий риск, а высокая оценка (2 или 3) отражает высокий риск; таким образом, риск в целом можно оценить при стабильном профиле пациента [78].
Оценка риска (вне зависимости от способа ее проведения) может быть в дальнейшем сопоставлена с оценкой вероятности кариеса по ICCMS™ [49, 50], сочетающей оценку клинической активности кариеса с оценкой уровня риска. Можно оценить, имеет ли пациент низкий, умеренный или высокий риск развития новых поражений или прогрессирования существующих кариозных поражений в течение следующих нескольких лет. Риск развития кариеса зубов можно снизить эффективными рекомендациями по питанию, улучшением контроля за налетом и повышенным использованием фтора, например, использованием зубной пасты с содержанием фтора 1450 ppm вместо 1050 ppm, при условии комплаентности пациента.
Клиническая оценка. С целью поиска и оценки всех кариозных поражений на отдельных поверхностях зубов проводится клинический осмотр (элемент выявления и оценки в ICCMS™ 4D). Целью является обнаружение всех имеющихся кариозных поражений и оценка их глубины, активности и факторов риска на уровне зуба. В отдельных случаях можно оценить и секрецию слюны (в некоторых странах измеряются также ее буферная емкость и наличие S. mutans). Хотя эти тесты и могут повысить мотивацию пациента к полноценной профилактике, с увеличением объема знаний о сложном строении биопленки клиническая значимость таких исследований становится все ниже и ниже. Количество зубного налета также подлежит оценке, поскольку это помогает оценить активность кариеса. Последующая профессиональная чистка зубов позволяет выявить кариозные поражения на ранних и более поздних стадиях на чистой (свободной от налета), сухой поверхности зуба. Локализация кровоточивости десны при аккуратном зондировании также считается показателем активности поражения. В большинстве случаев простого клинического осмотра недостаточно для формирования окончательного заключения. Это связано с тем, что при визуальном осмотре стоматолог или гигиенист может упустить из вида значительное количество поражений на ранних и даже более тяжелых стадиях [82, 83] (Рис. 6а).
Полость рта затем высушивается ватными шариками, каждый зуб осматривается с помощью потока сжатого воздуха. Затем на основании внешнего вида поверхностей зуба оценивается глубина поражения [47–50]. Несмотря на то, что на протяжении многих лет во многих странах стоматологи использовали острый зонд для зондирования фиссур зуба, сейчас считается, что тактильная оценка имеет невысокую диагностическую ценность и может привести к преобразованию неактивного поражения в активное.
Затем проводится оценка активности обнаруженных поражений. В системе классификации ICDAS [48, 84, 85] используются несколько критериев активности: локализация поражения (является ли это место областью скопления налета), цвет поражения (беловатый или коричневатый), тактильные ощущения (шершавая или гладкая поверхность) при зондировании поражения, блеск поверхности, наличие полости, и, наконец, находится ли поражение рядом с десневой линией и кровоточит ли десна при зондировании. Поражение считается активным при преимущественном наличии у него следующих характеристик: есть место отложения налета, поражение беловатое, шероховатое, с полостью, десна кровоточит; окончательное заключение по поражению может включать более детальную оценку активности: низкая, умеренная, высокая. Если поражение неактивно, окончательный диагноз может быть представлен начальным, умеренным или глубоким приостановленным кариесом [47].
Рентгенологическая оценка. Диагностическая рентгенография начала использоваться в диагностике кариеса сразу после своего появления (Рис. 6b). Тем не менее, существует тонкое равновесие между диагностической пользой и небольшими, но реальными рисками использования ионизирующего излучения. Таким образом, решение об использовании дентальных рентгенограмм для определения кариеса зависит от таких факторов, как результат тщательного клинического обследования, статус риска пациента по кариесу, его возраст и сроки последнего рентгенографического исследования. Прикусная рентгенография позволяет получить ценную информацию о кариесе коронок зубов, но в некоторых случаях требуются дополнительные снимки в нестандартных проекциях.
Несмотря на то, что дозы ионизирующего излучения снизились с усовершенствованием рентгенологической аппаратуры, повышением чувствительности пленок и сенсоров, врач все еще должен снижать воздействие излучения на пациента до разумного минимума, а также, по возможности, пользоваться иными диагностическими методами для снижения радиационного воздействия. Например, показанием к рентгенографии зубов является обнаружение при клиническом осмотре визуально малодоступного кариозного поражения.
Следует отметить, что в некоторых случаях, например, на апроксимальных поверхностях зубов, прямая визуализация кариозного поражения практически невозможна. В такой ситуации вся оценка глубины поражения и вовлеченности пульпы может строиться исключительно на рентгенографии. Тем не менее, данную информацию следует сочетать с информацией об активности кариеса и общем риске кариеса при формировании персонализированного лечебного плана, в том числе при выборе между оперативным и консервативным лечением. Рентгенологическая информация также незаменима при обследовании подозрительных фиссур зубов. При высоком потреблении фтора внешне небольшое кариозное поражение может распространяться вплоть до внутренних слоев дентина. Данные примеры указывают на важность сочетания клинической и рентгенологической информации для постановки точных диагнозов, в соответствии с которыми будут составляться подходящие планы лечения. Частота повторных осмотров, как клинических, так и рентгенологических, определяется в индивидуальном порядке в соответствии с риском кариеса.
При постановке окончательного диагноза стоматолог сочетает информацию о визуально и рентгенологически обнаруженных поражениях (рис. 6).
Несмотря на продолжительную историю успешного применения фторирования воды, при котором концентрация фтора в питьевой воде поддерживается или доводится до уровня между 0,7 мг/л и 1,5 мг/л, что позволяет максимизировать эффективность профилактики кариеса при минимизации риска флюороза зубов, ВОЗ рекомендует учитывать объем потребляемой воды и получение фтора из других источников при утверждении национальных стандартов [60], но данная тема во многих странах была и остается противоречивой. В странах, где существуют противоречия, основным аргументом является выбор между всеобщей пользой с одной стороны и получением индивидами медикамента без их согласия с другой стороны. Кроме того, чрезмерное потребление фтора детьми в период формирования постоянных зубов связано с риском развития штрихообразных дефектов на зубах. Это и есть флюороз зубов. Чаще всего встречаются легкие формы флюороза, видимые только специалисту-стоматологу при хорошем освещении в условиях клиники. Более заметные формы флюороза менее распространены, однако могут значительно влиять на эстетику зубного ряда.
Несмотря на громогласные споры и страшилки об опасностях фторирования воды, данный метод используется во многих странах на протяжении десятилетий и до сих пор поддерживается рядом специалистов в сферах здравоохранения и стоматологии по всему миру. Современные высококачественные исследования относительно степени выгоды, достижимой фторированием воды, малочисленны, эта выгода может быть не столь высока, как предполагалось до широкого применения фтора в питании и в зубных пастах, и до значительных изменений в образе жизни. Тем не менее, считается, что выгода в отношении профилактики детского кариеса значительна [161]. Также существуют критические отзывы авторитетных ученых касательно использованной в недавних Кокрейновских обзорах методологии систематического обзора, при которой критерии включения исследований в обзор значительно расширяются для достижения более полного понимания эффективности фторирования воды [162]. В качестве альтернативы на коммунальном уровне используются фторирование соли и, в некоторых местах, фторирование молока, однако доказательства по данным вмешательствам более ограничены.
Лечение
Начальные поражения
Начальные поражения (даже активные) подвергаются консервативному лечению с помощью реминерализующей терапии, которая включает изменения поведения и стимуляцию реминерализации, обычно с помощью фторсодержащих продуктов [1]. Реминерализация направлена на прекращение прогрессирования поражения или, в идеале, на его обратное восстановление. К минерализующей терапии также относится анализ пищевых и гигиенических привычек пациента с последующими рекомендациями, побуждающими к изменению поведения [86].
Фтор повышает скорость и выраженность реминерализации поражений в начальной стадии [87, 88]. Фтор чаще всего используется местно либо в виде пасты, геля или лака стоматологом, либо в виде зубной пасты, геля или раствора для полоскания полости рта в домашних условиях [89] (Вставка 1). Подкисленные фторсодержащие продукты имеют низкое значение pH в диапазоне 3,0–4,0. Снижение pH в средстве доставки фтора в лабораторных условиях привело к увеличению длительности проникновения минеральных ионов вглубь дефекта в связи с предотвращением блокирования поверхностных пор эмали, являющихся воротами в более глубокие области поражения [86, 90]. Наиболее полное восстановление структуры твердых тканей при кариесе достижимо, когда ионы кальция и фосфора проникают в достаточных концентрациях в присутствии немного повышенных концентраций фтора [91]. Слюна является самым важным источником ионов вокруг зубов, и ее поток может усилиться при жевании резинок без сахара [92]. Фторированная питьевая вода показала свою эффективность в плане увеличения местной концентрации фтора в слюне и налете [93]. Совсем недавно предпринимались попытки еще большего увеличения реминерализационного потенциала путем введения водорастворимых соединений кальция и фтора с высокой биодоступностью в препараты для местного применения, такие как жевательные резинки без сахара, дентальные кремы и лаки. Эти продукты содержат стабилизированный фосфорилированным казеином аморфный фосфат кальция и фосфорилированные олигосахаридные комплексы кальция, а также их фторсодержащие вариации [94–96]. Ранние исследования позволяют предположить, что данные препараты могут оказывать противокариесогенный эффект, однако на данный момент их доказательная база недостаточна [94–96].
Хотя консервативный подход к лечению начальных поражений и кажется наиболее выгодным, возможно также применение малоинвазивных методов. Фиссурные герметики представляют собой материалы на основе смолы и стеклоиономеров. Новая разработка на основе смолы с поверхностным, предварительно прореагировавшим стеклоиономерным наполнителем, как ожидается, будет высвобождать фтор в течение длительного времени за счет способности изменять заряд иона [97]. Стеклоиономерные наполнители высвобождают и другие ионы, способствуя улучшению состояния минеральных тканей зуба [98].
При обнаружении кариеса в начальной стадии необходимо задуматься о длительном наблюдении в сочетании с модификацией факторов риска кариеса. Хирургические вмешательства могут рассматриваться лишь при прогрессировании поражения дальше начальной стадии [99–101].
Умеренные поражения
Целью неинвазивного лечения умеренных поражений (Рис. 7) является остановка дальнейшего прогрессирования и восстановление потерянных минеральных веществ. Доступно два варианта.
Механическое блокирование. Клинические наблюдения говорят о том, что прогрессия бесполостных поражений на окклюзионных поверхностях может быть остановлена с помощью смоляных фиссурных герметиков [102]. Герметизация поражения позволяет предотвратить проникновение бактерий и продуцируемых ими кислот вглубь дефекта. Процедуру необходимо проводить на сухих зубах, а герметики нуждаются в периодической проверке и уходе. Схожей технологией для остановки кариеса на апроксимальных поверхностях является инфильтрация смолой слоя дентина [103]. Поражения, ограниченные наружной третью дентина, подвергаются обработкой смолой, которая проникает в подповерхностные поры и восстанавливает их. Хотя мало известно о долгосрочных результатах такого лечения, очевидно, что микроинвазивное лечение является менее затратным в долгосрочной перспективе, чем оперативное лечение [104, 105].
Фториды. Фториды для самостоятельного и профессионального применения используются местно с целью реминерализации и прекращения разрушения эмали (Вставка 1). В настоящее время местное применение фторида диамминсеребра является экономически выгодной альтернативой для остановки КРД и кариеса корней зубов у пожилых пациентов, особенно если другие варианты недоступны [106, 107].
В скором времени арсенал неинвазивного восстановительного лечения умеренных кариозных поражений может пополниться новейшими методами на основе нанотехнологий, пептидов, кристаллов гидроксиапатита и биоинженерных биопленок [108, 109].
Глубокие поражения
Глубокие поражения все еще часто подвергаются классическому лечению: деминерализованные ткани полностью удаляются и замещаются пломбировочным материалом. Однако развитие адгезивных техник и устранение необходимости механической ретенции (благодаря композитным материалам и окрашенным в цвет тканей зубов смесям пластика и стекла) позволили стоматологам применять новые, более щадящие методики. Тем не менее, есть данные невысокой доказательности, указывающие на более высокую частоту несостоятельности и вторичного кариеса при применении композитных материалов в сравнении с амальгамой (смесь ртути и других металлов) [110].
Недавней разработкой является этапное или частичное удаление кариозных тканей, при котором устраняются только поверхностные слои поражения. По результатам систематических обзоров был сделан вывод, что данный подход снижает частоту обнажения пульпы и способствует остановке кариеса и формированию третичного дентина (то есть отложению нового защитного слоя дентина в ответ на прогрессию кариозного поражения как молочных, так и постоянных зубов) [110, 111]. Хотя эти методы и являются более эффективными с клинической точки зрения, сейчас еще рано рекомендовать конкретные клинические стратегии. Необходимо также отметить, что для применения этих методов пораженные зубы должны быть жизнеспособными и не давать выраженной симптоматики. Кроме того, успех зависит от качественного пломбирования, полностью герметизирующего зуб и устраняющего активность бактерий, оставшихся в глубоких слоях дентина. Спорным вариантом лечения развившихся бессимптомных поражений во временных молярах является техника Hall [112], когда зуб не обрабатывается обычным способом, а покрывается предварительно сформированной коронкой из нержавеющей стали. Данная методика демонстрирует замечательные клинические результаты в сравнении с традиционным реставрационным лечением [113].
С помощью экономической модели удалось оценить эффективность популяционной профилактики кариеса у детей в Чили в сравнении с отсутствием какого-либо вмешательства [70]. Фторирование соли, коммунальное фторирование воды и фторирование молока в школах позволили сэкономить больше всего бюджетных средств, в совокупности с последующими программами полоскания полости рта растворами со фторидами в школах. Школьные программы, включающие в себя аппликации фторгеля, использование фиссурных герметиков и контролируемую чистку зубов со фторсодержащими зубными пастами показали эффективность, но не привели к экономии бюджетных средств во временном промежутке в 6 лет. Ожидается, что программы использования фиссурных герметиков смогут показать свою эффективность при применении у детей с высоким риском кариеса.
В Нью-Йорке, США динамическое моделирование использовали с целью сравнения различных подходов к профилактике кариеса у детей раннего возраста в популяциях с низким доходом, участвующих в федеральной программе оказания медицинских услуг малообеспеченным слоям населения [71]. Это позволило определить объем выгоды, полученной благодаря коммунальному фторированию воды, мотивационному интервьюированию (особенно при проведении его с опекунами детей до 2 лет) и программам чистки зубов фторсодержащими зубными пастами в течение 10 лет. Программы реминерализующей терапии с использованием препаратов фтора рекомендованы детям раннего возраста с высоким риском. Этот подход уже реализован детскими медицинскими учреждениями в виде программы «Into the Mouths of Babes» в Северной Каролине [163].
Дети с очень высоким риском развития кариеса
Для предотвращения кариеса и успешного лечения заболеваний полости рта очень важно поддержание здоровья полости рта в периоды новорожденности и раннего детства, что облегчает формирование правильного поведения и способствует хорошему состоянию полости рта [114]. Неотъемлемым шагом к достижению этого является просвещение опекунов и их врачей касательно важности стоматологической помощи в периоды беременности и новорожденности, особенно сейчас, когда разработаны специальные детские диагностические критерии и профилактические меры [115]. Это в особенности важно для детей с высоким риском развития КРД. Несмотря на отсутствие различий в патогенезе и принципах лечения КРД и других форм детского и взрослого кариеса, КРД в большей степени связан с отдельными поведенческими факторами риска, наиболее важным из них является использование бутылок со сладкими напитками и соками в ночное время («Бутылочный» кариес. — прим. перев.). Несмотря на наличие анатомических различий между временными и постоянными зубами (например, эмаль молочных зубов значительно тоньше и, следовательно, кариес молочных зубов быстрее добирается до дентина), механизмы, патофизиология и подходы к лечению идентичны независимо от типа пораженных зубов. Тем не менее, особенности клинического приема более молодых пациентов и вовлечение опекунов создают определенные сложности.
CAMBRA — это основанный на доказательствах подход, адаптированный под конкретные нужды детей с предельно агрессивным течением КРД [115, 116]. CAMBRA для КРД помогает врачам, во-первых, оценить риск развития кариеса и риск прогрессирования кариеса в раннем возрасте индивидуально для пациента на основании возраста, стоматологического статуса и факторов риска, во-вторых, подготовить индивидуализированный план лечения или профилактики, прежде чем принимать решение об оперативном лечении, в третьих, формализовать план последующего наблюдения, основанный на риске и возрасте ребенка, и, в-четвертых, обеспечить индивидуальные рекомендации для опекунов, с целенаправленными задачами самоуправления, основанные на возрасте, рисках и нуждах каждого отдельного пациента в любой отдельный момент времени. Данная версия CAMBRA позволяет оценить риск развития кариеса и прогрессирования заболевания у детей раннего возраста как низкий, умеренный или высокий.
Оценка кариеса может производиться с помощью техники, стоящей на трех «китах»: риск и/или биологические факторы, такие как продолжительное использование бутылки, сон с бутылкой, частота и характер перекусов, прием определенных препаратов и некоторые другие факторы риска; защитные факторы, такие как использование фторированной водопроводной воды, зубной пасты со фтором или продолжительное использование ксилита (рекомендуется некоторыми стоматологами, однако доказательная база противоречива); любые ранние признаки деминерализации поверхности эмали или полостей в раннем возрасте, к которым, в числе прочих, относятся присутствие зубной биопленки и слабый слюнной клиренс [117, 118].
Данные рекомендации для детей, предоставляемые CAMBRA, подразумевают применение ранних вмешательств в комплексе первичной медицинской помощи. Кроме того, врачам рекомендуется использовать минимально инвазивные варианты лечения, такие как применение фторлака [119]. Необходимо консультировать опекунов и разъяснять важность формирования правильных привычек зубной гигиены. После прорезывания первого зуба можно использовать немного (не больше рисового зернышка) фторсодержащей зубной пасты с целью профилактики раннего кариеса [120]. Такая практика отлично себя зарекомендовала в профилактике кариеса, особенно у детей раннего возраста [117].
Наблюдение и повторный прием
Последним элементом продолжительного лечения кариеса является определение необходимости повторного приема, что зависит от возраста и персонального риска пациента. В настоящее время назначение повторного приема спустя 6 месяцев неприемлемо. Если риск оценивается как низкий, следующий визит следует отложить на >1 год для взрослых, умеренный и высокий риски требуют более скорого повторного посещения. После подходящего основанного на риске интервале повторного посещения, цикл лечения кариеса начинается снова (Рис. 5).
Качество жизни
С учетом научных, клинических и общественных аспектов кариеса, важно осознавать влияние, которое заболевание оказывает на качество жизни. Увеличение средней продолжительности жизни и развитие стоматологии, благодаря которому многие люди сохраняют свои естественные зубы до пожилого возраста, привели к относительному сдвигу бремени нелеченого кариеса в сторону взрослого населения [121]. Кариес по-прежнему остается весьма часто встречаемым у взрослых (18–65 лет) и пожилых людей (>65 лет) заболеванием [121–123], однако он также распространен среди детей раннего возраста [121, 124].
Зубная боль все еще широко распространена среди детей и взрослых и тесно связана с кариесом зубов, особенно среди групп с низким социально-экономическим положением. По оценкам, с каждым пораженным кариесом молочным зубом вероятность возникновения зубной боли повышается на 5–6 % [125]. Недавно в Великобритании было проведено национальное исследование, в ходе которого было выявлено, что зубная боль наблюдается у 18 % детей в возрасте 12 лет, у 15 % — в возрасте 15 лет [126]. Несмотря на то, что кариес зубов может протекать бессимптомно, особенно на начальных стадиях, кариес связан со снижением качества жизни пациентов и их семей [127]. Кариес негативно влияет на повседневную активность детей [128, 129]. Кариес также выраженно снижает качество жизни детей раннего возраста и их родителей [130]. Таким же образом, зубная боль и распад твердых тканей зуба часто связаны с ухудшением связанного с состоянием полости рта качества жизни у взрослых. Среди взрослых в Великобритании, Уэльсе и Северной Ирландии 16 % сообщили о частом, 17 % — о тяжелом влиянии состояния полости рта на их повседневную жизнь. У детей с начальным кариесом распространенность частого и тяжелого влияния на качество жизни составила 24 %, у детей с тяжелым кариесом по критериям PUFA (пульпит, изъязвление, фистулы, абсцессы) — 38 %. В 2010 году нелеченый кариес оказался причиной почти 5 миллионов лет жизни, скорректированных по нетрудоспособности (DALY), еще 4,5 миллиона были связаны с выраженной потерей зубов. Кариес вносил свой вклад в показатель DALY в разных возрастных группах, но больше всего среди детей, молодых взрослых и взрослых среднего возраста. Кариес является наиболее частой стоматологической причиной DALY у людей младше 35 лет, в то время как потеря зубов в основном вносила свой вклад в DALY у взрослых среднего возраста и пожилых людей [18].
Влияние кариеса зубов не ограничивается симптоматикой со стороны полости рта и пагубным влиянием на качество жизни. Кариес постоянных зубов коррелирует с недостаточным питанием [131]; дети с КРД недополучают ряд питательных веществ по сравнению со здоровыми детьми [132, 133]. В других исследованиях была показана связь между кариесом и недостаточным приростом роста и веса детей [134–137]. Недостаточно данных для того, чтобы сказать, влияет ли лечение кариеса на рост [138–141], для выяснения этого требуются последующие исследования с длительным наблюдением и хорошей методологией. Тем не менее, лечение тяжелых форм кариеса зубов у детей привело к значительному уменьшению зубной боли и вероятности сепсиса, что улучшило показатель удовлетворенности зубами и улыбкой, а также аппетит, по сравнению с детьми, у которых кариес зубов не подвергался лечению [141]. В дополнение к росту и развитию, кариес также негативно влияет на успеваемость в школе, поскольку дети с плохим состоянием полости рта более склонны к пропускам занятий, а также в среднем получают оценки ниже, чем дети с лучшим состоянием полости рта [142, 143]. Наконец, тяжелая степень кариеса также связывалась с ощутимо повышенным риском госпитализации и связанными с ней финансовыми издержками [127, 144].
Кариес сильнее влияет на более бедные социальные группы [122, 125, 130, 145], имеются данные, подтверждающие взаимосвязь между социально-экономическим неравенством и высоким риском кариеса среди низких социально-экономических слоев [146]. Это указывает на важность сосредоточения внимания не только на поведенческих и биологических факторах риска, но и на более широких социальных и средовых детерминантах заболевания [147].
Перспективы
Кариес зубов остается одним из наиболее распространенных хронических заболеваний по всему миру [9, 148]. Его лечат хирургическими методами уже как минимум столетие. Меры общественного здравоохранения, такие как фторирование воды и местное применение фторидов, оказали значительное влияние на заболеваемость кариесом зубов в развитых странах. Тем не менее, неспособность устранить или приостановить заболеваемость во многих частях мира, а также наличие в развитых странах уязвимых популяционных групп, указывают на актуальность этой проблемы.
В грядущей эпохе наибольшего успеха добьются системы здравоохранения, основанные на эффективности и учете исходов заболеваний, а не на количестве проведенных процедур [149]. Лечение кариеса зубов также должно развиваться по модели, в которой все проводимое лечение направлено на достижение максимально благоприятного исхода. Соответственно, первым результатом лечения кариеса на индивидуальном и популяционном уровнях является сохранение естественных, здоровых зубов. Следующий исход — установление уверенного контроля над заболеванием, остановка или обращение кариозного процесса вспять. Оба эти результата являются важными условиями наиболее благоприятного исхода лечения кариеса: естественного восстановления утраченных твердых тканей зуба и полного восстановления его функции. Именно в расчете на этот исход страховые компании и пациенты оплачивают дорогостоящее лечение. Чтобы стимулировать поиск оптимального лечения, проведенные манипуляции должны оплачиваться соответственно достигнутой положительной динамике.
Для того чтобы обеспечить качественную помощь пациентам с кариесом, стоматологи должны определять стадию кариозного процесса, оценивать факторы риска (на медицинском, биологическом, поведенческом, социальном уровнях и на уровне зубов), составлять комплексные планы лечения. Все это позволяет предотвращать новые случаи кариеса, контролировать поражения в начальной стадии, восстанавливать утраченные ткани и функции зубного ряда [54]. Оплата труда стоматологов при оценке всех исходов этих процессов так же важна, как и оплата их труда за достижение благоприятных исходов путем выполнения процедур, поскольку именно эти результаты позволяют достигнуть здоровья зубов. Несомненно, предлагаемая авторами система оценки лечения является глобальным, революционным нововведением для стоматологической помощи, которая до настоящего времени была сосредоточена исключительно на выполнении процедур. Процедурно-ориентированная система оплаты не теряет своей актуальности, но она должна стать частью более развитой модели системы здравоохранения, направленной на поддержание здоровья. Внедрение новой парадигмы в стоматологическую практику и обучение специалистов будет нелегким делом и потребует времени.
К счастью, существует несколько примеров успешного изменения парадигмы лечения в стоматологии. Например, в ходе серии клинических исследований по сравнению хирургических и нехирургических методов лечения заболеваний периодонта, проведенных в 1970-х и 1980-х годах, было выявлено, что для большинства степеней тяжести заболеваний периодонта оба подхода позволяли получать схожие результаты [150]. Несмотря на бурную реакцию сторонников хирургического лечения, появление доказательной базы привело к резкому (в течение двух десятилетий) сдвигу в сторону нехирургического лечения. Точно также может измениться и подход к лечению кариеса [151]. Другой заслуживающий внедрения подход заключается в разработке и распространении среди стоматологов рекомендаций по правильному ведению пациентов с кариесом. Для стоматологов привычной практикой является принятие стандартов, продиктованных страховыми компаниями, государственными агентствами, советами по лицензиям, а также авторитетами в области здравоохранения. Ярким примером изменения поведения, связанного с введением новых стратегий, является принятие мер по контролю инфекций и стандартов гигиены труда и радиационной безопасности.
Что касается других перспективных принципов, качественных доказательств их преимуществ пока слишком мало [152]. Непрерывное образование и статьи в стоматологических журналах, несмотря на свой обязательный характер, сами по себе недостаточно убедительны, чтобы повлиять на устоявшиеся среди профессионалов взгляды. Данный вывод подтверждается процессом внедрения фиссурных герметиков. Хотя герметики и основаны на тех же материалах, что и композитные пломбы, их внедрение происходило гораздо медленнее, чем внедрение композитных пломб [153]. Вероятно, это можно объяснить тем, что, в соответствии с исследованиями [154], фиссурные герметики продвигались в качестве замены оперативному лечению, принятому стоматологами в качестве золотого стандарта. В то же время, композитные пломбы заменили серебряную амальгаму, от которой пациенты и стоматологи отказались довольно легко из-за опасений по поводу контакта со ртутью и эстетических соображений.
Ожидается, что предложенная интегрированная система лечения кариеса и эффективной стоматологической помощи потребует изменений многих, но не всех, устоявшихся норм практики. Внедрение потребует разработки многоэтапной стратегии, коллективного вовлечения всех стоматологов, преподавателей и законодателей, а также проведения исследований, направленных на оценку эффективности новой парадигмы лечения кариеса, при необходимости ее улучшения. Следует понимать, что сроки и ключевые моменты внедрения этой системы непредсказуемы.
Проблема кариеса крайне актуальна по всему миру в связи с затратами на лечение, потерями школьного и рабочего времени, в некоторых случаях тяжелыми местными и системными инфекциями, и, изредка, даже летальными исходами. Именно поэтому необходимо добиться повсеместного введения описанных в данной статье принципов. Необходимо обеспечить взаимодействие стоматологических клиник, образовательных учреждений, профессиональных и государственных объединений с целью создания организации, члены которой могли бы делиться опытом в этой сфере и помогать проводить исследования эффективности описанной концепции. Первые шаги в виде создания консенсусных рекомендаций по ведению кариеса уже предприняты [49]. К счастью, на сегодняшний день доступны технологии, которые помогут в изменении устоявшихся норм и сборе данных. Использование компьютеризированных напоминаний, электронного аудита, обратной связи и алгоритмов принятия решений «stop-and-go» в электронных историях болезни создают новые возможности, способствующие изменению поведения практикующих стоматологов. Эффективность аудита и обратной связи в изменении поведения специалистов здравоохранения была незначительной [155]. Объединение аудита и обратной связи в электронных историях болезни позволит ввести напоминания для практикующих стоматологов о необходимости следовать стандартам лечения в процессе его осуществления.
Источники
2. Koussoulakou, D. S., Margaritis, L. H. & Koussoulakos, S. L. A curriculum vitae of teeth: evolution, generation, regeneration. Int. J. Biol. Sci. 5, 226–243 (2009).
3. Petersen, P.-E., Bourgeois, D., Ogawa, H., Estupinan-Day, S. & Ndiaye, C. The global burden of oral diseases and risks to oral health. Bull. World Health Organ. 83, 661–669 (2005).
4. Broadbent, J. M., Thomson, W. M. & Poulton, R. Trajectory patterns of dental caries experience in the permanent dentition to the fourth decade of life. J. Dent. Res. 87, 69–72 (2008). This paper provides a rare and excellent perspective on longitudinal caries data on adults and shows how caries develops over the life course.
5. Pitts, N. et al. Global oral heath inequalities: dental caries task group — research agenda. Adv. Dent. Res. 23, 211–220 (2011).
6. American Academy of Pediatric Dentistry. American Academy of Pediatric Dentistry reference manual 2014–2015. Pediatr. Dent. 36 (6 reference manual), 1–140 (2014).
7. US Department of Health and Human Services. Oral health in America: a report of the Surgeon General. National Institute of Dental and Craniofacial Research https://www.nidcr.nih.gov/datastatistics/ surgeongeneral/report/executivesummary.htm (2000).
8. Dye, B. A. et al. Trends in pediatric dental caries by poverty status in the US. Int. J. Paediatr. Dent. 20, 132–143 (2010).
9. Dye, B. A. et al. Trends in oral health status: United States, 1988–1994 and 1999–2004. Vital Health Stat. 11, 1–92 (2007).
10. Dye, B. A., Vargas, C. M., Fryar, C. D., Ramos-Gomez, F. & Isman, R. Oral health status of children in Los Angeles County and in the United States, 1999–2004. Community Dent. Oral Epidemiol. 45, 135–144 (2016).
11. Pitts, N. B. Discovering dental public health: from Fisher to the future. Community Dent. Health 11, 172–178 (1994).
12. Topping, G. V. & Pitts, N. B. in Detection, Assessment, Diagnosis and Monitoring of Caries Vol. 21 (ed. Pitts, N.) 15–41 (Karger, 2009). This paper outlines original consensus developments and literature supporting the ICDAS caries classification system, which is designed to be used in epidemiology, research, practice and education.
13. Kühnisch, J. et al. Occlusal caries detection in permanent molars according to WHO basic methods, ICDAS II and laser fluorescence measurements. Community Dent. Oral Epidemiol. 36, 475–484 (2008).
14. Pitts, N. B., Chadwick, B. & Anderson, T. Children’s Dental Health Survey 2013. Report 2: dental disease and damage in children: England, Wales and Northern Ireland. National Health Service http://content.digital.nhs.uk/catalogue/ PUB17137/CDHS2013-Report2-Dental-Disease.pdf (2015).
15. Patel, R. N. et al. Variability of methodologies used to determine national mean DMFT scores for 12-year-old children in European countries. Community Dent. Health 33, 286–291 (2016).
16. Pitts, N., Melo, P., Martignon, S., Ekstrand, K. & Ismail, A. Caries risk assessment, diagnosis and synthesis in the context of a European Core Curriculum in Cariology. Eur. J. Dent. Educ. 15 (Suppl. 1), 23–31 (2011).
17. Agustsdottir, H. et al. Caries prevalence of permanent teeth: a national survey of children in Iceland using ICDAS. Community Dent. Oral Epidemiol. 38, 299–309 (2010).
18. Marcenes, W. et al. Global burden of oral conditions in 1990–2010: a systematic analysis. J. Dent. Res. 92, 592–597 (2013).
19. Moynihan, P. J. & Kelly, S. A. Effect on caries of restricting sugars intake: systematic review to inform WHO guidelines. J. Dent. Res. 93, 8–18 (2014). This rigorous systematic review of the impact of sugar intake on caries development formed the basis of the recent WHO guidance on sugar consumption for caries, obesity and diabetes mellitus. 20. Sheiham, A. & James, W. P. Diet and dental caries: the pivotal role of free sugars reemphasized. J. Dent. Res. 94, 1341–1347 (2015).
21. Zero, D. T. et al. The biology, prevention, diagnosis and treatment of dental caries: scientific advances in the United States. J. Am. Dent. Assoc. 140 (Suppl. 1), 25S–34S (2009).
22. Reisine, S. & Litt, M. Social and psychological theories and their use for dental practice. Int. Dent. J. 43, 279–287 (1993).
23. Fejerskov, O. Concepts of dental caries and their consequences for understanding the disease. Community Dent. Oral Epidemiol. 25, 5–12 (1997).
24. Selwitz, R. H., Ismail, A. I. & Pitts, N. B. Dental caries. Lancet 369, 51–59 (2007).
25. Zero, D. T. Sugars — the arch criminal? Caries Res. 38, 277–285 (2004).
26. Takahashi, N. Microbial ecosystem in the oral cavity: metabolic diversity in an ecological niche and its relationship with oral diseases. Int. Congr. Ser. 1284, 103–112 (2005).
27. Zero, D. T. Dental caries process. Dent. Clin. North Am. 43, 635–664 (1999).
28. ten Cate, J. M. & Featherstone, J. D. Mechanistic aspects of the interactions between fluoride and dental enamel. Crit. Rev. Oral Biol. Med. 2, 283–296 (1991).
29. Featherstone, J. D. The continuum of dental caries — evidence for a dynamic disease process. J. Dent. Res. 83, C39–C42 (2004). This paper provides an overview of the dynamic nature of the caries process with alternating periods of demineralization and remineralization and how changing risk factors can affect the caries balance.
30. Wilson, M. Microbial Inhabitants of Humans. Their Ecology and Role in Health and Disease (Cambridge Univ. Press, 2005).
31. Devine, D. A., Marsh, P. D. & Meade, J. Modulation of host responses by oral commensal bacteria. J. Oral Microbiol. 7, 26941 (2015).
32. Nobbs, A. H., Jenkinson, H. F. & Jakubovics, N. S. Stick to your gums: mechanisms of oral microbial adherence. J. Dent. Res. 90, 1271–1278 (2011).
33. Zijnge, V. et al. Oral biofilm architecture on natural teeth. PLoS ONE 5, e9321 (2010).
34. Wright, C. J. et al. Microbial interactions in building of communities. Mol. Oral Microbiol. 28, 83–101 (2013).
35. Scannapieco, F. A. Saliva–bacterium interactions in oral microbial ecology. Crit. Rev. Oral Biol. Med. 5, 203–248 (1994).
36. Hara, A. T. & Zero, D. T. The caries environment: saliva, pellicle, diet, and hard tissue ultrastructure. Dent. Clin. North Am. 54, 455–467 (2010).
37. Jakubovics, N. S., Yassin, S. A. & Rickard, A. H. Community interactions of oral streptococci. Adv. Appl. Microbiol. 87, 43–110 (2014).
38. Klein, M. I., Hwang, G., Santos, P. H., Campanella, O. H. & Koo, H. Streptococcus mutansderived extracellular matrix in cariogenic oral biofilms. Front. Cell. Infect. Microbiol. 5, 10 (2015).
39. Sheiham, A. & James, W. P. A reappraisal of the quantitative relationship between sugar intake and dental caries: the need for new criteria for developing goals for sugar intake. BMC Public Health 14, 863 (2014).
40. Loesche, W. J. Role of Streptococcus mutans in human dental decay. Microbiol. Rev. 50, 353–380 (1986).
41. Rosier, B. T., De Jager, M., Zaura, E. & Krom, B. P. Historical and contemporary hypotheses on the development of oral diseases: are we there yet? Front. Cell. Infect. Microbiol. 4, 92 (2014).
42. Marsh, P. D. Are dental diseases examples of ecological catastrophes? Microbiology 149, 279–294 (2003). This is an important paper outlining the shift of thinking around the ecological relationship between the biofilm and the tooth in health and disease and how this links to caries pathogenesis.
43. Takahashi, N. & Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42, 409–418 (2008).
44. Hong, L., Levy, S. M., Warren, J. J. & Broffitt, B. Association between enamel hypoplasia and dental caries in primary second molars: a cohort study. Caries Res. 43, 345–353 (2009).
45. Fisher, J. & Glick, M. A new model for caries classification and management: the FDI World Dental Federation caries matrix. J. Am. Dent. Assoc. 143, 546–551 (2012).
46. Ismail, A. et al. Caries management pathways preserve dental tissues and promote oral health. Community Dent. Oral Epidemiol. 41, e12–e40 (2013).
47. Pitts, N. B. & Ekstrand, K. R. International Caries Detection and Assessment System (ICDAS) and its International Caries Classification and Management System (ICCMS) — methods for staging of the caries process and enabling dentists to manage caries. Community Dent. Oral Epidemiol. 41, e41–e52 (2013). This paper describes the journey from the caries classification of the ICDAS system to the integrated clinical, radiographic and risk-based caries management system ICCMS™.
48. International Caries Detection and Assessment System (ICDAS) Foundation. What is ICDAS. ICDAS Foundation https://www.icdas.org/what-is-icdas (2017).
49. Pitts, N. B. et al. ICCMS™ guide for practitioners and educators. ICDAS Foundation https://www.icdas.org/ uploads/ICCMS-Guide_Full_Guide_With_Appendices_ UK.pdf (2014). This guide outlines best evidence as to how the ICCMS™ caries management system can be used practically by both educators and clinicians.
50. Ismail, A., Pitts, N. B. & Tellez, M. The international caries classification and management system (ICCMSTM) an example of a caries management pathway. BMC Oral Health 15, S9 (2015).
51. Watt, R. G. Social determinants of oral health inequalities: implications for action. Community Dent. Oral Epidemiol. 40 (Suppl. 2), 44–48 (2012). This paper considers the important social determinants underlying oral health inequalities and outlines action required to improve health equity.
52. Jürgensen, N. & Petersen, P. E. Promoting oral health of children through schools — results from a WHO global survey. Community Dent. Health 30, 204–218 (2013).
53. World Health Organization. Oral health: action plan for promotion and integrated disease prevention. WHO http://apps.who.int/iris/bitstream/10665/ 21909/1/b120_10-en.pdf (2006).
54. Weintraub, J. A. Sustainable oral health interventions. J. Public Health Dent. 71, S95–S96 (2011).
55. Panagakos, F. Partners in prevention: a winning approach for communities and companies. J. Evid. Base Dent. Pract. 12, 58–61 (2012).
56. Alliance for a Cavity-Free Future. About the alliance for a cavity-free future. Alliance for a Cavity-Free Future www.allianceforacavityfreefuture.org/en/us/about-us (2016).
57. The Community Preventive Services Task Force. Dental caries (cavities): community water fluoridation. The Community Guide www.thecommunityguide.org/ oral/fluoridation.html (2013).
58. U.S. Department of Health and Human Services Federal Panel on Community Water Fluoridation. U.S. Public Health Service recommendation for fluoride concentration in drinking water for the prevention of dental caries. Public Health Rep. 130, 318–331 (2015).
59. Griffin, S. O., Jones, K. & Tomar, S. L. An economic evaluation of community water fluoridation. J. Public Health Dent. 61, 78–86 (2001).
60. World Health Organization. Guidelines for drinking-water quality. WHO http://apps.who.int/iris/ bitstream/10665/44584/1/9789241548151_eng.pdf (2011).
61. Pollick, H. F. Salt fluoridation: a review. J. Calif. Dent. Assoc. 41, 395–404 (2013).
62. Marthaler, T. M. Salt fluoridation and oral health. Acta Med. Acad. 42, 140–155 (2013).
63. Bánóczy, J., Rugg-Gunn, A. & Woodward, M. Milk fluoridation for the prevention of dental caries. Acta Med. Acad. 42, 156–167 (2013).
64. Yeung, C. A., Chong, L. Y. & Glenny, A. M. Fluoridated milk for preventing dental caries. Cochrane Database Syst. Rev. 3, CD003876 (2015).
65. Wright, J. T. et al. Evidence-based clinical practice guideline for the use of pit-and-fissure sealants: a report of the American Dental Association and the American Academy of Pediatric Dentistry. J. Am. Dent. Assoc. 147, 672–682 (2016).
66. The Community Preventive Services Task Force. Dental caries (cavities): school-based dental sealant delivery programs. The Community Guide www.thecommunityguide.org/oral/schoolsealants.html (2013).
67. Griffin, S. O. et al. Use of dental care and effective preventive services in preventing tooth decay among U.S. Children and adolescents — Medical Expenditure Panel Survey, United States, 2003–2009 and National Health and Nutrition Examination Survey, United States, 2005–2010. MMWR Suppl. 63, 54–60 (2014).
68. Siegal, M. D. & Detty, A. M. Do school-based dental sealant programs reach higher risk children? J. Public Health Dent. 70, 181–187 (2010).
69. Weintraub, J. A., Stearns, S. C., Rozier, R. G. & Huang, C. C. Treatment outcomes and costs of dental sealants among children enrolled in Medicaid. Am. J. Public Health. 91, 1877–1881 (2001).
70. Mariño, R., Fajardo, J. & Morgan, M. Cost-effectiveness models for dental caries prevention programmes among Chilean schoolchildren. Community Dent. Health 29, 302–308 (2012).
71. Edelstein, B. L., Hirsch, G., Frosh, M. & Kumar, J. Reducing early childhood caries in a Medicaid population: a systems model analysis. J. Am. Dent. Assoc. 146, 224–232 (2015).
72. Public Health England. Delivering better oral health: an evidence-based toolkit for prevention — third edition. Gov.uk https://www.gov.uk/government/ uploads/system/uploads/attachment_data/file/601832/ delivering_better_oral_health.pdf (2014).
73. Scottish Intercollegiate Guidelines Network. SIGN138. Dental interventions to prevent caries in children: a national clinical guideline. Scottish Intercollegiate Guidelines Network http://www.sign.ac.uk/pdf/ SIGN138.pdf (2014).
74. Weyant, R. J. et al. Topical fluoride for caries prevention: executive summary of the updated clinical recommendations and supporting systematic review. J. Am. Dent. Assoc. 144, 1279–1291 (2013).
75. Marinho, V. C., Higgins, J. P., Logan, S. & Sheiham, A. Topical fluoride (toothpastes, mouthrinses, gels or varnishes) for preventing dental caries in children and adolescents. Cochrane Database Syst. Rev. 4, CD002782 (2003).
76. World Health Organization. Guideline: sugars intake for adults and children. WHO http://apps.who.int/iris/ bitstream/10665/149782/1/9789241549028_ eng.pdf (2015).
77. Disney, J. A. et al. The University of North Carolina Caries Risk Assessment study: further developments in caries risk prediction. Community Dent. Oral Epidemiol. 20, 64–75 (1992).
78. Bratthall, D. & Hänsel Petersson, G. Cariogram — a multifactorial risk assessment model for a multifactorial disease. Community Dent. Oral Epidemiol. 33, 256–264 (2005).
79. Twetman, S., Ekstrand, K. R. & Keller, M. K. Caries — en biofilmmedieret sygdom. Tandlægebladet 17, 1–6 (English summary) (2013).
80. Walsh, T. et al. Fluoride toothpastes of different concentrations for preventing dental caries in children and adolescents. Cochrane Database Syst. Rev. 1, CD007868 (2010).
81. Carvalho, J. C., Ekstrand, K. R. & Thylstrup, A. Dental plaque and caries on occlusal surfaces of first permanent molars in relation to stage of eruption. J. Dent. Res. 68, 773–779 (1989).
82. Mejàre, I. Bitewing examination to detect caries in children and adolescents — when and how often? Dent. Update 32, 588–590 (2005).
83. Ridell, K., Olsson, H. & Mejàre, I. Unrestored dentin caries and deep dentin restorations in Swedish adolescents. Caries Res. 42, 164–170 (2008).
84. Ekstrand, K. R., Bruun, G. & Bruun, M. Plaque and gingival status as indicators for caries progression on approximal surfaces. Caries Res. 32, 41–45 (1998).
85. Ekstrand, K. R., Martignon, S., Ricketts, D. J. & Qvist, V. Detection and activity assessment of primary coronal caries lesions: a methodologic study. Oper. Dent. 32, 225–235 (2007).
86. Amaechi, B. T. Remineralization therapies for initial caries lesions. Curr. Oral Health Rep. 2, 95–101 (2015).
87. Zero, D. T. Dentifrices, mouthwashes, and remineralization/caries arrestment strategies. BMC Oral Health 6, S9 (2006).
88. Ten Cate, J. M. & Fetherstone, J. D. Mechanistic aspects of the interactions between fluoride and dental enamel. Crit. Rev. Oral Biol. Med. 2, 283–296 (1991).
89. Newbrun, E. Topical fluorides in caries prevention and management: a North American perspective. J. Dent. Educ. 65, 1078–1083 (2001).
90. Lee, Y. E. et al. Comparison of remineralization effect of three topical fluoride regimens on enamel initial carious lesions. J. Dent. 38, 166–171 (2010).
91. Amaechi, B. T. & van Loveren, C. Fluorides and nonfluoride remineralization systems. Monogr. Oral Sci. 23, 15–26 (2013).
92. Kandelman, D. & Gagnon, G. A 24-month clinical study of the incidence and progression of dental caries in relation to consumption of chewing gum containing xylitol in school preventive programs. J. Dent. Res. 69, 1771–1775 (1990).
93. Featherstone, J. D. Prevention and reversal of dental caries: role of low level fluoride. Community Dent. Oral Epidemiol. 27, 31–40 (1999).
94. Reynolds, E. C., Cai, F., Shen, P. & Walker, G. D. Retention in plaque and remineralization of enamel lesions by various forms of calcium in a mouthrinse or sugar-free chewing gum. J. Dent. Res. 82, 206–211 (2003).
95. Kitasako, Y., Sadr, A., Hamba, H., Ikeda, M. & Tagami, J. Gum containing calcium fluoride reinforces enamel subsurface lesions in situ. J. Dent. Res. 91, 370–375 (2012).
96. Hamba, H., Nikaido, T., Inoue, G., Sadr, A. & Tagami, J. Effects of CPP-ACP with sodium fluoride on inhibition of bovine enamel demineralization: a quantitative assessment using micro-computed tomography. J. Dent. 39, 405–413 (2011).
97. Tay, F. R. et al. The glass-ionomer phase in presin-based restorative materials. J. Dent. Res. 80, 1808–1812 (2001).
98. Ito, S. et al. Effects of surface pre-reacted glass-ionomer fillers on mineral induction by phosphoprotein. J. Dent. 39, 72–79 (2011).
99. Holmgren, C., Gaucher, N., Decerle, N. & Doméjean, S. Minimal intervention dentistry II: part 3. Management of non-cavitated (initial) occlusal caries lesions — non-invasive approaches through remineralization and therapeutic sealants. Br. Dent. J. 216, 237–243 (2014).
100. Ricketts, D., Lamont, T., Innes, N. P., Kidd, E. & Clarkson, J. E. Operative caries management in adults and children. Cochrane Database Syst. Rev. 3, CD003808 (2013).
101. Kidd, E. & Fejerskov, O. Changing concepts in cariology: forty years on. Dent. Update 40, 277–286 (2013).
102. Zandona, A. F. & Swift, E. J. Jr. Critical appraisal. Evidence for sealing versus restoration of early caries lesions. J. Esthet. Restor. Dent. 27, 55–58 (2015).
103. Meyer-Lueckel, H., Bitter, K. & Paris, S. Randomized controlled clinical trial on proximal caries infiltration: three-year follow-up. Caries Res. 46, 544–548 (2012).
104. Schwendicke, F., Meyer-Lueckel, H., Stolpe, M., Dörfer, C. E. & Paris, S. Costs and effectiveness of treatment alternatives for proximal caries lesions. PLoS ONE 9, e86992 (2014).
105. Schwendicke, F., Stolpe, M., Meyer-Lueckel, H. & Paris, S. Detecting and treating occlusal caries lesions: a cost-effectiveness analysis. J. Dent. Res. 94, 272–280 (2015).
106. Wierichs, R. J. & Meyer-Lueckel, H. Systematic review on noninvasive treatment of root caries lesions. J. Dent. Res. 94, 261–271 (2015).
107. Duangthip, D., Jiang, M., Chu, C. H. & Lo, E. C. Non-surgical treatment of dentin caries in preschool children — systematic review. BMC Oral Health 15, 44 (2015).
108. Clarkson, B. H. & Exterkate, R. A. M. Noninvasive dentistry: a dream or reality? Caries Res. 49 (Suppl. 1), 11–17 (2015).
109. Marsh, P. D., Head, D. A. & Devine, D. A. Prospects of oral disease control in the future — an opinion. J. Oral Microbiol. 6, 261–276 (2014).
110. Rasines Alcaraz, M. G. et al. Direct composite resin fillings versus amalgam fillings for permanent or adult posterior teeth. Cochrane Database Syst. Rev. 3, CD005620 (2014).
111. Ferreira, J. M., Pinheiro, S. L., Sampaio, F. C. & de Menezes, V. A. Caries removal in primary teeth — a systematic review. Quintessence Int. 43, e9–e15 (2012).
112. Innes, N. P., Evans, D. J. & Stirrups, D. R. The Hall technique; a randomized controlled clinical trial of a novel method of managing carious primary molars in general dental practice: acceptability of the technique and outcomes at 23 months. BMC Oral Health 7, 18 (2007).
113. Seale, N. S. & Randall, R. The use of stainless steel crowns: a systematic literature review. Pediatr. Dent. 37, 145–160 (2015).
114. Gajendra, S. & Kuma, J. V. Oral health and pregnancy: a review. NY State Dent. J. 70, 40–44 (2004).
115. The American Academy of Pediatric Dentistry (AAPD) Council on Clinical Affairs. Guideline on caries-risk assessment and management for infants, children and adolescents. American Academy of Pediatric Dentistry http://www.aapd.org/media/policies_guidelines/ g_cariesriskassessment.pdf (2014).
116. Ramos-Gomez, F. J. A model for community-based pediatric oral health: implementation of an infant oral care program. Int. J. Dent. 2014, 156821 (2014).
117. Ramos-Gomez, F. & Ng, M.-W. Into the future: keeping healthy teeth caries free: pediatric CAMBRA protocols. J. Calif. Dent. Assoc. 39, 723–733 (2011).
118. Institute of Medicine. Oral Health Literacy. Roundtable on Health Literacy; Board on Population Health and Public Health Practice (National Academies Press, 2003).
119. Karlinsey, R. L. & Pfarrer, A. M. Fluoride plus functionalized β-TCP: a promising combination for robust remineralization. Adv. Dent. Res. 24, 48–52 (2012).
120. American Dental Association Council on Scientific Affairs. Fluoride toothpaste use for young children. J. Am. Dent. Assoc. 145, 190–191 (2014).
121. Kassebaum, N. J. et al. Global burden of untreated caries: a systematic review and metaregression. J. Dent. Res. 94, 650–658 (2015). This systematic review considers the global burdens associated with untreated caries, how these can be quantified and compared with other non-communicable diseases.
122. White, D. A. et al. Adult Dental Health Survey 2009: common oral health conditions and their impact on the population. Br. Dent. J. 213, 567–572 (2012).
123. Thomson, W. M. Epidemiology of oral health conditions in older people. Gerodontology 31 (Suppl. 1), 9–16 (2014).
124. Vernazza, C. R., Rolland, S. L., Chadwick, B. & Pitts, N. Caries experience, the caries burden and associated factors in children in England, Wales and Northern Ireland 2013. Br. Dent. J. 221, 315–320 (2016).
125. Slade, G. D. Epidemiology of dental pain and dental caries among children and adolescents. Community Dent. Health 18, 219–227 (2001).
126. Ravaghi, V., Holmes, R. D., Steele, J. G. & Tsakos, G. The impact of oral conditions on children in England, Wales and Northern Ireland 2013. Br. Dent. J. 221, 173–178 (2016).
127. Casamassimo, P. S., Thikkurissy, S., Edelstein, B. L. & Maiorini, E. Beyond the DMFT: the human and economic cost of early childhood caries. J. Am. Dent. Assoc. 140, 650–657 (2009).
128. Krisdapong, S., Prasertsom, P., Rattanarangsima, K. & Sheiham, A. Relationships between oral diseases and impacts on Thai schoolchildren’s quality of life: evidence from a Thai national oral health survey of 12- and 15-year-olds. Community Dent. Oral Epidemiol. 40, 550–559 (2012).
129. Montero, J. et al. Oral health-related quality of life in 6- to 12-year-old schoolchildren in Spain. Int. J. Paediatr. Dent. 26, 220–230 (2016).
130. Abanto, J. et al. Impact of dental caries and trauma on quality of life among 5- to 6-year-old children: perceptions of parents and children. Community Dent. Oral Epidemiol. 42, 385–394 (2014).
131. Psoter, W. J., Reid, B. C. & Katz, R. V. Malnutrition and dental caries: a review of the literature. Caries Res. 39, 441–447 (2005).
132. Schroth, R. J. et al. Vitamin D status of children with severe early childhood caries: a case–control study. BMC Pediatr. 13, 174 (2013).
133. Schroth, R. J., Levi, J., Kliewer, E., Friel, J. & Moffatt, M. E. Association between iron status, iron deficiency anaemia, and severe early childhood caries: a case–control study. BMC Pediatr. 13, 22 (2013).
134. Ayhan, H., Suskan, E. & Yildirim, S. The effect of nursing or rampant caries on height, body weight and head circumference. J. Clin. Pediatr. Dent. 20, 209–212 (1996).
135. Sheiham, A. Dental caries affects body weight, growth and quality of life in pre-school children. Br. Dent. J. 201, 625–626 (2006).
136. Oliveira, L. B., Sheiham, A. & Bönecker, M. Exploring the association of dental caries with social factors and nutritional status in Brazilian preschool children. Eur. J. Oral Sci. 116, 37–43 (2008).
137. Alkarimi, H. A., Watt, R. G., Pikhart, H., Sheiham, A. & Tsakos, G. Dental caries and growth in school-age children. Pediatrics 133, e616–e623 (2014).
138. Acs, G., Shulman, R., Ng, M. W. & Chussid, S. The effect of dental rehabilitation on the body weight of children with early childhood caries. Pediatr. Dent. 21, 109–113 (1999).
139. Malek Mohammadi, T., Wright, C. M. & Kay, E. J. Childhood growth and dental caries. Community Dent. Health 26, 38–42 (2009).
140. Gemert-Schriks, M. C. M. et al. The influence of dental caries on body growth in prepubertal children. Clin. Oral Invest. 15, 141–149 (2010).
141. Alkarimi, H. A. et al. Impact of treating dental caries on schoolchildren’s anthropometric, dental, satisfaction and appetite outcomes: a randomized controlled trial. BMC Public Health 12, 706 (2012).
142. Jackson, S. L., Vann, W. F. Jr, Kotch, J. B., Pahel, B. T. & Lee, J. Y. Impact of poor oral health on children’s school attendance and performance. Am. J. Public Health 101, 1900–1906 (2011).
143. Krisdapong, S., Prasertsom, P., Rattanarangsima, K. & Sheiham, A. School absence due to toothache associated with sociodemographic factors, dental caries status, and oral health-related quality of life in 12- and 15-year-old Thai children. J. Public Health Dent. 73, 321–328 (2013).
144. Griffin, S. O., Gooch, B. F., Beltrán, E., Sutherland, J. N. & Barsley, R. Dental services, costs, and factors associated with hospitalization for Medicaid-eligible children, Louisiana 1996–1997. J. Public Health Dent. 60, 21–27 (2000).
145. Moles, D. Epidemic of dental abscesses? Dental abscesses have increased most among poorer people. BMJ 336, 1323 (2008).
146. Schwendicke, F. et al. Socioeconomic inequality and caries: a systematic review and meta-analysis. J. Dent. Res. 94, 10–18 (2015).
147. Fisher-Owens, S. A. et al. Influences on children’s oral health: a conceptual model. Pediatrics 120, e510–e520 (2007).
148. Bagramian, R. A., Garcia-Godoy, F. & Volpe, A. R. The global increase in dental caries. A pending public health crisis. Am. J. Dent. 22, 3–8 (2009).
149. Porter, M. E. A strategy for health care reform — toward a value-based system. N. Engl. J. Med. 361, 109–112 (2009).
150. Kaldahl, W. B., Kalkwarf, K. L. & Patil, K. D. A review of longitudinal studies that compared periodontal therapies. J. Periodontol. 64, 243–253 (1993).
151. Innes, N. & Evans, D. Association between parental guilt and oral health problems in preschool children. Br. Dent. J. 206, 549–550 (2009).
152. Eccles, M. P. et al. Developing clinical practice guidelines: target audiences, identifying topics for guidelines, guideline group composition and functioning and conflicts of interest. Implement. Sci. 7, 60 (2012).
153. Tellez, M., Gray, S. L., Gray, S., Lim, S. & Ismail, A. I. Sealants and dental caries: dentists’ perspectives on evidence-based recommendations. J. Am. Dent. Assoc. 142, 1033–1040 (2011).
154. Beauchamp, J. et al. Evidence-based clinical recommendations for the use of pit-and-fissure sealants: a report of the American Dental Association Council on Scientific Affairs. Dent. Clin. North Am. 53, 131–147 (2009).
155. Phelan, M. P. et al. A multifaceted intervention to improve electronic health record (EHR) nursing documentation for emergency department blood draws. Acad. Emerg. Med. 22, S322–S323 (2015).
156. Fejerskov, O., Thylstrup, A. & Larsen, M. J. Rational use of fluorides in caries prevention. A concept based on possible cariostatic mechanisms. Acta Odontol. Scand. 39, 241–249 (1981).
157. Fluoride Recommendations Work Group. Recommendations for using fluoride to prevent and control dental caries in the United States. Centers for Disease Control and Prevention. MMWR Recomm. Rep. 50, 1–42 (2001).
158. Hellwig, E. & Lennon, A. M. Systemic versus topical fluoride. Caries Res. 38, 258–262 (2004).
159. Margolis, H. C., Moreno, E. C. & Murphy, B. J. Effect of low levels of fluoride in solution on enamel demineralisation in vitro. J. Dent. Res. 65, 23–29 (1986).
160. ten Cate, J. M. Current concepts on the theories of the mechanism of action of fluoride. Acta Odontol. Scand. 57, 325–329 (1999).
161. Iheozor-Ejiofor, Z. et al. Water fluoridation for the prevention of dental caries. Cochrane Database Syst. Rev. 6, CD010856 (2015).
162. Rugg-Gunn, A. J. et al. Critique of the review of ‘Water fluoridation for the prevention of dental caries’ published by the Cochrane Collaboration in 2015. Br. Dent. J. 220, 335–340 (2016).
163. Pahel, B. T., Rozier, R. G., Stearns, S. C. & Quiñonez, R. B. Effectiveness of preventive dental treatments by physicians for young Medicaid enrollees. Pediatrics 127, e682–e689 (2011).
