Лимфатические сосуды мозговых оболочек и обмен жидкости в ЦНС

Абстракт | Лимфатическая система мозговых оболочек способна переносить жидкость, иммунные клетки и макромолекулы из центральной нервной системы (ЦНС) в глубокие шейные лимфатические узлы. Ее открытие позволило более четко описать многочисленные взаимодействия между нервной и иммунной системами в норме и при патологии. Однако остаются малоизученными точная локализация лимфатических сосудов мозговых оболочек и пути оттока спинномозговой жидкости (СМЖ) в лимфатическую систему. В данной статье авторы обсуждают потенциальные различия лимфатических сосудов на периферии и в ЦНС и рассматривают предполагаемые механизмы оттока (дренажа) лимфы из ЦНС, а также соответствие этих механизмов общепринятым представлениям о циркуляции СМЖ.
Основные положения
- В твердой мозговой оболочке обнаружены рабочие лимфатические сосуды классического строения, способные отводить жидкость с иммунными клетками из мозговых оболочек, паренхимы мозга и СМЖ.
- Лимфатическая система мозговых оболочек необходима для эффективного удаления интерстициальной жидкости (ИЖ) мозга и может представлять собой общий путь удаления продуктов метаболизма паренхимы мозга, предварительно выведенных через глимфатическую систему, осуществляющую обмен между СМЖ и ИЖ.
- Необходимо дальнейшее изучение точного расположения лимфатических сосудов в слоях мозговых оболочек.
- Динамика потока и поступление СМЖ в лимфатические сосуды мозговых оболочек также остаются слабо изучены.
CCL21 (CC-хемокин 21) — цитокин подсемейства CC, функционирующий как хемоатрактантный белок иммунных клеток.
CD31 — эндотелиальный маркер, присутствующий на поверхности тромбоцитов, моноцитов, нейтрофилов, некоторых Т-лимфоцитов и эндотелиальных клеток, а также многих других типах клеток организма; также известен как тромбоцитарно-эндотелиальная молекула адгезии (PECAM-1).
Lyve-1 (гиалуроновый рецептор 1 эндотелия лимфатических сосудов) — мембранный гликопротеин – поверхностный рецептор эндотелиальных клеток лимфатических сосудов; также известен как белок, содержащий внеклеточный домен сцепления 1 (XLKD1).
Подопланин — мембранный гликопротеин типа 1 с неопределенной функцией, обнаруженный в клетках альвеол легких, подоцитах почек и эндотелиальных клетках лимфатических сосудов.
Prox1 (гомеобоксный белок Prospero 1) — фактор транскрипции, участвующий в процессах развития нескольких органов, включая развитие лимфатической системы.
VEGFR3 (рецептор 3 фактора роста эндотелия сосудов) — рецепторная тирозинкиназа, которая располагается на поверхности клетки, распознает VEGFc и VEGFd и участвует в лимфангиогенезе.
Функции лимфатических сосудов мозговых оболочек
Проведенные в последние 20 лет исследования поставили под сомнение исторически сложившийся взгляд на ЦНС как иммунологически привилегированную систему, показав, что иммунологический надзор за ЦНС является важным аспектом ее гомеостаза, а также ответа на повреждения и нейродегенеративные состояния [1–9]. Оболочки мозга — важная часть иммунной системы, которая обеспечивает правильность иммунологического надзора за ЦНС [6, 7, 10–12]. Недавно при поиске путей движения иммунных клеток сквозь оболочки мозга была обнаружена и описана система сосудов, проходящих вдоль перисинуозного пространства [1, 13, 14]. По иммуногистологическим и структурным характеристикам эти сосуды соответствуют лимфатическим и способны переносить жидкость и макромолекулы [1, 13]. Клетки этих сосудов экспрессируют все стандартные маркеры эндотелиальных клеток лимфатических сосудов, в том числе Prox1 (гомеобоксный белок Prospero 1), CD31, Lyve-1 (гиалуроновый рецептор 1 эндотелия лимфатических сосудов), подопланин, VEGFR3 (рецептор 3 фактора роста эндотелия сосудов) и CCL21 (CC-хемокин 21) (см. Глоссарий) [1, 13]. Кроме того, функциональные эксперименты показали, что в физиологических условиях в лимфатических сосудах мозговых оболочек присутствуют многочисленные иммунные клетки, что указывает на их возможную роль в осуществлении иммунологического надзора за мозгом [1].
Помимо участия в иммунном надзоре, лимфатическая система ЦНС, скорее всего, участвует в очистке паренхимы мозга от продуктов метаболизма. За выведение гидрофильных и липофильных веществ, а также продуктов метаболизма из паренхимы мозга в СМЖ, отвечает так называемая «глимфатическая» система, осуществляющая обмен между СМЖ и интерстициальной (межклеточной) жидкостью [15–19]. Предполагается, что далее макромолекулы и другие продукты метаболизма выводятся из СМЖ путем дренажа по лимфатическим сосудам слизистой носа в шейные лимфоузлы [9, 20], предположительно через решетчатую пластинку [21, 22].
Несмотря на наличие массы данных о различных путях оттока и динамике жидкостей в ЦНС, некоторые важные детали анатомических и физиологических путей дренажа лимфы остаются невыясненными. Ниже авторы рассматривают эти противоречия.
Обмен и потоки жидкостей в ЦНС
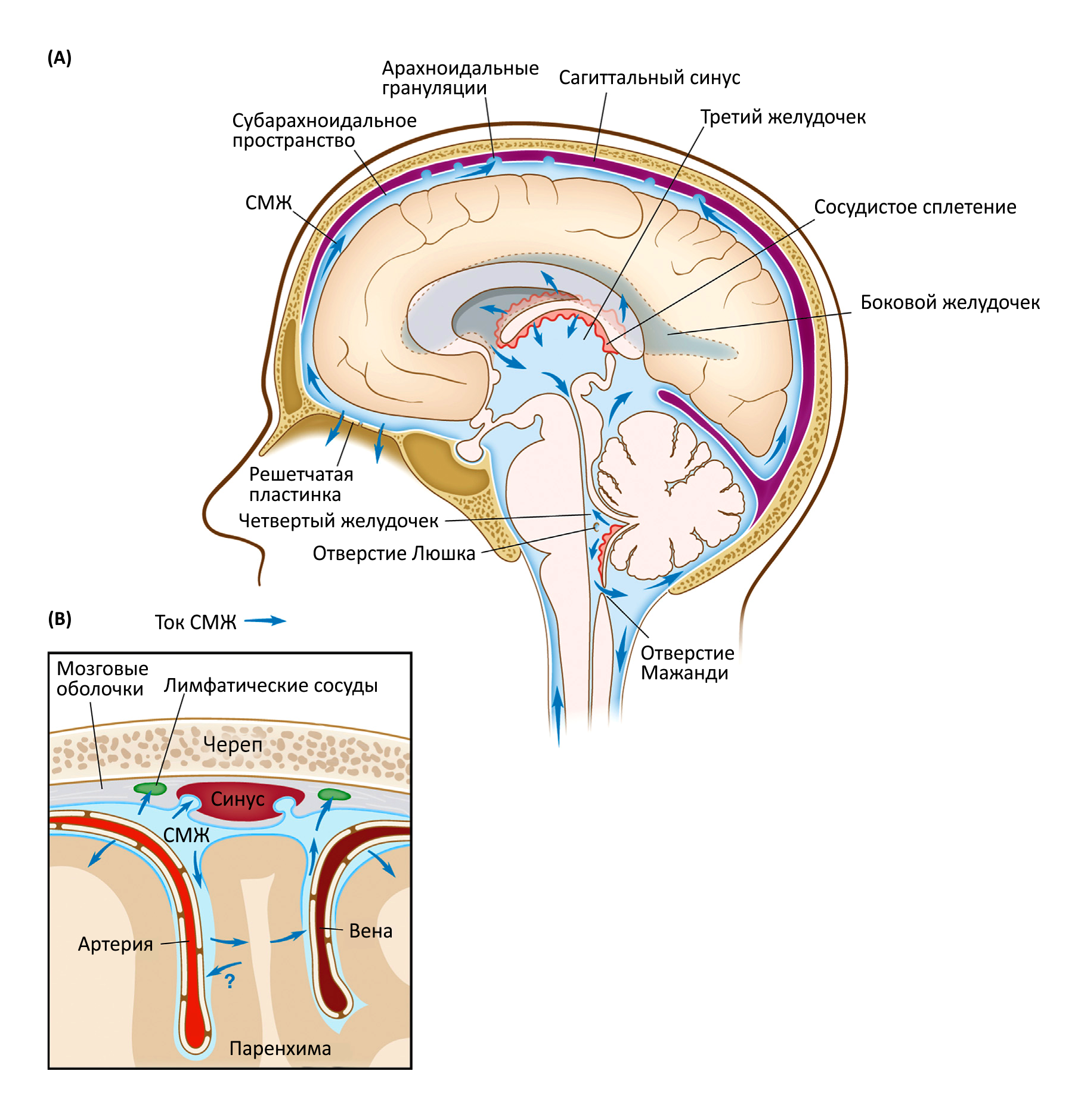
Поток СМЖ представляет собой тонко регулируемый процесс со сложной, на данный момент полностью не изученной, динамикой [23–25]. СМЖ вырабатывается сосудистыми сплетениями, из боковых и третьего желудочка течет в четвертый, откуда через отверстия Люшка и Мажанди поступает в субарахноидальное пространство над бороздами мозга (Рис. 1). Выведение СМЖ из внутричерепной циркуляции осуществляется благодаря ее дренажу в венозные синусы твердой мозговой оболочки через арахноидальные грануляции, которые содержат клапаны, предотвращающие обратный ток крови или СМЖ [26–29] (Рис. 1). Грануляции обнаружены в субарахноидальном пространстве между паутинной и твердой мозговой оболочкой. Предполагалось, что они обеспечивают неравномерный, пульсирующий поток СМЖ в более крупных отделах полости черепа [26–29]. СМЖ также поглощается периневрием черепно-мозговых и спинномозговых нервов и путем дренажа поступает в лимфатические сосуды, расположенные рядом с ними [21, 30]. Следует отметить, что обнаружение новых путей выведения СМЖ ведет к необходимости пересмотреть вклад каждого отдельного маршрута выведения СМЖ в общую динамику [1, 13].
Внутричерепной поток СМЖ связан с циркуляцией ИЖ в паренхиме, а их взаимоотношения регулируются силами объемного потока, артериальным и венозным давлением и внутричерепным давлением паренхимы [15–18]. В последнее время возрождается интерес к описанной в 1980-е годы системе обмена СМЖ-ИЖ, известной сегодня как «глимфатическая» система [15, 16, 31]. Предполагается, что она обеспечивает выведение макромолекул из паренхимы мозга в спинномозговую жидкость. Работа этой системы основана на притоке СМЖ через периартериальные пространства в паренхиму головного мозга и ее оттоке (вместе с гидрофильными и липофильными соединениями) через паравенозные пространства в субарахноидальное пространство [15]. Считается, что эффективность системы обусловлена пульсацией артериол и давлением СМЖ, и зависит (по крайней мере, частично) от количества водных пор, образуемых AQP4 (аквапорином 4) [15, 17, 18, 32]. Считается, что эффективность работы этой системы повышается во время сна [18]. Вопрос о том, оттекает ли ИЖ от паренхимы мозга (к СМЖ) по периартериальным или паравенозным пространствам, остается предметом дискуссий [33, 34] и требует более глубокого изучения. Лимфатическая система мозговых оболочек выступает в роли нового игрока в системе циркуляции СМЖ, поэтому требуется описание ее взаимоотношений с другими путями оттока жидкости.
Макромолекулы (например, бета-амилоид (Aβ)), предположительно выводятся из паренхимы ЦНС с участием различных механизмов, таких как фагоцитоз с последующим протеолитическим расщеплением мононуклеарными фагоцитами [35–37] и гладкомышечными клетками сосудов [38], трансцитоз через гематоэнцефалический барьер (ГЭБ) [39–41] и выведение с током ИЖ [18, 42, 43]. Предыдущие исследования показали, что у мышей в нормальных физиологических условиях около 85% Aβ выводится из мозга путем трансваскулярного клиренса (То есть, через ГЭБ. — прим. ред.), хотя меньшее количество этого белка выводится другими путями, в частности, с током ИЖ [44, 45]. Последний путь выведения имеет особое значение, поскольку и у мыши и у человека было показано накопление Aβ по ходу течения ИЖ [46,47], что указывает на возможную дисфункцию этих путей при болезни Альцгеймера. С учетом того, что у мышей с недостаточным количеством лимфатических сосудов мозговых оболочек наблюдается нарушение способности выведения макромолекул из паренхимы мозга [13], требуются дополнительные исследования для выяснения анатомических и функциональных взаимоотношений между потоком ИЖ и лимфатической системой мозговых оболочек.
Показано, что трансваскулярный клиренс Aβ происходит внутри паренхимы мозга [37, 44, 45, 48]. Выведение белка опосредовано рецептор-зависимым трансцитозом, в основном, с участием транспортера LRP1 (белка 1, родственного белкам семейства рецепторов липопротеинов низкой плотности) [39, 44, 45, 48]. Показано, что в трансваскулярном клиренсе Aβ участвует семейство молекул ApoE [49, 50]. Действительно, Aβ в комплексе с apoE2 или apoE3 быстро выводится через LRP1, в то время как Aβ, связанный с apoE4, генетическим маркером предрасположенности к болезни Альцгеймера, выводится медленно и исключительно путем трансцитоза и интернализации, опосредованной рецепторами липопротеинов очень низкой плотности (рЛПОНП) [49, 50]. Похожим образом, выведение может осуществляться через эндотелиальные клетки лимфатических сосудов, экспрессирующие скавенджер-рецептор SRB1 [51], который, как известно, способен связывать фибриллярный Aβ [52]. Следующим шагом для понимания механизма этих сложных взаимодействий будет выяснение механизма выведения макромолекул из паренхимы ЦНС эндотелиальными клетками лимфатических сосудов.
Поскольку у мышей с недостаточным количеством лимфатических сосудов в мозговых оболочках не было выявлено каких-либо отклонений в уровне внутричерепного давления, можно предположить, что лимфатическая система мозговых оболочек не вовлечена в дренаж водной составляющей СМЖ [13]. Таким образом несколько путей дренажа СМЖ могут иметь различные функции: решетчатая пластинка и арахноидальные грануляции могут выступать в роли клапана для поддержания давления СМЖ, в то время как лимфатические сосуды мозговых оболочек осуществляют скорее иммунологическую функцию, т. е. дренаж макромолекул и иммунных клеток в шейные лимфоузлы для поддержания иммунологического надзора за мозгом. Для подтверждения селективности и функциональной значимости каждого из этих путей в поддержании функции мозга необходимо больше исследований взаимодействия между различными путями дренажа СМЖ.
Лимфатические сосуды мозговых оболочек: анатомические особенности
Где проходят лимфатические сосуды в ЦНС? Известно, что лимфатические сосуды располагаются в области синусов [1], а Aspelund с соавт. также сообщили, что обнаружили лимфатические сосуды в области основания черепа и вдоль средних менингеальных артерий [13]. У человека средние менингеальные артерии проходят по внешней поверхности твердой мозговой оболочки и, следовательно, не являются частью ЦНС. Мозговые оболочки мыши очень тонкие, поэтому разделить их на слои и определить точное местонахождение лимфатических сосудов не представляется возможным. Возможны три варианта: лимфатические сосуды располагаются в пределах листков твердой мозговой оболочки, либо проходят по внутренней поверхности твердой мозговой оболочки, либо лежат в субарахноидальном пространстве вместе с корковыми венами мозга (Рис. 2).
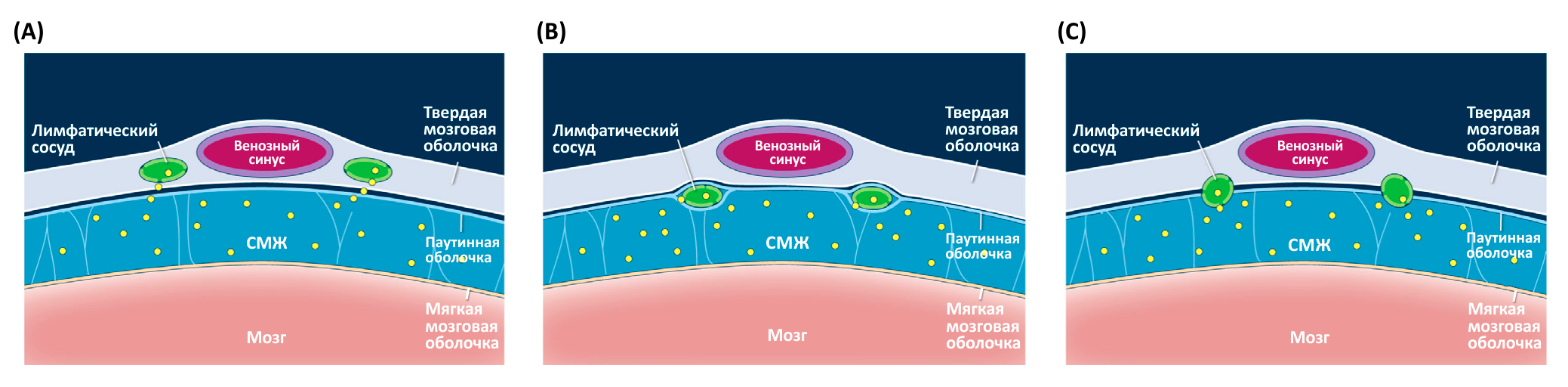
Точное определение расположения лимфатических сосудов мозговых оболочек необходимо для того, чтобы понять, как именно эти сосуды выводят вещества и клетки из СМЖ [1, 13]. Если лимфатические сосуды мозговых оболочек располагаются в субарахноидальном пространстве, то они буквально «купаются» в СМЖ, которая, следовательно, может легко диффундировать в их просвет. Однако в случае если лимфатические сосуды мозговых оболочек располагаются в пределах листков твердой мозговой оболочки или на внутренней поверхности твердой мозговой оболочки, то они физически отделены от субарахноидального пространства. Отсюда возникает вопрос: каким образом изотопные маркеры, вводимые в СМЖ, боковой желудочек или паренхиму мозга, поступают в лимфатические сосуды мозговых оболочек? В некоторых исследованиях предполагается, что СМЖ транспортируется к твердой мозговой оболочке через паутинную оболочку [53–55]. Это могло бы объяснить накопление изотопных маркеров из СМЖ в лимфатических сосудах, расположенных в твердой мозговой оболочке. Кроме того, экспрессия белков-транспортеров клетками паутинной оболочки [56] также может обеспечить перенос меченых веществ из СМЖ в твердую мозговую оболочку. Также имеется еще одна возможность: наличие сходных с арахноидальными грануляциями структур, которые способны осуществлять дренаж СМЖ в лимфатические сосуды твердой мозговой оболочки через паутинную оболочку и внутренний слой твердой мозговой оболочки. Чтобы лучше понять циркуляцию жидкости по лимфатическим сосудам мозговых оболочек, необходимо провести дополнительные анатомические исследования.
Лимфатические сосуды мозговых оболочек: микросреда
В периферических тканях макромолекулы способны диффундировать из ИЖ в лимфатические сосуды через зазоры между эндотелиальными клетками [57]. Особенности периферических лимфатических сосудов: отсутствие перицитов и прерывистая базальная мембрана, — позволяют клеткам и молекулам проникать внутрь. Существуют различные типы лимфатических сосудов, в том числе лимфатические капилляры и собирающие сосуды — последние содержат двустворчатые клапаны для предотвращения обратного тока лимфы [58–60]. Продвижение лимфы по лимфатическим сосудам (антероградно) обеспечивается сокращением гладкомышечных клеток, окружающих собирательные сосуды, а также пульсацией артерий [57]. Лимфатические сосуды мозговых оболочек по строению напоминают периферические лимфатические сосуды (отсутствие клапанов и окружающих гладкомышечных клеток) [1], за исключением сосудов основания черепа, в которых обнаружены клапаноподобные структуры [13], позволяющие говорить о том, что они занимают промежуточное положение между капиллярами и собирательными сосудами.
В отличие от сосудов периферических тканей, лимфатические сосуды мозговых оболочек, скорее всего, подвержены влиянию среды с иными физическими свойствами, определяющими развитие и функционирование сосудов. Лимфатические сосуды мозговых оболочек слабее покрыты тканью и имеют меньший диаметр по сравнению с периферическими лимфатическими сосудами [1]. Это позволяет предположить, что физическое воздействие окружающей среды или другие факторы способны ингибировать краевой рост и расширение лимфатических сосудов мозговых оболочек. Более того, однократное введение рекомбинантного VEGFc (фактора роста эндотелия сосудов С) в периферических тканях способно стимулировать краевой рост и пролиферацию лимфатических сосудов [61, 62], в то время как в мозговых оболочках в ответ на это наблюдается лишь небольшое увеличение диаметра сосудов [1]. Это наблюдение подтверждает гипотезу о том, что среда мозговых оболочек может ограничивать расширение сосудов, вызываемое динамикой потока СМЖ. Может возникнуть вопрос: ограничивает ли малый диаметр лимфатических сосудов мозговых оболочек количество или спектр антигенов, проникающих в шейные лимфоузлы и участвующих в иммунологической привилегированности мозга? Для оценки роли лимфатических сосудов мозговых оболочек в выведении макромолекул и клеток из ЦНС, а также для лучшего понимания их роли в иммунологической привилегированности мозга, необходимо проведение исследований развития и пластичности лимфатических сосудов мозговых оболочек.
Заключение
Постепенное общее признание физиологической роли иммунитета мозговых оболочек в надзоре за ЦНС привело к нескольким важным открытиям, которые помогли охарактеризовать специфическую иммунную систему ЦНС. Одним из них является открытие лимфатических сосудов мозговых оболочек, способных выводить жидкость, иммунные клетки и макромолекулы из ЦНС и СМЖ. Хотя открытие этих сосудов помогает объяснить возможную связь ЦНС и периферической иммунной системы, тем не менее, оно вызывает ряд вопросов, которые еще предстоит прояснить (см. Нерешенные вопросы). Лимфатические сосуды мозговых оболочек могут оказаться ключевым компонентом механизма иммунного ответа на повреждение ЦНС при черепно-мозговой травме или инсульте. Дисфункция же лимфатических сосудов мозговых оболочек может иметь множество различных проявлений, вплоть до развития неврологических и нейродегенеративных заболеваний.
Как лимфатические сосуды мозговых оболочек абсорбируют макромолекулы и иммунные клетки из СМЖ, если они располагаются в пределах твердой мозговой оболочки?
Какие силы регулируют абсорбцию и как они соотносятся с физиологическими изменениями гемодинамических сил СМЖ?
Где именно проходят лимфатические сосуды мозговых оболочек?
Существуют ли в пределах полости черепа структуры, эквивалентные периферическим предсобирательным и собирательным лимфатическим сосудам?
1. Louveau, A. et al. (2015) Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337 – 341
2. Cserr, H.F. et al. (1992) Drainage of brain extracellular fl uid into blood and deep cervical lymph and its immunological signi fi cance. Brain Pathol. 2, 269 – 276
3. Steinman, L. (2004) Elaborate interactions between the immune and nervous systems. Nat. Immunol. 5, 575 – 581
4. Walsh, J.T. et al. (2014) Regulatory T cells in central nervous system injury: a double-edged sword. J. Immunol. 1950 193, 5013 – 5502
5. Schwartz, M. and Raposo, C. (2014) Protective autoimmunity: a unifying model for the immune network involved in CNS repair. Neuroscientist 20, 343 – 358
6. Kipnis, J. et al. (2012) Pro-cognitive properties of T cells. Nat. Rev. Immunol. 12, 663 – 669
7. Ransohoff, R.M. and Engelhardt, B. (2012) The anatomical and cellular basis of immune surveillance in the central nervous system. Nat. Rev. Immunol. 12, 623 – 635
8. Derecki, N.C. et al. (2010) Regulation of learning and memory by meningeal immunity: a key role for IL-4. J. Exp. Med. 207, 1067 – 1080
9. Louveau, A. et al. (2015) Revisiting the mechanisms of CNS immune privilege. Trends Immunol. 36, 569 – 577
10. Russi, A.E. and Brown, M.A. (2015) The meninges: new therapeutic targets for multiple sclerosis. Transl. Res. 165, 255 – 269
11. Weller, R.O. (2005) Microscopic morphology and histology of the human meninges. Morphologie 89, 22 – 34
12. Decimo, I. et al. (2012) Meninges: from protective membrane to stem cell niche. Am. J. Stem Cells 1, 92 – 105
13. Aspelund, A. et al. (2015) A dural lymphatic vascular system that drains brain interstitial fl uid and macromolecules. J. Exp. Med. 212, 991 – 999
14. Andres, K.H. et al. (1987) Nerve fi bres and their terminals of the dura mater encephali of the rat. Anat. Embryol. (Berl.) 175, 289 – 301
15. Iliff, J.J. et al. (2012) A paravascular pathway facilitates CSF fl ow through the brain parenchyma and the clearance of interstitial solutes, including amyloid b . Sci. Transl. Med. 4, 147ra111
16. Yang, L. et al. (2013) Evaluating glymphatic pathway function utilizing clinically relevant intrathecal infusion of CSF tracer. J. Transl. Med. 11, 107
17. Thrane, V.R. et al. (2013) Paravascular microcirculation facilitates rapid lipid transport and astrocyte signaling in the brain. Sci. Rep. 3, 2582
18. Xie, L. et al. (2013) Sleep drives metabolite clearance from the adult brain. Science 342, 373 – 377
19. Kress, B.T. et al. (2014) Impairment of paravascular clearance pathways in the aging brain. Ann. Neurol. 76, 845 – 861
20. Harling-Berg, C. et al. (1989) Role of cervical lymph nodes in the systemic humoral immune response to human serum albumin microinfused into rat cerebrospinal fl uid. J. Neuroimmunol. 25, 185 – 193 TINS 1247 No. of Pages 6
21. Kida, S. et al. (1993) CSF drains directly from the subarachnoid space into nasal lymphatics in the rat. Anatomy, histology and immunological signi fi cance. Neuropathol. Appl. Neurobiol. 19, 480 – 488
22. Harris, M.G. et al. (2014) Immune privilege of the CNS is not the consequence of limited antigen sampling. Sci. Rep. 4, 4422
23. Spector, R. et al. (2015) A balanced view of the cerebrospinal fl uid composition and functions: focus on adult humans. Exp. Neurol. 273, 57 – 68
24. Hladky, S.B. and Barrand, M.A. (2014) Mechanisms of fl uid move- ment into, through and out of the brain: evaluation of the evidence. Fluids Barriers CNS 11, 26
25. Brinker, T. et al. (2014) A new look at cerebrospinal fl uid circula- tion. Fluids Barriers CNS 11, 10
26. Kido, D.K. et al. (1976) Human spinal arachnoid villi and granu- lations. Neuroradiology 11, 221 – 228
27. Go, K.G. et al. (1986) Fluid secretion in arachnoid cysts as a clue to cerebrospinal fl uid absorption at the arachnoid granulation. J. Neurosurg. 65, 642 – 648
28. Upton, M.L. and Weller, R.O. (1985) The morphology of cerebro- spinal fl uid drainage pathways in human arachnoid granulations. J. Neurosurg. 63, 867 – 875
29. Tripathi, B.J. and Tripathi, R.C. (1974) Vacuolar transcellular chan- nels as a drainage pathway for cerebrospinal fl uid. J. Physiol. 239, 195 – 206
30. Johnston, M. et al. (2004) Evidence of connections between cerebrospinal fl uid and nasal lymphatic vessels in humans, non- human primates and other mammalian species. Cerebrospinal Fluid Res. 1, 2
31. Bradbury, M.W. et al. (1981) Drainage of cerebral interstitial fl uid into deep cervical lymph of the rabbit. Am. J. Physiol. 240, F329 – F336
32. Iliff, J.J. et al. (2013) Cerebral arterial pulsation drives paravascular CSF – interstitial fl uid exchange in the murine brain. J. Neurosci.
33, 18190 – 18199 33. Schley, D. et al. (2006) Mechanisms to explain the reverse peri- vascular transport of solutes out of the brain. J. Theor. Biol. 238, 962 – 974
34. Carare, R.O. et al. (2008) Solutes, but not cells, drain from the brain parenchyma along basement membranes of capillaries and arter- ies: signi fi cance for cerebral amyloid angiopathy and neuroimmu- nology. Neuropathol. Appl. Neurobiol. 34, 131 – 144
35. Hawkes, C.A. and McLaurin, J. (2009) Selective targeting of peri- vascular macrophages for clearance of beta-amyloid in cerebral amyloid angiopathy. Proc. Natl. Acad. Sci. U.S.A. 106, 1261 – 1266
36. Simard, A.R. et al. (2006) Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer's disease. Neuron 49, 489 – 502
37. Bakker, E.N.T.P. et al. (2016) Lymphatic clearance of the brain: perivascular, paravascular and signi fi cance for neurodegenerative diseases. Cell. Mol. Neurobiol. 36, 181 – 194
38. Bell, R.D. et al. (2009) SRF and myocardin regulate LRP-mediated amyloid-beta clearance in brain vascular cells. Nat. Cell Biol. 11, 143 – 153
39. Zlokovic, B.V. et al. (2010) Low-density lipoprotein receptor- related protein-1: a serial clearance homeostatic mechanism con- trolling Alzheimer's amyloid b -peptide elimination from the brain. J. Neurochem. 115, 1077 – 1089
40. Zhao, Z. et al. (2015) Central role for PICALM in amyloid- b blood- brain barrier transcytosis and clearance. Nat. Neurosci. 18, 978 – 987
41. Deane, R. et al. (2009) Clearance of amyloid-beta peptide across the blood-brain barrier: implication for therapies in Alzheimer's disease. CNS Neurol. Disord. Drug Targets 8, 16 – 30
42. Tarasoff-Conway, J.M. et al. (2015) Clearance systems in the brain-implications for Alzheimer disease. Nat. Rev. Neurol. 11, 457 – 470
43. Mawuenyega, K.G. et al. (2010) Decreased clearance of CNS beta-amyloid in Alzheimer's disease. Science 330, 1774
44. Shibata, M. et al. (2000) Clearance of Alzheimer's amyloid-ss(1-40) peptide from brain by LDL receptor-related protein-1 at the blood- brain barrier. J. Clin. Invest. 106, 1489 – 1499
45. Deane, R. et al. (2004) LRP/amyloid beta-peptide interaction mediates differential brain ef fl ux of Abeta isoforms. Neuron 43, 333 – 344
46. Morris, A.W.J. et al. (2016) Vascular basement membranes as pathways for the passage of fl uid into and out of the brain. Acta Neuropathol. (Berl.) 131, 725 – 736
47. Preston, S.D. et al. (2003) Capillary and arterial cerebral amyloid angiopathy in Alzheimer's disease: de fi ning the perivascular route for the elimination of amyloid beta from the human brain. Neuro- pathol. Appl. Neurobiol. 29, 106 – 117
48. Storck, S.E. et al. (2016) Endothelial LRP1 transports amyloid- b (1- 42) across the blood-brain barrier. J. Clin. Invest. 126, 123 – 136
49. Bell, R.D. et al. (2007) Transport pathways for clearance of human Alzheimer's amyloid beta-peptide and apolipoproteins E and J in the mouse central nervous system. J. Cereb. Blood Flow Metab. 27, 909 – 918
50. Deane, R. et al. (2008) apoE isoform-speci fi c disruption of amyloid beta peptide clearance from mouse brain. J. Clin. Invest. 118, 4002 – 4013
51. Lim, H.Y. et al. (2013) Lymphatic vessels are essential for the removal of cholesterol from peripheral tissues by SR-BI-mediated transport of HDL. Cell Metab. 17, 671 – 684
52. Kunjathoor, V.V. et al. (2004) beta-Amyloid promotes accumula- tion of lipid peroxides by inhibiting CD36-mediated clearance of oxidized lipoproteins. J. Neuroin fl ammation 1, 23
53. Johnston, M. et al. (2007) Possible role of the cavernous sinus veins in cerebrospinal fl uid absorption. Cerebrospinal Fluid Res. 4, 3
54. Zenker, W. et al. (1994) Morphological indications for considerable diffuse reabsorption of cerebrospinal fl uid in spinal meninges particularly in the areas of meningeal funnels. An electronmicro- scopical study including tracing experiments in rats. Anat. Embryol. (Berl.) 189, 243 – 258
55. Squier, W. et al. (2009) Demonstration of fl uid channels in human dura and their relationship to age and intradural bleeding. Childs Nerv. Syst. 25, 925 – 931
56. Yasuda, K. et al. (2013) Drug transporters on arachnoid barrier cells contribute to the blood-cerebrospinal fl uid barrier. Drug Metab. Dispos. 41, 923 – 931
57. Alitalo, K. (2011) The lymphatic vasculature in disease. Nat. Med. 17, 1371 – 1380
58. Dejana, E. et al. (2009) The control of vascular integrity by endo- thelial cell junctions: molecular basis and pathological implications. Dev. Cell 16, 209 – 221
59. Kerjaschki, D. (2014) The lymphatic vasculature revisited. J. Clin. Invest. 124, 874 – 877
60. Sweet, D.T. et al. (2015) Lymph fl ow regulates collecting lymphatic vessel maturation in vivo. J. Clin. Invest. 125, 2995 – 3007
61. Alessio, S. and D ’ et, al. (2014) VEGF-C-dependent stimulation of lymphatic function ameliorates experimental in fl ammatory bowel disease. J. Clin. Invest. 124, 3863 – 3878
62. Aspelund, A. et al. (2014) The Schlemm's canal is a VEGF-C/ VEGFR-3-responsive lymphatic-like vessel. J. Clin. Invest. 124, 3975 – 3986
