Молекулярные основы работы мышечной ткани

1. Строение и метаболизм мышечной ткани
Движение.
Как много и как мало в данном слове. Для человека такое естественное свойство его опорно-двигательного аппарата открывает тысячи возможностей, и каждый наш день наполнен движением. И человек вовсе не заключен в своем теле, как в душной камере, напротив, люди вольны использовать ресурсы, данные им природой, во всю мощь. Мышцы — удивительная ткань, возможности которой в условиях меняющихся нагрузок поражают воображение, а функциональные возможности скелетно-мышечной системы восхищают изящностью исполнения. А потому интересно было бы взглянуть на то, как же обеспечивается мышечная работа в целом.
В мышечной ткани происходит преобразование химической энергии в механическую работу. В качестве источника энергии химических связей используется АТФ, получаемая мышечными клетками в результате метаболических процессов.
Миоциты разных типов мышечной ткани обладают различным набором ферментов, а также отличаются по количеству митохондрий и миоглобина — белка, осуществляющего перенос кислорода. Мышечные волокна, выполняющие взрывную работу за короткое время, покрывают необходимые энергетические затраты посредством анаэробного гликолиза, ферменты для осуществления которого присутствуют в клетках в норме в надлежащем количестве. За счет сравнительно низкого содержания миоглобина в клетках таких мышечных волокон под микроскопом они выглядят светлыми и потому называются белыми волокнами. Им в противоположность существуют красные мышечные волокна, которые обеспечивают совершение продолжительной работы мышцами и характеризуются более высоким содержанием миоглобина. Клетки красных мышечных волокон, которые, кроме прочего, составляют и сердечную мускулатуру, нуждаются в кислороде и потому имеют много митохондрий, а также богаты ферментами цикла Кребса и дыхательной цепи.
Глюконеогенез в мышечной ткани не протекает из-за отсутствия в ней нужных для его свершения ферментов. Продукты обмена веществ в мышечной ткани (лактат, возникающий при анаэробном гликолизе из пирувата, и аланин, являющийся продуктом трансаминирования из пирувата и аминокислот), пройдя циклы Кори и аланина, транспортируются по кровеносному руслу в печень для глюконеогенеза: в результате реакции повторного трансаминирования в печени возрастает количество необходимого пирувата. Гликоген печени при необходимости может стать источником глюкозы для мышечной ткани, что замыкает данный цикл. Синтез и разрушение гликогена в мышцах подчиняется гормональному контролю: инсулин способствует захвату глюкозы клетками и синтезу гликогена, тогда как катехоламины путем повышения уровня цАМФ стимулируют активность гликогенфосфорилазы. Катаболическое воздействие глюкокортикоидов ведет к разрушению мышечных белков и мобилизации аминокислот, которые в печени задействуются в глюконеогенезе.
Гидролитическое отщепление фосфатных групп от молекул АТФ дает мышечным клеткам необходимую для сокращения энергию. Еще одним макроэргическим фосфатом, используемым в мышцах, является креатинфосфат, отщепленная от которого креатинкиназой фосфатная группа переносится на АДФ. Неферментативно образующимся побочным продуктом превращения креатинфосфата является креатинин, который регулярно обнаруживается в крови и выводится через почки (суточное выводимое с мочой количество креатинина пропорционально мышечной массе). Таким образом, креатинфосфат представляет собой своего рода энергетический резерв, обеспечивая скорое восстановление количества молекул АТФ. У такой системы восстановления АТФ есть важное преимущество перед накоплением АТФ, заключающееся в том, что после превращения АТФ в АДФ вследствие разрыва фосфодиэфирной связи не создаеактся невыгодного соотношения АТФ/АДФ, что могло бы негативно сказываться на функции АТФ из-за концентрационной зависимости от энергии Гиббса. Есть и еще одна система, служащая восстановлению АТФ в мышечной ткани, ключевым ее ферментом является аденилаткиназа (миокиназа), способная образовывать АТФ за счёт АДФ, а также фосфорилировать АМФ до АДФ.
Строение мышечных волокон
Клетки поперечно-полосатой мускулатуры отличаются от клеток гладкой мышечной ткани и ткани сердечной мышцы. Они образуют единый многоядерный синцитий. Клеточные ядра при этом смещены к краю клеток, а основное внутриклеточное пространство занято миофибриллами. Миофибриллы окружены саркоплазматическим ретикулумом, что достигается посредством формирования продольных и поперечных трубочек, а также лабиринтообразных впячиваний плазматической мембраны, благодаря чему возбуждение достигает этих участков. Плазматическая мембрана миоцитов — сарколемма — укреплена с внутренней стороны белками цитоскелета. В связывании с интегральными мембранными белками задействован белок дистрофин, мутации в гене которого приводят к развитию миодистрофии.
Скелетные мышцы структурно строго организованы в мышечные пучки, волокна, фибриллы и филаменты. Фибриллы поперечно-полосатых мышц состоят, прежде всего, из толстых миозиновых филаментов и тонких филаментов. Первый тип состоит из миозина и молекулярных моторных единиц. Второй тип филаментов включает F-актин и актин-связывающие белки — тропомиозин и тропонин. Головки тяжелых цепей миозина выдаются кнаружи и способны формировать связи с тонкими актиновыми филаментами. Актиновые филаменты, в свою очередь, закреплены на структурных белках, образующих так называемые Z-диски. Типичная поперечная исчерченность данного типа мышечной ткани, узнаваемая гистологически, создается благодаря устройству и расположению саркомера — функциональной единицы мышцы — который представляет собой участок миофибриллы между двумя Z-мембранами. Актиновые филаменты связываются как между собой, так и с Z-белками. Два других белка — титин и небулин — принимают участие в структурировании миофибрилл в процессе сокращения и расслабления. Титин прикрепляется к белкам Z-структуры и к М-линиям, сформированным миозином и структурными белками. Небулин закреплен в Z-структурах и исполняет регуляторную роль в построении тонких филаментов.
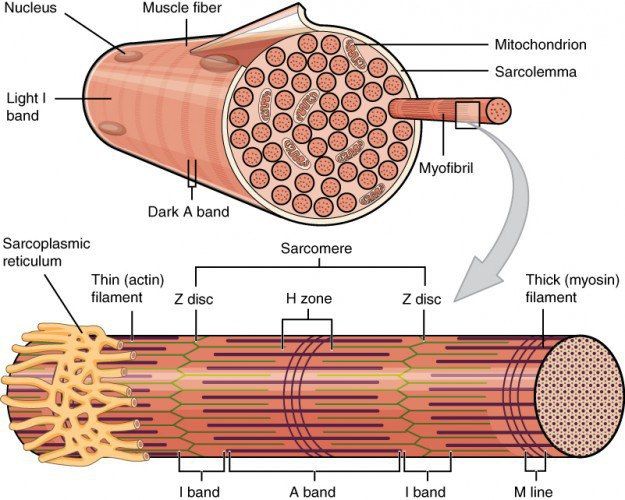
Рисунок 1. Строение миофибрилл.
Несмотря на строгую организацию, скелетная мускулатура являет собой крайне гетерогенную систему относительно устройства и выполняемых функций. С одной стороны, это позволяет подстроиться мышцам под возлагаемую на них нагрузку путем разборки/увеличения количества саркомеров или миофибрилл, с другой стороны — обмен различными изоформами белков разных свойств и качеств обуславливает функциональную реорганизацию.
Мышечное сокращение
Сокращение мышц находится в зависимости от концентрации ионов кальция. Передача возбуждения на нейромышечные окончания поперечно-полосатых волокон ведет к деполяризации наружной мембраны и открытию кальциевых каналов в мембране саркоплазматического ретикулума, простирающегося через все саркомеры. Концентрация ионов кальция в цитозоле резко возрастает, и они связываются с тропонином С. Это приводит к конформационным изменениям субъединиц тропонинового комплекса, что имеет следствием смещение позиции тропомиозина. Это событие делает возможным связывание участков цепей миозина с актином. Головки миозина расщепляют АТФ до АДФ и остатка фосфорной кислоты, а высвобождающаяся при этом энергия обеспечивает смену ее конформации. Свершившееся связывание ионов кальция с тропонином С является необходимым для взаимодействия миозина с актиновыми волокнами, которое влияет на изменение угла между легкой и тяжелой цепями миозина. Такой сдвиг оканчивается перемещением актинового филамента к центру саркомера. Скольжение тонких филаментов относительно толстых приводит к укорочению саркомеров и сокращению мышцы. После этого происходит экзергоническая смена конформации головки миозина, а продукты гидролиза АТФ выносятся из клетки. Для повторения цикла необходимо очередное внесение АТФ в систему. Если мотонейроны перестают получать раздражение извне, то в работу вступает АТФ-зависимый кальциевый насос, перекачивающий более не востребованные ионы кальция из цитоплазмы в цистерны саркоплазматического ретикулума, где они связываются с кальсеквестрином, обладающим высокой связывающей способностью. В связи с этим концентрация свободных ионов кальция снижается, что энергетически облегчает последующее поглощение этих ионов.
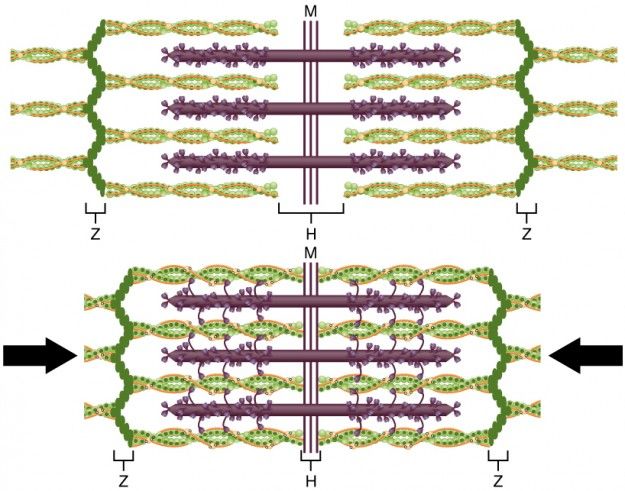
Молекулярные компоненты системы, осуществляющей высвобождение кальция из саркоплазматического ретикулума, известны лишь частично. Начало сигнальной цепочки опосредуют дигидропиридиновые рецепторы плазматической мембраны, которые сменяют свою конформацию под влиянием деполяризации мембраны. Это приводит к открытию кальциевых каналов и активации рианодиновых рецепторов терминальных цистерн саркоплазматического ретикулума. Преходящее повышение концентрации ионов кальция в цитоплазме мышечных клеток ведет и к метаболическим изменениям. Например, дефосфорилированная форма киназы гликогенфосфорилазы может активироваться комплексом кальмодулина с ионами кальция, а потому мышечное возбуждение связано с кратковременным разрушением гликогена.
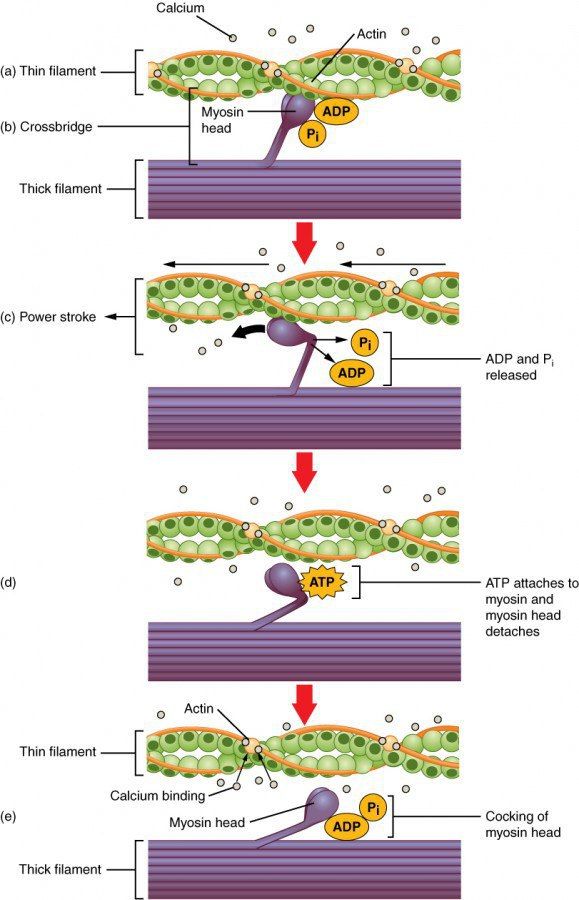
Рисунок 3. Схема мышечного сокращения.
2. Пластичность мышц и тренировочные нагрузки: молекулярные основы
Клетки сформировавшейся скелетной мускулатуры представляют собой конечную форму дифференцировки и в целом могут быть поделены на два типа:
- Клетки, формирующие многоядерный синцитий, или миосимпласты, представляющие собой вытянутые мышечные тубы, заполненные миофибриллами со смещенными на периферию ядрами. Слившиеся в синцитий клетки более не делятся. В качестве структурной единицы каждой из миофибрилл, заполняющих симпласт, выделяют саркомер;
- Клетки, остающиеся самостоятельными и располагающиеся на поверхности симпластов — их называют миосателлитами. Этот пул клеток является регенеративным источником мышечной ткани, а также обеспечивает увеличение мышечной массы в ответ на силовые нагрузки.
Нагрузки, оказываемые на мышцы, могут быть различными по характеру, и ответное мышечное сокращение будет соответствовать типу нагрузки. Выдающаяся способность мышц откликаться на тренировки изменением экспрессии сократительных белков и метаболических ферментов приводит к тому, что происходит увеличение плотности и количества мышечных волокон того типа, который необходим для наиболее эффективного выполнения возлагаемой нагрузки. Например, может происходить смена быстро сокращающихся и быстро утомляемых волокон типа II на медленно сокращающиеся, устойчивые к утомлению волокна I типа. То, какая работа совершалась мышцами, будет непосредственно влиять также на способ их восстановления и вызываемую гипертрофию клеток. Так, к примеру, высокоинтенсивные тренировки с большими свободными весами ведут к гипертрофии волокон типа II, тогда как продолжительные тренировки с меньшей нагрузкой — к увеличению мышечных волокон типа I.
Итак, одной из исключительнейших характеристик скелетной мускулатуры является мышечная пластичность. В зависимости от физиологических потребностей свойства мышечных волокон могут изменяться. Наряду с физиологически обусловленными изменениями типов волокон вследствие активности мышц их преобразования происходят и при отсутствии активности (например, по причине малоподвижного образа жизни), а также при разрушении мышечных белков в пожилом возрасте и в случае развивающихся миопатий (например, мышечная дистрофия Дюшенна). Два основных типа мышечных волокон, быстрые (тип II) и медленные (тип I), отличаются друг от друга составляющими их сократительными белками, ферментами энергетического обмена и белками, отвечающими за секвестирование ионов кальция, а значит, и уровнем внутриклеточного содержания Са2+. Изоформы тяжелых цепей миозина (MyHC, myosin heavy chain), различные по своей АТФ-азной активности, представляют собой главный параметр для определения типа мышечных волокон. Как было сказано чуть выше, разные внешние стимулы могут инициировать превращение одного типа волокон в другой. Таким стимулом может быть различная по объему и интенсивности нагрузка.
Во время силовой нагрузки на мышечные клетки оказывают воздействие многочисленные стимулы (например, пассивные механические силы, ток ионов через плазматическую мембрану, пониженное парциальное давление кислорода, факторы роста и т. д.), которые инициируют пути передачи сигналов внутри клеток, опосредующие транскрипцию соответствующих генов, а также регулируют процесс трансляции. Преобразование мышечными клетками оказываемых стимулов в активность специфических генов может быть изучено на моделях клеточных культур (например, линия миобластов С2С12, культуры клеток миосателлитов).
Изменения путей передачи внутриклеточных сигналов и генной экспрессии, сопровождающие преобразования типов волокон мышечной ткани, идентифицированы пока только частично. Важным исходным сигналом является рост внутриклеточной концентрации ионов кальция и Са2+/кальмодулин-зависимой фосфатазы кальцинейрина. Кальцинейрин дефосфорилирует семейство факторов транскрипции — NFAT (nuclear factor of activated T-cells). Изоформы NFAT находятся в цитоплазме в фосфорилированном (т. е. неактивном) состоянии. В дефосфорилированной форме они перемещаются в клеточное ядро, где активируют гены-мишени. Различные киназы путем фосфорилирования/рефосфорилирования способны влиять на локализацию NFAT внутри клетки, а потому можно заключить, что расположение этих факторов транскрипции зависит от баланса в действии фосфатаз и киназ. В экспериментах по трансформации быстрых волокон в медленные с помощью ионофора кальция или путем электростимуляции сигнальный путь кальцинейрин/NFAT обнаружил свое незаменимое участие в регуляции экспрессии гена MyHCI/β — тяжелой цепи миозина, характерной для медленных мышечных волокон типа I. При этом при ионофор-индуцированной экспрессии был определен решающий момент, роль которого отведена связыванию с промотором гена MyHCI/β одного из представителей NFAT и рекрутингу коактиватора р300. Кроме того, с помощью комбинирования различного по продолжительности раздражения в культурах клеток удавалось поддерживать стабилизацию мышечных волокон того или иного типа. Например, при более коротком времени стимуляции и более продолжительной фазе покоя транспорт NFAT в ядро не осуществляется и стабилизируются уже волокна второго типа, а не первого. Но для основательного понимания специфической для каждого типа мышечных волокон генной регуляции этих результатов не достаточно. Для этого требуется изучение возможных пересечений путей сигнальной трансдукции с уделением особенного внимания взаимодействию факторов транскрипции с коактиваторами и репрессорами, а также возможным посттрансляционным модификациям (например, сумоилирование, ацетилирование).
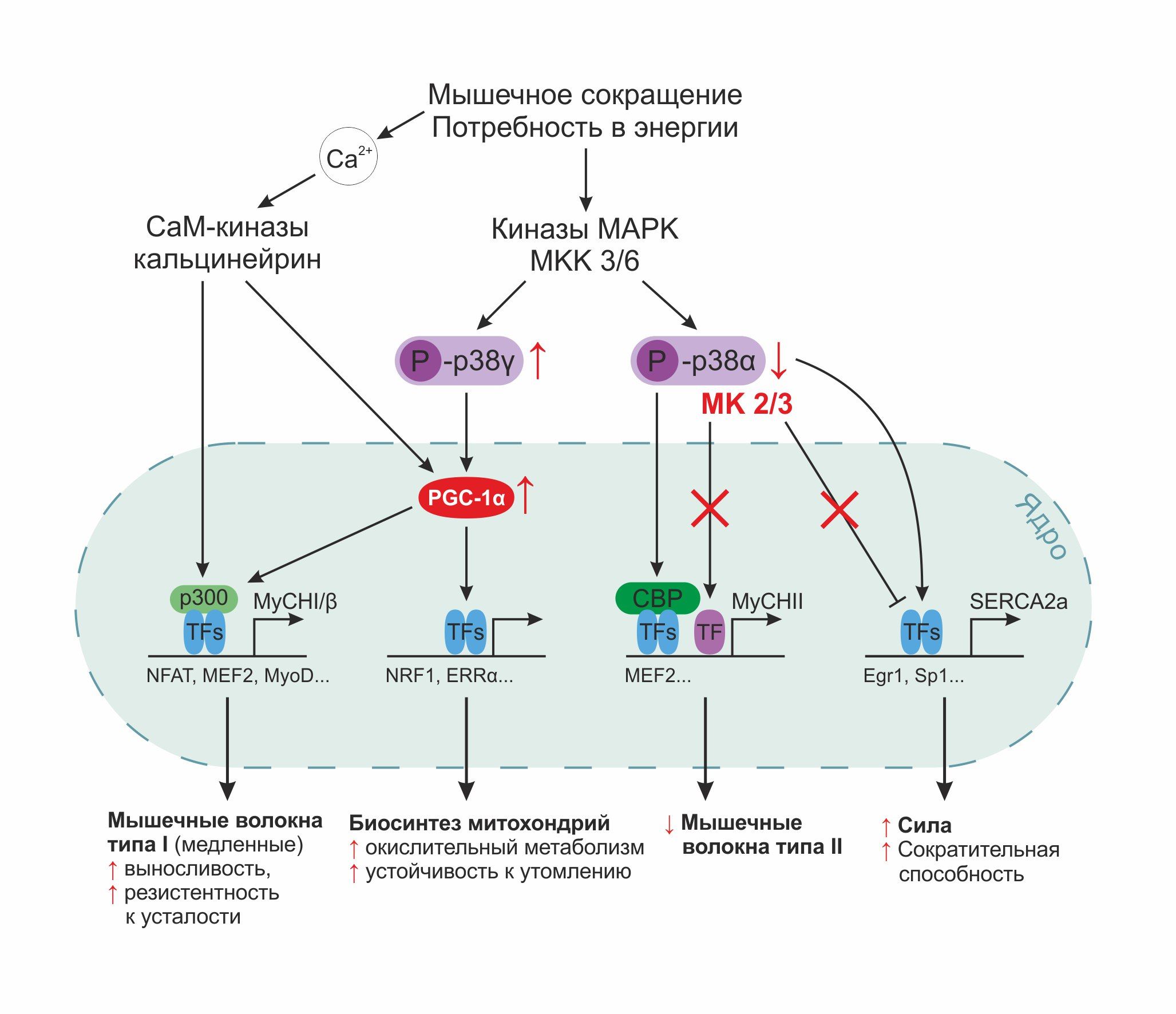
Еще один важный сигнальный путь, реализуемый в клетках скелетной мускулатуры, связан с р38 митоген-активируемой протеинкиназой (МАРК). Семейство МАРК задействовано в регуляции различных клеточных процессов, таких как пролиферация, дифференцировка, апоптоз, канцерогенез. Активация р38 может быть опосредована стрессовыми реакциями (УФ-излучение, тепловой шок, осмотический шок и т. д.), а также с помощью цитокинов, липополисахаридов, TNFα, ростовых и трофических факторов. Однако стресс-индуцированная активация р38 МАРК не является единственно возможным запуском данного пути. Инициация дифференцировки клеток скелетной мускулатуры представляет собой альтернативный вариант, дающий ход данному пути. С началом миогенеза в эмбриональном периоде киназная активность р38 МАРК повышается и оказывает непосредственное влияние на клеточную дифференцировку путем упорядоченной во времени экспрессии соответствующих генов. Стимуляция р38 МАРК довольно продолжительна и длительное время сохраняется в уже дифференцированных клетках. Поэтому в скелетной мышечной ткани взрослых сигнальный путь р38 МАРК рассматривается в рамках адаптивных процессов при тренинге. р38 МАРК и МАРК-активирующие протеинкиназы 2 и 3 играют роль при силовой нагрузке на мышцы, когда вследствие «утечки» электронов из цепи переноса на молекулярный кислород происходит образование свободных радикалов. Активность р38 МАРК выше в быстрых мышечных волокнах, нежели в медленных. На схеме в приложении наглядно показаны молекулярные механизмы действия р38 МАРК-индуцированной, стрессонезависимой регуляции генов, продуктами которых являются как тяжелая цепь MyHCII, характерная для быстрых мышечных волокон, для чего привлекается коактиватор СВР (CREB-binding protein; CREB-связывающий белок; CREB — cAMP response element-binding protein — клеточный фактор транскрипции), так и тяжелая цепь MyHCI, свойственная волокнам первого типа.
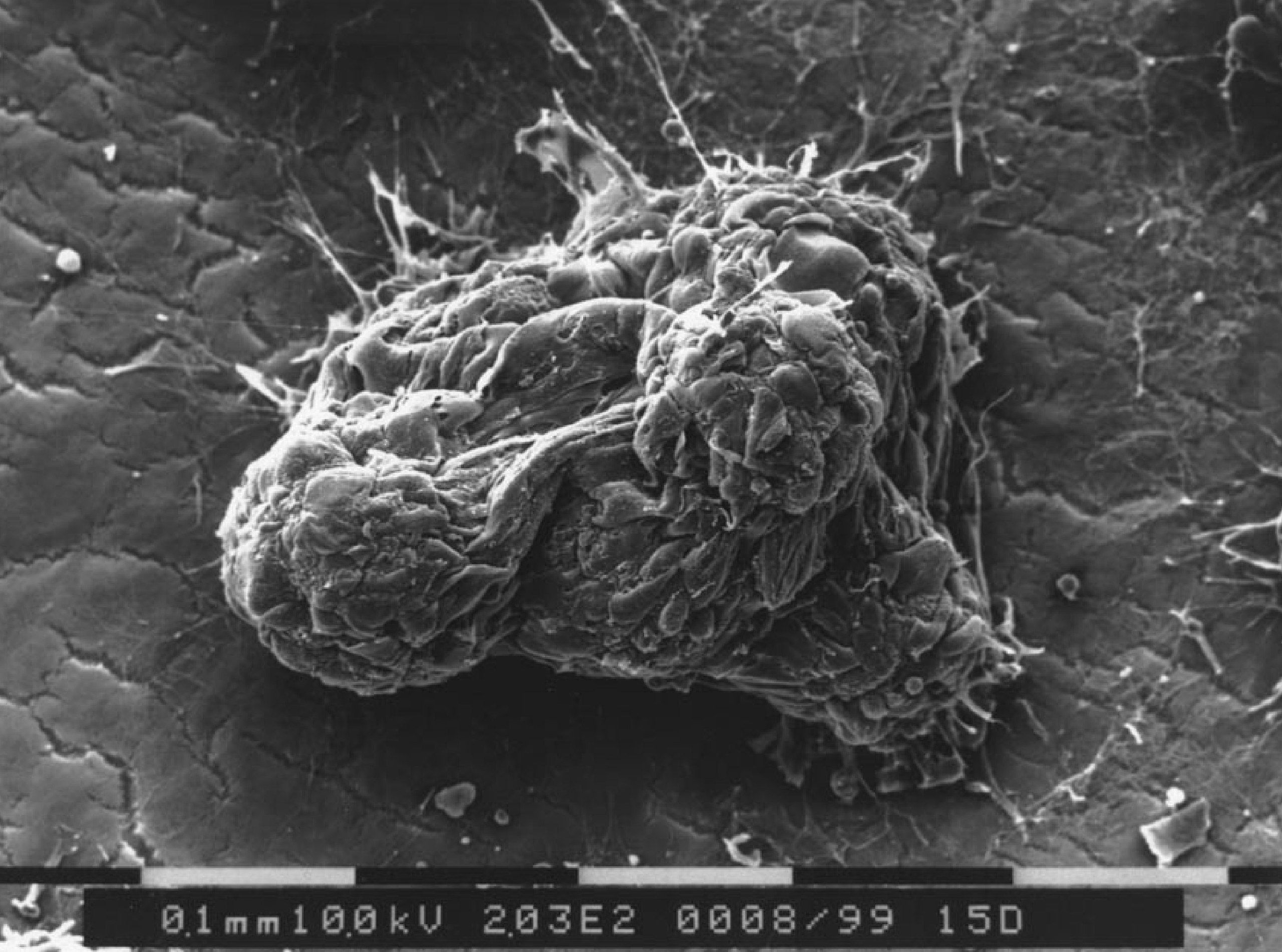 Рисунок 5. Снимок мышечных клеток на микроносителе; растровый электронный микроскоп.
Рисунок 5. Снимок мышечных клеток на микроносителе; растровый электронный микроскоп.
Метаболическая адаптация и мышечная гипертрофия
В ходе приспособления мышечных клеток к даваемым нагрузкам работают не только механизмы, сопряженные с изменением экспрессии изоформ миозина и, как следствие, с преобразованием типов мышечных волокон, но также задействованы и метаболические процессы. К примеру, смена типов волокон с быстрых на медленные влечет за собой увеличение объемов окислительного и снижение анаэробно-гликолитического метаболизма. Эти изменения не зависят от функционирования сигнальных путей, описанных выше, поскольку экспериментально показано, что усиленный синтез того или иного типа сократительных белков, вызванный активацией пути кальцинейрин/NFAT, может происходить и в отсутствие запущенного метаболического каскада процессов, равно как и метаболические процессы не меняются под влиянием, например, блокирования активности кальцинейрина. Поэтому параметры, обуславливающие метаболические приспособительные реакции мышечной ткани в ответ на нагрузку, особенно интересны. Одним из таких параметров может быть количество доступного кислорода, которое может иметь влияние на экспрессию митохондриальных факторов транскрипции (PGC1) и ферментов (фумараза, цитратсинтаза), а также гликолитических ферментов (ЛДГ, ГА-3-ФДГ). Снижение количества кислорода ведет к активации одной из изоформ семейства гипоксия-индуцированных факторов (HIF; hypoxia inducible factor), которая, проникая в ядро и связываясь с конкретным участком ДНК (не без привлечения коактиватора р300), активирует гены, основными результатами экспрессии которых являются усиление гликолиза, увеличение потребления глюкозы и ангиогенез.
Кроме того, немаловажным моментом является сильное изменение соотношения АТФ/АДФ/АМФ при сократительной активности мышц, поскольку АМФ-зависимые протеинкиназы могут воздействовать на факторы транскрипции генов метаболических ферментов. Быстрые мышечные волокна очень чувствительны к снижению уровня АТФ и истощению запасов гликогена, что имеет место при высоконагрузочных изматывающих тренировках. При этом, если поступающих питательных веществ организму после такой тренировки недостаточно, то запущенное стимуляцией мышц увеличение количества мРНК гена MyHCII не будет сопровождаться столь же интенсивным процессом трансляции, и в итоге синтез миозина будет снижаться. Это подчеркивает важность основательного подхода к питанию и отдыху, а также к распределению нагрузок в тренировочные дни.
Метаболически активные гормоны также обладают важным влиянием на профиль генной экспрессии в клетках скелетной мускулатуры. К таким гормонам относятся инсулин, инсулиноподобный фактор роста 1 (IGF1), гормон роста, которые регулируют клеточную дифференцировку и рост, влияя на экспрессию генов через тирозинкиназные рецепторы. При сильном метаболическом и энергетическом истощении запускаются реакции катаболизма, в которых принимают участие все три вышеперечисленных гормона, а также кортизол, действие которого взаимосвязано с уровнем гликогена, но может быть запущено и стрессовыми реакциями. Действуя через стероидные рецепторы, кортизол опосредует прекращение активности множества генов, среди которых тип миозина, присутствующий в быстрых мышечных волокнах.
Отдельно хотелось бы обратить внимание на роль IGF1 и подобных ему факторов роста (среди которых можно выделить MGF — mechanical growth factor) в мышечной гипертрофии. Образование факторов роста инициируется в ходе растяжения мышц и их сокращения. IGF1 и MGF могут действовать как аутокринно, так и паракринно, и ведут, с одной стороны, к повышенному синтезу сократительных белков разных типов мышечных волокон, и, с другой стороны, к пролиферации миосателлитных клеток, которые могут сливаться с уже имеющимися мышечными волокнами, а также формировать новые. Передача сигналов от рецепторов IGF1, имеющая следствием мышечную гипертрофию, регулируется посредством сигнального пути AKT/mTOR, однако к данному пути мы обратимся в следующей части.
3. Изменения скелетных мышц на молекулярном и клеточном уровнях в ответ на тренировочные нагрузки
Сокращение постмитотических многоядерных мышечных клеток, формирующих симпласт, дает людям возможность выполнять любые задачи, связанные с приложением мышечной силы. Мышечные волокна обладают различными метаболическими характеристиками и сократительными свойствами, неодинаковы по длине и диаметру, а самым замечательным их свойством является способность подстраиваться под физиологические (а также патофизиологические) изменения организма, инициируемые сменой функциональной нагрузки на скелетную мускулатуру. Такая пластичность подразумевает удлинение или укорочение мышечных волокон, их утолщение/утончение, а также регуляцию генетических механизмов, детерминирующих тип мышечных волокон. Объем и вид осуществляемых в мышечной ткани перестроек зависит от молекулярного и клеточного ответа, определяемого сочетанием внешних раздражений, к которым относятся и тренировочные нагрузки.
В продолжение хотелось бы еще немного углубиться в молекулярные основы данных процессов, чтобы приблизиться к пониманию того, как именно происходит тренировка мышц и прирост мышечной силы. В связи с этим хотелось бы начать с того, что для того, чтобы быть способными формулировать эффективные и индивидуальные тренировочные рекомендации, необходимо знать, какие механико-биологические условия ведут к какой реакции мышечной ткани, а также отмечать причинно-следственные взаимосвязи клеточного ответа со структурной, сократительной и метаболической адаптацией мышц. Кроме того, важно понимать, к какому функциональному эффекту приводит данная адаптация. Таким образом, необходимо уловить связи между внешним раздражением, адаптацией и результирующим эффектом. Для этого обязательным является понимание качественных и количественных показателей тренировочных нагрузок. Однако литература по данному вопросу нередко противоречива, и часто на деле неверно интерпретируемые результаты ведут к столь же неверным выводам.
В силовом тренинге нагрузка, как правило, определяется степенью противодействия оказываемой нагрузке, количеством подходов и повторов в каждом подходе, паузами между подходами, количеством тренировок в неделю и их длительностью. Однако только лишь этих показателей недостаточно. Помимо них, влияние на скелетные мышцы также оказывают анатомические особенности конкретного человека, обуславливающие его индивидуальное исполнение упражнения, тип и режим мышечного сокращения в каждом повторении, как и длительность повторения, паузы между ними, полная продолжительность мышечного напряжения, охват групп мышц в выполняемом движении, выполняется ли упражнение до «отказа».
Структурные изменения, ведущие к увеличению мышечной силы, имеют двойную — нейро-мышечную — природу. Нервная составляющая заключается в том, что тренировочный процесс оказывает влияние на величину кортикальных полей, вовлеченных в выполнение какого-либо определенного движения. Также нервный компонент можно охарактеризовать как синхронизацию между моторными единицами (функциональные единицы скелетных мышц; мышечные волокна + иннервирующий их мотонейрон), выполняемой нагрузкой и специфической для типа нагрузки адаптацией. Кроме того, во время тренировки происходит обучение мышц, непосредственно участвующих в выполнении движения, вместе с мышцами, необходимыми для обеспечения стабилизации, скоординированной активности. Это проявляется, в первую очередь, в совпадении по времени наибольшей интенсивности активности необходимых групп мышц и того момента, когда эта активность максимально необходима для эффективного выполнения движения (например, максимальная активация мышц-агонистов при одновременном сдерживании антагонистов). Именно повышение мышечной активности стоит за подъмом силовых качеств у начинающих спортсменов, структурные изменения мышечной ткани (например, утолщение мышечных волокон) запускаются несколько позже. К нервному компоненту относятся также перестройки на уровне моторной единицы, среди которых выделяют порог возбудимости мотонейронов, частоту и устойчивость генерируемых импульсов. Мышечные же изменения, связанные с увеличением мускульной силы, характеризуются теми процессами, которые мы рассматривали ранее (например, утолщение мышечных волокон за счет смены соотношения синтезируемых изоформ тяжелых цепей миозина (MyHC)). Стоит также отметить, что регуляция толщины мышечных волокон тесно сопряжена с регуляцией их длины, хотя зависимость прослеживается не во всех типах мышц.
Как можно вспомнить, гипертрофия скелетных мышц определяется увеличением размеров мышечных волокон, которое может сопровождаться также увеличением количества клеточных ядер в волокне (но не обязательно). Гипертрофия волокна может происходить как в продольном, так и в поперечном измерении. В отличие от гипертрофии, мышечная гиперплазия представляет собой увеличение количества миоцитов, за счет чего и происходит увеличение мышцы, однако у людей постнатальное деления клеток, формирующих симпласт, не происходит, а делятся клетки-миосателлиты, располагающиеся на поверхности симпластов.
Итак, обратимся для начала к тому, какие сигнальные внутриклеточные пути приводят к мышечной гипертрофии. Роль центрального молекулярного переключателя играет протеинкиназа В (PKB). Фосфорилированная активная форма PKB выполняет функцию центрального эффектора анаболических сигналов, препятствуя при этом развитию катаболических реакций. К активации PKB приводит запуск сигнального пути IGF-1/PI3K. Данный путь запускается под действием усиленной мышечной нагрузки вследствие инициируемой экспрессии гена IGF-1 (insulin-like growth factor 1). В мышечной ткани человека различают 3 изоформы IGF-1: IGF-1Ea, IGF-1Eb и IGF-1Ec (механический фактор роста; mechanogrowth factor, MGF). MGF представляет собой специфическую изоформу IGF-1, реагирующую на механические воздействия, и имеет ключевое значение для мышечной гипертрофии. Синтезированный IGF-1, действуя по ауто- или паракринному механизму, связывается с соответствующими рецепторами (IGFR), что вызывает конформационные изменения в тирозинкиназных доменах рецепторов. Как следствие, происходит транс-фосфорилирование рецепторов, а затем и фосфорилирование IRS-1 (insulin receptor substrate 1). IRS-1, в свою очередь, активирует PI3K (фосфоинозитид-3-киназа), результатом чего становится продукция фосфатидилинозитол-3,4,5-трифосфатов и активация PKB с помощью 3-фосфоинозитидзависимой киназы (3-phosphoinositide-dependent protein kinase 1, PDK1). Эффективность специфического для мышечной ткани IGF-1 зависит от степени связывания с IGFR, что находится под контролем IGF-1 связывающих белков, способных облегчать связывание IGF-1 с рецептором или препятствовать этому.
Также передача сигналов, ведущих к мышечной гипертрофии, осуществляется по путям, начинающимся с активации протеинкиназы В: PKB/mTOR и PKВ/GSK3β. Активация обоих путей приводит к выраженной гипертрофии мышц вследствие повышения интенсивности биосинтеза белка. Активация mTOR (mammalian target of rapamycin; мишень рапамицина млекопитающих) после фосфорилирования PKB может повлечь за собой два варианта развития событий, каждый из которых имеет результатом усиление трансляции мРНК. Первый вариант заключается в активации посредством mTOR рибосомальной протеинкиназы S6, способствующей процессу трансляции. Второй вариант подразумевает сдерживающее влияние mTOR на активность PHAS-1 (репрессор трансляции; осуществляет свое влияние на процесс трансляции за счет ингибирования эукариотического фактора инициации трансляции — eIF-4E). Действуя же по пути PKВ/GSK3β, фосфорилированная протеинкиназа В ведет к инактивации GSK3β (glycogen synthase kinase 3 beta), так как в активной форме эта киназа гликогенсинтазы блокирует проведение трансляции на матрице мРНК.
Помимо положительных активирующих сигналов, способствующих своей активностью мышечной гипертрофии, хотелось бы упомянуть и о роли негативных регуляторов роста мышечной ткани. Миостатины (иначе также называют фактором роста и дифференцировки 8), относящиеся к семейству белков TGF-β (transforming growth factor-β), выполняют функцию торможения клеточного цикла миобластов в период перехода от G1- до S-фазы. Руководит данным влиянием единственный ингибитор Cdk2 (циклинзависимая киназа 2; cyclin-dependent kinase 2) — миостатин р21. Также миостатины препятствуют дифференцировке миобластов за счет снижения экспрессии MyoD/миогенина. Мутации в гене миостатина, приводящие к утрате реализации его функций, вызывают крайне выраженный рост мускулатуры, что не раз было продемонстрировано в экспериментах с некоторыми видами крупного рогатого скота. Также в 2004 г. был зафиксирован примечательный случай мутации в гене миостатина, ведущей к выпадению его влияний, у маленького мальчика. Замеры его обхвата бедра показали результат, превышающий стандартные средние размеры более чем в 7 раз. Однако подобные мутации встречаются у людей очень редко. Более того, наблюдаются полиморфизмы гена миостатина без каких-либо влияний на особенности мышечной ткани. Хотя не исключено, что какие-то небольшие изменения в генах миостатинов, не приводящие к глобальным изменениям структуры ткани, все же могут делать вклад в склонность мышц к большей чувствительности в ответ на нагрузки, а значит, и в более высокие показатели мышечной силы.
Говоря о гипертрофии мышц, хочется также немного подробнее вспомнить о роли клеток-миосателлитов. Они располагаются между базальной мембраной и сарколеммой мышечных волокон. Именно за счет этих клеток происходит регенерация мышечной ткани после повреждений. Покоящиеся миосателлиты активируются непосредственно травмированием мышцы. В ответ на повреждение эти клетки начинают активно пролиферировать, а затем сливаются с остатком поврежденного мышечного волокна, а также друг с другом, формируя новые мышечные волокна. Клетки-сателлиты приводятся в активное состояние также под влиянием тяжелой мышечной работы. В ходе тренировки, когда мышцы подвергаются изолированной работе, постоянному растяжению и сокращению, противодействуя тяжелому весу, происходят микроповреждения мышечных волокон. Такие микротравмы вызывают развитие процесса, сходного с воспалительным, в ходе чего в зону повреждения активно мигрируют нейтрофильные гранулоциты и макрофаги. Инфильтрирующие мышечную ткань провоспалительные клетки, а также поврежденные мышечные волокна ведут к активному синтезу факторов роста, которые регулируют пролиферацию и дифференцировку миосателлитов. В экспериментах in vitro цитокины (в частности, HGF — фактор роста гепатоцитов) проявляли свое влияние на миосателлиты. Также было подтверждено, что на ранних стадиях регенерации поврежденные ткани продуцируют HGF в объеме, прямо пропорциональном степени повреждения. Не обходится пролиферативная активность миосателлитов и без влияния пути IGF-1/PI3K/PKB, который имеет одним из результатов инактивацию фактора транскрипции FOXO1 (forkhead box protein O1) путем фосфорилирования, что способствует усилению синтеза белка. Стоит также отметить, что, вероятно, эффект IGF-1 на миосателлиты зависит от каждой конкретной изоформы.
4. Мышечная работа и силовая нагрузка: молекулярные изменения, реакция моторных единиц
Мышечные волокна получают эфферентную иннервацию от мотонейронов. Мотонейрон и иннервируемые им волокна в совокупности рассматриваются как моторная единица. Потенциал действия, возникающий в мотонейроне, стимулирует следующую вслед за ним генерацию ПД в мышечной клетке, распространяющегося в клетке со скоростью 3–5 м/с. Электромеханическое сопряжение, ведущее к передаче ПД на цитоплазматическую мембрану миоцита, происходит следующим образом. Вспомним, что мембранная система в глубине саркоплазмы (саркоплазматический ретикулум), состоящая из вытянутых трубочек и удлиненных терминальных цистерн, является, кроме прочего, хранилищем ионов кальция, а плотные контакты с Т-трубочками по бокам каждого саркомера называются триадами. Так вот, вытянутые цистерноподобные впячивания сарколеммы (Т-трубочки) передают ПД внутрь мышечного волокна на границе между А- и I-полосами. На уровне триад, в мембранах Т-трубочек, находятся потенциал-управляемые кальциевые каналы — рецепторы дигидропиридина (DHPR) — которые не пропускают ионы кальция, оставаясь закрытыми и работая только в качестве датчиков, улавливающих возбуждение. DHPRs состоят в плотных контактах с кальциевыми каналами, расположенными в мембранах терминальных цистерн — рецепторами рианодина (RyR). ПД ведет к перестройкам DHPR, и, как следствие, к открытию RyR. Результатом данных изменений становится ток ионов кальция из саркоплазматического ретикулума в клетки. За этим следует инициация активности тропонина и тропомиозина, и с задержкой в 10–15 мс происходит мышечное сокращение. То есть, в норме выделение ацетилхолина в нервно-мышечном синапсе приводит к деполяризации мембраны мышечной клетки, высвобождению ионов кальция и, в конечном счете, к ее сокращению. Частота и длительность нервной стимуляции определяет амплитуду и продолжительность так называемых Са2+-волн, а также развиваемую мышцей силу (за счет регуляции концентрации ионов кальция в цитоплазме). Также стоит отметить, что колебания концентрации ионов кальция в цитозоле оказывают влияние на различные сигнальные пути в клетке, компонентами которых являются кальций-зависимые соединения, как, например, Са2+/кальцинейрин, Са2+/СаМКII(IV), PKC (кальций-зависимая протеинкиназа С).
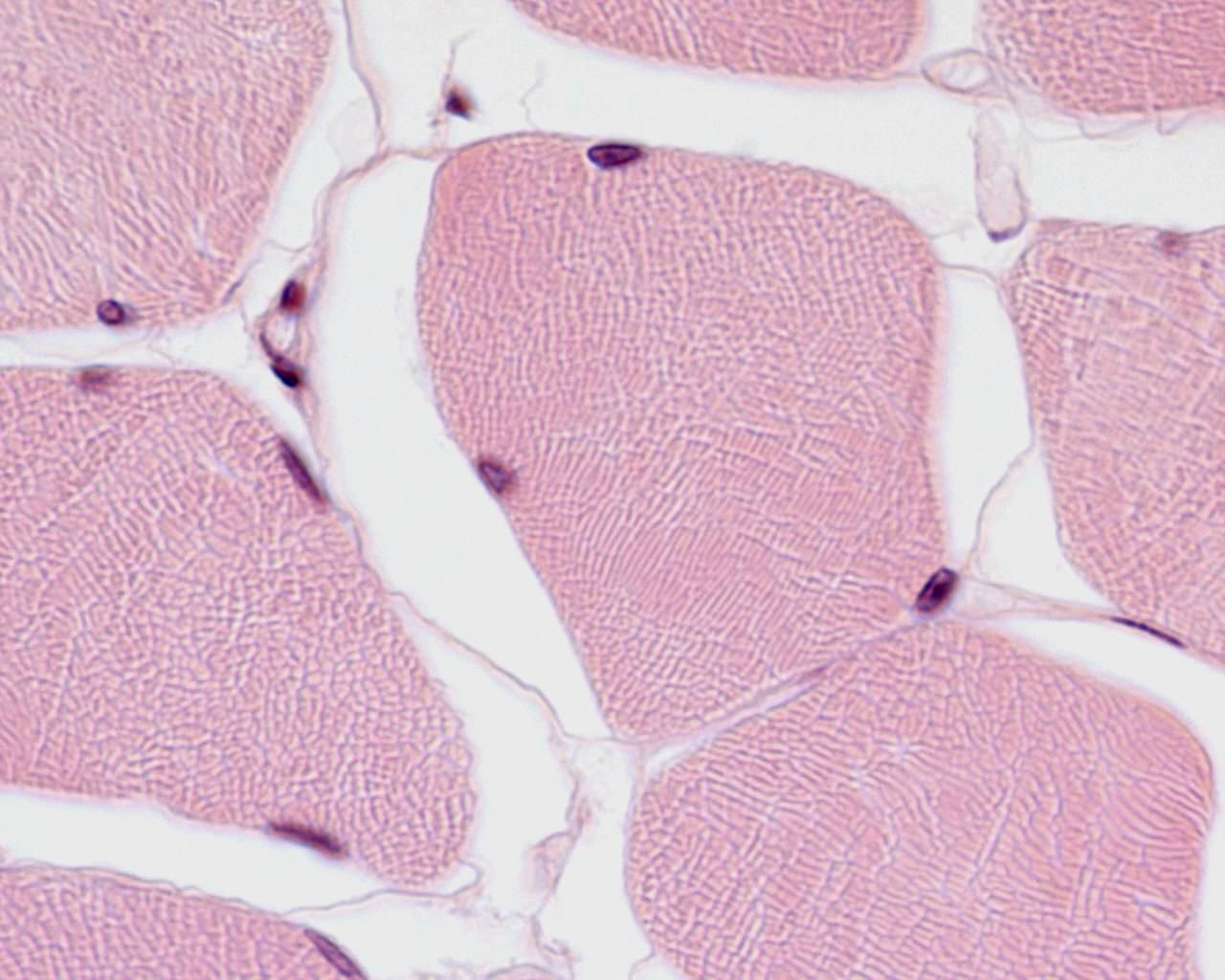
Рисунок 7. Скелетная мышца, поперечный срез.
Благодаря перечисленным ферментам обеспечивается тесная взаимосвязь между мышечным возбуждением и транскрипцией целевых генов, отвечающих за синтез изоформ MyHC, окислительных ферментов, nAChR (nicotinic acetylcholine receptor; никотиновый ацетилхолиновый рецептор), SCL2A4 (solute carrier family 2, member 4), GLUT4, SERCA1, а также генов, регулирующих работу митохондрий. Участие кальцинейрина в сигнальной трансдукции путем дефосфорилирования фактора транскрипции NFAT описано выше.
Для каждой моторной единицы в отдельности действует правило «все или ничего»: один ПД ведет к единичному сокращению иннервируемых волокон. Амплитуда сокращения одной моторной единицы каждый раз одинакова, поскольку возбуждаются всегда одни и те же волокна. Для мышцы же целиком данное правило уже не является справедливым, поскольку может быть активировано разное количество мышечных волокон в зависимости от прилагаемой нагрузки.
Все мышечные волокна, как мы уже говорили, не идентичны, и делятся на 2 типа:
- Typе I — медленные волокна («красные»), богаты миоглобином, в них синтезируется медленная изоформа миозина; данный тип волокон сокращается сравнительно медленно и дает меньший вклад в развиваемую мышцей силу в расчете на одну использованную молекулу АТФ;
- Typе II (+ подтипы А и В, характеризующиеся меньшей и большей утомляемостью соответственно) — быстрые волокна («белые»), содержащие меньше миоглобина, в короткое время позволяют мышце развить максимальную силу.
Волокна типа I преимущественно тонические, IIА — фазические и тонические, IIВ — в основном, фазические. Итак, подытоживая, можно сказать, что в зависимости от типа мышечные волокна отличаются синтезируемой изоформой MyHC, объемом митохондрий, содержанием миоглобина, плотностью капиллярных сетей, оксидативным потенциалом ферментов. За каждой из этих характеристик стоят функциональные генные домены, независимая регуляция которых осуществляется специфически (в зависимости от типа волокна) в ответ на влияния извне. С одной стороны, возможно, регуляция генетических структур осуществляется в каждом виде волокон по-своему, с другой стороны — возможно, что, например, экспрессия форм MyHC в пределах отдельно взятого волокна неоднородна, и волокна можно рассматривать по данному признаку как «полиморфные».
Точно так же, как различаются между собой типы мышечных волокон, не одинаковы и моторные единицы. Они делятся на типы:
- S (медленное сокращение, низкая утомляемость);
- FR (быстрое сокращение, низкая утомляемость);
- FF (быстрое сокращение, быстрое утомление).
Если промежуток между двумя ПД меньше, чем длительность одного сокращения, которое может составлять от 50 до 500 мс, то происходит накладывание раздражающих потенциалов (суперпозиция), что приводит к сильному механическому ответу сокращающейся мышцы. Если мышечные волокна успевают расслабиться между поступающими ПД, то тетаническое сокращение осуществляется не в полной мере. Если же интервал между ПД даже меньше, чем 1/3 от длительности одного сокращения, то наблюдается полное тетаническое сокращение (тетанус), развиваемая при котором сила в 3–10 раз выше, чем при однократном сокращении. Таким образом, при быстрых контролируемых движениях мотонейроны генерируют ПД с частотой 6–8 Hz, и, благодаря повторяющимся сокращениям, развивается тетанус, повышающий силу сокращения.
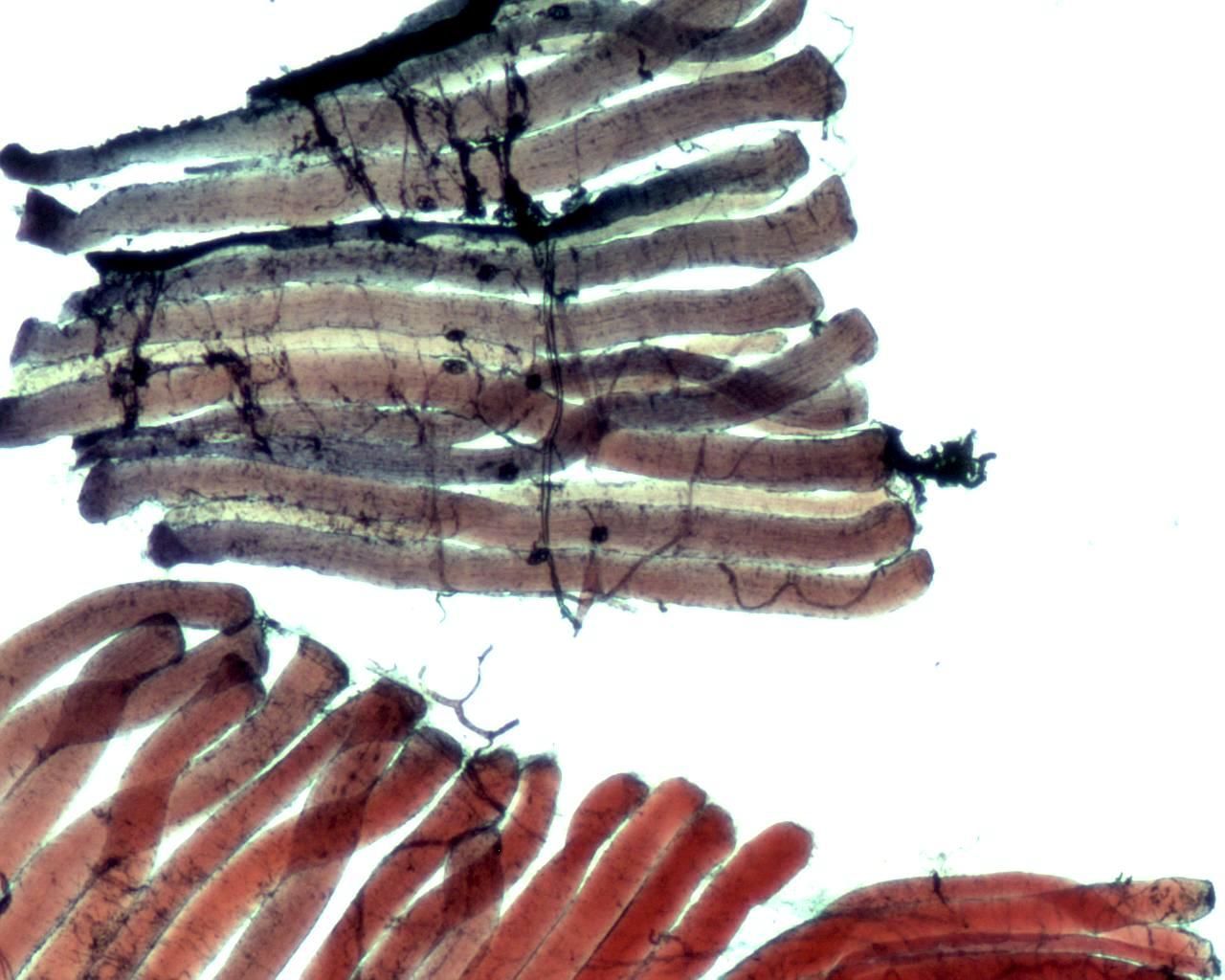
Рисунок 8. Нейромышечные соединения.
Кроме того, благодаря вовлечению большего количества моторных единиц сила мышечного ответа может увеличиваться еще больше. Флуктуации кальциевых волн регулируются молекулярными механизмами, что обуславливает специфическую для каждого типа волокон экспрессию генов. Привлечение дополнительных моторных единиц инициируется развиваемой мышечной силой в ответ на нагрузку. Кроме того, количество задействованных при мышечной работе моторных единиц пополняется в последовательности, зависящей от размера тела мотонейрона, а именно сначала вовлекаются меньше единицы, затем большие. Наименьшие по размеру моторные единицы составляют мышечные волокна первого типа. Соответственно, если требуемая мышечная сила в ответ на нагрузку невелика, то активны только моторные единицы волокон типа I, а если требуется развить большую силу, то в сокращение вовлекаются все более крупные моторные единицы пропорционально необходимой силе (особенно это характерно для массивных мышц). Например, для m. vastus lateralis (четырехглавая мышца бедра) было экспериментально доказано, что при субмаксимальных сокращениях до отказа порог, при прохождении которого начинается вовлечение новых моторных единиц, снижается, и при возрастающей усталости их рекрутинг становится все интенсивнее, причем порядок запуска моторных единиц не изменяется. Данный механизм имеет фундаментальное значение, но объяснить его довольно просто: если какие-то мышечные волокна утомляются, их сократительная способность (а значит, и сила) снижается; при этом, чтобы продолжать поддерживать сократимость всей мышцы на прежнем уровне, начинается усиленное возбуждение мотонейронов, ведущее к активации больших моторных единиц, так как порог их возбудимости при повышенном входящем возбуждающем сигнале преодолевается первым.
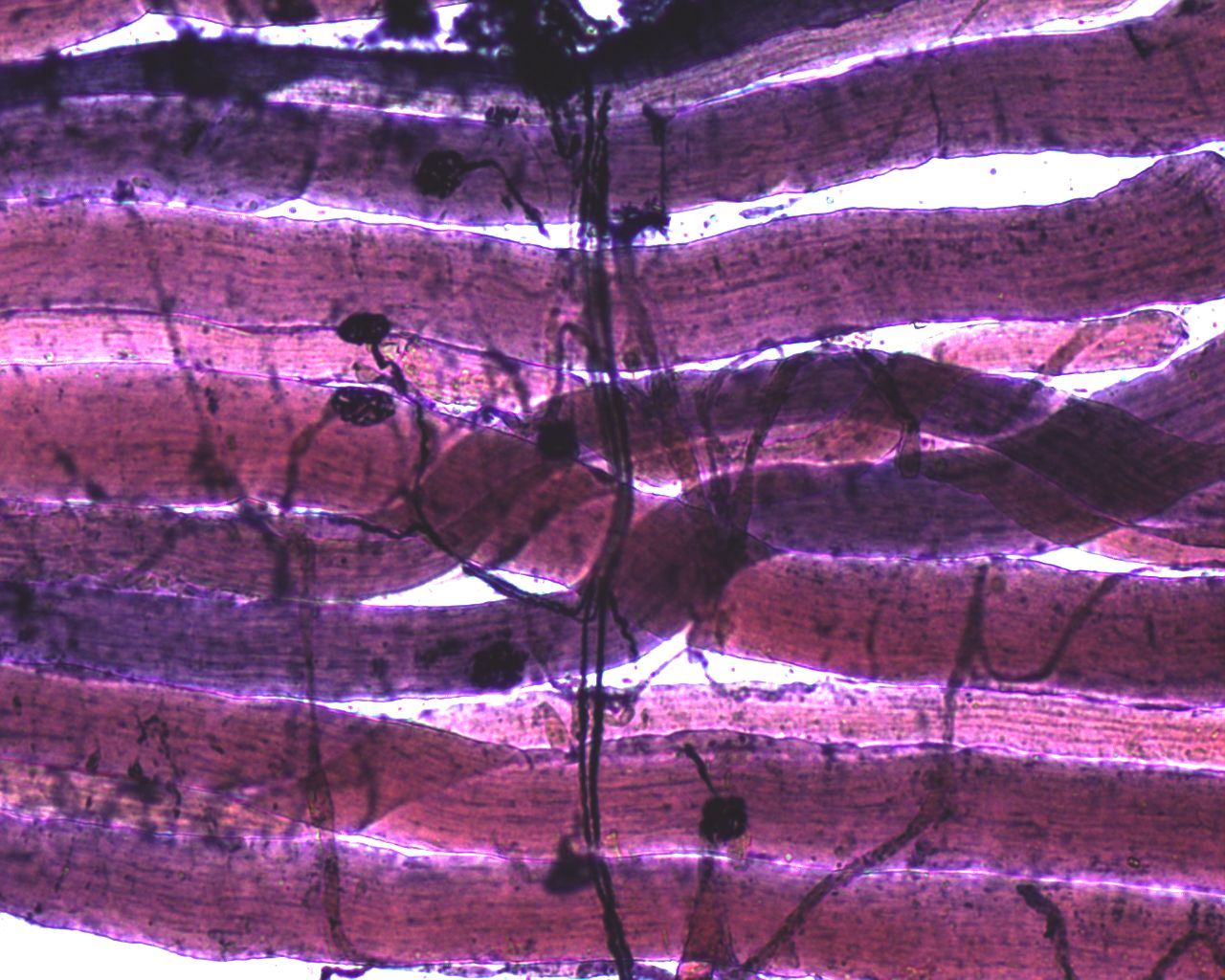
Рисунок 9. Нейромышечные соединения.
На основе вышеприведенных данных была сформулирована теоретическая модель активности в пределах мышечных волокон при том или ином типе сокращений. Упрощенно она выглядит следующим образом. Принимая то, что подход в упражнении выполняется до локального произвольного мышечного отказа (то есть при постоянном объеме движений все вовлеченные при совершении упражнения мышцы перманентно сопротивляются возложенной нагрузке, без пауз, без прекращения выполнения посреди упражнения), была отмечена равная степень вовлечения моторных единиц при различных вариациях степени напряжения. Одновременно с этими данными были получены сведения о зависимости уровня белкового синтеза от интенсивности тренировки: при равном количестве АТФ и задействованных моторных единицах биосинтез белка стимулируется также в равной степени, вне зависимости от требуемого сопротивления весу. Расчет проводился в процентах от 1 ПМ (1 повторение с максимальным весом), и при всех вышеперечисленных условиях тренировочная нагрузка в размере 60, 75 и 90 % ПМ сопровождалась одинаковой по интенсивности стимуляцией процесса синтеза белка.
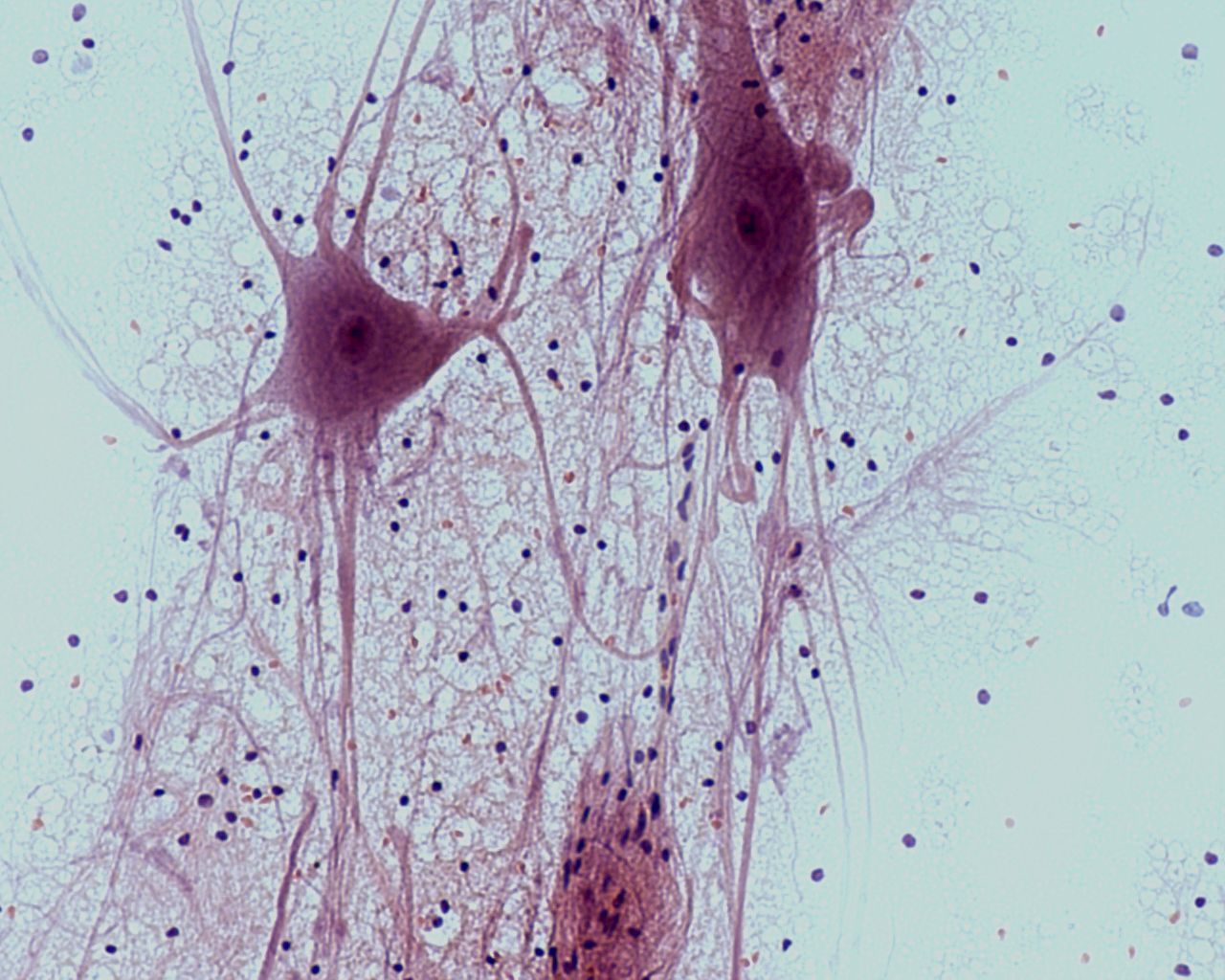
Рисунок 10. Мотонейроны.
Помимо процессов биосинтеза, тренировочные нагрузки опосредуют также и разрушение белка. Примерно в течение 3-х часов после тренировки синтез белка повышен, и на таком уровне он может сохраняться до 48-ми часов. Если резкий подъем синтеза белка обуславливается изменением трансляционной и посттрансляционной регуляции, то при системных тренировках обнаруживается также повышенный уровень мРНК миофибриллярных белков. В данном случае повышение транскрипции происходит вследствие повышенной ядерной активности миоцитов и за счет внедрения клеток-миосателлитов, что экспериментально было подтверждено на примере трех групп людей — спортсменов-силовиков, людей, занимавшихся силовым видом спорта, но взявших перерыв на несколько недель, и нетренированных людей. У первых двух групп, в сравнении с третьей, на поперечном срезе мышечного волокна было обнаружено большее количество ядер. Также в некоторых исследованиях была отмечена повышенная экспрессия мРНК MyHC-изоформ после многонедельных (6–19 недель) тренировок, включающих концентрические и эксцентрические сокращения мышц. Кроме того, был сделан вывод о том, что изменения генной экспрессии и типов мышечных волокон происходит не одновременно из-за сравнительно медленного превращения белков различных изоформ MyHC. Со временем процент мышечных волокон, в которых наблюдается несовпадение синтезируемого белка и экспрессированной мРНК, увеличивается, как, например, в волокнах типа IIX обнаруживалась мРНК MyHC IIA, на матрице которой синтезировался соответствующий белок MyHC, что способствовало превращению исходного мышечного волокна в тип IIA.
Источники:
- Heinrich P. C., Müller M., Graeve L. (ed.). Löffler/Petrides Biochemie und Pathobiochemie. – Springer-Verlag, 2014.
- Волков Н. И. и др. Биохимия мышечной деятельности //Киев: Олимпийская литература. – 2000. – Т. 503.
- Нельсон Д. Л., Кокс М. М., Ленинджер А. Основы биохимии Ленинджера. – 2011.
- Scharf M. et al. Mitogen-activated protein kinase-activated protein kinases 2 and 3 regulate SERCA2a expression and fiber type composition to modulate skeletal muscle and cardiomyocyte function //Molecular and cellular biology. – 2013. – Т. 33. – №. 13. – С. 2586-2602.
- Potthoff M. J., Olson E. N. MEF2: a central regulator of diverse developmental programs //Development. – 2007. – Т. 134. – №. 23. – С. 4131-4140.
- Meissner J. D. et al. The p38α/β mitogen-activated protein kinases mediate recruitment of CREB-binding protein to preserve fast myosin heavy chain IId/x gene activity in myotubes //Journal of Biological Chemistry. – 2007. – Т. 282. – №. 10. – С. 7265-7275.
- Lin Y. et al. PGC-1α is associated with C2C12 Myoblast differentiation //Central European Journal of Biology. – 2014. – Т. 9. – №. 11. – С. 1030-1036.
- Insulin-like Growth Factor-1 (IGF-1) Inversely Regulates Atrophy-induced Genes via the Phosphatidylinositol 3-Kinase/Akt/Mammalian Target of Rapamycin (PI3K/Akt/mTOR) Pathway, 2005
- M. Toigo Trainingsrelevante Determinanten der molekularen und zellulären Skelettmuskeladaptation, Schweizerische Zeitschrift für „Sportmedizin und Sporttraumatologie“, 2006
- Human myostatin negatively regulates human myoblast growth and differentiation, 2011
- Flück, Hoppeler Molecular basis of skeletal muscle plasticity-from gene to form and function
- Booth, Thomason Molecular and cellular adaptation of muscle in response to exercise: perspectives of various models (просто легендарная статья, не смотрите, что древняя, на ней правда основаны многие будущие выводы в данной области)
- Pape, Kurtz, Silbernagl Physiologie, Thieme, 2014
- M. Toigo Trainingsrelevante Determinanten der molekularen und zellulären Skelettmuskeladaptation, Schweizerische Zeitschrift für „Sportmedizin und Sporttraumatologie“, 2006
- Sharples Cellular and Molecular Exercise Physiology: Historical Perspective for the Discovery of Mechanisms Contributing to Skeletal Muscle Adaptation, 2017
