Эпителиально-мезенхимальный переход: молекулярная симфония для факторов транскрипции.

Когда я думаю об опухолевых клетках, то неизменно вспоминаю «Войну и мир»: мужественные командиры со своими солдатами, победные стратегии своих генералов и провальные походы противника (и наоборот), боевые подвиги и полное разорение, развороченное место недавнего боя и даже своеобразное метафоричное небо над Аустерлицем – не спешат больше бешено экспрессируемые белки на борьбу с диверсантами, защитные механизмы сдают оборону, а некоторые и вовсе переходят на сторону врага, и в звенящей от контузии тишине только мириады клеток разбредаются по организму, готовые создавать новые очаги, которые погубят его. Процесс перехода от мира к войне и наоборот это ведь тоже одна из форм пластичности, пластичности нашей жизни, переход от стабильного состояния к шаткому и неустойчивому, а затем закономерное возвращение к покою. Возможно, в этом и проявляются общие закономерности самой природы жизни, ведь к какому бы уровню организации живого мы ни обращались, всегда можно разглядеть общие фундаментальные идеи, указывающие на то, что все в этом мире взаимосвязано.
В части 1 мы с вами уже рассматривали основополагающие принципы, согласно которым протекает трансформация эпителиальных клеток в мезенхимальные. Обобщив, напомним себе, что как одна из форм эпителиальной пластичности, эпителиально-мезенхимальный переход (или трансформация, ЭМТ) включает в себя определенные изменения морфологии клеток эпителия, являющиеся отражением событий, происходящих на молекулярном уровне. Для эпителиальных клеток характерно наличие постоянных межклеточных контактов и адгезия с подлежащими клетками. Специализированные комплексы поверхностных белков эпителиоцитов формируют межклеточные контакты разных типов, благодаря чему поддерживается целостность эпителия. Все эти типы соединений клеток нам знакомы: субапикальные плотные контакты (tight junctions), адгезивные контакты (adherens junctions), десмосомы и хаотично разбросанные щелевые контакты (gap junctions) между латеральными поверхностями. Мезенхимальные же клетки, в отличие от эпителиальных, имеют непостоянную форму и не формируют подобных контактов друг с другом. Инициация ЭМТ влечет за собой разобщение вышеперечисленных соединений, поскольку задействованные в их формировании белки релокализуются либо подвергаются деградации. Разрывы плотных контактов в ходе ЭМТ сопровождаются снижением экспрессии клаудина и окклюдина, а также уменьшением количества белка zonula occludens 1 - ZO1 (белок плотных контактов, обозначается также как TJP1) в области межклеточных соединений. При дестабилизации адгезивных контактов Е-кадгерин подвергается разрушению в цитоплазматической мембране, что считается одним из решающих направляющих событий в развитии ЭМТ. Также экспрессия Е-кадгерина может быть снижена за счет метилирования промотора гена CDH1, мутаций или изменения обусловленной факторами транскрипции регуляции данного гена, ответственного за синтез Е-кадгерина, вследствие чего процесс транскрипции нарушается и синтезируемая мРНК обрывается. В итоге взаимодействие между Е-кадгерином и β-катенином, находящимся в цитоплазме и играющим роль проводника между трансмембранным кадгерином и актиновыми филаментами цитоскелета, более невозможно, и β-катенину грозит та же участь – разрушение. Однако он может избежать ее, например, если клетка реагирует на WNT-сигналинг, так как в этом случае β-катенин не фосфорилируется киназой гликогенсинтазы GSK-3β и локализуется в ядре, связываясь там с энхансерными факторами транскрипции TCF/LEF. Таким образом, вспоминая материал первой части, можно описать ЭМТ как процесс, в ходе которого полярные фиксированные эпителиальные клетки трансдифференцируются, приобретая характеристики подвижных мезенхимальных клеток.
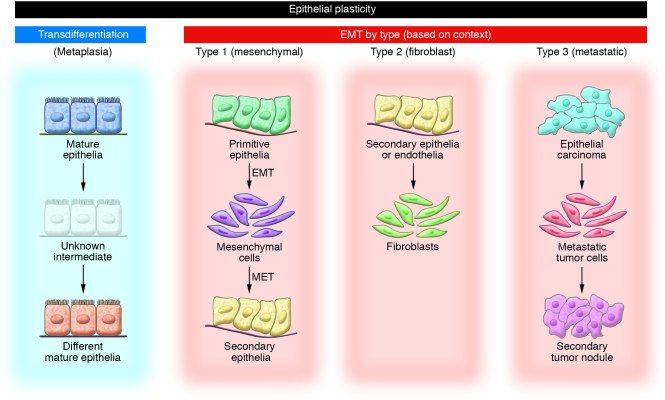
- Незрелые клетки эпителиального фенотипа, которые превращаются в мезенхимальные, из которых потом формируются клетки эпителия в участках, согласно программе гаструляции и миграции клеток нервного гребня.
- эпителиальные/эндотелиальные клетки заполняют интерстициальные пространства фибробластными клетками.
- ЭМТ как часть метастатического процесса при опухолевой прогрессии, когда эпителиальные клетки покидают первичный очаг, мигрируют и реконструируются во вторичную ткань.
Поддержание ЭМТ осуществляется за счет того, что экспрессия контактных белков транскрипционно снижается. Кроме того, в клетках позвоночных были обнаружены важные белковые комплексы – PAR (включает PAR6, PAR3 и атипичную протеинкиназу С – aPKC) и Crumbs-комплекс (представляет собой белок CRB, ассоциированный с Lin‑7 1 (PALS1) и связанным с ним белком плотных контактов – PATJ), расположенные в апикальной части и определяющие границы верхушечной области клетки за счет образования плотных контактов, а также Scribble-комплекс (включает в себя белки SCRIB, DLG и LGL), определяющий базолатеральный полюс клетки. Снижение экспрессии контактных белков препятствует взаимодействию данных белковых комплексов с мембранными структурами, как, например, подавление экспрессии Е-кадгерина становится причиной того, что SCRIB перестает связываться с базолатеральной мембраной, в результате чего клеточная подвижность только усиливается. Репрессия синтеза прочих белков полярности, как то CRB3 и LGL2, также вносит вклад в дестабилизацию эпителиального фенотипа. (см. Схему 3)
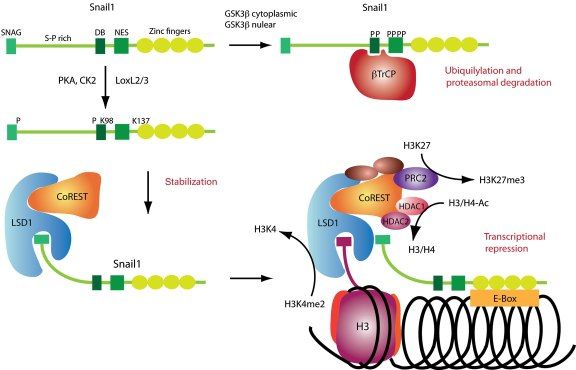
Схема 2.
Важно понимать, что в основе активации мезенхимального фенотипа лежит активность множества факторов транскрипции, которые изменяют генную экспрессию. В настоящем посте мы сконцентрируем внимание на основных регуляторах – транскрипционных факторах SNAIL, TWIST и ZEB – чья экспрессия активируется на самых ранних этапах ЭМТ. Вклад факторов транскрипции в развитие ЭМТ зависит от типа клеток и ткани, задействованных в реализации сигнальных каскадов, потенцирующих ЭМТ. Нередко регуляторы транскрипции оказывают взаимное влияние друг на друга и совершают кооперативную работу по воздействию на таргетные гены. Зачастую одни и те же факторы транскрипции отвечают как за репрессию генов эпителиальных клеток, так и за активацию генов, отвечающих за развитие мезенхимального фенотипа.
Среди транскрипционных факторов SNAIL в клетках позвоночных были идентифицированы SNAIL1 (SNAIL), SNAIL2 (SLUG) и SNAIL3 (Smuc), и все они являются непосредственными активаторами программы ЭМТ как во время физиологического развития организма, так и при фиброзе или опухолевых процессах. Экспрессия генов, обуславливающих основные морфо-функциональные свойства эпителиальных клеток, угнетается за счет связывания фактора транскрипции с мотивом цепи ДНК, называемым E‑box (5′-CANNTG-3′) и имеющимся в составе промоторов целевых генов, что возможно вследствие наличия в структуре транскрипционных факторов высококонсервативных доменов типа «цинкового пальца» на С-терминальном конце. Связываясь с участком E‑box в проксимальной области промотора гена Е-кадгерина, SNAIL1 рекрутирует белковый комплекс PRC2 и связывает его компоненты, благодаря наличию на N-терминальном конце эволюционно консервативного домена SNAG. В состав комплекса PRC2 входят метилтрансферазы гистонов (EZH2, G9a и SUV39H1), корепрессор SIN3A, гистоновые деацетилазы и лизин-специфическая деметилаза (LSD1). Как можно понять из названий, каждый из компонентов комплекса PRC2 направлен на координацию различных модификаций гистонов, в частности – метилирование и ацетилирование гистона H3 по 4-ому остатку лизина, 9-ому и 27-ому (H3K4, H3K9 и H3K27), причем метилирование одних участков препятствует транскрипции хроматина, тогда как ацетилирование этих же участков, напротив, является маркером доступности для осуществления транскрипции. Это крайне важный для понимания момент, поскольку промоторы генов, как и в случае гена Е-кадгерина, имеют обе метки сразу, – и метильную, и ацетильную – что позволяет своевременно активировать ген при поступлении активирующего сигнала и, в то же время, сохранять ген неактивным в отсутствие данного сигнала. Такой двойной контроль промотора гена Е-кадгерина, вероятно, является одой из причин обратимости ЭМТ. (см. Схему 2)
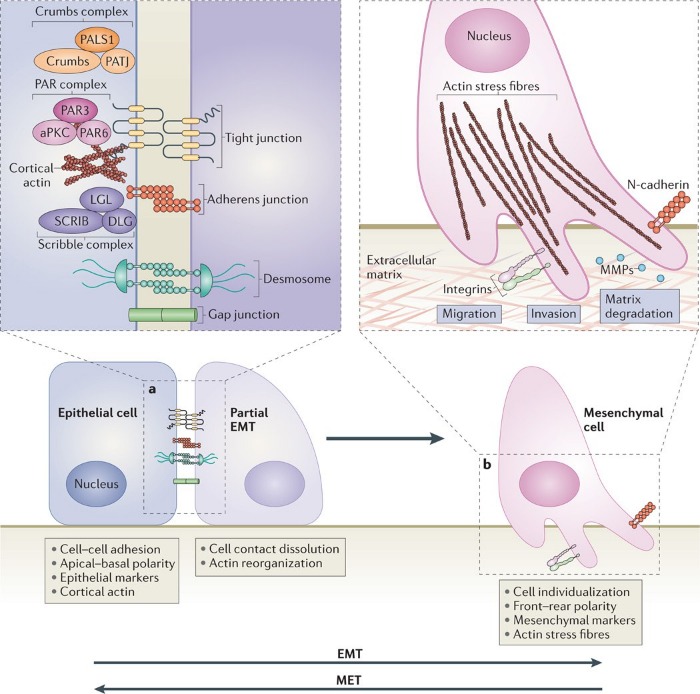
Схема 3.
Вспоминая содержание предыдущего поста, напомним себе, что запуск и поддержание ЭМТ становится возможным именно благодаря сигналам, исходящим из клеточного микроокружения, включая внеклеточный матрикс (коллаген, гиалуроновая кислота). Важную роль в регуляции ЭМТ играют разнообразные растворимые факторы, как, например, эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), фактор роста гепатоцитов (HGF), костные морфогенетические белки (BMPs), трансформирующий фактор роста бета (TGF-β), Notch, Wnt, фактор некроза опухоли альфа (TNF-α) и цитокины. Многие из перечисленных сигнальных молекул индуцируют и экспрессию транскрипционных факторов SNAIL, совершая тем самым еще больший вклад в эпителиально-мезенхимальную трансформацию. Например, рецепторные тирозинкиназы, активированные HGF, FGF или EGF, направляют сигналы по путям RAS-MAPK или PI3K-Akt, что в кооперации с деятельностью TGF-β ведет к активности SNAIL. При этом интересны взаимоотношения между TGF-β и SNAIL: изначально TGF-β индуцирует высокую экспрессию SNAIL, при этом SNAIL позволяет трансформирующимся злокачественным клеткам избегать супрессивного воздействия TGF-β (в частности, обеспечивает уклонение от TGF-β-опосредованного апоптоза), а на поздних стадиях и сам TGF-β становится перебежчиком на темную сторону и уже не подавляет развитие опухоли, а стимулирует ее прогрессию, побуждая активность SNAIL через Smad-зависимые пути.
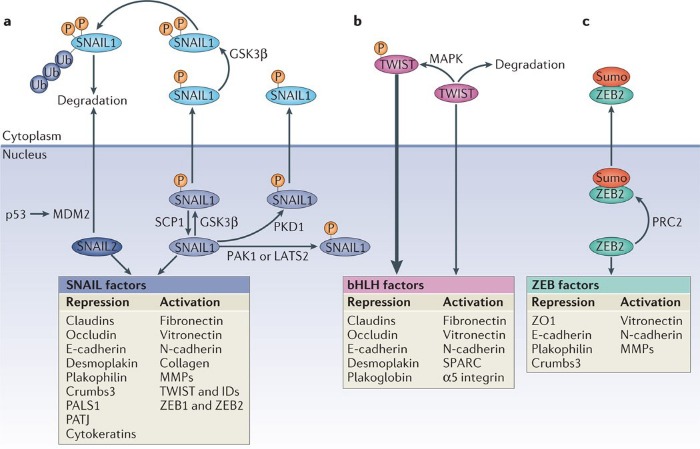
В самом начале поста мы упоминали о взаимосвязи между сигнальным путем Wnt, репрессией гена Е-кадгерина и развитием ЭМТ. В этой взаимосвязи есть место и транскрипционным факторам SNAIL. Например, в клетках рака молочной железы каноничный путь Wnt запускает ЭМТ вследствие инициируемой экспрессии внутриклеточного белка Axin2, что стабилизирует уровень SNAIL, а потому, если исключить активность GSK-3β, то сигнальная передача от Wnt может становиться причиной индукции ЭМТ и последующего опухолевого метастазирования, поскольку активность β-катенина и SNAIL сохранится. Синергия в работе между SNAIL и β-катенином позволяет злокачественным клеткам выживать и распространяться также за счет того, что сигнал от Wnt, передаваемый через белки пути β-катенин/TCF4/Snail, приводит к ингибированию митохондриального дыхания, поскольку угнетается активность цитохромоксидазы COX, а также к гликолитическому переходу, так как клетка начинает усиленно потреблять глюкозу и продуцировать лактат.
Активации SNAIL зачастую вторит активность таких факторов транскрипции как ZEB, что нередко происходит под влиянием совместной деятельности SNAIL1 и TWIST1. Экспрессия ZEB точно так же повышается в ответ на сигналы TGF-β и Wnt, а также факторы роста, запускающие путь RAS-MAPK, что характерно и для регуляции SNAIL. В регуляции активности ZEB участвует и уже знакомый нам комплекс PRC2, который сумоилирует ZEB по окончании трансляции, что обуславливет локализацию данного фактора транскрипции в цитоплазме, в результате чего репрессия генов, вызванная ZEB, ослабевает.
Источники:
- Christofori G. Snail1 links transcriptional control with epigenetic regulation, 2010
- Wang, Shi, Chai, Ying, Zhou The Role of Snail in EMT and Tumorigenesis, 2014
- Zeisberg, Neilson Biomarkers for epithelial-mesenchymal transitions, 2009
- Lamouille, Xu, Derynck Molecular mechanisms of epithelial-mesenchymal transition, 2014
