Биомаркеры для прогнозирования реакции трансплантат против хозяина после трансплантации аллогенных гемопоэтических стволовых клеток крови

Трансплантация аллогенных гемопоэтических стволовых клеток крови (аллоТГСК) сегодня является основным способом лечения злокачественных гематологических новообразований, в частности лейкемии, лимфомы, миеломной болезни и др. Однако аллоТГСК может привести к тяжелым посттрансплантационным осложнениям, таким как реакция «трансплантат против хозяина» (РТПХ), что весьма ограничивает использование этого метода лечения. РТПХ, Т86.0 по МКБ-10, делят на две формы: острую (оРТПХ) и хроническую (хРТПХ). Большинство исследований РТПХ сосредоточено на оРТПХ, при этом хРТПХ, более сложная и многогранная, изучена хуже. Хроническая РТПХ — это полиорганное аутоиммунное расстройство, которое является основной причиной заболеваемости и смертности после аллоТГСК, не связанной с рецидивом опухолей. хРТПХ встречается примерно у 50 % пациентов, что составляет 13 000–15 000 пациентов в год во всем мире. Возникает высокая потребность в раннем прогнозировании развития РТПХ и, в особенности, ее хронической формы.
В последнее десятилетие в диагностике и прогнозировании заболеваний получили широкое применение различные биомаркеры. На роль биомаркеров подходят клетки, различные факторы, выделенные из тканей-мишеней, факторы, растворенные в жидкостях организма. В качестве предикторов для о/хРТПХ в этом обзоре рассмотрены биомаркеры на основе B-лимфоцитов, белков теплового шока и микроРНК, которые могут прогнозировать развитие тяжелой оРТПХ (III–IV степени), общую смертность и ожидаемое развитие хРТПХ у пациентов после трансплантации.
Клеточные биомаркеры
Донорские Т-лимфоциты, нацеленные на аллоантигены реципиента, играют ведущую роль в индукции РТПХ. Разрушение тканей хозяина Т-лимфоцитами обычно происходит путем секреции провоспалительных цитокинов, таких как интерлейкин-1 (IL-1), фактор некроза опухолей альфа (TNF-α) и интерферон-гамма (IFN-γ), или прямой цитолитической активностью иммунных эффекторных клеток. Важную роль в патогенезе хРТПХ играют не только T-лимфоциты, но и B-лимфоциты. Таким образом, наличие ауто- и аллоантител, повышенные уровни В-клеточного активатора (BAFF) в плазме крови, цитокины семейства фактора некроза опухолей и накопление CD-клеток с CD19+CD21low служат в качестве биомаркеров для РТПХ. Поэтому определение этих клеток и измерение их цитолитической активности против тканей хозяина были использованы для диагностики РТПХ.
Низкое содержание В-лимфоцитов в крови может быть признаком недостаточной продукции В-лимфоцитов в костном мозге у пациентов с хРТПХ и оРТПХ. Напротив, нарушение регуляции гомеостаза В-лимфоцитов со стойким высоким уровнем BAFF может вызвать усиленный рост некоторых субпопуляций В-клеток. У пациентов, у которых не развивается хРТПХ, повышенные уровни BAFF нормализуются через 6 месяцев, тогда как у пациентов с развивающимся хРТПХ они остаются очень высокими и позже. Наблюдаемое высокое соотношение BAFF/B-лимфоциты у пациентов с хРТПХ предполагает, что при дефиците B-лимфоцитов их аутореактивные клоны, которые в противном случае подвергались бы апоптозу, могли потенциально выживать из-за избытка BAFF, что, в свою очередь, могло бы способствовать развитию хРТПХ. Кроме того, было обнаружено, что повышенная активация В-лимфоцитов, аберрантная В-лимфоцитарная сигнализация и длительная выживаемость активированных В-лимфоцитов связаны с хРТПХ. Нарушение гомеостаза В-лимфоцитов может быть связано с повышенным или уменьшенным числом различных субпопуляций В-лимфоцитов во время хРТПХ. Greinix и коллеги сообщили о повышенном относительном числе CD19+CD21low B-лимфоцитов у пациентов с активным хРТПХ по сравнению с пациентами без хРТПХ в исследовании у 70 пациентов.
Кузьмина и ее коллеги исследовали, может ли число CD19+CD21low B-лимфоцитов предсказать результат экстракорпорального фотофереза (ECP), который используется как один из вариантов иммуномодулирующего лечения хРТПХ. Не ответившие на ECP пациенты имели значительно большее (p = 0,02) относительное число CD19+CD21low B-лимфоцитов (в среднем 22 %) в периферической крови до начала ECP, по сравнению с пациентами, достигшими полного ответа (CR) (в среднем 8 %) и частичного ответа (в среднем 16 %) после 6 месяцев терапии ECP. Эти данные свидетельствуют о том, что количество CD19+CD21low B-лимфоцитов может служить прогностическим клеточным биомаркером. Кроме того, пациенты с CR имели значительно более низкое относительное число CD19+CD21low B-лимфоцитов на 6-й, 12-й и 21-й месяц после начала ECP по сравнению с пациентами, у которых не было эффекта от ECP, подтверждая, что CD19+CD21low B-лимфоциты могут быть потенциальными клеточными биомаркерами для объективной оценки ответа в хРТПХ.
В исследовании с 227 пациентами Greinix и его коллеги подтвердили повышение количества CD19+CD21low B-лимфоцитов у пациентов с диагностированной хРТПХ.
По другим данным регуляторные B-лимфоциты (Breg) участвуют в патогенезе хРТПХ. Breg (CD19+IgM+CD27+ и CD19+CD24hiCD38hi) продуцируют интерлейкин-10 (IL-10). У пациентов с хРТПХ было обнаружено, что количество клеток Breg уменьшается и, следовательно, они меньше продуцируют IL-10 по сравнению с здоровыми донорами и реципиентами без хРТПХ.
CD4+CD25+Foxp3+ (Treg) играют незаменимую роль в поддержании толерантности после аллоТГСК. Плохое восстановление Treg после аллоТГСК коррелировало с последующим развитием хРТПХ. Кроме того, у пациентов с длительной хРТПХ отмечался дефицит Treg в крови. Эти результаты привели к вмешательствам, направленным на увеличение числа клеток Treg путем введения низких доз IL-2, что успешно подавило проявления хРТПХ. Исходя из этого, Treg можно рассматривать как диагностические и прогностические клеточные биомаркеры хРТПХ.
Greinix и коллеги сообщили, что количество CD4+CD45RA+ Т-лимфоцитов и CD4+CD45RA+CD31+ Т-лимфоцитов было значительно увеличено у пациентов с недавно диагностированной хРТПХ по сравнению с сопоставимой во времени группой пациентов без хРТПХ. Кроме того, эти подмножества Т-лимфоцитов у пациентов с развившимся хРТПХ относительно пациентов с неразвившейся хРТПХ при подсчете после 100 от проведения аллоТГСК также были значительно увеличены. Помимо этих субпопуляций Т-лимфоцитов, CD3+, CD56+, ,NK-, T-лимфоциты были значительно увеличены на 100 день после аллоТГСК у пациентов, у которых впоследствии развилась хРТПХ, что могло также служить в качестве прогностического клеточного биомаркера.
Растворимые биомаркеры
Белок теплового шока (Hsp70) в качестве биомаркера опухолей и РТПХ
Известно, что белки семейства Hsp70 играют важную роль в транспорте, фолдинге и денатурации белков, а также в индукции иммунных реакций. Обнаружено, что количество основного стресс-индуцируемого белка Hsp70 увеличивается при многих различных патологических процессах, включая воспалительные, аутоиммунные и опухолевые. Hsp70 также обнаружен на поверхности клеточной мембраны многих типов опухолевых клеток, включая аномальные лейкоциты. Этот белок прикрепляется к мембранам клеток через липидные молекулы. Кроме того, жизнеспособные опухолевые клетки, содержащие на своей мембране прикрепленные Hsp70, способны секретировать Hsp70 в кровоток в липидных везикулах — экзосомах. Поэтому экзосомальный Hsp70 служит в качестве опухолеспецифического биомаркера для жизнеспособной опухолевой массы. Функционально внеклеточные HSP как самостоятельно, так и в сочетании с антигенными пептидами играют важную роль в индукции воспалительных иммунных реакций. Помимо Hsp70 в составе липидной везикулы, Hsp70 может выделяться некротизированными и воспаленными тканями в виде свободной молекулы. Это означает, что основной стресс-индуцируемый Hsp70 секретируется в кровообращение либо живыми опухолевыми клетками в липидных везикулах (предположительно опухолевыми экзосомами), либо в качестве отдельных молекул из некротических и/или воспаленных тканей. При хРТПХ воспалительные реакции могут возникать в коже (77 %), легких (50 %), ротовой полости (63 %), печени (58 %), глазах (54 %), суставах (32 %), ЖКТ (20 %) и половых путях (16 %). Поэтому свободные Hsp70, антитела, направленные против высокого уровня Hsp70, мРНК, могут являться потенциально новыми молекулярными биомаркерами для диагностики и прогнозирования возникновения воспаления при хРТПХ. В качестве потенциальных маркеров для диагностики РТПХ помимо белков семейства Hsp70 рассматриваются и другие стрессовые белки.
В исследованиях на людях было обнаружено, что повышенные уровни антител против HSP70 и HSP90 связаны с развитием о/хРТПХ.
Связь тяжести заболевания РТПХ и экспрессии Hsp70 может быть объяснена иммуномодулирующей активностью Hsp70. На сегодняшний день в нескольких исследованиях сообщалось об участии Hsp70 в продуцировании провоспалительных цитокинов, таких как TNF- α, IL-1, IL-6 и IL-12, и секреции оксидов азота (NO) и хемокинов с помощью дендритных клеток, моноцитов и макрофагов. Более того, Hsp70 может активировать внутриклеточные сигнальные каскады, которые влияют на иммунорегуляторные функции иммунных клеток путем связывания через липидные молекулы Hsp70 с рецепторами на клеточной поверхности, такими как Toll-подобные рецепторы 2 и 4 (TLR2/4), скавенджер-рецептор CD36, связанный с рецептором к ЛПНП белок CD91, рецептор лектина C-типа LOX-1, скавенджер-рецептор SR-A и CD40. Через индукцию провоспалительных цитокинов Hsp70 способствует патогенезу аутоиммунных и различных хронических воспалительных заболеваний. Таким образом, Hsp70 активирует адаптивную и врожденную иммунные системы хозяина, инициируя «аллоиммунитет». Другой механизм иммунорегуляторной активности Hsp70 основан на его способности связываться с различными пептидами. Экзогенный Hsp70 может сопровождать и перекрестно представлять антигены и переносить их в антигенпрезентирующие клетки и, таким образом, стимулировать адаптивный иммунный ответ. Поэтому неудивительно, что экспрессия Hsp70 часто усиливается в аллотрансплантатах, что, в свою очередь, приводит к прогрессированию заболевания и отторжению аллотрансплантата.
Предполагается, что РТПХ можно лечить с помощью коррекции уровня Hsp70. В эксперименте на мышах получали снижение уровней Hsp70 путем введения 15-дезоксиспергуалина (DSG) — иммунодепрессанта, связывающегося с Hsp70, что значительно снижало смертность, связанную с РТПХ. Применение DSG уменьшало уровень Hsp70 в селезенке и лимфатических узлах, ингибировало продукцию анти-Hsp70 и уменьшало количество IL-2, IFN-γ, TNF-α и IL-10 в сыворотке крови.
В заключение можно отметить, что контроль уровня белка Hsp70 и/или анти-Hsp70 в сыворотке крови после аллоТГСК может служить диагностическим средством для прогнозирования начала РТПХ. Кроме того, генетическая или фармакологическая коррекция экспрессии Hsp70 может иметь терапевтический потенциал при лечении РТПХ.
Белковые маркеры для диагностики РТПХ
Для диагностики о/хРТПХ в различных исследованиях пытались использовать биомаркеры, содержащиеся в слюне и сыворотке крови. Исследования биомаркеров в слюне не дали каких-либо положительных результатов. Проведенные поиски биомаркеров для прогнозирования РТПХ в сыворотке крови (в исследованиях рассматривались различные белки: Reg-3α, ST2, sTNFR1) показали, что ни один из описанных на сегодняшний день белковых маркеров плазмы крови не может предсказать развитие РТПХ, но они могут помочь диагностировать оРТПХ, особенно оРТПХ в ЖКТ, и определить прогноз в очень ранний момент времени, когда клинические проявления еще скудны и не позволяют прогнозировать исход.
МикроРНК как биомаркеры для диагностики РТПХ
В течение последнего десятилетия в плазме крови и моче были обнаружены циркулирующие короткие одноцепочечные микроРНК. Интересно, что эти микроРНК оказались устойчивыми к РНКазе, кипячению, изменениям рН, продолжительному хранению и циклам замораживания-оттаивания. Функционально молекулы микроРНК рассматриваются как одна из основных групп регуляторов трансляции, обладающих способностью контролировать дифференцировку клеток крови и иммунные функции. Стабильность микроРНК в системном кровотоке может быть связана с тремя основными механизмами защиты от РНКазы: микроРНК могут быть связаны с защитными белками, такими как нуклеофосмин-1 (NPM1) и/или Argonaute 2 (Ago2), микроРНК может образовывать комплексы с липидами или липопротеинами, включая ЛПВП и ЛПНП, и микроРНК может быть инкапсулирована во внеклеточные липидные везикулы, такие как экзосомы. Комплекс микроРНК и этих белков и/или везикул позволяет селективно выделять микроРНК в кровоток и защищать их во внеклеточной среде. Циркулирующие микроРНК являются надежными биомаркерами различных заболеваний, включая аутоиммунные состояния, такие как ревматоидный артрит и системная красная волчанка, и опухоли. Ряд исследований также оценил связь между циркулирующими микроРНК и развитием РТПХ с многообещающими результатами.
Циркулирующие микроРНК могут быть обнаружены в биологических жидкостях при минимальных инвазивных вмешательствах с использованием относительно простых и точных технологий. Кроме того, циркулирующие микроРНК имеют преимущества перед биомаркерами на основе белков, поскольку они менее сложные, обнаруживаются в разных тканях или биологических средах и могут быть легко определены с использованием общих лабораторных методов.
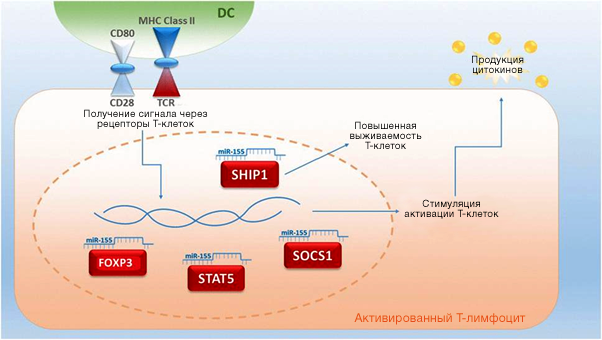
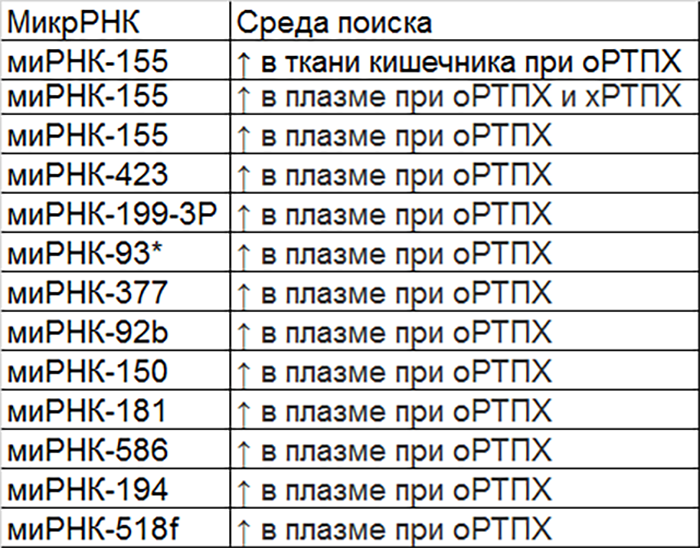
Хотя исследования микроРНК для диагностики РТПХ находятся в начальном состоянии, уже были получены данные, согласно которым ряд микроРНК может повышаться при РТПХ, как острой, так и хронической (микроРНК-155, микроРНК-423, микроРНК-199-3p, микроРНК-93 и микроРНК-377). Последние четыре микроРНК смогли предсказать оРТПХ через 6 недель после аллоТГСК, до появления симптомов. Исследования микроРНК-155 дали противоречивые результаты в отношении его использования в качестве биомаркера, хотя уровень микроРНК-155 у больных с РТПХ достоверно повышался. Применение ингибиторов микроРНК-155 снижало тяжесть заболевания и увеличивало выживаемость.
В других исследованиях было изучено множество циркулирующих микроРНК (микроРНК-181, микроРНК-92b, микроРНК-586, микроРНК-194 и др.), многие из них как биомаркеры для РТПХ показывают большие перспективы (табл. 1), но эти исследования все еще находятся в зачаточном состоянии. Требуется подтверждение результатов независимыми научными группами, и это осложняется различиями в схемах лечения и профилактики, используемых в разных клинических центрах. Сотрудничество между группами позволит стандартизировать протоколы и технологии, что может существенно повлиять на воспроизводимость результатов и является вероятным объяснением отсутствия согласованности в результатах на сегодняшний день. Ожидается, что в течение следующих нескольких лет по мере увеличения количества исследований в качестве биомаркеров для диагностики и прогнозирования РТПХ будут предложены и подтверждены конкретные модели микроРНК.
Таблица 1. МикроРНК, повышение уровня которых отмечалось при оРТПХ.
Источник:
Juric M. K. et al. B-cell-based and soluble biomarkers in body liquids for predicting acute/chronic graft-versus-host disease after allogeneic hematopoietic stem cell transplantation //Frontiers in immunology. – 2017. – Т. 7. – С. 660.
