Формирование противоопухолевой активности естественных киллеров с помощью культивирования ex vivo

Естественные киллеры (NK) являются перспективным инструментом для использования в адоптивной (от англ. adopt — принимать) иммунотерапии, так как они эффективно распознают и убивают опухолевые клетки. В этом контексте культивирование ex vivo служит привлекательным вариантом для увеличения численности NK и усиления их противоопухолевого потенциала при клиническом применении. Были разработаны различные стратегии культивации NK для адоптивной иммунотерапии. В этом обзоре собраны различные подходы к культивированию NK и влияние этих способов на формирование их противоопухолевой активности.
Сейчас для культивирования и расширения возможностей естественных киллеров используются интерлейкины: IL-2, IL-12, IL-15, IL-18 и IL-21. Выбор соответствующей комбинации цитокинов — важный фактор, непосредственно влияющий на созревание, пролиферацию, выживаемость, распределение субпопуляций, активацию и функционирование NK. Важно отметить, что цитокины могут регулировать экспрессию некоторых активирующих рецепторов на NK, тем самым увеличивая их чувствительность к опухолевым клеткам, которые экспрессируют соответствующие лиганды. Помимо использования цитокинов, для культивирования NK с выраженным влиянием на активацию и их экспансию используют кокультивацию с аутологичными вспомогательными клетками, не являющимися NK, или добавляют рост-инактивированные фидерные клетки. Кроме того, культивирование ex vivo использовалось для уничтожения опухолевых клеток, которые ранее были устойчивы к атаке NK. Часто у онкологических больных NK-лимфоциты не выполняют своих функций, например, за счет подавления активирующих их рецепторов или ослабления противоопухолевой активности. В таком случае культивирование ex vivo может быть полезно для активации и улучшения противоопухолевых свойств NK для преодоления иммуносупрессии. Этот обзор обобщает современные знания о модуляции активности естественных киллеров с помощью различных стратегий культивирования ex vivo, направленных на повышение цитотоксичности NK для клинического применения при злокачественных заболеваниях.
Введение
В качестве важной части врожденной иммунной системы естественные киллеры (NK) рассматриваются как первая линия защиты от опухолевых клеток. Человеческие NK морфологически являются крупными гранулярными лимфоцитами с поверхностным маркером CD56. Существует две основных популяции NK: субпопуляция CD56highCD16neg, имеющая преимущественно иммуномодулирующую функцию, в основном осуществляемую путем секреции интерферона IFN-γ и субпопуляцию CD56lowCD16pos с прямым цитотоксическим действием. Активация NK основана на сбалансированной системе, объединяющей сигналы от активирующих и ингибирующих рецепторов. Ингибирующие сигналы эти лимфоциты получают в основном от иммуноглобулиноподобных рецепторов (KIR). Лиганды ингибирующих KIR в составе молекул первого класса главного комплекса гистосовместимости человека (MHC I) высоко экспрессируются здоровыми клетками и тем самым предотвращают активацию NK. Злокачественные клетки часто не имеют молекулы МНС I на их поверхности, а так как сигналы от активирующих рецепторов преобладают, NK становятся активными и реагируют на встреченные мишени.
NK также могут быть активированы сверхэкспрессией индуцированных стрессом поверхностных лигандов на инфицированных или опухолевых клетках, которые распознаются активирующими рецепторами, такими как рецепторы естественной цитотоксичности (NCR) NKp30, NKp44 и NKp46, и т. д. В этом случае активирование сигналов нарушает подавление собственных сигналов и приводит к активации NK. Кроме того, естественные киллеры активируются после взаимодействия с покрытыми антителами мишенями для CD16, который связывается с Fc-фрагментом антител и опосредует сильный активирующий сигнал. С помощью активирующих и ингибирующих рецепторов NK, в отличие от Т- и В-лимфоцитов, могут немедленно реагировать без предварительного введения прайминга или антигена.
Активированные NK выполняют свои функции через различные механизмы. Прямая цитотоксичность осуществляется с помощью экзоцитоза с высвобождением цитотоксических гранул, которые содержат гранзимы и перфорин, что приводит к лизису клетки-мишени. Кроме того, NK индуцируют апоптоз клеток-мишеней путем экспрессии лигандов рецепторов смерти, таких как лиганд, индуцирующий апоптоз (Fas) или один из факторов некроза опухоли (TRAIL). Получение и высвобождение IFN-γ NK-клетками после активации также влияет на опухоль, поскольку IFN-γ ингибирует ангиогенез в опухоли, обладает антиметастатической активностью и действует проапоптотично.
Способность опухолевых клеток обходить иммунный ответ является основной предпосылкой для формирования и прогрессирования рака. В рамках «иммунного редактирования» опухоли подвергаются генетическим, эпигенетическим и фенотипическим изменениям, тем самым становясь гетерогенной клеточной популяцией, которая не только не обнаруживается, но и не может быть уничтожена иммунными клетками из-за снижения контроля над опухолевыми антигенами и лигандами рецепторов естественных киллеров. Кроме того, злокачественные клетки подавляют NK, блокируя NKG2D-рецептор путем сбрасывания NKG2D-лигандов или повышая активность MHC I. Иммуносупрессивные цитокины, такие как трансформирующий фактор роста-β, IL-10 или иммуносупрессивные ферменты, такие как индоламин-2,3-диоксигеназа, дополнительно ухудшают противоопухолевые ответы NK пациентов с раком.
Таким образом, модуляция рецепторов NK ex vivo потенциально может помочь в преодолении ингибирования иммунного ответа. В ряде исследований сообщалось о повышении активности рецепторов DNAM-1, NKG2D и других NK-активирующих рецепторов в определенных условиях культивирования, в основном связанных со стимуляцией с помощью IL-2. Кроме того, другие IL, такие как IL-12, IL15, IL-18 или IL-21 и IFN типа I, формируют профиль экспрессии рецепторов NK.
Естественные киллеры могут играть важную роль в клеточной иммунотерапии, а парентеральное введение NK-лимфоцитов представляет собой привлекательную стратегию лечения больных раком. В этом контексте культивация NK для их клинического применения не только необходима для увеличения количества вводимых пациенту клеток, но также позволяет предварительно активировать и модифицировать их противоопухолевые свойства. Для культивирования ex vivo NK из разных источников могут стимулироваться различными цитокинами и, чтобы достичь эффективных скоростей размножения, NK культивируют среди аутологичных вспомогательных клеток или вместе с различными типами инактивированных аутологичных или аллогенных фидерных клеток. Помимо прочего, генетически можно воздействовать на NK ex vivo для дальнейшего увеличения их противоопухолевой активности, например, для интеграции рецепторов химерных антигенов против различных опухолевых антигенов. В этом обзоре рассмотрены варианты культивирования NK без генетических модификаций. Существует много разных протоколов экспрессии NK ex vivo, имеющих разные особенности и возможности. Здесь приведен всесторонний обзор схем получения соответствующих количеств функциональных естественных киллеров, исходные системы материалов и культур, а также использование цитокинов, фидерных клеток и других добавок.
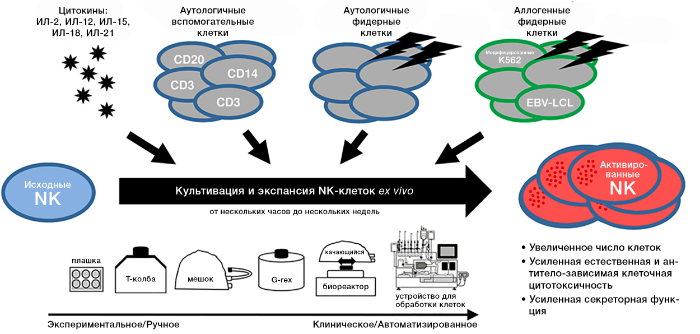
Рисунок 1. Использование различных механизмов активации и культивации NK клеток для усиления противоопухолевой активности.
Исходный материал для экспансии NK и роль чистоты NK
В настоящее время основным источником для культивирования NK в целях последующего клинического использования являются клетки периферической крови. Чистота изолята NK, то есть их количество по отношению к другим клеткам, является важным фактором для успеха последующего терапевтического применения. Для ex vivo кокультивации NK часто используют смесь мононуклеаров периферической крови (PBMC), тем самым избегая дальнейшей очистки. В то время как культивирование NK среди других вспомогательных клеток является практической стратегией для культивации аутологичных клеток, это может иметь решающее значение при использовании аллогенных клеток, поскольку не-NK-клетки могут вызывать нежелательные побочные эффекты. Аллореактивные T-клетки являются основным фактором риска для пациента, поскольку они опосредуют реакцию «трансплантат против хозяина» (РТПХ), тяжелое осложнение после аллогенной трансплантации гемопоэтических стволовых клеток (ТГСК). Кроме того, полученные чужеродные B-клетки могут приводить к В-клеточному лимфопролиферативному расстройству после реактивации инфекции вирусом Эпштейна-Барр (EBV). Таким образом, очистка NK необходима и в настоящее времени реализована в большинстве клинических протоколов путем магнитной сепарации клеток, последующего истощения CD3-экспрессирующих и обогащения CD56-экспрессирующих лимфоцитов.
Экспансия клеток NK с цитокинами
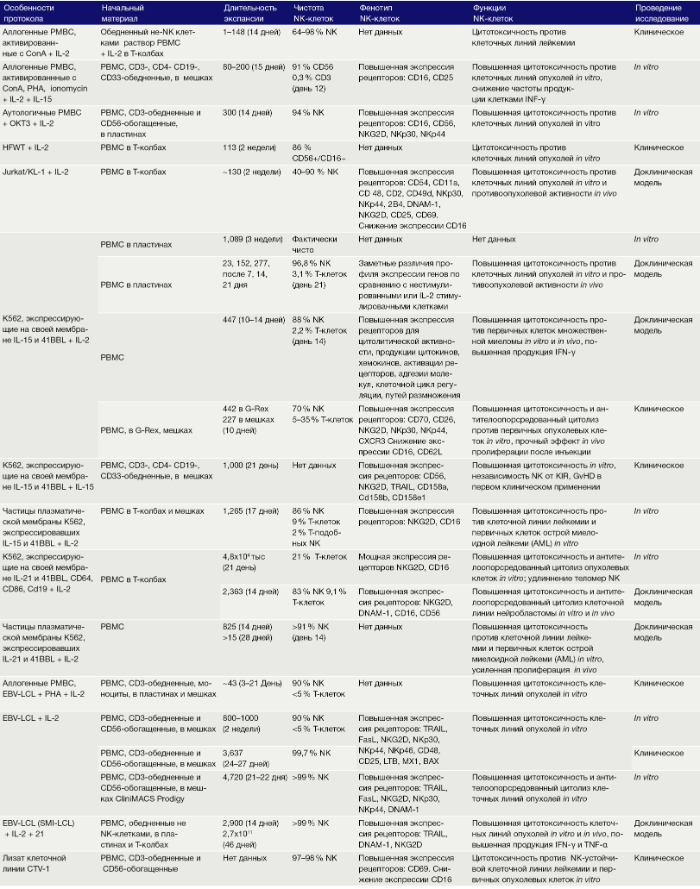
Цели культивации NK ex vivo — это усиление естественной цитотоксичности и самонаведения на опухолевые участки при поддержании «собственной» защиты. Исследования, проведенные с цитокин-стимулированными NK или РВМС, показали безопасность этого подхода и клинические ответы на адоптивный перенос NK после ТГСК. В следующем параграфе авторы описывают различные протоколы культивации NK ex vivo, начиная с очищенных NK (Табл. 1) или PBMC (Табл. 2). Концепции использования цитокинов в присутствии инактивированных фидерных клеток будут рассмотрены в последующих разделах этого обзора.
Таблица 1. Культивирование ex vivo очищенных NK клеток только с цитокинами.
Открыть таблицу в отдельной вкладке
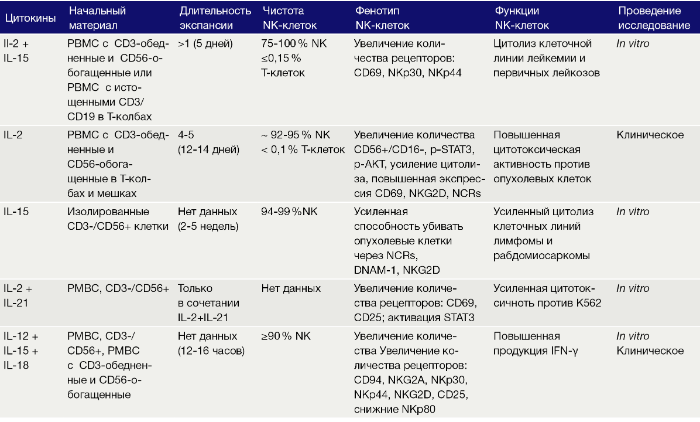
Таблица 2. Культивирование ex vivo NK клеток совместно со вспомогательными клетками.
Открыть таблицу в отдельной вкладке
Роль IL-2
В начале 1980-х годов исследователи из Розенберга показали, что NK, активированные интерлейкином-2 (лимфокин-активированные клетки — LAK), способны атаковать аутологичные свежие опухолевые клетки. В первых клинических испытаниях с использованием клеток LAK и терапии IL-2 клинический ответ не превышал эффективность монотерапии IL-2.
В течение последующих 20 лет исследований было выяснено, что NK играют важную роль в регулировании баланса между эффектом «трансплантат против лейкемии» (РТПЛ) и реакцией «трансплантат против хозяина» (РТПХ) после аллогенной трансплантации гемопоэтических стволовых клеток, особенно гаплоидентичных ГСК, демонстрируя повышенную противоопухолевую активность, избегая при этом РТПХ. Продукт лейкофереза, из которого удалили клетки CD3+ и добавили клетки CD56+, культивировали в среде, содержащей IL-2 (1000 Ед/мл) сроком до 2 недель, что давало экспансию 0,1–3 × 109 CD56+ NK, иногда достаточных для множественных инфузий пациентам с гемобластозами. Медиана расширения NK была пятикратной, а медиана чистоты NK составила > 94 % при загрязнении < 0,1 % T-клеток. Стимуляция ex vivo c IL-2 индуцировала повышенную секрецию цитокинов клетками NK, усиление внутриклеточной сигнализации STAT3/AKT и усиление регуляции различных NCR и nkg2d-рецепторов. Во всех случаях LAK демонстрировали гораздо более высокую цитотоксическую активность в отношении клеток-мишеней K562 (клеточная линия хронической миелогенной лейкемии) по сравнению с нестимулированными NK.
Кроме того, после криоконсервации и оттаивания LAK демонстрировали умеренную и высокую жизнеспособность при активации IL-2, тогда как жизнеспособность нестимулированных NK была низкой. В 2004 и 2005 гг. клинические исследования с использованием активированных IL-2 донорских NK осуществлялись параллельно в Европе и США. Эффективность была получена в отношении ряда опухолевых заболеваний: Миллер и его коллеги использовали IL-2 с гаплоидентичными NK для лечения 43 пациентов с распространенным раком, причем 19 из них страдали острым миелоидным лейкозом, а затем исследовали эффективность этого подхода у пациентов с раком яичников и молочной железы и В-клеточной неходжкинской лимфомой. Важно отметить, что авторы сообщили о персистенции in vivo и даже экспансии аллореактивных донорских NK у пациентов, предварительно получавших высокую дозу подготовительного режима, состоящего из 5 дней внутривенного введения 60 мг/кг циклофосфамида и 25 мг/м² внутривенного флударабина. Следует отметить, что успешное приживление LAK зависело от режима предварительного лечения пациентов, который также отвечал за повышенные концентрации IL-15 в плазме крови. Кроме того, обнаружена персистенция in vivo донорских LAK на 7-е сутки после инфузии и успешная экспансия in vivo (более 100 донорских LAK на микролитр крови пациента через 14 суток после инфузии), которые коррелируют с клиренсом лейкоза. Экспансия же регуляторных Т-клеток хозяина ассоциировалась с низким числом LAK.
Параллельно Koehl с соавт. сообщили о трех педиатрических пациентах с многократно рецидивирующим лейкозом. Несмотря на персистенцию бластных клеток после первичной ТГСК, повторные переливания LAK после гаплоидентичной ТГСК привели к стойкой ремиссии, сохраняющейся от нескольких недель до нескольких месяцев. В следующем клиническом исследовании они также продемонстрировали небольшое клиническое преимущество у пациентов с различными злокачественными новообразованиями, получающих LAK по сравнению с пациентами, получающими только покоящиеся NK. Интересно, что LAK, в отличие от нестимулированных NK, способствовали изменению распределения субпопуляций лейкоцитов в периферической крови. Между тем, безопасность и целесообразность использования LAK для адоптивной иммунотерапии были продемонстрированы в различных клинических исследованиях, которые были обобщены в недавнем обзоре Koehl с соавт.
Влияние IL-15 на экспансию NK
Активность NK-клеток может зависеть не только от IL-2. Цитокин IL-15 может быть более предпочтительным для лечения рака, поскольку он ингибирует гибель NK, вызванную активацией, и считается безопасным. Кроме того, по сравнению с IL-2, IL-15 приводит к более устойчивой противоопухолевой способности NK. Однако непрерывное влияние IL-15 на NK вызывает их функциональное истощение за счет снижения окисления жирных кислот, что приводит к снижению цитотоксичности in vitro и снижению действия на опухоль in vivo. Таким образом, оптимальное дозирование и время культивирования с IL-15 имеет решающее значение для активации NK ex vivo. Очищенные NK после экспансии с использованием IL-15 проявляют повышенный цитолиз с помощью рецепторов NCR и CD69 лейкозных и всех бластных клеток. Повышенная цитотоксичность IL-15-стимулированных NK против лейкемии и линий рабдомиосаркомы можно отнести на счет NCR, DNAM-1 и NKG2D. Использование IL-15 для экспансии NK из обогащенных CD56 со смесью мононуклеаров периферической крови (PBMC) в течение 20 дней приводило к 23-кратному увеличению популяции CD3-CD56+ NK с конечной чистотой около 98 %. Естественные киллеры, полученные с использованием последнего протокола, были хорошо перенесены 15 пациентами с немелкоклеточным раком легкого в фазе I клинических испытаний с применением двух-четырех доз 0,2–29×106 NK/кг, что свидетельствует о безопасности применения этой комбинации.
IL-21 усиливает эффекторные функции NK
Цитокин IL-21 в комбинации с IL-2 или IL-15 используют в некоторых протоколах для стимуляции NK. IL-21 принадлежит к семейству IL-2 и сигнализирует через гетеродимер, состоящий из общей γ-цепи и α-цепи рецептора IL-21. Активированные CD4+ Т-клетки являются основными продуцентами IL-21, который влияет на многие типы клеток, экспрессирующих рецептор к IL-21, включая NK. IL-21 играет роль в развитии NK из костномозговых предшественников, он необходим для их функционального созревания, но IL-21, как известно, вызывает апоптоз NK, что приводит к более короткому сроку их жизни in vitro. Таким образом, время воздействия IL-21 на NK оказывается критическим. Помимо влияния на пролиферацию NK, IL-21 усиливает эффекторные функции NK, включая секреторные и цитотоксические функции, а также усиленные ответы антителозависимой клеточно-опосредованной цитотоксичности (АЗКЦТ). Культивирование CD3-обедненной смеси с PBMC в течение 13–20 дней с IL-21 и IL-15 без дополнительных фидерных клеток позволило получить активированные NK с чистотой > 90 %, которые были применены в клинических испытаниях с участием 41 пациента с лейкемией, они получали инфузии донорских NK через 2–3 недели после ТГСК. Несмотря на то, что экспансия NK была слабой в этих условиях (в 3,7 раза), они обладали сильной цитотоксической активностью против первичных бластов костного мозга перед трансплантацией, и инфузии с медианной дозой 2×108 NK/кг хорошо переносились и коррелировали с снижением прогрессирования лейкемии по сравнению с контрольной группой.
IL-12/15/18 Индуцированные клетки NK
Интерлейкин-12 был первоначально выявлен как NK-стимулирующий фактор, индуцирующий пролиферацию, усиленную цитотоксичность и продукцию IFN-γ NK-клетками при культивировании в смеси с PBMC. IL-12 продуцируется дендритными клетками (ДК), макрофагами и В-клетками, а его рецептор состоит из двух субъединиц (α и β), которые опосредуют передачу сигналов через члены семейства JAK-STAT. IL-2 усиливает ответ NK на действие IL-12, увеличивая экспрессию рецептора к IL-12 и STAT4, что является важным фактором для чувствительности к IL-12. Кроме того, было обнаружено, что IL-12-опосредованное образование IFN-γ NK-клетками требует прайминга с IL-18, который, в свою очередь, усиливает пролиферацию NK, индуцированную IL-15. Из-за синергических эффектов разумно комбинировать различные цитокины для стимуляции ex vivo NK. Особый интерес вызвала комбинация IL-12, IL-15 и IL-18, поскольку она создает так называемые «клетки, индуцированные цитокинами» (CIML) NK, которые проявляют повышенную способность продуцировать IFN-γ и при повторной стимуляции в более позднее время. Важно отметить, что этот ответ памяти передается потомству таких клеток и поддерживается до нескольких месяцев. Кроме того, адоптивный перенос клеток CIML NK имел явную противоопухолевую активность против меланомы или лимфомы in vivo, для чего требовался IL-2 из CD4+ T-клеток. IL-12, IL-15 и IL-18 вместе индуцируют повышенную экспрессию CD25, что делает клетки CIML NK чувствительными к низким концентрациям IL-2 in vitro и in vivo. Таким образом, существует четкое обоснование применения адоптивного переноса экспрессированных ex vivo клеток CIML NK вместе с инъекциями IL-2 в качестве комбинированной терапии. Недавно клетки CIML NK совместно с применением низких доз IL-2 были использованы в I фазе клинических исследований на человеке, клинический ответ наблюдался у пяти из девяти пациентов.
Аутологичные вспомогательные клетки и аутологичные фидерные клетки для экспансии NK
Хотя цитокины эффективно активируют NK и усиливают их функции, одних только цитокинов не хватает для достаточной экспансии ex vivo (табл. 1). Следовательно, в дополнение к активации цитокинами можно использовать стимуляцию аутологичными вспомогательными клетками для дальнейшей экспансии NK и преодоления барьера, ограничивающего количество NK, в целях дальнейшей адоптивной терапии NK-клетками (табл. 2). Созревание NK в среде из РВМС более эффективно, чем культивирование чистых NK, поскольку другие типы клеток обеспечивают дополнительные факторы для пролиферации NK. CD14+ клетки, например, усиливают пролиферацию NK ex vivo через прямой контакт клеток и растворимые факторы. После активации, например, конканавалином А, Т-клетки также вызывают пролиферацию NK.
Стимуляция NK совместно с PBMC, IL-2 и анти-CD3-антителами OKT-3 приводит к их активной экспансии, вероятно, путем активации Т-клеток, и это используется в нескольких клинических протоколах для культивирования NK. Тем не менее, начало культивирования в PBMC идет вместе с обширным сосуществованием нежелательных CD3+/CD56- T-клеток и CD3+/CD56+ NK-подобных T (NKT) клеток, которые составляют большинство клеток в конечном клеточном продукте. Тем не менее, инфузия этого гетерогенного клеточного продукта без удаления потенциально аллореактивных Т-клеток не вызывала побочных эффектов, таких как РТПХ, в исследовании безопасности применения с пятью онкологическими больными. Это можно объяснить тем, что Т-клетки могут потерять свою аллореактивность во время экспансии ex vivo. Таким образом, низкая чистота NK может быть менее критичной для долгосрочных культивируемых клеточных продуктов по сравнению с NK, непосредственно полученными от донора, но для доказательства этой гипотезы необходимо больше клинических данных. Следует отметить, что этот подход также позволяет получить эффективную экспансию функциональных NK, полученных от пациентов с хроническим B-клеточным лимфолейкозом и миеломной болезнью, что позволяет проводить терапию аутологичными NK и дополнительно избегать возможные риски безопасности терапии с использованием донорских клеток.
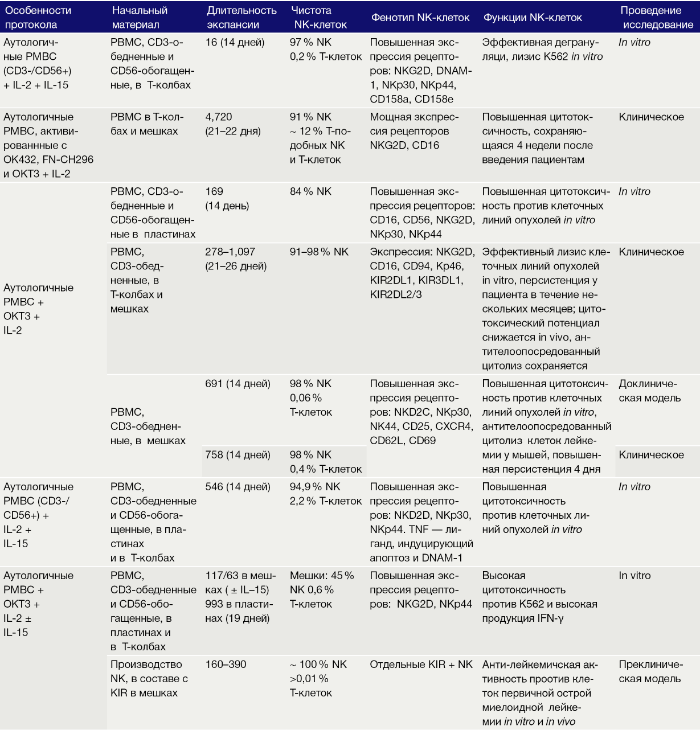
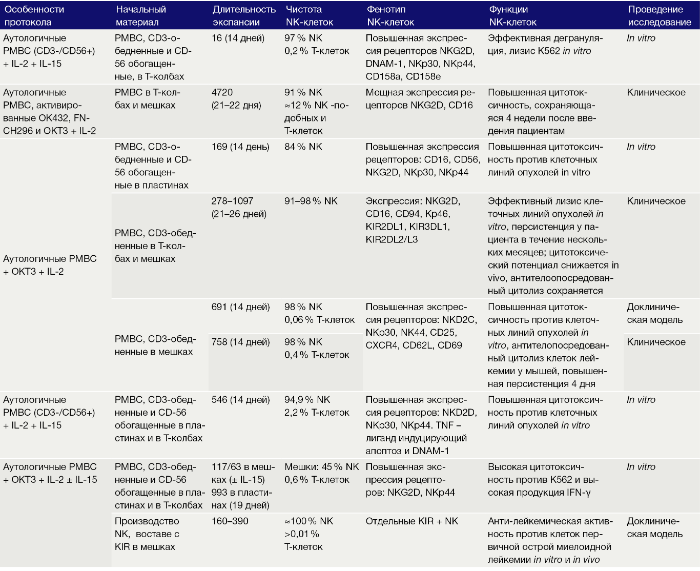
Смесь PBMC, обогащенная клетками CD56, вместе с соответствующим не-CD56-PBMC в соотношении 1:1 дает 89-кратную экспансию NK с конечным продуктом, состоящим из 92 % NK через 21 день. Альтернативно, добавление облученных аутологичных РВМС в культуру представляет собой стратегию использования этих «фидерных клеток» для активации и экспансии NK, но позволяет избежать их совместной экспансии (табл. 3). Следует отметить, что термин «фидерные клетки» используется авторами для всех инактивированных клеток, которые добавляются в культуру, тогда как кокультурные не-NK-клетки, которые не инактивированы, определяются как «вспомогательные клетки». Помимо инактивации размножения, облучение может вызывать усиление регулирующих способностей клеток РВМС при помощи поверхностных молекул, таких как ULBP1-3, которые дополнительно усиливают активацию NK, например, через рецептор NKG2. Тем не менее облученные аутологичные РВМС индуцируют только слабую пролиферацию NK без дополнительной активации фидерными клетками (16-кратная экспансия в течение 2 недель). Облучение аутологичных РВМС, ранее активированных IL-2, ОКТ-3 и Ретронектином, позволяет через 4 недели вызывать увеличение популяции NK в 4720 раз, с чистотой NK 91 %. Чтобы получить более чистый конечный продукт с 98 % NK, можно начать культивировать с уже CD3-обедненными PBMC и добавить облученные аутологичные РВМС в качестве питающих клеток вместе с IL-2 и OKT-3. Наивысшая чистота может быть достигнута путем магнитной сепарации клеток. Как продемонстрировано Siegler с соавт., GMP-совместимые (соответствующие европейским стандартам качества применения лекарственных препаратов) и качественно очищенные одиночные клетки KIR+NK могут достигнуть экспансии в 160–390 раз за 19 дней с помощью IL-2, IL-15, OKT-3 и облученных аутологичных РВМС.
Таблица 3. Культивирование ex vivo NK клеток с аутологичными фидерными клетками.
Открыть таблицу в отдельной вкладке
Экспансия NK с помощью аллогенных фидерных клеток
Использование облученных аллогенных клеток в качестве фидерных клеток является еще одним вариантом стимуляции экспрессии NK ex vivo (Табл. 4). По сравнению с аутологичными РВМС, аллогенные РВМС могут быть еще более эффективными в качестве вспомогательных клеток для стимуляции NK. В исследовании экспансии NK у пациентов с генерализованными лимфомами или с терминальными стадиями солидных опухолей, при использовании облученных аллогенных фидерных клеток здоровых доноров удалось достичь 300-кратная экспансии NK, тогда как при использовании аутологичных фидерных PBMC этот показатель составил лишь 169 раз. Кроме того, в то время как количество аутологичных фидерных клеток ограничено, так как они должны быть получены непосредственно от пациента, для аллогенных фидерных клеток можно использовать клеточные линии. Клеточные линии могут быть легко выращены до достаточного количества, а с целью экспансии NK-лимфоцитов можно использовать большой количество различных клеточных линий, таких как HFWT, K562, RPMI 1866, Daudi, KL-1, MM-170 и различные EBV-трансформированные лимфобластоидные клеточные линии (EBV-LCL).
Таблица 4. Культивирование ex vivo NK клеток с аллогенными фидерными клетками.
Открыть таблицу в отдельной вкладке
Культивирование PBMC вместе с клеточной линией опухоли Вильмса (HFWT) и IL-2 приводит к значительной экспансии NK, и интересно, что при этом условии NK возникают не только из зрелых CD3-/CD56+ NK, но также из CD3-/CD14-/CD19-/CD56-NK-предшественников, экспрессирующих CD122. В 2004 году ранние клинические данные показали, что адоптивный перенос аутологичных NK, продуцируемых кокультурой с облученным HFWT, безопасен, а пациенты с рецидивирующей злокачественной глиомой частично ответили на лечение.
Другим преимуществом клеточных линий является то, что относительно легко генетически модифицировать их и интегрировать дополнительные факторы для стимуляции NK. В последние годы были использованы модифицированные клетки K562 (хронической миелогенной лейкемии), такие как K562, экспрессирующие мембранные IL-15 и 4-1BBL (K562-mb15-4-1BBL). В то время как немодифицированные K562 индуцируют слабую пролиферацию NK (увеличение клеток NK в 2,5 раза за 1 неделю), с K562-mb15-4-1BBL число NK может быть значительно увеличено от 20 до 1000 раз за 1–3 недели. Кроме того, стимуляция NK с помощью K562-mb15-4-1BBL показала, что NK действительно обладают значительным пролиферативным потенциалом ex vivo — максимальная экспансия NK составила 5,9×104 раз. NK-лимфоциты, полученные с помощью K562-mb15-4-1BBL, демонстрируют повышенную естественную цитотоксичность против нескольких аллогенных и аутологичных опухолей in vitro, эффективно опосредуют АЗКЦТ и проявляют противоопухолевую эффективность в моделях ксенотрансплантата мыши для лечения саркомы и миеломы. Следует отметить, что в клиническом исследовании, оценивающем адоптивный перенос K562-mb15-4-1BBL после ТГСК, острая РТПХ произошла у пяти из девяти пациентов, хотя доноры были полностью совместимы по HLA, а дозы инъецированных NK и котрансперфицированных Т-клеток были низкими (1–10×106 и ≤ 2×104/кг). Эти наблюдения предполагали, что острая РТПХ опосредуется Т-клетками, но NK, по-видимому, могут оказывать косвенное влияние на этот тяжелый побочный эффект. Важно отметить, что в другой группе использовали NK, полученные после экспансии с использованием аналогичного варианта K562, экспрессирующего 4-1BBL и IL-15 в другом режиме лечения, и не наблюдали РТПХ, хотя вводили до 1×108 NK/кг.
Кроме того, Денман и его коллеги обнаружили, что K562, экспрессирующий 4-1BBL и мембранный IL-21 вместо IL-15, еще более эффективен для экспрессии NK ex vivo, и еженедельная рестимуляция этой клеточной линией поддерживает длительную пролиферацию NK в течение нескольких недель. В кокультуре с K562, экспрессирующими мембранные формы IL-21 и 4-1BBL, NK показывают увеличенную длину теломер и улучшенную активацию сигнального пути STAT-3, что объясняет данный эффект для экспансии NK в течение длительного времени. Адоптивный перенос этих NK, после стимуляции их K562-mb21-4-1BBL, в экспериментах на мышах, улучшал выживаемость животных, что указывает на терапевтический эффект таких NK.
Стимулирующий эффект клеточной линии EBV-LCL на пролиферацию NK был обнаружен более 30 лет назад. В 1994 году раннее клиническое испытание уже оценило адоптивный перенос аутологичных NK, культивируемых совместно с клеточной линией LAZ 388, для лечения 10 пациентов с метастатической аденокарциномой почек. Совсем недавно клеточные линии TM-LCL и SMI-LCL были зарегистрированы для экспансии NK, что позволило примерно в 800 раз увеличить число NK с высокой степенью чистоты в течение 2 недель. NK, полученные с помощью EBB-LCL-фидерных клеток, в настоящее время применяются в исследовании, которое тестирует их на аутологичный адоптивный с предполагаемыми дозами до 1×109 NK/кг. Недавно сообщалось, что повторная стимуляция SMI-LCL в среде, содержащей IL-2, и добавление IL-21 только в начале культивирования дает возможность 1011-кратной экспансии NK через 6 недель. Это наиболее эффективный протокол для экспансии NK в настоящий момент. NK, полученные с помощью последнего метода, являются высокоцитотоксичными in vitro, демонстрируют устойчивую высокую продуктивность IFN-γ и TNF-α, аналогичную клеткам CIML NK, и эффективно контролируют меланому в экспериментах на мышах.
Хотя фидерные клетки и, в частности, аллогенные линии фидерных клеток, позволяют генерировать значительное количество NK для адоптивной терапии, эта стратегия имеет недостатки, поскольку линии фидерных клеток должны быть безопасны для пациентов. Квалификация клеточной линии модифицированных клеток K562, например, включает дорогостоящие вирусологические тесты и анализы, проверяющие клетки на отсутствие бактериального и микоплазменного загрязнения. В этом контексте лизаты из клеточных линий, содержащих NK-стимулирующие факторы, могут быть альтернативой интактным фидерным клеткам для сведения к минимуму проблем безопасности. Праймирующий эффект лизата клеточной линии лейкоза CTV-1 на NK является независимым от KIR и не требует добавления цитокинов, таких как IL-2 или IL-15, что делает его уникальным подходом для активации NK. В Британском исследовании NK, культивированные с лизатом CTV-1, применяли в первой фазе клинических исследований для лечения лейкоза, с положительным эффектом у четырех из семи пациентов и отсутствием явлений токсичности, связанной с инфузией NK.
Другим шагом вперед с регулятивной точки зрения может быть добавление только определенных фрагментов фидерных клеток в культуру, которые ответственны за активацию NK, вместо использования интактных фидерных клеток или их лизатов. Следует отметить, что экспансия NK ex vivo с IL-2 и частицами плазматической мембраны, полученными из экспрессирующих K562-mb15-4-1BBL, по скорости экспансии сравнима со стимуляцией интактными питающими клетками и намного лучше, чем стимуляция с помощью раствора IL-15, 4-1BBL и IL-2. Частицы плазменной мембраны из K562, экспрессирующие мембранно-связанные IL-21 и 4-1BBL, также взаимодействуют с NK ex vivo и могут быть вариантом экспансии NK in vivo, что уже было доказано в экспериментах на мышах.
Технические аспекты культивации NK-клеток
В этом разделе описываются технические аспекты экспансии NK, начиная от простых Т-колб, в которых культивируют клетки для маленьких экспериментов, до стандартизированных и автоматизированных систем для масштабного клинического применения. Выбор адекватной системы культивирования основан на предполагаемом применении клеток. Авторы большинства доклинических экспериментальных исследований выращивают NK в Т-колбах. Они очень удобны для тестирования и сравнения различных культуральных добавок параллельно, например, с различными концентрациями цитокинов. Однако для клинических применений в больших масштабах культивирование в чашках и колбах неуместно по разным причинам. Во-первых, из-за небольшого объема Т-колб, одновременно нужно использовать большое их количество, например, для лечения одного пациента необходимо 51 Т-колбы. Кроме того, T-колбы должны время от времени открываться для смены питательной среды или сбора клеток, что может привести к загрязнению клеточного продукта. Хотя вероятность заражения для каждой Т-колбы сводится к минимуму работой в специальных стерильных шкафах, потенциальный риск зависит от количества колб.
Чтобы преодолеть недостатки малых объемов для культивирования клеток, экспансию NK часто проводят в мешках для клеточных культур, что позволяет работать с большими объемами в закрытой системе, так как все требуемые этапы могут быть выполнены путем соединения труб в стерильных условиях для создания возможности последующего переноса сред, сбора клеток и т. д. К сожалению, в разных отчетах описывается, что эффективность экспансии NK снижается после перехода протокола из T-колб в более крупный масштаб в мешки для клеточных культур. Кроме того, системы мешков по-прежнему требуют нескольких трудоемких вмешательств во время экспозиции, особенно когда разные культуры устанавливаются параллельно.
Другой системой являются колбы G-Rex, которая позволяет избежать частых этапов обработки для обмена сред во время культивирования. В отличие от обычных клеточных культуральных колб, дно G-Rex обладает высокой газопроницаемостью, обеспечивая оптимальный обмен CO2 и подачу O2 для клеток. Таким образом, по своей конструкции колбы G-Rex могут быть заполнены непосредственно большим количеством клеточной культуры, и смена питательной среды не требуется в течение длительного времени. Для экспансии NK использовали систему G-Rex в течение 10 дней без манипуляций с клетками или их кормления, что приводило к более высокому эффективному размножению NK по сравнению с мешками для клеточной культуры. К сожалению для получения больших количеств клеток в целях клинических испытаний все еще требуются несколько колб G-Rex, громоздких и дорогостоящих, при этом они по-прежнему являются открытой системой и могут потребовать адаптации к замкнутой системе.
Автоматизированные системы должны сочетать возможность сокращения вмешательств во время культивации с закрытостью системы. Автоматизация производства клеток гарантирует постоянное качество продукции без необходимости в высококвалифицированных специалистах, а также в конечном итоге экономит средства, что делает клеточную терапию доступной за пределами специализированных академических центров. В последнее время различные исследователи сообщают об автоматизированных процедурах экспансии NK с помощью качающихся биореакторов, получая 2-10×109 GMP-совместимых NK. Но этой системе все еще требуется предшествующая ручная культивация, поскольку в качестве инокулята для автоматической культуры требуются относительно высокое количество клеток.
Централизованная обработка продуктов NK, вероятно, будет проводиться главным образом в специализированных центрах по производству клеточных продуктов. Следовательно, после культивирования ex vivo потребуется хранение продукта NK и отгрузка в место использования. По сравнению с обычными NK, IL-2-активированные NK менее чувствительны к замораживанию, так как они показывают более высокую выживаемость и жизнеспособность после оттаивания. Тем не менее, различные группы ученых заявляют, что криоконсервация культивируемых NK сопровождается падением жизнеспособности и цитотоксичности клеток, хотя цитотоксичность может быть восстановлена путем короткой повторной стимуляции, например, путем экспозиции в среде, содержащей IL-2. Плохая выживаемость NK может быть проблемой во время длительного хранения культуры in vitro, так что использование свежезамороженных клеток для инфузии может быть ее решением. Интересно, что другие группы исследователей заявляют, что замораживание и оттаивание не влияют на цитотоксичность или пролиферативную способность культивируемых NK в их исследованиях. Эти расходящиеся наблюдения могут быть связаны с различными методами культивирования и различными протоколами замораживания и оттаивания, которые следует исследовать дальше. Без замораживания транспортировка подготовленных клеток в соответствующие временные рамки является сложной задачей, и любая задержка во время отгрузки влияет на качество клеточного продукта с критическими последствиями для пациента. В качестве альтернативы автоматизированные и закрытые системы для обработки клеток открывают путь для стратегий масштабирования и децентрализованного производства NK непосредственно в месте предполагаемого использования, избегая процесса замораживания и отгрузки. Но несмотря на то, что децентрализованное производство в клиниках кажется многообещающим, клеточная терапия очень сложна и все еще находится в раннем развитии, так что качественная подготовка квалифицированных специалистов в конкретных учреждениях является разумным подходом в настоящее время.
Заключение и перспективы
Сравнение различных протоколов культивирования NK в деталях сложнее, поскольку они чрезвычайно гетерогенны. Продолжительность культивирования NK ex vivo колеблется от нескольких часов для короткой активации NK до нескольких недель для долгосрочной экспансии, используются разные исходные материалы с различной чистотой NK, различные цитокины объединяются в разных дозах, а NK клетки часто кокультивируются с различными питающими клетками при разных соотношениях NK и фидерных клеткок. Тем не менее, по-разному активированные NK ex vivo демонстрируют некоторые общие характеристики.
В целом, культивируемые ex vivo NK проявляют повышенную цитотоксичность и могут даже реагировать на опухолевые мишени, ранее проявлявшие резистентность к лизису NK. Это объясняет использование IL-2 или IL-15 практически в каждом протоколе, так как известно, что оба цитокина усиливают активность NK. Однако при активации NK различными стимулами, в том числе IL-2 и IL-15, за счет действия металлопротеаз происходит снижение уровня поверхностных CD16. Fc-рецептор CD16 имеет решающее значение для NK для обеспечения их цитотоксичности и будет иметь особое значение для потенциальной комбинированной терапии вместе с моноклональными антителами. Следует отметить, что, хотя уровень CD16 на NK снижается в некоторых исследованиях, NK остаются цитотоксичными. Тем не менее, ингибирование соответствующих металлопротеаз для поддержания CD16 на NK может быть вариантом дальнейшего увеличения функции цитотоксичности у активированных ex vivo NK.
Другим клинически значимым аспектом является индуцированная опухолью иммуносупрессия, и NK могут получить способность ее преодолевать. Различные исследовательские группы сообщили о признаках подавления NK у больных раком, в виде более низкой экспрессии рецепторов NK, например, NCR, NKG2D, DNAM-1 и 2B4, пролиферации опухолевой клеткой лигандов, таких как NKp30 и NKG2D, или высвобождение блокирующих лигандов NKG2D, таких как MICA и ULBP3, через экзосомы, полученные из опухоли. Примечательно, что ex vivo культивирование NK, полученных от пациентов, часто возможно с той же эффективностью, что и для NK, полученных от доноров, и можно нормализовать фенотип NK и их активацию. Кроме того, повышенные уровни NKG2D на ex vivo-активированных NK могут противодействовать ингибирующему их эффекту. В некоторых случаях высокая цитотоксичность экспрессированных ex vivo NK не зависит от ингибирования KIR.
В заключение, существует множество протоколов экспансии NK in vitro, каждый из которых имеет свои специфические преимущества и недостатки в отношении количества, функции и обработки клеток. Данные, обобщенные в этом обзоре, подчеркивают сложность, связанную с разработкой оптимального протокола терапии NK, который должен быть не только надежным и безопасным в использовании, но и высокоэффективным при нацеливании на различные формы злокачественных новообразований. Имея это в виду, необходимо предусмотреть дополнительные исследования, не только для дальнейшего определения стратегий очистки, экспансии и активации NK ex vivo, но и окончательную клиническую установку, включая предварительное кондиционирование, дозирование и сроки применения NK. Необходимо предпринять усилия для согласования протоколов на европейском и международном уровнях в целях обеспечения наивысшего качества и эффективности продукта NK для клинического применения. Наконец, что касается возможной опосредованной опухолью иммуносупрессии, необходимо разработать терапевтические концепции, которые либо непосредственно укрепляют NK для борьбы с враждебной средой опухоли, и/или в особенности противодействуют индуцированным опухолью иммуносупрессивные механизмы.
