Противоречие функций хорионического гонадотропина человека в онкогенезе
Хорионический гонадотропин человека (ХГЧ) — это не только всем известный показатель наличия беременности, но и онкомаркер. Однако функция его двоякая: если ранее при наличии опухоли считалось, что повышение уровня ХГЧ в сыворотке крови достоверно указывает на плохой клинический прогноз, то сегодня на основе этого белка создаются вакцины против рака. В чем же причина такого изменения отношения к ХГЧ?
Хорионический гонадотропин человека — это гликопротеин, в норме продуцируемый клетками синцитиотрофобласта здоровых беременных женщин. Его выработка начинается в первые 3-5 дней после оплодотворения, и уровень ХГЧ в сыворотке крови женщины постепенно нарастает, достигая своего пика к 3 месяцу беременности.
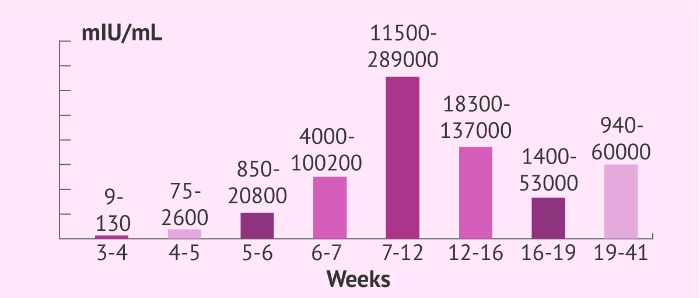
Рисунок 1 ❘ Динамика уровня бета-ХГЧ в сыворотке крови беременных женщин в соответствии со сроком беременности.
В строении ХГЧ выделяют альфа- и бета-субъединицы, связанные нековалентной связью. Альфа-субъединица по химическому строению аналогична гипофизарным гонадотропным гормонам, что делает невозможным использование ее как онкомаркера. Бета-субъединица, напротив, является строго специфичной и потому используется для диагностики беременности, многих акушерских и гинекологических патологий (например, пузырного заноса), а также нетрофобластических злокачественных опухолей. Так, бета-ХГЧ может обнаруживаться в сыворотке крови мужчин и небеременных женщин в концентрации выше 5 мЕд/мл при раке яичка и яичника, гепатоцеллюлярной карциноме, остеосаркоме, раке молочной железы и прямой кишки.
При беременности ХГЧ участвует в имплантации зародыша. В случае экспрессии в тканях нетрофобластических злокачественных опухолей ХГЧ имеет независимые функции, которые на сегодняшний день изучены не полностью. Исследования показывают, что бета-субъединица белка способна ингибировать апоптоз или стимулировать рост опухолевых клеток, и повышение ее уровня в сыворотке крови коррелирует с растущей агрессивностью опухоли. Например, при остеосаркоме высокий уровень ХГЧ в сыворотке крови ассоциирован с наличием опухоли, слабо реагирующей на неоадъювантную терапию. Однако прежде всего в современной диагностике ХГЧ используется как маркер рака яичника. Присутствие ХГЧ в сыворотке крови обнаруживается у 27% пациенток с доброкачественными опухолями и 67% пациенток с раком яичника. В ткани опухоли ХГЧ выделяют в 68% случаев вне зависимости от ее гистологического типа. При этом важно отметить, что встречаются методы определения в сыворотке крови не самого бета-ХГЧ, а его гипергликозилированных фракций. Показатели уровня белка в целом, его бета-субъединицы или гипергликозилированных фракций являются взаимозаменяемыми в диагностике злокачественных новообразований.
Среди всех функций ХГЧ в онкогенезе наиболее интересна следующая. Установлено участие этого белка в процессе васкулогенной мимикрии в ткани опухоли яичника. Васкулогенная мимикрия — это способность опухолевых клеток приобретать фенотип эндотелиоцитов и формировать аналогичные сосудам каналы для обеспечения кровоснабжения опухоли. Способность опухоли к васкулогенной мимикрии коррелирует с возрастающим риском метастазирования и неблагоприятным клиническим прогнозом. На основании этих данных была начата разработка препаратов на основе моноклональных антител, связывающих ХГЧ, а также вакцин, снижающих его выработку опухолевыми клетками in vitro.
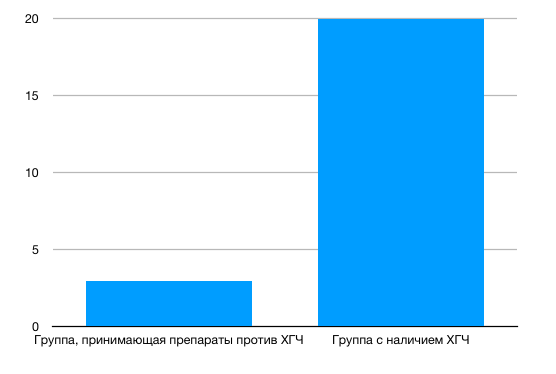
Рисунок 2 ❘ Среднее количество каналов, образованных по типу васкулогенной мимикрии, в ткани опухоли пациентов без ХГЧ и с обнаруженным ХГЧ в сыворотке крови.
Известно, что бета-ХГЧ участвует и в формировании опухолей молочной железы, однако его роль в онкогенезе считается противоречивой: одни исследования причисляют ему антионкогенные функции, другие называют его скорее проонкогенным фактором. В 2017 году было впервые установлено, что экспрессия ХГЧ связана с состоянием гена BRCA1, и повышение продукции белка наблюдается именно у пациентов с наличием мутации в этом гене. В ткани такой опухоли бета-ХГЧ запускает процессы миграции и инвазии клеток. Кроме того, хорионический гонадотропин принадлежит к семейству белков, способных формировать так называемый структурный “цистиновый узел”. Схожую структуру имеет трансформирующий фактор роста, участвующий в опухолевой прогрессии. Было установлено, что ХГЧ способен связываться с рецепторами к ТФР-бета и фосфорилировать их, что запускает пролиферацию клеток с дефектами гена BRCA1. Прерывание взаимодействия бета-ХГЧ и рецепторов к ТФР-бета может стать эффективной стратегией терапии рака молочной железы.
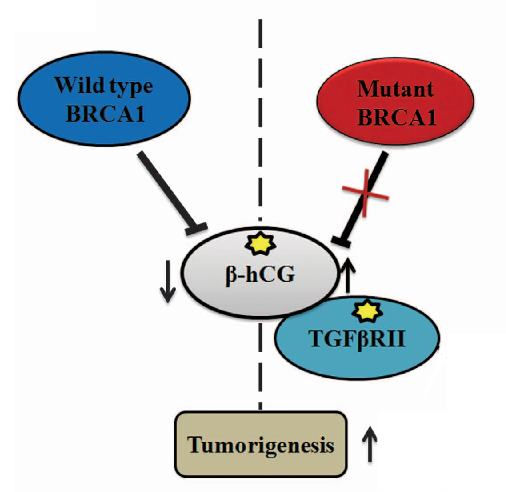
Рисунок 3 ❘ Упрощенная схема взаимодействия мутантного BRCA1 и бета-ХГЧ в формировании опухоли молочной железы.
Наиболее интересен тот факт, что встречаются и прямо противоположные данные в отношении роли ХГЧ в развитии рака молочной железы. Так, предположительно этот белок является защитным агентом против данного типа опухолей, а вакцина на основе бета-субъединицы ХГЧ не так давно показала свою эффективность против рака молочных желез у мышей. Известно, что беременность является защитным фактором против рака молочной железы. Именно ХГЧ предположительно формирует антионкогенный эффект состояния беременности, изменяя геном клеток молочных желез и тем самым делая их более устойчивыми к опухолевой трансформации. Также ХГЧ беременной женщины оказывает проапоптотический эффект, снижая выработку белков-маркеров пролиферации и повышая активность факторов апоптоза (в том числе широко известного p53).
Таким образом, плацентарный ХГЧ и эктопически экспрессируемый белок имеют противоположную роль в онкогенезе, что представляет интерес для исследователей в разных направлениях научной деятельности. Полученные знания имеют и высокую практическую ценность, ведь в настоящее время имитация беременности путем введения ХГЧ предложена как вариант предотвращения рака молочной железы, а управление продукцией бета-ХГЧ в опухолевых клетках может стать эффективным направлением таргетной терапии других опухолей.
Источники:
1. An HCG-rich microenvironment contributes to ovarian cancer cell differentiation into endothelioid cells in a three-dimensional culture system. / Min Su, Chao Fan, Sainan Gao [et al] // Oncol Rep. - 2015. - Vol. 34, №5. - p. 2395-2402.
2. Does hCG or hCG-beta play a role in cancer cell biology? / R. K. IIes, P. J. Delves, S. A. Butler. // Mol Cell Endocrinol. - 2010. - Vol. 329, №1-2. - p. 62-70.
3. Ectopic production of beta-hCG by osteosarcoma: a case report and review of the literature. / Oshrine BR, Sullivan LM, Balamuth NJ // J Pediatr Hematol Oncol. - 2014. - Vol. 36, №3. - p. 202-206.
4. A preliminary investigation of beta-hCG expression in patients with osteosarcoma. / Masrouha KZ, Khattab R, Tawil A [et al] // J Bone Joint Surg Br. - 2012. - Vol. 94, №3. - p. 419-424.
5. Hyperglycosylated hCG, hCG-beta and Hyperglycosylated hCG-beta: interchangeable cancer promoters. / Cole LA, Butler S. // Mol Cell Endocrinol. - 2012. - Vol. 349, №2. - p. 232-238.
6. Human Chorionic Gonadotropin and Breast Cancer. / Susanne Schuler-Toprak, Oliver Treeck, Olaf Ortmann. / Int J Mol Sci. - 2017. - Vol. 18, №7. - p. 1587.
7. Human chorionic gonadotropin and its relation to grade, stage and patient survival in ovarian cancer. / Lenhard M, Tsvilina A, Schumacher L [et al] // BMC Cancer. - 2012. - Vol. 12, №2.
8. BRCA1 regulation on beta-hCG: a mechanism for tumorigenicity in BRCA1 defective breast cancer. / S K Sengodan, R Nadhan, R S Nair [et al] // Nat Oncogen. - 2017. - Vol. 6. - p. 376.
