Нобелевская премия в области Медицины и физиологии 2018

Иллюстрация: Mattias Karlén
Нобелевский комитет Каролинского института сегодня решил присудить Нобелевскую премию в области Физиологии и медицины 2018 года Джеймсу Пи. Эллисону и Тасуку Хендзе.
За их открытие терапии рака с помощью ингибирования негативной иммунной регуляции
(краткий обзор ингибиторов контрольных точек: http://medach.pro/post/1565)
Резюме
Рак убивает миллионы людей каждый год и до сих пор остается одним из важнейших вызовов, брошенных человечеству, с точки зрения медицины. Благодаря стимулированию уже имеющейся способности иммунной системы атаковать опухолевые клетки нобелевские лауреаты этого года сделали возможным создание противоопухолевой терапии, основанной на совершенно новых принципах.
Джеймс П. Эллисон изучил открытый ранее белок, который работал в качестве «тормоза» иммунной системы. Он осознал потенциальную возможность выключения этого «тормоза», что привело бы к нападению иммунных клеток на опухоль. Затем он начал работать над превращением этой идеи в конкретные методы лечения пациентов.
Параллельно с ним Тасуку Хондзе обнаружил другой белок на поверхности иммунных клеток, и после тщательного исследования его функции пришел к выводу, что он также работает в качестве «тормоза», но его действие основано на несколько других механизмах. Методы лечения, основанные на его открытии, могут быть очень эффективны в борьбе против онкологических заболеваний.
Эллисон и Хондзе продемонстрировали, как разные стратегии в ингибировании этих «тормозов» иммунной системы могут быть использованы в качестве противоопухолевой терапии. Результаты трудов двух нобелевских лауреатов являются настоящей вехой в нашей борьбе против рака.
Можем ли мы вовлечь нашу иммунную систему в борьбу с раком?
Злокачественные новообразования представляют из себя неоднородную группу заболеваний, но все они характеризуются неконтролируемой пролиферацией атипичных клеток, а также их способностью проникать в здоровые органы и ткани. Существует множество методов терапии онкологических заболеваний, в том числе хирургическое вмешательство, лучевая терапия и другие стратегии лечения, многие из которых были отмечены предыдущими Нобелевскими премиями. В их числе гормональная терапия рака простаты (Хаггинс, 1966 год), химиотерапия (Элион и Хитчинс, 1988), а также трансплантация костного мозга при лейкемии (Томас, 1990). Однако запущенные опухоли все еще тяжело поддаются лечению, и разработка новых терапевтических стратегий является первостепенной задачей.
В конце XIX и начале XX вв. возникла идея, согласно которой активация иммунной системы и последующая атака опухолевых клеток может быть стратегией лечения рака. Предпринимались попытки заражения пациентов бактериями, чтобы активировать защитные системы организма. Результаты были весьма посредственными, но в сильно измененном виде этот подход дошел до наших дней в виде методики лечения рака мочевого пузыря. Тогда исследователям стало ясно, что имеющихся знаний недостаточно. Множество ученых были вовлечены в исследования фундаментальных принципов, лежащих в основе регулирования иммунной системы, и это помогло понять механизмы обнаружения опухолевых клеток иммунной системой. Несмотря на значительный научный прогресс, разработка новых методов лечения рака оставалась сложной задачей.
Тормоз и газ иммунной системы
Фундаментальным свойством нашей иммунной системы является наличие системы, которая отличает «своих» от «чужих», что позволяет уничтожать вторгающиеся бактерии, вирусы или иные опасности. Т-клетки — это тип лейкоцитов, являющихся ключевыми участниками в этой защите. У Т-клеток были обнаружены рецепторы, которые связываются с определенными структурами, опознанными как чужеродные, а затем через различные взаимодействия происходит активация иммунной системы, чтобы «поднять тревогу». Но для запуска полноценного иммунного ответа этого мало, нужны также дополнительные белки, которые служат «акселераторами» для Т-клеток (рис. 1). Множество ученых, участвующих в этом важном фундаментальном исследовании, определили другие белки, которые работают в качестве «тормоза» Т-клеток, ингибируя иммунный ответ. Этот сложный баланс между «акселератором-газом» и «тормозом» иммунной системы необходим для точного контроля иммунного ответа. Это позволяет иммунной системе успешно уничтожать чужеродные микроорганизмы и в тоже время избегать чрезмерной активации, которая привела бы к аутоиммунному поражению здоровых тканей и органов.
Новый принцип иммунотерапии
В 1990-х Джеймс П. Эллисон в своей лаборатории Калифорнийского университета в Беркли изучал белок Т-клеток CTLA-4. Он оказался одним из многих ученых, чьи наблюдения позволили установить, что CTLA-4 работает в качестве «тормоза» Т-клеток. Другие научные группы использовали этот «тормоз» в качестве мишени при лечении аутоиммунных заболеваний. Но у Эллисона была совершенно иная идея. Он уже разработал антитела, которые могли связываться с CTLA-4 и блокировать его функцию (рис. 1). Теперь он мог попробовать посмотреть, сможет ли блокада CTLA-4 выключить «тормоз» Т-клеток и заставить иммунную систему атаковать раковые клетки. Эллисон и соавторы провели первый эксперимент в конце 1994 года, и, к их восторгу, его удалось успешно повторить уже после Рождества. Больная раком мышь была вылечена с помощью антител, которые ингибировали «тормоз» и открывали возможность для противоопухолевой активности Т-клеток. Несмотря на почти полное равнодушие фармацевтических компаний, Эллисон продолжил свои труды в попытке создать новые методы лечения онкологических заболеваний у человека. Многообещающие результаты вскоре были представлены разными научными группами, а в 2010 году было проведено важное клиническое испытание, в котором была продемонстрирована чрезвычайно высокая эффективность лечения у пациентов с меланомой. У некоторых пациентов полностью исчезли клинические признаки меланомы. Такие выдающиеся результаты никогда ранее не были выявлены у таких пациентов.
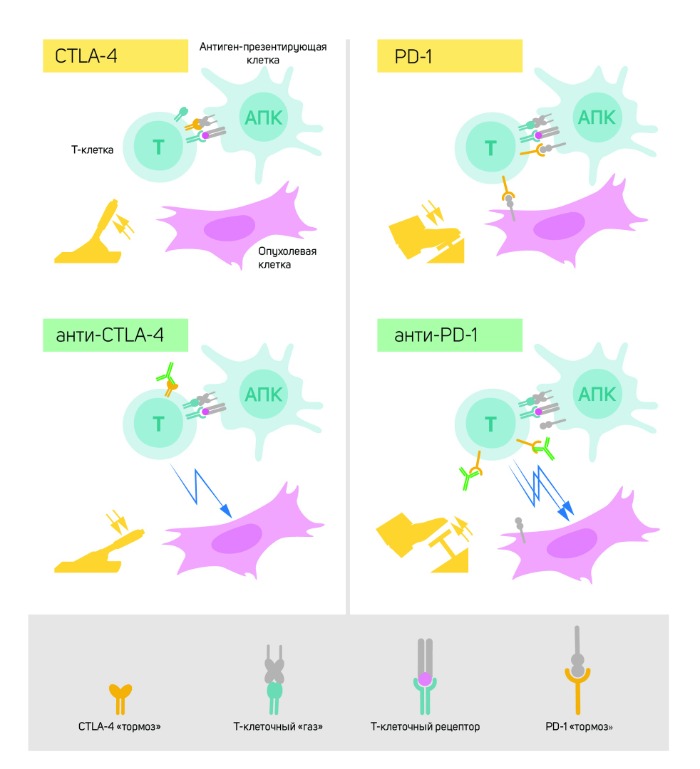
Вверху слева: для активации Т-клеток требуется, чтобы Т-клеточный рецептор связывался со структурами на других иммунных клетках, чтобы распознать объект как «не свой». Белок, функционирующий в качестве «акселератора» Т-клеток, также необходим для активации Т-клеток. CTLA-4 служит «тормозом» Т-клеток и ингибирует функции «акселератора».
Внизу слева: антитела (зеленые) против CTLA-4 блокируют функцию «тормоза», что приводит к активации Т-клеток и вынуждает их нападать на опухолевые клетки.
Вверху справа: PD-1 является еще одним «тормозом» Т-клеток, который ингибирует их активацию.
Внизу справа: антитела против PD-1 ингибируют функцию «тормоза», что позволяет Т-клеткам с высокой эффективностью уничтожать опухолевые клетки.
Открытие PD-1 и почему это важно для лечения рака
В 1992 году, за несколько лет до открытия Эллисона, Тасуку Хондзе обнаружил PD-1, другой белок, экспрессирующийся на поверхности Т-клеток. Преисполненный решимости разгадать его роль, он тщательно изучил его функцию в серии нескольких изящно поставленных экспериментов, которые он провел в своей лаборатории в университете Киото. Результаты этих экспериментов показали, что PD-1 близок по своим функциями «тормоза» к CTLA-4, но механизмы его работы несколько отличаются (Рис. 1). В опытах на животных, которые провел Хондзе и другие научные группы, блокада PD-1 также показала многообещающие перспективы для создания противоопухолевой терапии. Это открыло дорогу в клиники для PD-1 как терапевтической мишени. Вскоре начались клинические разработки и, наконец, в 2012 году было проведено важное клиническое исследование, которое явно продемонстрировало эффективность этого подхода в лечении пациентов с различными видами рака. Результаты были просто поразительными: наблюдались долгосрочная ремиссия и, возможно, полное излечение нескольких пациентов с метастазами, состояние которых было столь тяжелым, что их считали неизлечимо больными.
Ингибиторы контрольных точек в лечении рака сегодня и в будущем
После первых работ, показывающих эффект блокады CTLA-4 и PD-1 началось бурное изучение этого вопроса. Теперь мы знаем, что метод лечения, часто называемый «ингибирование контрольных точек», радикально влияет на исход нескольких групп пациентов с тяжелыми стадиями онкологических заболеваний. Также как и в случае с другими вариантами противоопухолевой терапии, наблюдаются побочные эффекты, в том числе и жизнеугрожающие. Они связаны с гиперактивацией иммунного ответа, что приводит к аутоиммунным реакциям, но это, как правило, управляемый процесс. И сейчас исследования направлены на то, чтобы лучше понимать механизм действия, что позволит улучшить само лечение и уменьшить побочные эффекты от него.
Доказано, что ингбирование PD-1 более эффективно, чем CTLA-4, и позволяет добиться лучшего исхода при раке легких, почки, некоторых лимфомах и меланоме. Новые клинические исследования выявили, что комбинированная терапия, направленная как на CTLA-4, так и на PD-1, может быть более эффективной, особенно у пациентов с меланомой. Поэтому Эллисон и Хондзе вдохновили исследователей на комбинирование различных стратегий, направленных на выключение «тормозов», что в итоге приводило бы к уничтожению опухолевых клеток намного более эффективно. Большое количество вариантов такого лечения уже проходят клинические испытания в качестве терапии онкологических заболеваний, а в качестве мишеней такой терапии исследуются все новые виды белков.
В течение более ста лет ученые пытались вовлечь иммунную систему в борьбу против рака. До тех пор, пока сегодняшние лауреаты Нобелевской премии по физиологии и медицине не совершили свои плодотворные открытия, не было значительного прогресса в клиническом применении этих подходов. Но терапия ингибирования контрольных точек произвела революцию в лечении онкологических заболеваний и фундаментально изменила наши взгляды на злокачественные новообразования.
