Двойная атака на устойчивые к антибиотикам микроорганизмы

Изопреноидные молекулы важны для многих патогенных микроорганизмов, а промежуточные соединения, образующиеся во время их синтеза, вызывают иммунные защитные реакции со стороны γδ Т-клеток (агранулоциты, расположенные в слизистых и коже, которые распознают антигены, не прошедшие процессинг, белки теплового шока и липидные антигены в комплексе с CD1 — прим. перев.). Эта уязвимость микроорганизмов используется «иммуноантибиотиками».
Возникновение штаммов патогенных микроорганизмов, устойчивых к лечению антибиотиками, — серьезная проблема для общественного здравоохранения во всем мире. Это служит стимулом к непрекращающимся разработкам лекарственных препаратов, включая определение возможных биологических мишеней, связанных с основными процессами, происходящими внутри бактериальной клетки. Однако разработка лекарственных средств идет медленно, а развитие устойчивости к новым, только созданным веществам остается постоянной проблемой. Первостепенное значение имеет поиск альтернативных путей борьбы с появлением устойчивых к антибиотикам бактерий. В статье в «Nature» Singh с соав. [1] описывают двойную стратегию решения этой проблемы.
Авторы рассматривают методику разработки нового класса молекул, называемых иммуноантибиотиками. Их цель — путь синтеза ключевой молекулы, необходимой для метаболизма микроорганизма. Таким образом, происходит стимуляция определенной популяции иммунных клеток. Клетки из группы, называемой γδ Т-клетками, обеспечивают общий (сходный с врожденным) мощный антимикробный иммунный ответ.
Singh с соавт. сосредоточили свое внимание на процессе ингибирования фермента, называемого IspH (рис. 1). Он катализирует один из этапов пути образования молекул, называемых изопреноидами. Изопреноиды являются ключевыми строительными блоками, необходимыми для синтеза разнообразных молекул у прокариот (организмы, лишенные ядра, например, бактерии — прим. авт.) и эукариот (организмы с ядром внутри клетки — прим. авт.). Однако IspH катализирует реакцию только в одном из звеньев пути синтеза изопреноидов, называемого метилэритритол-4-фосфатным (МЭФ) путем, который обнаруживается у бактерий и некоторых простейших (одноклеточных эукариот), но отсутствует у животных [2]. Некоторые ферменты этого пути, ключевые для таких процессов, как синтез клеточной стенки бактерий и производство энергии, уже привлекли внимание ученых как потенциальные мишени для противомикробных препаратов [3–7]. К таковым мишеням относится сам IspH [3, 6], присутствующий в разнообразных патогенных микроорганизмах, например, грамотрицательных бактериях, микобактериях (группа, куда входит возбудитель туберкулеза) и некоторых простейших, таких как Plasmodium falciparum (возбудитель малярии).
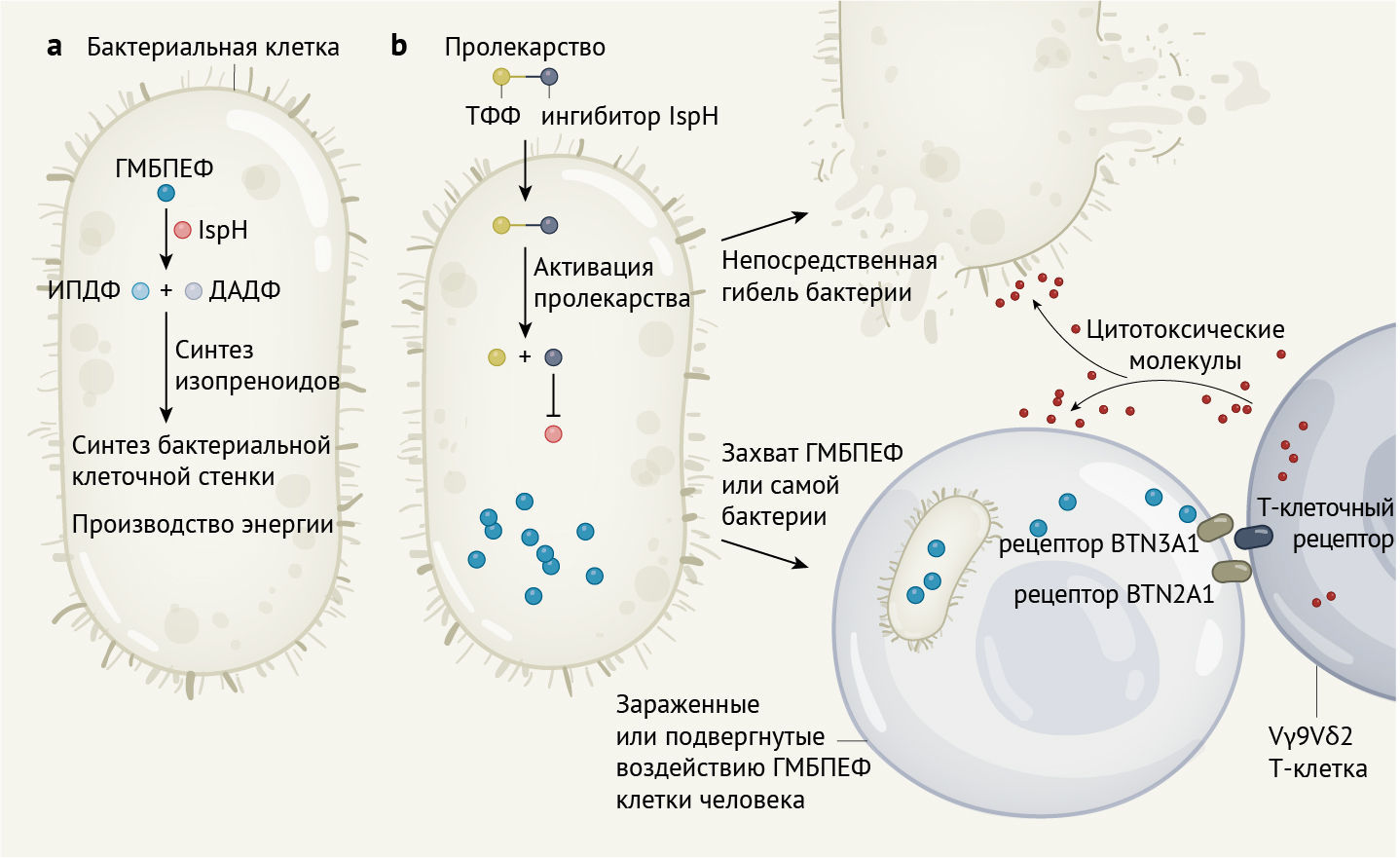
b — Singh с соавт. [1] использовали метод скрининга для определения ингибиторов IspH. Чтобы усилить проникновение в клетки, авторы создали ингибитор в форме пролекарства в виде производного сложного эфира трифенилфосфония (ТФФ). Внутри бактерии ингибитор отделен от группировки TФФ и прицельно связывается с IspH. Ингибирование IspH блокирует продукцию изопреноидов, в конечном итоге приводя к гибели бактерии. Он также увеличивает уровень ГМБПЕФ. ГМБПЕФ, который поглощается клетками человека или присутствует в клетках человека, зараженных бактериями, распознается иммунокомпетентными клетками, называемыми Vγ9Vδ2 Т-лимфоцитами. Этот процесс распознавания невозможен без рецепторов BTN3A1 и BTN2A1 на клетке-мишени и Т-клеточного рецептора (TCR, от англ. Т-cell receptor). При обнаружении ГМБПЕФ эти Т-клетки активируются и высвобождают молекулы, которые могут убивать инфицированные микроорганизмами клетки человека или непосредственно бактерии.
IspH как терапевтическая мишень представляет преимущество, выходящее за рамки его роли в образовании веществ, необходимых для синтеза изопреноидов. Особенность в том, что микробная молекула, (E)-4-гидрокси-3-метил-бут-2-енилпирофосфат (ГМБЕПФ), которую разрушает фермент, является той, которую иммунная система приматов научилась распознавать [8]. ГМБЕПФ в организме человека распознается с помощью иммунных клеток, известных как Vγ9Vδ2 Т-клетки, которые составляют примерно 1–10 % Т-лимфоцитов в крови. После того, как Vγ9Vδ2 Т-клетки распознают [9] клетки, подвергнутые воздействию ГМБПЕФ, посредством процесса, в основе которого лежит распознавание рецепторов BTN3A1 и BTN2A1(находятся в клетках-мишенях, рис. 1), происходит активация этих Т-лимфоцитов и их пролиферация. Они опосредуют мощные защитные реакции, включая производство молекул для киллинга и высвобождение сигнальных молекул — цитокинов.
Активированные Vγ9Vδ2 Т-лимфоциты способны либо непосредственно убивать человеческие клетки, подвергшиеся воздействию ГМБПЕФ (к примеру, при воздействии инфекции, вызванной внутриклеточными микроорганизмами), либо убивать сами клетки бактерий. Таким образом, стратегия Singh с соавт. по сосредоточению внимания на ферменте IspH сочетает рациональное прицельное воздействие на изопреноидный путь для ингибирования его и, следовательно, блокировку источника важнейших микробных молекул со стимуляцией иммунного ответа вследствие накопления ГМБПЕФ. Последнее является очень сильным сигналом, который запускает активацию Vγ9Vδ2 Т-клеток.
Авторами был применен структурно-ориентированный подход к скринингу in silico для выявления возможных ингибиторов IspH, и было протестировано около 10 млн соединений. Поразительно, при тестировании in vitro 2 из 24 наиболее многообещающих соединений ингибировали IspH с высокой эффективностью (в наномолярных концентрациях). Дальнейшая оптимизация молекулярных структур этих соединений улучшила их сродство к IspH по сравнению с сродством IspH к его природному субстрату, ГМБПЕФ.
Однако ученые ожидали, что физические характеристики ингибиторов будут препятствовать их проникновению в бактерии. Чтобы обойти это, Singh с соавт. приняли стратегию, ранее использовавшуюся для облегчения прохождения лекарств через мембраны. В ходе этого вырабатывается так называемое пролекарство — неактивная форма лекарства (в данном случае, сложноэфирное производное ингибитора фермента), которое легко усваивается клетками и затем метаболизируется в активную форму. Важно отметить, что в отличие от предыдущей работы [3, 6], описывающей ингибиторы IspH, этот метод с использованием пролекарства позволил таким ингибиторам успешно проникать в бактерии. Авторы подтвердили, что препараты ингибируют ферментный распад ГМБПЕФ, препятствуя основным микробным процессам, и что это приводит к гибели ряда различных бактерий, включая Escherichia coli, без заметных признаков токсичности лекарственного средства для клеток млекопитающих.
В соответствии со способностью ингибировать расщепление ГМБПЕФ ферментом IspH, использование пролекарств также привело к активации и пролиферации ГМБПЕФ-чувствительных Vγ9Vδ2 Т-клеток in vitro (из образцов мононуклеаров периферической крови человека во время бактериальной инфекции). Этот результат указывает на способность таких пролекарств действовать как иммуноантибиотики двойного действия. При тестировании in vivo на мышах пролекарства вызывали прямое противомикробное действие и контролировали бактериальную инфекцию посредством процесса, опосредованного γδ Т-клетками.
Singh с соавт. исследовали два ключевых аспекта возможностей этих новых соединений в борьбе с антибиотикорезистентностью. Во-первых, исследователи представляют данные исследований in vitro и in vivo, указывающие на прямое бактерицидное действие на множество клинически изолированных болезнетворных бактерий, устойчивых к современным антибиотикам, включая микроорганизмы с множественной лекарственной устойчивостью. Авторы отмечают, что ингибиторы IspH способны уничтожать бактерии с множественной лекарственной устойчивостью в большей степени, чем антибиотики (лучшие в своем классе). Во-вторых, используя модельную систему in vitro, Singh с соавт. продемонстрировали, что бактерии не приобретают устойчивости к ингибиторам IspH в присутствии γδ Т-клеток. В отсутствие этих Т-лимфоцитов устойчивость к лекарствам проявлялась в те же сроки, что и для обычных антибиотиков. Эти результаты подчеркивают потенциальное преимущество иммуноантибиотиков в борьбе с возникновением лекарственной устойчивости.
Исследование Singh с соавт. представляет многообещающие доказательства того, что может быть разработан новый класс противомикробных средств с двойным механизмом действия. Использование Vγ9Vδ2 Т-клеток привлекает своими терапевтическими преимуществами. Эти клетки, присутствующие у людей с ранних лет жизни, обладают мощными защитными функциями [10] и, в отличие от многих других типов Т-лимфоцитов, не зависят от распознавания молекул главного комплекса гистосовместимости (MHC), которые различаются у разных людей. Обнадеживающе звучит факт того, что метаболический путь, включающий фермент IspH, является общим для широкого круга клинически значимых болезнетворных микроорганизмов. Это позволяет предположить, что такие противомикробные препараты могут найти широкое применение.
Методы антибиотикотерапии в виде монотерапии (единственный тип лекарственного средства) часто приводили к возникновению лекарственной устойчивости, тогда как комбинированная терапия с использованием нескольких препаратов, оказывающих эффекты с помощью различных механизмов действия, оказалась более плодотворной и приводила к относительно меньшему количеству проблем с резистентностью. Этот механизм «два в одном», лежащий в основе стратегии Singh с соавт., может позволить прицельно воздействовать на существующие микроорганизмы с множественной лекарственной устойчивостью, а также снизить вероятность возникновения резистентности. Хотя последующие шаги на пути к разработке лекарств могут оказаться сложными, прогресс развития и направления клинического использования этого захватывающего класса соединений [иммуноантибиотиков], несомненно, будет в дальнейшем привлекать внимание.
