Клеточные технологии в иммунотерапии злокачественных новообразований: побочные эффекты адоптивной терапии с использованием CAR-CD8+-лимфоцитов
Сейчас всем очевидно, что иммунотерапия Т-лимфоцитами с химерными рецепторами экспансивно развивается, а список эффективно вылеченных злокачественных новообразований будет только расширяться. Однако, как любая история успеха, путь терапии с использованием CAR-СD8+-лимфоцитов это постоянное преодоление неудач и, казалось бы, неразрешимых препятствий.
Проблемы, связанные с созданием работоспособного химерного рецептора были рассмотрены в предыдущей главе, а сейчас пришло время коснуться побочных эффектов этого типа иммунотерапии. Наиболее частым и тяжелым осложнением является развитие синдрома выброса цитокинов (СВЦ) или синдрома цитокинового шторма. Данное осложнение связано с гиперактивацией иммунной системы и выбросом большого количества цитокинов за короткое время. СВЦ подробно разобран в предыдущей статье.
Неврологические нарушения были впервые отмечены при лечении острых лейкозов. Так, использование CD-19 специфичных CAR-CD8+-лимфоцитов у пациентов с острым B-лимфобластным лейкозом, наблюдались онемение, спутанность сознания, делирий, моторная афазия, снижение болевой чувствительности, миоклонус и даже эпилептиформные припадки. К счастью, в большинстве случаев нейротоксические эффекты были полностью обратимы [1-3].
Патогенез этих осложнений до конца не ясен. Поскольку похожие эффекты наблюдаются при введении блинатумомаба, возможно, они связаны с выбросом цитокинов [4,5]. Действительно, в части случаев, нейротоксичность возникает одновременно с СВЦ, однако может наблюдаться и изолированно. С другой стороны, возможна и прямая цитотоксичность со стороны CAR-CD8+-лимфоцитов, однако прямых доказательств этому в настоящий момент не получено.
Исследование лимфоцитов в цереброспинальной жидкости пациентов не позволило выявить четкой корреляции между соотношением химерных и нехимерных Т-лимфоцитов в ликворе и частотой неврологических осложнений. На данный момент остается открытым вопрос, являются ли эти осложнения специфичными для CD-19 специфичных CAR-CD8+-лимфоцитов или могут развиваться при использовании в качестве мишени других опухолевых антигенов [1-3].
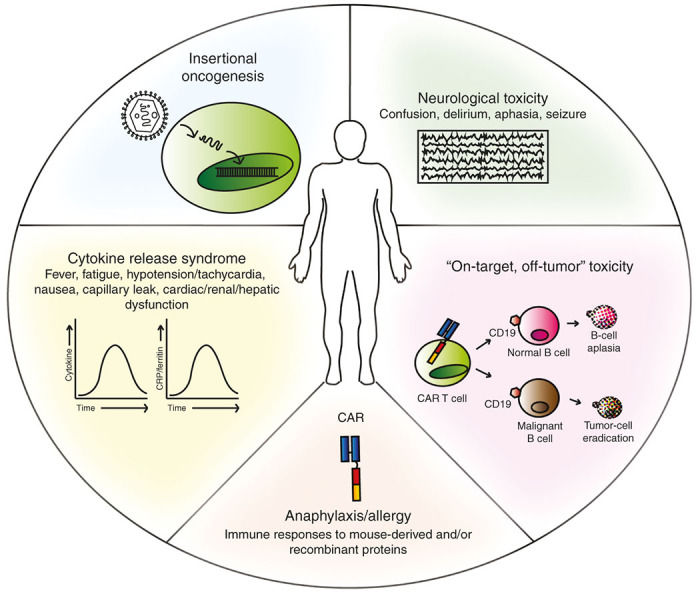
Рисунок 1 | Побочные эффекты адоптивной терапии с использованием CAR-CD8+-лимфоцитов [6].
В настоящее время при создании химерных рецепторов часто используют антигены, которые помимо опухоли экспрессируют здоровые ткани. Например, CD-19 находится на поверхности как лейкозных клеток, так и здоровых B-лимфоцитов, поэтому CAR-CD8+-лимфоциты будут в том числе приводить к B-лимфопении. Этот эффект называется «on-target/off-tumor». Степень тяжести лимфопении может варьироваться от небольшого снижения, до жизнеугрожающих состояний [7].
Подобные эффекты были отмечены также со стороны желудочно-кишечного тракта, дыхательной системы. В частности, использование Т-лимфоцитов, специфичных к карбоксиангидразе 9, в терапии рака почек привело к развитию синдрома холестаза, в связи с экспрессией карбоангидразы 9 на поверхности клеток желчных протоков [8,9]. Выбор в качестве мишени раково-эмбрионального антигена в терапии рака ободочной кишки приводил к развитию тяжелого колита, в связи повреждением нормальной ткани кишки [10]. Наиболее тяжелые осложнения наблюдались в случае химерных Т-лимфоцитов специфичных в отношении HER-2/neu. У части пациентов были зафиксированы острый респираторный дистресс-синдром, полиорганная недостаточность с последующим летальным исходом [11].
Отдельного внимания заслуживает перекрестная реакция химерных Т-лимфоцитов по отношению к здоровым тканям, даже при условии их специфичности только к неоантигенам. Так у пациентов, получивших дозу CAR-CD8+-лимфоцитов, направленных против MAGE-A3, были отмечены тяжелые кардиотоксические эффекты в связи с перекрестной реакцией на белок титин [12].
Как было описано в предыдущих статьях, антиген-распознающий домен химерных рецепторов обычно представлен антителом мышиного происхождения. С этим фактом связано то, что в организме пациента может развиваться иммуннологический ответ, как клеточный, так и гуморальноопосредованный. В клинической практике были отмечены случаи анафилактического шока. В частности, у ряда пациентов, получивших дозу CAR-CD8+-лимфоцитов, специфичных к мезотелину, отмечалось развитие острой сердечно-легочной недостаточности после третьего введения лимфоцитов. У пациентов в крови отмечалось наличие антител к мышиному белку и высокий уровень трипсина, что подтверждает гипотезу об IgE-опосредованной анафилактической реакции [13].
Перечисленные побочные эффекты являются серьезными, но не непреодолимыми ограничениями. В следующей главе речь пойдет о том, как можно их избежать или скорректировать, сделав иммунотерапию с использованием CAR-CD8+-лимфоцитов безопасной для пациентов.
Список литературы:
- Maude, SL, Frey, N, Shaw, PA, Aplenc, R, Barrett, DM, Bunin, NJ et al. (2014). Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med 371: 1507–1517.
- Davila, ML, Riviere, I, Wang, X, Bartido, S, Park, J, Curran, K et al. (2014). Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia. Sci Transl Med6: 224ra25.
- Lee, DW, Kochenderfer, JN, Stetler-Stevenson, M, Cui, YK, Delbrook, C, Feldman, SA et al. (2015). T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose-escalation trial. Lancet 385: 517–528.
- Buie, LW, Pecoraro, JJ, Horvat, TZ and Daley, RJ (2015). Blinatumomab: a first-in-class bispecific T-cell engager for precursor B-cell acute lymphoblastic leukemia. Ann Pharmacother 49: 1057–1067.
- Topp, MS, Gökbuget, N, Stein, AS, Zugmaier, G, O’Brien, S, Bargou, RC et al. (2015). Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol 16: 57–66.
- Bonifant CL, Jackson HJ, Brentjens RJ, Curran KJ. Toxicity and management in CAR T-cell therapy. Mol Ther Oncolytics. 2016;3:16011.
- Curran, KJ, Pegram, HJ and Brentjens, RJ (2012). Chimeric antigen receptors for T cell immunotherapy: current understanding and future directions. J Gene Med 14: 405–415.
- Lamers, CH, Sleijfer, S, Vulto, AG, Kruit, WH, Kliffen, M, Debets, R et al. (2006). Treatment of metastatic renal cell carcinoma with autologous T-lymphocytes genetically retargeted against carbonic anhydrase IX: first clinical experience. J Clin Oncol 24: e20–e22.
- Lamers, CH, Sleijfer, S, van Steenbergen, S, van Elzakker, P, van Krimpen, B, Groot, C et al. (2013). Treatment of metastatic renal cell carcinoma with CAIX CAR-engineered T cells: clinical evaluation and management of on-target toxicity. Mol Ther 21: 904–912.
- Parkhurst, MR, Yang, JC, Langan, RC, Dudley, ME, Nathan, DA, Feldman, SA et al. (2011). T cells targeting carcinoembryonic antigen can mediate regression of metastatic colorectal cancer but induce severe transient colitis. Mol Ther 19: 620–626.
- Morgan, RA, Yang, JC, Kitano, M, Dudley, ME, Laurencot, CM and Rosenberg, SA (2010). Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther 18: 843–851.
- Cameron, BJ, Gerry, AB, Dukes, J, Harper, JV, Kannan, V, Bianchi, FC et al. (2013). Identification of a Titin-derived HLA-A1-presented peptide as a cross-reactive target for engineered MAGE A3-directed T cells. Sci Transl Med 5: 197ra103.
- Maus, MV, Haas, AR, Beatty, GL, Albelda, SM, Levine, BL, Liu, X et al. (2013). T cells expressing chimeric antigen receptors can cause anaphylaxis in humans. Cancer Immunol Res 1: 26–31.
