Уровень меди в организме и риск рака молочной железы: какая взаимосвязь?

Согласно результатам нового исследования из Weill Cornell Medicine и Memorial Sloan Kettering Cancer Centre (MSK), истощение запаса меди в организме может привести к снижению выработки энергии теми опухолевыми клетками, которые мигрируют в разные части тела и развиваются в них (данный процесс известен как метастазирование). Открытие основных механизмов того, как истощение запасов меди в организме может снизить метастазирование при раке молочной железы, поможет разработать план дальнейших клинических испытаний.
▶ Читайте также: Hallmarks of Сancer: Новый взгляд (Полный перевод в PDF)
В серии публикаций с 2013 по 2021 год ученые из Weill Cornell Medicine продемонстрировали, что при лечении пациенток с тройным негативным раком молочной железы (ТНРМЖ) препаратами, снижающими уровень меди в организме, в ходе клинических испытаний II фазы наблюдалось увеличение времени до момента развития рецидива заболевания и метастазирования опухоли. В текущем исследовании, опубликованном 15 декабря в журнале Nature Communications, под руководством первого автора работы Дивьи Рамчандани, научного сотрудника отделения кардиоторакальной хирургии в Weill Cornell Medicine, ученые применили животные модели, чтобы лучше разобраться в причинах наблюдаемого явления.
По словам соавтора исследования Вивека Миттала, директора по исследованиям в Neuberger Berman Lung Cancer Center и профессора кардиоторакальной хирургии Ford-Isom в Weill Cornell Medicine, одной из отличительных черт ТНРМЖ является то, что это очень агрессивная, трудно поддающаяся лечению форма заболевания с высокой частотой рецидивов метастазирования и ограниченным спектром вариантов лечения. Даже после хирургического вмешательства и другого радикального лечения частота рецидивов высока, и, как правило, таковые наблюдаются уже в первое время после лечения. В результате, как считает Миттал, необходимы более эффективные методы лечения, нацеленные именно на данный тип рака.
Для протекания многих биохимических внутриклеточных процессов крайне важно присутствие атомов металлов. Хотя железо является наиболее известным, тем не менее, медь также играет важную роль. Этот элемент необходим для протекания процесса, называемого окислительным фосфорилированием (ОФ), который является ключевым для процесса выработки энергии в митохондриях. Доктор Миттал демонстрирует, что в метастатических раковых клетках при ТНРМЖ наблюдается высокое содержание меди и повышенный уровнь ОФ по сравнению с неметастатическими клетками. Исследователи выдвинули гипотезу о том, что метастатическим клеткам может требоваться много энергии для метастазирования в другие части тела и создания некоего пула. Тем самым, блокируя биодоступность меди, можно «отключить» источник питания этих клеток, что может предотвратить их дальнейшее распространение.
Чтобы снизить содержание меди, исследователи, как и в более раннем клиническом испытании, так и в недавнем исследовании на животных применили вещество под названием тетратиомолибдат (TM), которое разрабатывалось для лечения расстройства накопления меди (болезни Вильсона). Используя мышиные модели ТНРМЖ, ученые обнаружили, что при истощении запасов меди в организме первичные опухоли хотя и продолжали расти, однако их склонность к метастазированию значительно снижалась.
В ходе более детального изучения биологии раковых клеток, подвергшихся воздействию ТМ, обнаружилось, что метаболизм этих клеток изменился таким образом, что им стало труднее вырабатывать энергию. Интересно, что это нарушение энергетического статуса запустило важнейший датчик энергетического состояния клетки — AMФ-активируемую протеинкиназу (AMФПK). В отдельном исследовании также было обнаружено, что снижение содержания меди влияет на ремоделирование коллагена в так называемых преметастатических нишах — областях организма, где метастазирующие раковые клетки с легкостью закрепляются. Это служит объяснением тому, как ТМ тормозит распространение клеток ТНРМЖ при метастазировании в отдаленные органы и ткани.
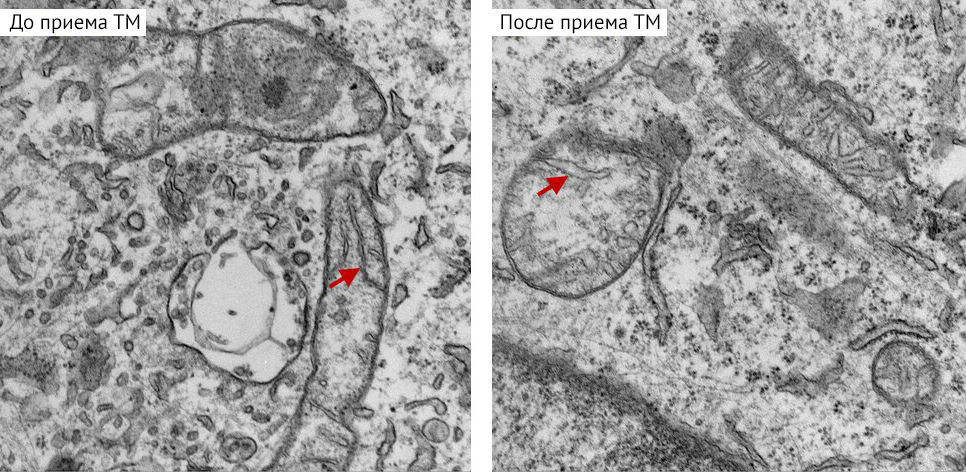
По словам Линды Вахдат, профессора из Weill Cornell Medicine, онколога в MSK, руководителя отделения онкологии и клинического директора онкологической службы больницы Норуолк, данная публикация основывается на исследовании, начатом в клинике, которое позже переместилось в лабораторию. Теперь это превратилось в поистине фундаментальную научную работу, которую авторы хотят развить в более крупное клиническое испытание.
Как сообщает доктор Миттал, исследователи используют полученные данные для планирования крупного рандомизированного исследования рака молочной железы. Оно станет II фазой испытания с участием 177 пациентов, где планируется рассмотреть использование ТМ в качестве адъювантного лечения (т. е. такого, которое назначается после завершения иного) для снижения риска рецидива у пациенток с ТНРМЖ. Ожидается, что набор испытуемых в исследование начнется осенью 2022 года посредством Консорциума трансляционных исследований рака молочной железы (Translational Breast Cancer Research Consortium) при поддержке Фонда исследований рака молочной железы и программы NCI NExT.
В более раннем испытании, по словам доктора Вахдат, у пациентов наблюдалось крайне мало побочных эффектов от приема ТМ (кратность приема которого в таблетированной форме составляет два или три раза в день). Происходит истощение запасов меди в организме пациентов до того уровня, при котором сохраняется протекание нормальных биохимических функций клеток, а процессы, связанные с развитием опухолей, уже не идут.
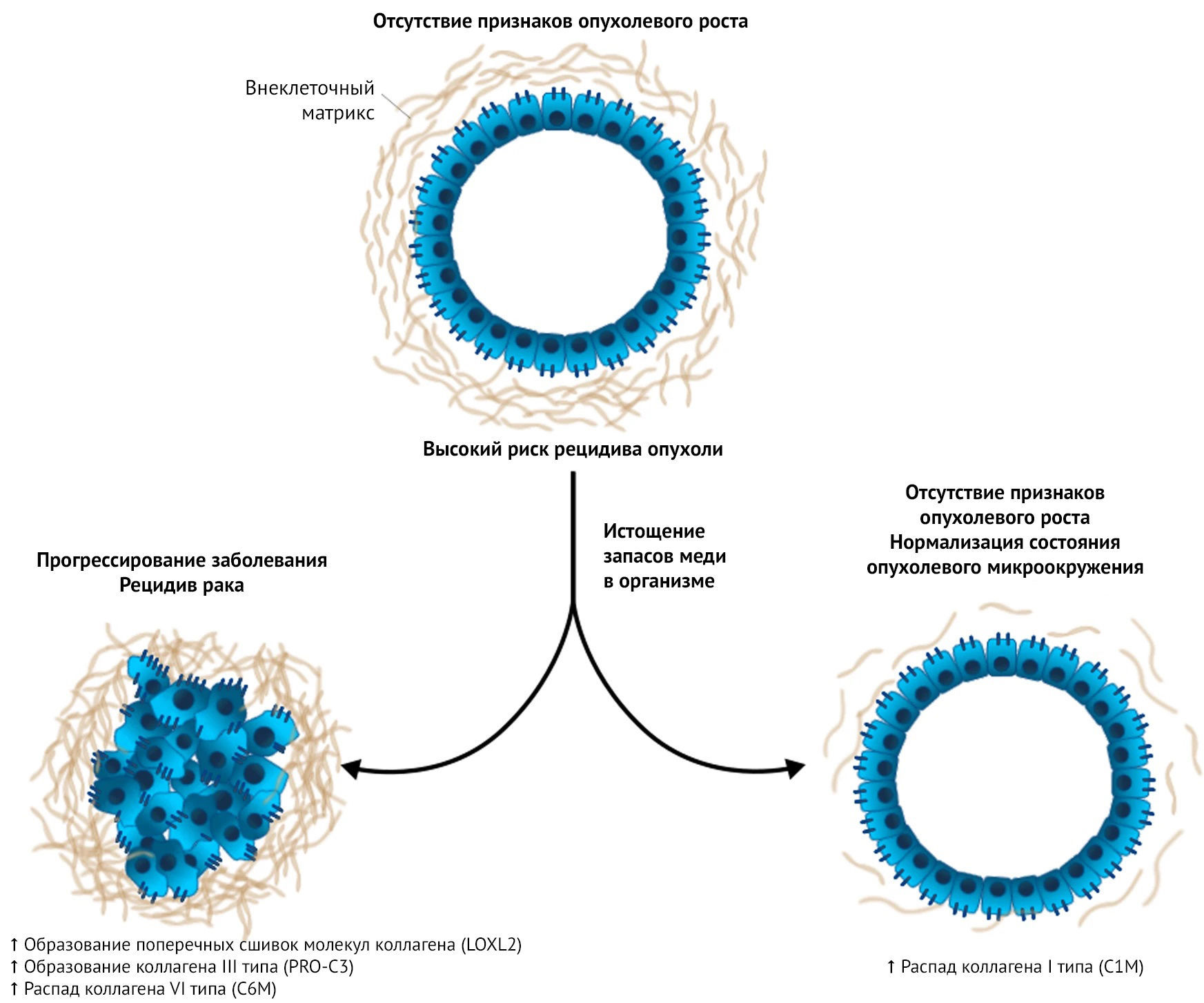
Прим. перев.: C1M, Pro-C3, C6M — одни из маркеров процессинга коллагена.
Лабораторные исследования станут важным компонентом предстоящего испытания, так как целью является подбор правильного лечения для конкретного пациента в конкретный период времени. Ученые изучат биоптаты тканей пациентов, чтобы проанализировать метаболические особенности как опухолевых, так и здоровых тканей. Доктора Миттал и Вахдат планируют перенести полученные ныне результаты в изучение метаболического репрограммирования, опосредованного медью, и изменений во внеклеточном матриксе при метастазировании ТНРМЖ, используя недавно полученный грант в размере 2,8 миллиона долларов от Национального института рака.
