Прилежащее ядро, стресс и локальная проницаемость ГЭБ
Небольшая ремарка, посвященная исследованию “Social stress induces neurovascular pathology promoting depression”, которое опубликовали в журналеNature Neuroscience в 2017 году.
Состояние хронического стресса способствует локальному повышению проницаемости гемато-энцефалического барьера (ГЭБ) в области прилежащего ядра, нарушению сосудистой архитектоники ГЭБ, повышенному образованию провоспалительных цитокинов.
Исследование заключалось в проведении серии экспериментов на мышах.
Постановка эксперимента довольно-таки интересна: мыши оказывались под воздействием хронического социального стресса, обусловленного буллингом (CSDS — chronic social defeat stress) — мышиная модель депрессии. В данном эксперименте выявляли стресс-чувствительных (Stress Susceptible — SS) мышей, у которых после теста проявлялись симптомы депрессии (избегание социального взаимодействия, апатия, ангедония), и стресс-устойчивых (resilient — RES) мышей, которые оставались психически здоровыми.
Тест представлял из себя ограниченное по времени (10 минут) избиение испытуемых мышей сородичами более крупного размера ежедневно в течение 10 дней. Затем измеряли параметры, указывающие на изменения в биологии эндотелиоцитов, ангиогенезе, сосудистой проницаемости, структуре и функции ГЭБ. К этим параметрам относились уровни экспрессии таких генов, как Pecam1, Cdh5, Vegfa, Cxcl1, Cldn-5 и других.
Важно, что уровни экспрессии мРНК Cldn-5 (наиболее важный белок плотных контактов) в прилежащем ядре (nucleus accumbens, NAc) были значительно снижены у SS-мышей относительно контрольной группы и группы RES-мышей, и уровень экспрессии мРНК Cldn-5 коррелировал с избеганием испытуемыми социального взаимодействия (т. е. мышь забивалась в угол клетки для предотвращения всякого взаимодействия с другими мышами). В гиппокампе уровень Cldn-5 был ниже у обеих групп по сравнению с контрольной, тем не менее, у RES-мышей уровень экспрессии Cldn-5 был значительно выше в сравнении с таковым у SS-мышей. Ни в префронтальной коре (PFC), ни в гипоталамусе таких изменений не было найдено.
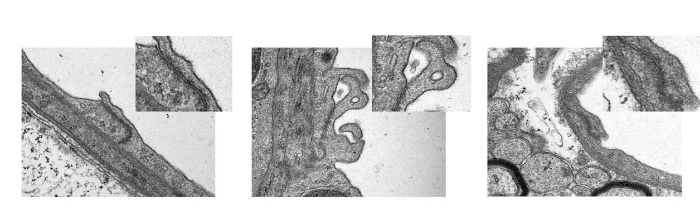
На трансмиссионной электронной микроскопии видны нарушения плотных контактов у SS мышей (2-ая фотография)
Вклад хронического стресса в развитие депрессии доказывает еще и то, что мыши, которым давали антидепрессанты, пошли на поправку. Длительный прием имипрамина мышами из SS группы (в течении 35 дней) продемонстрировал снижение у них депрессивной симптоматики, а также повышение экспрессии Cldn-5 в NAc, по сравнению с SS-группой, оставшейся без антидепрессантов.
Положительный эффект на мышах не доказывает наличие такого же эффекта у людей. Далее необходимо проиллюстрировать патогенетическую обоснованность происхождения психопатологической симптоматики из-за локальной проницаемости ГЭБ, сниженного уровня экспрессии Cldn-5 и эффект от приема антидепрессантов на человеческой модели.
Были проанализированы две когорты пациентов (Техасская и Монреальская) с большим депрессивным расстройством (БДР), окончивших жизнь самоубийством, путем посмертного изучения их мозга. Около половины в каждой из когорт не принимали антидепрессанты.
В Монреальской когорте, уровни Cldn-5 в NAc у лиц, которые никогда не принимали никакие антидепрессанты, были снижены по сравнению с контрольной группой.
В Техасской когорте не было замечено вышеописанных корреляций. Также в обеих представленных выше когортах изменений ни в PFC, ни в гиппокампе по сравнению с контрольной группой обнаружено не было. Возможно, отсутствие эффекта от лечения и послужило причиной суицида в большинстве случаев БДР.
Так или иначе, снижение Cldn-5 может быть частично специфичным для аффективных расстройств, так как не было найдено никаких изменений при посмертном исследовании NAc у пациентов, употреблявших кокаин, относительно контрольной группы.
В следующем эксперименте на мышах, не подверженных стрессу, была проведена стереотаксическая инъекция адено-ассоциированного вируса, способного активировать shРНК (короткие образующие шпильки РНК) белка клаудина-5, внутрь NAc. Активация shРНК достигалась последующим введением данным мышам (мыши-AAV-shRNA-Cldn-5) доксициклина (прим. — тем самым исследователи сумели подавить экспрессию Cldn-5 именно в NAс). Подобная процедура была также проведена и у другой группы мышей (мыши-AAV-shRNA), экспрессия Cldn-5 у которых не была затронута.
Через 2 недели половина мышей была подвергнута подпороговому стрессу, состоящему из трех пятиминутных боев (после каждого боя мышам был предоставлен 15 минутный отдых) с крупными и агрессивными мышами. Уточнение! Без проведения про-депрессивных манипуляций этот протокол оказался бы бесполезен для активации депрессивного поведения, и, таким образом, не мог быть использован для определения факторов восприимчивости к стрессу.
В дальнейшем у всех AAV-инъецированных мышей были оценены депрессия и тревожность. Потеря Cldn-5 сама по себе не вызывала депрессии, однако когда ее комбинировали с подпороговым стрессом, суммарно это приводило к активации депрессивного поведения. Депрессия проявлялась в виде снижения груминга (ангедония), ранней иммобилизации в стрессовом плавательном тесте (мышь отправляют плавать в стеклянный цилиндр, заполненный водой, засекая время, в течение которого мышь будет продолжать совершать попытки выбраться), а также апатии, проводя свой досуг в части клетки, недоступной для взаимодействия с другими мышами. У контрольной группы и у AAV-shRNA мышей таких симптомов не наблюдалось. Инъекция в гиппокамп показала схожий эффект, отличия были только в отсутствии изменений в груминге.
На МРТ с контрастом у SS-мышей и у AAV-shRNA-Cldn-5 мышей прослеживалось явное повышение проницаемости ГЭБ в области NAc по сравнению с контрольной группой, RES и AAV-shRNA-мышами.
Кроме того, у SS-мышей с помощью иммуногистохимии и проточной цитометрии выявили повышенную экспрессию CCR-2 (C-C chemokine receptor 2–expressing). CCR-2 способствует миграции иммунных клеток к источнику воспаления. У SS-мышей наблюдалась аккумуляция моноцитов в желудочках мозга и в сосудах NAc.
Локальная аккумуляция IL-6 в NAc у SS была выявлена с помощью ретроорбитальной инъекции рекомбинантного мышиного IL-6, связанного с биотином, который затем подсвечивался маркированными антителами к биотину (т. е., с помощью флюоресценции). В других регионах мозга таких особенностей не было выявлено. В контрольной группе и RES-группе после инъекции не было выявлено аккумуляции IL-6.
Подавление синтеза Cldn-5 при помощи AAV-shRNA способствовала инфильтрации IL-6, связанным с биотином, внутрь паренхимы NAc.
Мышам, ранее не подвергавшимся стрессу, имплантировали канюлю прямо в NAc. Им вводили IL-6 или плацебо, сравнивая результат, а также подвергали этих мышей стрессу.
Выявлено: стресс + IL-6 = активирует избегание социального взаимодействия; стресс + плацебо = не вызывает избегание социального взаимодействия; отсутствие стресса + плацебо или IL-6 = не вызывают избегания социального взаимодействия. То есть в данном эксперименте явно показано взаимодействие стресса и провоспалительного цитокина IL-6 в формировании депрессии.
Таким образом можно пронаблюдать, что стресс + локальная проницаемость ГЭБ в NAc + локальный иммунный ответ = депрессивное поведение. Устранение одного из компонентов приводит к разрушению всей системы и устранению депрессии.
Источник:
Menard C. et al. Social stress induces neurovascular pathology promoting depression //Nature neuroscience. – 2017. – Т. 20. – №. 12. – С. 1752.
