Генетически-модифицированные близняшки
Первые генетически-модифицированные близняшки родились в Китае. Генетик Hi Jiankui из Южного университета науки и технологий в Шэньчжэне. Выложил видео из лаборатории и рассказал о своем эксперименте:
Hi Jiankui с помощью генной инженерии на клеточном уровне на момент оплодотворения смог вырезать ген CCR5 из цепей ДНК. Один из родителей близняшек (Лулу и Нана), является носителем вируса ВИЧ.
CCR5 (C-C chemokine receptor type 5) — белок человека, кодированный данным геном, относится к подклассу рецепторов бета-хемокинов из класса интегральных белков. Хемокин — белок адгезии, относится к семейству цитокинов, контролирующих клеточную миграцию, инициирует иммунный ответ и хемотаксис клеток. Рецепторы к хемокинам сопряжены с G-белком и находятся на поверхности CD4, CD8 и T-клеток. CCR5 — является коферментом для проникновения (М-тропных) штаммов ВИЧ-1 в клетку.
Вирус проникает в клетку с помощью двух рецепторов: сначала взаимодействует с CD4, который закрепляет и захватывает гликопротеин, затем CCR5 приближается к комплексу CD4-ВИЧ и связывается с ним. Это влияет на конформацию вирусного гликопротеина gp41, вследствие чего вирус проникает в мембрану и инфицирует клетку. Данный механизм отражен на рисунке 1.
Инфицированный организм продуцирует от одного до десяти миллиардов вирусных частиц в день. Среднее время полного истощения CD4 и начала развития симптомов СПИДа, составляет 10 лет.
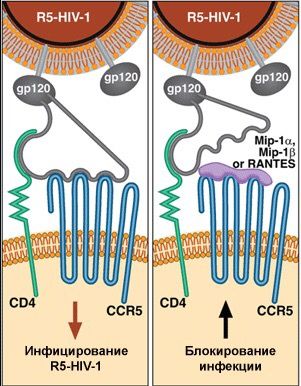
Рисунок 1. Поражение клетки ВИЧ-1
В генетике известны мутации CCR5-Δ32, которые делают человека невосприимчивым к ВИЧ-1. Данная мутация в гетерозиготном состоянии уменьшает риск инфицирования, а в гомозиготном сводит этот риск к 1 %.
Для того, чтобы вырезать CCR5 ген, Hi Jiankui воспользовался методом CRISPR/Cas9. CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — регулярно сгруппированные, разделенные короткие палиндромные повторы. CRISPR/Cas9 — система адаптивного иммунитета состоящая из двух частей: CRISPR-кассета и прилегающий к ней кластер генов Cas. Кассета — блок палиндромных повторов перемежающихся со спайсерами (прим.: спайсеры — участки нетранскребируемой ДНК, «память» об инородном генетическом материале). Cas9 — нуклеаза, разрезающая ДНК, выделенная из культуры Streptococcus pyogenes (возбудитель скарлатины). Лидирующая последовательность играет роль промотора, с которого начинается транскрипция CRISPR на РНК. Получившаяся молекула РНК с помощью РНКазы III разрезается на фрагменты CRISPR РНК (crРНК), в состав которой входит спайсер и кусочки повторов. Для активации Cas9 белка необходима tracrРНК (trans-activating CRISPR RNA), которая закодирована рядом с Cas-кластером. Следующим этапом идет образование интерференционного функционального модуля (рабочая иммунная единица), который состоит из дуплекса crРНК-tracrРНК и связанного с ним белка Cas9. Чтобы комплекс crРНК- tracrРНК-Cas9 узнал закодированный участок ДНК, необходимо наличие РАМ (protospacer adjacent motif).
 Рисунок 2. Механизм работы CRISPR/Cas9 системы
Рисунок 2. Механизм работы CRISPR/Cas9 системы
Для генной инженерии ученые генетики усовершенствовали CRISPR/Cas9: поместили на векторы (молекулы нуклеиновой кислоты ДНК, используемые для передачи генетического материала внутрь клетки in vivo) ген Cas9-белка и CRISPR-кассеты, спайсеры запрограммировали идентично участку, который необходимо изменить. Ученые смогли объединить crРНК и tracrРНК в молекулу sgРНК (single guide РНК) и заменить РНКазу III на другие рибонуклеазы. В итоге получилась простая двухкомпонентная система: ген cas9 и CRISPR-кассета транскрибируются в клеточном ядре. CRISPR-транскрипт после транскрипции нарезается на отдельные sgРНК, которые объединяются с белками Cas9 и ищут комплементарный участок в геноме, в котором в дальнейшем наблюдается сплайсинг. Далее репарация идет по двум альтернативным путям: негомологичное соединение концов (просто сшивание), или гомологичная рекомбинация (с двух концов комплементарных участков-«заплаток»).
Генетический эксперимент получил широкую огласку и критику со стороны мировой общественности и министерства здравоохранения Китая. Относительно ученого будет собрана комиссия, поскольку его действия сочли не гуманными и неправомерными.
Считаете ли вы этичным модифицировать гены еще не рожденных эмбрионов?
Источники
1) Wright A.V., Nuñez J.K., Doudna J.A. Biology and applications of CRISPR systems: harnessing nature’s toolbox for genome engineering. Cell. 2016, 29–44;
2) Ebina H., Misawa N., Kanemura Y., Koyanagi Y. Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. 2013;
3) K., Kaminski R., Gordon J., Cosentino L., Hu W. Genome editing strategies: potential tools for eradicating HIV-1/AIDS. J. Neurovirol. 2015 310–321;
4) Liao H.K., Gu Y., Diaz A., Marlett J., Takahashi Y., Li M. et al. Use of the CRISPR/Cas9 system as an intracellular defense against HIV-1 infection in human cells. Nat. Commun., 2015;
5) Haworth G.H., Peterson C.W. CCR5-edited gene therapies for HIV cure: Closing the door to viral entry. J. Cytotherapy 2017, 1325-1338;
6) Espy N., Pacheco B., Sodriski J., Adaptation of HIV-1 to cells with low expression of the CCR5 coreceptor, 2017 90-107;
7) Chira S., Gulei D., Hajitou A. Et al. CRISPR/Cas9: Transcending the Reality of Genome Editing J. Molecular Therapy 2017, 211-222.
