HER2: известные данные о роли рецептора фактора роста в онкогенезе и новые технологии направленной на него терапии

Одной из наиболее серьезных проблем онкологии настоящего времени является высокая распространенность рака молочной железы. Поверхностным маркером такой опухоли зачастую является HER2 — рецептор фактора роста, о котором и пойдет речь в данном материале.
HER2 (human epidermal growth factor receptor 2, человеческий рецептор эпидермального фактора роста 2 типа) представляет собой гликопротеиновый рецептор, ассоциированный с поверхностью мембран клеток эпителиального и мезенхимального происхождения. HER2 относится к семейству рецепторов тирозинкиназ, которое включает 4 подтипа белков: HER1 или EGFR, HER2, HER3 и HER4 [1]. Активация рецепторов этого семейства обычно протекает после связывания с соответствующими лигандами. Однако HER2 на поверхности клетки постоянно находится в активной конформации, образуя гомодимеры или гетеродимеры с другими рецепторами своего семейства [2].

Рисунок 1 ❘ Типичное строение мономерного HER2 с внеклеточным, трансмембранным и внутриклеточным доменами.
В норме HER2 необходим для нормального развития молочных желез, в большом количестве присутствует на поверхности недифференцированных клеток эмбриона. Кроме того, HER2 был обнаружен в тканях почек, сердца, органов желудочно-кишечного тракта. Основным физиологическим эффектом этого рецептора является запуск клеточной пролиферации и подавление апоптоза [3]. В негативных условиях именно это действие HER2 становится основой развития многих злокачественных новообразований.
Структура HER2 кодируется протоонкогеном ERBB2, в структуре которого в случае развития опухоли зачастую обнаруживаются соматические мутации. Мутации могут влиять на строение как внеклеточного, так и трансмембранного участка HER2. При наличии таких измененных доменов сигнальные пути, поддерживающие опухолевый рост, функционируют даже в том случае, если в организме присутствуют нормальные копии гена данного рецептора [2]. Тип мутаций в гене ERBB2 определяет степень чувствительности опухоли к действию терапевтических агентов. Наибольшее число мутаций в гене HER2 обнаружено при нейроэндокринных опухолях предстательной железы, раке мочевого пузыря и плоскоклеточных карциномах. Кроме того, участие гена HER2 в онкогенезе доказано на примере его амплификации, обнаруживаемой при опухолях молочных желез и гастроэзофагеальных новообразованиях. Частота встречаемости мутаций и амплификаций ERBB2 в опухолях различного типа неодинакова.
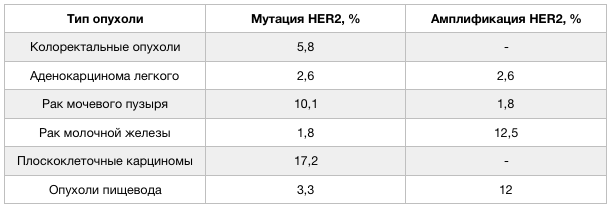
Рисунок 2 ❘ Частота встречаемости мутаций и амплификаций гена HER2 при различных опухолях.
Прогностические данные в отношении опухолей, связанных с мутацией и амплификацией гена HER2, также различаются. При раке молочной железы отмечен меньший процент выживаемости пациентов, опухоль которых была вызвана мутацией гена. В случае немелкоклеточного рака легкого такой взаимосвязи выявлено не было. Для других распространенных опухолей подобная корреляция также не отмечалась, либо данные исследований неоднозначны [3].
Повышение выработки HER2 отмечается в 20 % случаев рака молочной железы и является негативным прогностическим фактором. Агрессивность роста и инвазии HER2-положительных опухолей связана с функционированием его как рецептора фактора роста, активирующего сигнальные пути, которые запускают рост и дифференцировку клеток, а также подавляют апоптоз. Кроме того, HER2-положительные опухоли часто являются малодифференцированными и имеют большую вероятность метастазирования в регионарные лимфоузлы и отдаленные органы [4].
Количество HER2 на поверхностях опухолевых клеток значительно, что позволяет достоверно отличать нормальные клетки от злокачественно измененных, используя методы иммуногистохимии и FISH. Кроме того, мутации в гене ERBB2 определяются современными методами генетических исследований, о чем было рассказано в материале про наследственные опухолевые синдромы (https://medach.pro/post/1858).
Современные технологии позволяют использовать для лечения HER2-позитивных опухолей высокоэффективные препараты таргетной терапии, внедрение которых существенно повлияло на общую выживаемость пациентов. Особенностью строения HER2 является крайняя стабильность эпитопов внеклеточных доменов, что позволяет эффективно исследовать и тестировать средства таргетной терапии. Такие препараты разрабатываются на основе моноклональных антител, ингибиторов малых молекул и препаратов-конъюгатов.
Наиболее распространены препараты моноклональных антител (например, трастузумаб), которые имеют двойной эффект: с одной стороны, они связываются с юкстамембранным и димеризационным доменами HER2, прекращая их активность, с другой стороны, обладают прямым цитотоксическим эффектом. Ингибиторы малых молекул (такие, как лапатиниб) снижают внутриклеточную каталитическую активность, прекращая таким образом функционирование сигнальных путей, ассоциированных с ростом опухолевой клетки. Препараты-конъюгаты имеют множественное действие в отношении опухолей и в настоящее время показывают более высокую эффективность в сравнении с изолированным применением препаратов моноклональных антител [5].
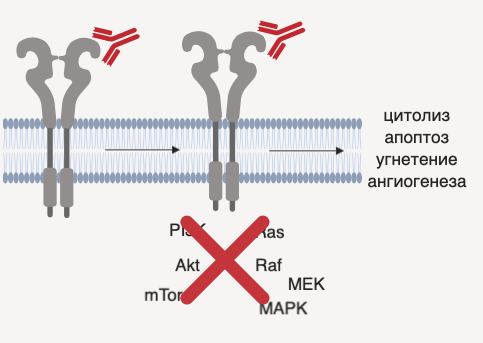
Рисунок 3 ❘ Принцип действия препаратов моноклональных антител, активных в отношении HER2.
Важным аспектом таргетной терапии HER2-позитивных новообразований является выработка резистентности опухолей к препаратам моноклональных антител. Снижение эффективности таких препаратов наблюдается у пациентов с крайне высокой концентрацией рецептора на поверхности опухолевых клеток. Резистентность к трастузумабу в настоящее время отмечается у 60 % пациентов и реализуется несколькими путями, например, путем снижения синтеза внеклеточных доменов HER2 в опухолевых клетках. В тканях подобных опухолей отмечается накопление карбоксилированных внутриклеточных доменов HER2, которые в будущем могут стать предикторами резистентности опухоли к трастузумабу [6]. Еще одним механизмом, связанным с формированием резистентности опухоли к препаратам таргетной терапии против HER2, является эпителиально-мезенхимальный переход [2]. Подобная тенденция требует поиска новых стратегий лечения. Так, показали себя эффективными комбинации HER2-направленных агентов и двойных блокаторов HER2. В сравнении с трастузумабом более эффективными оказываются препараты биспецифичных антител (например, эртумаксомаб) [7]. Несомненно, разработки в этой области должны продолжаться. Главной целью исследовательской работы в направлении изучения HER2 становится снижение смертности пациентов от рака молочной железы, опухолей легких и желудка, а также улучшение долгосрочных прогнозов при лечении таких новообразований.
Источники
1. HER2 in breast cancer stemness: a negative feedback loop towards trastuzumab resistance. / Babak Nami, Zhixiang Wang. // Cancers (Basel). - 2017. - Vol. 9, №3. - p. 40.
2. Activating HER2 mutations as emerging targets in multiple solid cancers. / Claire M Connell, Gary J Doherty. // ESMO Open. - 2017. - Vol. 2, №5.
3. HER2-positive gastric cancer. / Narikazu Boku. // Gastric cancer. - 2014. - Vol. 17, №1. - p. 1-12.
4. Emerging treatments for HER2-positive early-stage breast cancer: focus on neratinib. / Hampig Raphael Kourie, Elie El Rassy, Florian Clatot [et al]. // Onco Targets Ther. - 2017. - Vol. 10. - p. 3363-3372.
5. Treatment of HER2-positive breast cancer. / Maria Christina Figueroa-Magalhaes, Danijela Jelovac, Roisin Connolly, Antonio C Wolff. // Breast. - 2014. - Vol. 23, №2. - p. 128-136.
6. HER2-directed therapy: current treatment options for HER2-positive breast cancer. / Ahmed S, Sami A, Xiang J. // Breast Cancer. - 2015. - Vol. 22, №2. - p. 101-116.
7. Development and clinical application of anti-HER2 monoclonal and bispecific antibodies for cancer treatment. / Shengnan Yu, Qian Liu, Xinwei Han [et al]. // Exp Hematol Oncol. - 2017. - Vol. 6, №31.
