Стволовые клетки слизистой оболочки желудка: от современной терминологии к перспективной канцерпревенции
Рак желудка (РЖ) является глобальной проблемой в здравоохранении. Несмотря на успехи в лечении, вследствие частого рецидивирования и метастазирования опухолей общий прогноз неблагоприятный [1]. Необходим поиск новых терапевтических подходов для улучшения клинических исходов РЖ. Модель раковых стволовых клеток (РСК) предложена для объяснения опухолевой гетерогенности, определяющей высокую частоту рецидивов и резистентность к системной терапии [2]. РСК идентифицированы во многих солидных злокачественных опухолях, включая РЖ. Воздействие на активное меньшинство РСК может увеличить эффективность терапии [3].
Опухолевая гетерогенность
Большинство опухолей имеет моноклональное происхождение, но к моменту обнаружения она состоит из генетически, эпигенетически и фенотипически гетерогенных клонов. Две основные концепции пытаются объяснить эту гетерогенность: гипотеза раковых стволовых клеток и модель клональной (стохастической) эволюции (рис. 1).
Модель клональной эволюции предполагает, что каждая опухолевая клетка обладает способностью инициировать образование опухоли. Прогрессия направляется редкими стохастическими событиями, происходящими во всех клетках. Клетки с мутациями, которые дают преимущество в росте, будут преобладать над остальными клетками опухоли и могут образовать новый клон, содержащий клетки различного фенотипа, имеющие различный пролиферативный потенциал [4–6].
Теория РСК, сформулированная в 1997 году [7], базируется на утверждении, что в структуре популяций опухолевых клеток существует четкая иерархия, на вершине которой находится популяция трансформированных клеток, имеющих сходные с нормальными стволовыми клетками свойства. РСК называют опухоль-инициирующими клетками (tumor-initiating cells, TIC) или опухоль-генерирующими клетками (tumor-propagating cells, TPC) [8,9]. Согласно концепции, популяция РСК:
- Составляет незначительную долю общей популяции клеток опухоли;
- Экспрессирует специфический набор поверхностных маркеров;
- Селективно поддерживает способность к онкогенезу в отличие от других популяций опухолевых клеток;
- Поддерживает рост гетерогенной массы, содержащей полный набор частично (или полностью) дифференцированных раковых клеток;
- Образует отдельный пул клеток, идентифицируемый биологическими и физико-химическими методами (по меньшей мере два пула клеток в опухоли: РСК и их производные — дифференцированные в разной степени клетки);
- Проявляет способность, подобно нормальным стволовым клеткам, к неограниченному самообновлению и дифференцировке по многим направлениям [9];
- Проявляет высокую устойчивость к стандартной терапии [2].
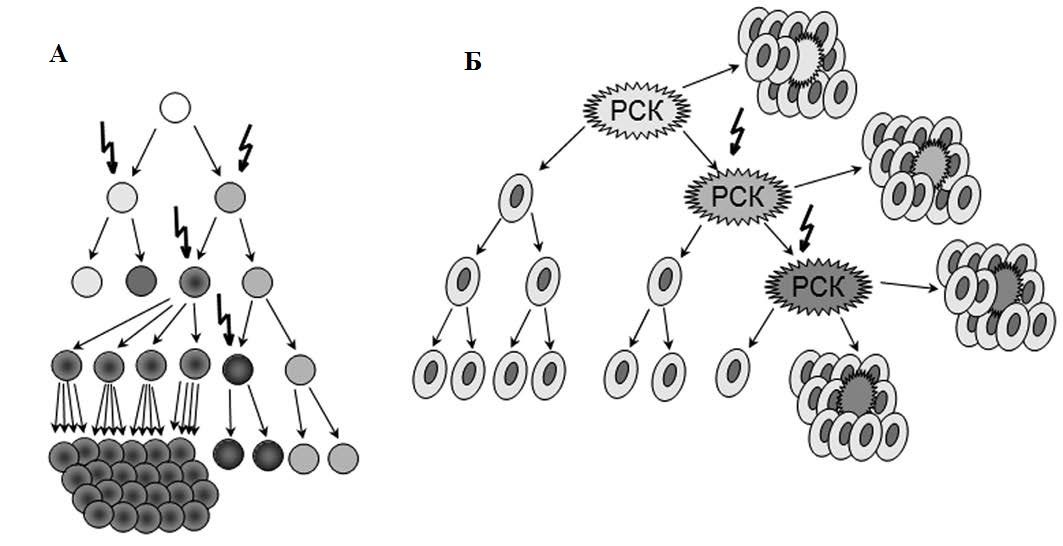
Рис. 1 | Модели опухолевой гетерогенности. А — эволюционная стохастическая модель; Б — иерархическая модель раковых стволовых клеток [5].
Самообновление желудочного эпителия и стволовые клетки желудка (СКЖ)
Строение слизистой оболочки желудка человека гистологически неоднородно. Принципиально отличают фундальные и антральные желудочные единицы [10]. Непрерывное клеточное обновление желудочного эпителия происходит за счет пролиферации и дифференцировки мультипотентных СКЖ, впервые обнаруженных в области перешейка желез. Эти недифференцированные клетки обладают двумя определяющими характеристиками. Во-первых, они способны длительно поддерживать свою популяцию (самообновление). Во-вторых, взрослые стволовые клетки являются источником всех клеточных линий желудочных единиц из-за асимметричных делений, ведущих к различным типам клеток-предшественников, которые пролиферируют (транзиторные амплифицирующиеся клетки) и дифференцируются в зрелые клетки (мультипотентность) [11]. В регуляции СКЖ участвуют следующие сигнальные пути: Wnt/[beta]-катенин (активация самоподдержания и ингибирование дифференцировки), киназа PI3K/Akt (рост, выживание и пролиферация клеток), трансформирующий фактор роста [beta] (TGF-[beta]) (ингибирующее влияние на пролиферацию клеток) и инсулиноподобный фактор роста 1. Ниша стволовых клеток образует сложную динамическую систему с нервной системой и сосудистым руслом [12].
Потомки стволовой клетки распространяются в двух направлениях (к просвету и к основанию железы) и образуют три основных клеточных линии с 11 типами клеток (рис. 2):
- Поверхностные (добавочные) мукоциты: прекурсоры поверхностных мукоцитов, поверхностные пре-мукоциты, зрелые поверхностные мукоциты (AAA лектин и TFF1);
- Главные клетки: прекурсоры шеечных мукоцитов, шеечные пре-мукоциты, зрелые шеечные мукоциты (GSII лектин и TFF2), предшественники зимогенных клеток и зрелые зимогенные клетки (внутренний фактор [GIF], пепсиноген, Mist1);
- Париетальные клетки: прекурсоры париетальных клеток, пре-париетальные клетки, париетальные клетки (H/K-АТФаза и VEGF).
Темпы обновления париетальных и зимогенных клеток ниже, чем остальных [13].
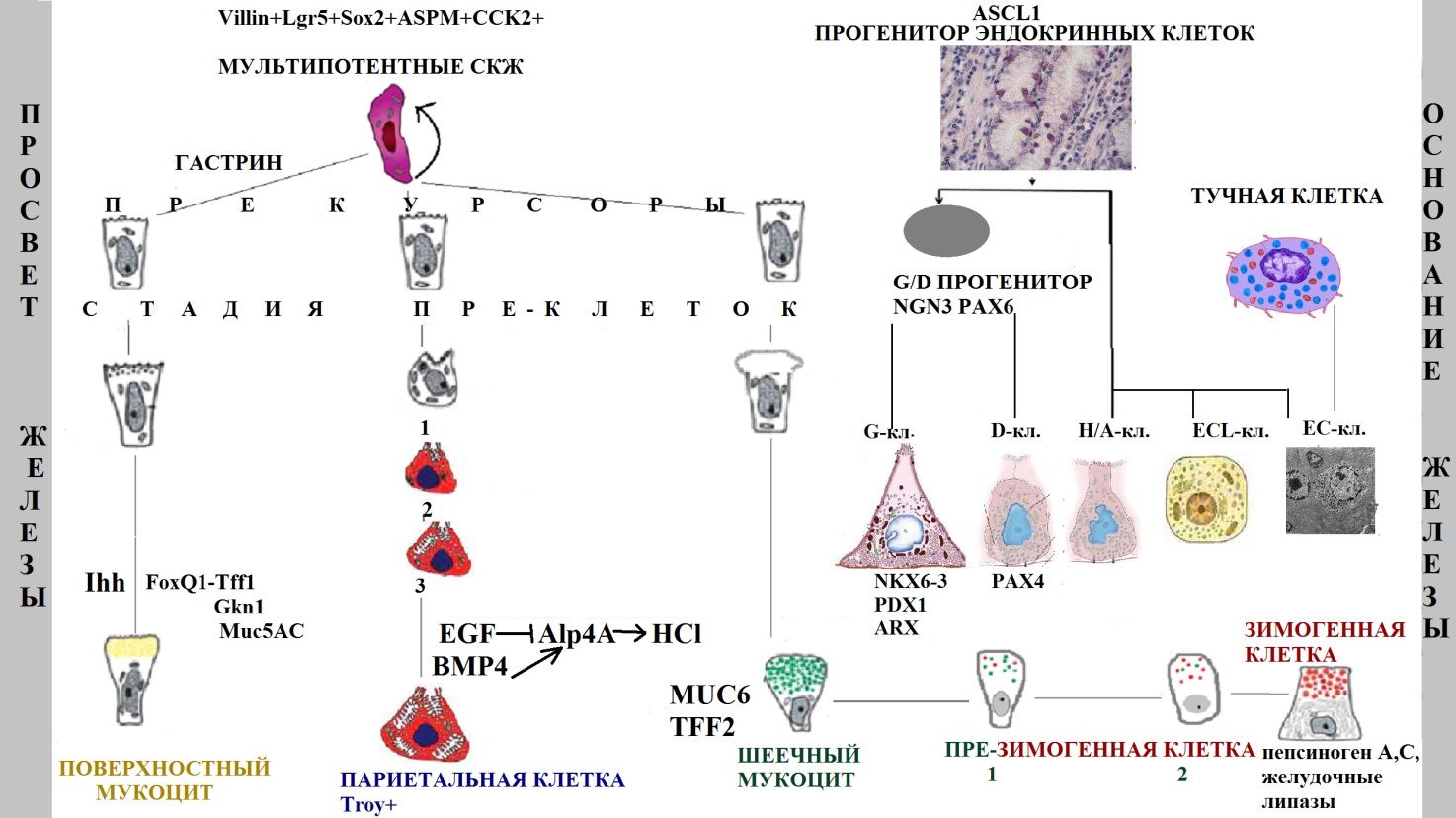
Рис. 2 | Схематическое изображение желудочной единицы человека и ее двунаправленного самообновления из мультипотентных стволовых клеток. Представлены стадии дифференцировки основных клеточных линий и некоторые из характерных секретируемых продуктов (предложена автором статьи на основе исследований [10,13,14,22]).
Также встречаются эндокринные клетки 5 основных типов: G-клетки (гастрин-продуцирующие), D-клетки (соматостатин-продуцирующие), энтерохромаффинные (EC) клетки (серотонин-продуцирующие), EC-подобные клетки (гистамин-продуцирующие) и X/A клетки (грелин-продуцирующие). В результате асимметричного деления мультипотентной СКЖ образуется эндокринный прогенитор (маркер Ascl1), под влиянием различных транскрипционных факторов подвергающийся коммитированию в определенную клеточную линию. Бипотентная клетка-предшественник D- и G-клеток экспрессирует маркеры NGN3 и PAX6. NKX6-3, PDX1 и ARX необходимые для ее дифференцировки в G-клетки, PAX4 требуется для продукции D-клеток. Интересно, что в теле желудка EC-клетки могут формироваться из неэпителиальных тучных клеток [14].
Молекулярные маркеры СКЖ обнаружены совсем недавно. Первым биомаркером стал виллин (Villin). Это специфичный для эпителиальных клеток кальций-регулируемый белок, модулирующий реорганизацию актиновых микрофиламентов. В отличие от активно пролиферирующих стволовых клеток перешейка, виллин-положительные СКЖ (V-СКЖ) находятся в состоянии покоя. Они расположены в нижней трети антральных желез [10].
Другая популяция СКЖ экспрессирует рецептор Lgr5, связывающий G-белок (Gpr49). Lgr5+ СКЖ (L-СКЖ) встречаются в основании фундальных и антральных желез в желудке эмбриона, но в постнатальном периоде ограничены антрумом. По аналогии с V-СКЖ, L-СКЖ также мультипотентны, но обладают высокой пролиферативной активностью [15]. Сосуществование активных и покоящихся стволовых клеток обнаружено в нескольких типах тканей. Считается, что активные стволовые клетки отвечают за физиологическое обновление ткани, а покоящиеся служат в качестве резерва, прежде всего, в случае травмы [16]. Особый интерес вызывает субпопуляция полностью коммитированных зимогенных клеток в основании фундальных желез, обладающих мультипотентностью. Эти клетки экспрессируют член суперсемейства рецепторов фактора некроза опухолей Troy. Troy+ клетки (Т-СКЖ) пролиферируют медленно и активируются после цитотоксического медикаментозного повреждения ткани [10].
Популяция СКЖ, экспрессирующая маркер Sox2 (S-СКЖ), рассеяна в перешейке фундальных и антральных желез, а также в их нижних частях. Они обладают мультипотентностью и имеют потенциал к самообновлению. Интересно, что S-СКЖ происходят из фетальных Sox2+ клеток-предшественников. S-СКЖ наиболее близки по характеристикам к СКЖ, первоначально обнаруженным в пролиферативной зоне перешейка [17].
Недавно была выделена новая популяция стволовых клеток (в позиции +4) в мышиной антральной железе с экспрессией рецептора к гастрину CCK2 (C-СКЖ). Они локализованы немного выше типичного расположения L-СКЖ. C-СКЖ способны подвергаться конверсии за счет гормонального триггера (обработка прогастрином, но не амидированным гастрином, приводит к переходу C-СКЖ в L-СКЖ) [18].
Важной проблемой является соотношение моноклонального происхождения желудочной единицы и факта неоднородности популяции стволовых клеток. Наиболее вероятной кажется конкурентная модель, которая предполагает достижение конкретной стволовой клеткой клонального доминирования [19]. СКЖ демонстрируют уникальную пластичность, перемещаясь в различных направлениях между стадиями мультипотентности и коммитированных прогениторов. Вероятным индуктором трансдифференцировки является Notch-сигналинг [20].
РСК в желудке
Поскольку РСК образуются из регионарных стволовых клеток [19], закономерно предположить связь СКЖ и РЖ. Для обнаружения предполагаемых маркеров РСК (табл. 1) были использованы два основных подхода. В первом использованы генетические манипуляции и трейсинг клеточных популяций РСК на мышиных моделях. Другой основан на изучении мышиных клеток из ксенотрансплантатов РЖ человека [21,22].
Таблица 1 | Обзор исследований иммуногистохимических маркеров РСК при РЖ.
Маркер | Функции | Статистически значимые клинико-патологические ассоциации | Источник |
CD44v9 трансмембранный (ТМ) гликопротеин | интегратор внеклеточных и внутриклеточных сигналов, регулирует пролиферацию, миграцию и дифференцировку клеток, ЭМП | низкая пятилетняя выживаемость, метастазирование в лимфатические узлы, чаще ассоциирован с РЖ кишечного типа | Hirata 2013 [23] |
CD133/Prom1 (проминин-1) гликопротеин, содержащий пять ТМ доменов | связывается с мембранным холестерином, модулирует структуру выростов плазматической мембраны и локальных мембранных доменов | метастазирование, активная инвазия, низкая пятилетняя выживаемость | Hashimoto 2014 [24] |
ALDH1 альдегид дегидрогеназа 1 | окисляет внутриклеточные альдегиды и превращает ретинол в модулятор пролиферации — ретиноевую кислоту, гиперрегуляция усиливает пролиферацию, устойчивость к алкилирующим агентам и защиту от окислительного стресса | метастазирование, глубокая инвазия, чаще ассоциирован с РЖ диффузного типа | Nishikawa 2013 [25] |
Также для идентификации РСК при РЖ были рекомендованы маркеры стволовых клеток ОСТ-4, SOX2, NANOG [26].
V-СКЖ и опухолевый супрессор Klf4. V-СКЖ сосредоточены в пределах малой кривизны антрального отдела желудка [10], места частой локализации РЖ [12]. Трансформация V-СКЖ может привести к РЖ. Транскрипционный фактор Klf4 (Kruppel-like factor 4) принадлежит к Klf-семейству «цинк-пальцевых» и активно экспрессируется в кишечнике, является одним из четырех транскрипционных факторов «коктейля Яманаки», достаточных для трансформации фибробластов в индуцированные плюрипотентные стволовые клетки [27]. Снижение экспрессии Klf4 ассоциировано с РЖ и прогрессией опухоли, что позволяет рассматривать его как опухолевый супрессор [12]. Удаление Klf4 в мукоцитах мышиного желудка с использованием трансгена Foxa3-Cre, экспрессирующего Cre рекомбиназу (cyclic recombinase), приводит к распространению гипертрофии и предраковой метаплазии в антральном и фундальном отделах в течение 6 месяцев [28]. В этой модели инициация опухоли значительно ускоряется при введении химического мутагена N-нитрозо-N-метилмочевины (НММ). При этом желудочные аденомы не прогрессируют в аденокарциномы даже в присутствии НММ, что свидетельствует о необходимости дополнительных генетических мутаций для прогрессирования рака. Тем не менее, эти исследования установили роль трансформации V-СКЖ в возникновении РЖ, а также супрессорную активность Klf4 [29].
РСК желудка костномозгового происхождения
Мультипотентные мезенхимальные стволовые клетки (ММСК) костного мозга в условиях хронического воспаления мигрируют в слизистую оболочку желудка, где активно взаимодействуют с микросредой. В условиях «нездорового» микроокружения (избыток активных форм кислорода (АФК) и хроническое воспаление) ММСК может спровоцировать появление аденокарциномы [30].
H. pylori (HP) и дизрегуляция самообновления желудочного эпителия
H. pylori-индуцированный хронический гастрит является самым важным фактором риска для некардиального РЖ [12]. HP-инфекция приводит к характерным провоспалительным сигналам: активации факторов ядерной транскрипции NF-kB и АР-1, высвобождению интерлейкина-8 (IL-8) и фактора некроза опухоли альфа (TNF[alpha]). HP способны колонизировать антральные железы, что приводит к изменению динамики самообновления клеток за счет пролиферации L-СКЖ. Предполагается, что HP-инфекция связана с повреждением ДНК в L-СКЖ [31].
Отличительной чертой карцином (эпителиальных опухолей) является изменение фенотипа клеток для обретения инвазивных свойств. Например, изменение полярности клетки: из апикально-базолатерального (в эпителиальных клетках) в плоский тип (мезенхимальный фенотип). Этот процесс известен как эпителиально-мезенхимальный переход (ЭМП) [26]. Опухолевые клетки, подвергшиеся ЭМП, переходят в стволоподобное состояние (экспрессия Bmi1). HP-инфекция инициирует ЭМП с помощью фактора транскрипции ZEB1 и микроРНК miR-200. Классический маркер эпителиального фенотипа Е-кадгерин/CDH1 не экспрессируется в мезенхимальных клетках, что способствует утрате межклеточных контактов и инвазивному росту. Многочисленные исследования установили связь CDH1 мутаций с развитием наследственного РЖ диффузного типа [32].
Новые подходы к терапии РЖ
РСК желудка можно отличить по их способности накапливать флуоресцентный краситель Hoechst 33342 (анализ родственной популяции). По сравнению с их дифференцированными дочерними клетками, РСК желудка также известны своей повышенной устойчивостью к химио- и радиотерапии, ассоциированы с частыми рецидивами. Такая «сверхтуморогенность» позволяет рассматривать РСК-таргетную терапию в качестве перспективной стратегии лечения РЖ. Потенциальными мишенями являются транскрипционные факторы TR3 и Atoh1, а также лиганды B7-H1 и SHH [33].
Многочисленные исследования механизмов регуляции взрослых стволовых клеток позволили предположить, что стволовые клетки могут функционировать и в опухолях, являясь центральными элементами их развития. Такие клетки получили название раковых стволовых клеток (РСК). Концепция РСК актуальна и для РЖ. Гастроканцерогенез включает в себя довольно широкий спектр патологических процессов, обусловленных дизрегуляцией дифференцировки популяций нормальных СКЖ. СКЖ рассматривают как неоднородную популяцию, имеющую разный состав в фундальном и антральном отделе (соответственно Т-, L-, S- и L-, C-, S-, V-СКЖ). Тем не менее многие вопросы остаются неразрешенными. Так как все популяции СКЖ (Villin+, Lgr5+, Troy+, CCK2+ и Sox2+ клетки) были идентифицированы в мышиных моделях, наличие их в желудке человека должно быть установлено экспериментально. Перешеек желудочной железы уже не является единственным средоточием СКЖ. Они обнаружены в области дна железы (T-, L-СКЖ) и выше (C-СКЖ). Существенные различия наблюдаются и в темпах пролиферации: часть СКЖ находится в покоящемся состоянии (покоящаяся резервная популяция), в то время как другие клетки активно пролиферируют (основа постоянного самообновления эпителия). Многочисленные свидетельства того, что РСК инициируют рост и метастазирование опухоли подчеркивают необходимость создания новых противоопухолевых препаратов, уничтожающих именно данную популяцию клеток. Является перспективной таргетная терапия (индукция дифференцировки РСК в более зрелые раковые клетки, блокировка сигнальных путей, таких как Wnt и Notch, введение антител к поверхностным белкам клеточной мембраны РСК) и иммунотерапия.
Источники:
1. Siegel, R.L., K.D. Miller and A.Jemal, 2015.Cancer statistics. CA Cancer J Clin., 65(1):5-29.
2. Vermeulen, L. et al., 2012.The developing cancer stem-cell model: clinical challenges and opportunities. Lancet Oncol., 13(2):83-89.
3. Dewi, D.L. et al., 2011.Cancer stem cell theory in gastrointestinal malignancies: recent progress and upcoming challenges. J Gastroenterol., 46(10):1145-1157.
4. Beck,B. and C. Blanpain, 2013.Unravelling cancer stem cell potential.Nat Rev Cancer.,13(10):727-738.
5. O'Connor, M.L. et al., 2014. Cancer stem cells: A contentious hypothesis now moving forward. Cancer Lett., 344(2):180-187.
6. Greaves, M. and C.C. Maley, 2012. Clonal evolution in cancer. Nature, 481(7381):306-313.
7. Bonnet, D. and J.E. Dick,1997.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med.,3(7):730-737.
8. Valent, P.et al., 2012. Cancer stem cell definitions and terminology: the devil is in the details. Nature Review Cancer, 12(11):767-775.
9. White, A.C. and W.E. Lowry, 2015.Refining the role for adult stem cells as cancer cells of origin. Trends Cell Biol., 25(1):11-20.
10. Hoffmann, W.,2015.Current Status on Stem Cells and Cancers of the Gastric Epithelium. Int J Mol Sci., 16(8):19153-19169.
11. Karam, S.M. and C. P. Leblond, 1993. Dynamics of epithelial cells in the corpus of the mouse stomach. I. Identification of proliferative cell types and pinpointing of the stem cell. Anat Rec., 236:259–279.
12. Gomceli, I., B. Demiriz and M.Tez, 2012. Gastric carcinogenesis.World J of Gastroenterology, 18(37):5164-5170.
13. Khurana, S.S.,2013. The Mechanism of the Gastric Epithelial Stem Cell Response to Metaplastic Injury.Washington: All Theses and Dissertations (ETDs), pp:1199.
14. Willet, S.G. and J.C.Mills, 2016. Stomach Organ and Cell Lineage Differentiation: from Embryogenesis to Adult Homeostasis. Cell Mol. Gastroenterol. Hepatol., 2(5):546-559.
15. Barker, N. et al. ,2010. Lgr5 (+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell, 6(1):25-36.
16. Li, L. and H. Clevers, 2010.Coexistence of quiescent and active adult stem cells in mammals. Science, 327:542–545.
17. Carrasco-Garcia, E. et al., 2016.Paradoxical role of SOX2 in gastric cancer. Am J Cancer Res., 6(4):701-713.
18.Hayakawa, Y, et al., 2015.CCK2R identifies and regulates gastric antral stem cell states and carcinogenesis. Gut., 64(4):544-53
19. Barker, N., S. Bartfeld and H. Clevers, 2010.Tissue-resident adult stem cell populations of rapidly self-renewing organs.Cell Stem Cell,7:656–670.
20. Kim, T.H. and R.A. Shivdasani, 2011.Notch signaling in stomach epithelial stem cell homeostasis. J. Exp. Med., 208:677–688.
21. Brungs, D. et al., 2016.Gastric cancer stem cells: evidence, potential markers, and clinical implications. JGastroenterol., 6(4):313-326.
22. McCracken, K.W., E. Catá and J. Wells,2014. Modelling human development and disease in pluripotent stem-cell-derived gastric organoids. Nature,516(7531):400-404.
23. Hirata, K. et al., 2013. CD44 variant 9 expression in primary early gastric cancer as a predictive marker for recurrence. Br J Cancer, 109(2):379-386.
24. Hashimoto, K. et al., 2014. Expression of CD133 in the cytoplasm is associated with cancer progression and poor prognosis in gastric cancer. Gastric Cancer, 17(1):97-106.
25. Nishikawa, S., 2013.Aldehyde dehydrogenase high gastric cancer stem cells are resistant to chemotherapy. Int J Oncol.,42(4):1437-1442.
26. Zhao, X., F.Wang and M.Hou,2016. Expression of stem cell markers nanog and PSCA in gastric cancer and its significance. Oncology Letters, 11(1):442-448.
27. Takahashi, K.,2016.A decade of transcription factor-mediated reprogramming to pluripotency.Nat Rev Mol Cell Biol.,7(3):183-193.
28. Li, Q. et al., 2012. Disruption of Klf4 in villin-positive gastric progenitor cells promotes formation and progression of tumors of the antrum in mice. Gastroenterology, 142(3):531-42.
29.Tetreault, M.P.,2013.Krüppel-like factors in cancer. Nature Rev.Cancer:701–713.
30. Yaghoobi,M.,2015.Bone Marrow-Derived Stem Cells in Pathogenesis of Helicobacter Pylori-Associated Gastric Cancer.Clin Transl Gastroenterol., 6:100-110.
31. Bessède, E. et al., 2015. Helicobacter pylori infection and stem cells at the origin of gastric cancer. Oncogene, 34(20):2547-55.
32. Hansford, S., 2015. Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond.JAMA Oncol., 1(1):23-32.
33. Dragu, D.L. et al., 2015. Therapies targeting cancer stem cells: Current trends and future challenges. World J Stem Cells, 7(9):1185-201.
