Уязвимость раковых клеток к высоким дозам витамина С. Часть 2

Особенности метаболизма раковых клеток
Повышенный уровень неустойчивых форм железа
В присутствии редокс-активных переходных металлов, таких как железо, витамин С оказывает прооксидантное действие. Железо является важным кофактором для ряда белков. Большинству организмов требуется железо в связи с его уникальной способностью эффективно переключаться между двумя состояниями окисления — двухвалентным железом (Fe2+, восстановленное) и трехвалентным железом (Fe3+, окисленное) — в ответ на изменения лигандов в окружающей среде.
Из-за высокой реактивности биохимических свойств большая часть неустойчивых форм железа должна быть связана трансферрином в плазме, храниться в составе ферритина внутри клетки или использоваться в качестве кофакторов, таких как гем, в белки.
Клетки содержат небольшие пулы Fe2+ (~ 3–5 % или ~ 1 мкМ у человека) в цитозоле и митохондриальном матриксе для быстрого доступа к нему.
Реакция Fe2+ в этих пулах с H2O2 может привести к образованию гидроксильного радикала (•OH) посредством реакции Фентона (Часть 1, рисунок 1б). Чтобы продлить эту реакцию, аскорбат отдает электроны Fe3+ для восстановления редокс-активного Fe2+, тем самым непрерывно генерируя активные формы кислорода и способствуя гибели клеток. Многочисленные исследования клеточных культур in vitro показали, что фармакологический аскорбат продуцирует внеклеточный H2O2, способствуя гибели раковых клеток.
Однако точные механизмы данного процесса в настоящее время плохо изучены. Некоторые исследования показали, что внеклеточный H2O2 может синтезироваться посредством самопроизвольного самоокисления даже в отсутствии железа, путем взаимодействия с кислородом.
Согласно другим данным неустойчивые металлы (особенно Fe2+ в среде) катализируют самоокисление аскорбата, тем самым способствуя синтезу внеклеточного H2O2 как в бесклеточных, так и в клеточных культуральных системах.
Однако большая часть неустойчивого Fe2+ изолируется трансферрином in vivo, а эти исследования проводились in vitro.
В противовес этой гипотезе было показано, что Asc•- и H2O2 синтезируется in vivo в результате внутривенного введения аскорбата крысам (0,5 г/кг–1). В свою очередь, ежедневная внутрибрюшинная инъекция с высокой дозой аскорбата (4 г/кг–1) ингибировала рост нейробластомы на модели ксенотрансплантата, а опухоли имели повышенную активность контрольной точки киназы 2 (CHK2) и гистона 2AX (H2AX).
Предполагается, что фармакологический аскорбат способствует повреждению ДНК в опухолях in vivo, хотя in vivo связь между аскорбатом и образованием H2O2 не была продемонстрирована.
В таком случае, важный вопрос заключается в том, как внеклеточный H2O2, образующийся из фармакологического аскорбата, может быть селективно токсичным для раковых клеток. Если он синтезируется в равной степени в раковых и в нормальных клетках, независимо от точного механизма, фармакологический аскорбат не обеспечит дополнительного преимущества по сравнению с другими вариантами прооксидантной терапии в плане терапевтического окна.
Итак, авторы предполагают три механизма, с помощью которых аскорбат-индуцированная H2O2 избирательно убивает определенные типы раковых клеток.
Во-первых, микроокружение опухоли содержит много неустойчивых форм железа, реакция которого с аскорбатом приведет к образованию H2O2 и •OH, которые могут быть смертельны для раковых клеток.
Во-вторых, если опухолевые клетки имеют повышенные, по сравнению с нормальными клетками, уровни внутриклеточных неустойчивых форм железа, тогда внеклеточный H2O2 от аутоксидации аскорбата может диффундировать в опухолевые клетки и реагировать с внутриклеточными пулами неустойчивых форм железа, способствуя образованию •OH внутри опухолевых клеток.
В-третьих, внеклеточный H2O2 может способствовать повышению уровня внеклеточного дегидроаскорбата, создавая окислительное микроокружение. В результате дегидроаскорбат транспортируется в опухоли, которые экспрессируют высокие уровни транспортера глюкозы 1 (ГЛЮТ1), вызывая окислительный стресс в этих клетках.
В статье описаны два механизма, с помощью которых аскорбат-индуцированная H2O2 избирательно убивает определенные типы раковых клеток.
Железосодержащие и гемсодержащие ферменты участвуют в важных клеточных процессах, таких как клеточное дыхание, синтез ДНК, клеточный цикл и эпигенетические модификации. У раковых клеток есть высокая потребность в легкодоступном неустойчивом Fe2+. Доказано, что перепрограммирование метаболизма железа может происходить с помощью различных механизмов, включая активацию нескольких путей поступления железа или подавление путей экспорта и хранения железа при различных типах рака, таких как рак молочной железы, рак предстательной железы и лимфома.
Например, пул внутриклеточного неустойчивых форм Fe2+ в клетках рака молочной железы примерно в два раза выше, чем в нормальных эпителиальных клетках молочной железы. Кроме того, связанные с опухолью макрофаги могут способствовать выделению железа в микроокружение опухоли.
У пациентов с запущенным раком молочной железы наблюдаются значительно более высокие уровни Fe2+ в плазме, чем в контрольных группах здоровых людей. Таким образом, опухолевые клетки с высоким уровнем внеклеточных и/или внутриклеточных неустойчивых форм железа могут быть более чувствительны к применению аскорбата в высоких дозах (Часть 1, рисунок 1б).
Подтверждая эту гипотезу, недавнее исследование показало, что повышенный уровень митохондриальных активных форм кислорода в раковых клетках легких и глиобластомы приводит к повышению уровня внутриклеточных неустойчивых форм железа за счет усиления регуляции Tf-рецептора (TfR), таким образом повышая чувствительность этих раковых клеток к аскорбату.
Другое исследование показало, что в клетках множественной миеломы содержится повышенный запас неустойчивых форм железа из-за низкой экспрессии ферропортина-1, что приводит к избирательной чувствительности этих клеток к фармакологическим дозам аскорбата.
Несмотря на многообещающие доклинические исследования, остается еще много вопросов для ученых.
Увеличение потребления дегидроаскорбата через ГЛЮТ1
Метаболическое перепрограммирование опухолевых клеток, также известное как эффект Варбурга, важно для выживания и пролиферации опухолей. Онкогенные мутации KRAS и BRAF способствуют этому частично за счет повышения уровня ГЛЮТ1. Предполагается, что использование знаний о селективной экспрессии ГЛЮТ1 и повышенной потребности в гликолизе может помочь в разработке новых методов лечения рака. Высокие дозы аскорбата могут атаковать слабые места в клетках колоректального рака с мутациями KRAS или BRAF.
После введения аскорбат окисляется до ДГК (дегидроаскорбиновая кислота). Благодаря своему структурному сходству с глюкозой, ДГК эффективно поглощается через ГЛЮТ1 в KRAS и BRAF мутантных клетках. Внутри клетки ДГК быстро восстанавливается обратно в аскорбат за счет глутатиона и НАДФ, что способствует истощению внутриклеточных антиоксидантов и увеличению эндогенных уровней АФК. Это инактивирует гликолитический фермент глицеральдегид-3-фосфатдегидрогеназу (ГАФД) путем окисления остатка цистеина в активном центре. Кроме того, АФК приводит к активации поли-(АДФ-рибозо)-полимеразы (ПАРП), что в свою очередь приводит к истощению НАД+ (ключевого кофактора ГАФД), тем самым дополнительно ингибируя ГАФД (Часть 1, рисунок 1б). Ингибирование ГАФД в высоко гликолитических мутантных клетках KRAS или BRAF в конечном итоге приводит к «энергетическому кризису» и гибели клеток, чего не наблюдается у их аналогов дикого типа.
По результатам эксперимента in vitro, ежедневное внутрибрюшинное введение аскорбата (4 мкг—1) ингибировало рост опухоли у мышей с мутацией Apc–/–, KrasG12D/+, тогда как у мышей с Apc–/– не влияло на рост опухоли. Предполагается, что аскорбатная терапия может применяться и при других видах рака, если они обладают высокой экспрессией ГЛЮТ1 и высокой гликолитической активностью.
Например, недавние исследования показали, что рак желудка и фон Гиппеля-Линдау (VHL), при которых наблюдается высокая экспрессия ГЛЮТ1 и высокая гликолитическая активность, хорошо реагируют на терапию аскорбатом в высоких дозах.
Из-за нестабильности ДГК, а также химического и биологического равновесия между аскорбатом и ДГК трудно определить точное количество ДГК, полученного из аскорбата. Несмотря на эту проблему, многие исследования показали, что раковые клетки с высоким содержанием ГЛЮТ1, но с малым количеством натрий-зависимых переносчиков витамина С, поглощают аскорбат в виде ДГК как in vitro, так и in vivo. Хотя исследование показало, что ДГК является фармакологически активным агентом, важно отметить, что аскорбат (не ДГК) необходимо использовать как в доклинической, так и в составе клинической противоопухолевой терапии. Болюсное введение высоких доз ДГК оказывает только временное воздействие на раковые клетки in vitro и in vivo из-за его крайней нестабильности при нейтральном pH.
Кроме того, деградация ДГК приводит к образованию многих нежелательных химических веществ, таких как 2,3-ДКГ и оксалат, которые снижают эффективность терапии. Напротив, аскорбат имеет значительно более длительный период полураспада в среде для культивирования клеток и в плазме. Поскольку известно, что микроокружение опухоли является кислым, добавление высоких концентраций аскорбата будет способствовать эффективной и непрерывной генерации ДГК из аскорбата. Кроме того, когда окисление миллимолярных уровней аскорбата генерирует внеклеточный H2O2, как мы обсуждали ранее, это приведет к большим количествам внеклеточного ДГК, поскольку ДГК является основной окисленной формой аскорбата.
Окислительный стресс в раковых клетках, вызванный высокими дозами аскорбата и возникающий в результате описанного выше механизма, также подтверждается исследованиями с участием людей. У пациентов с дефицитом глюкозо-6-фосфатдегидрогеназы (Г6ФД) отмечалась гемолитическая анемия после внутривенного введения аскорбата в высоких дозах. Хотя в эритроцитах наблюдается высокая экспрессия ГЛЮТ1 и энергия генерируется за счет гликолиза (аналогично мутантным клеткам KRAS или BRAF), они имеют повышенный уровень антиоксидантных ферментов и повышенный поток глюкозы в пентозофосфатном пути, чтобы генерировать больше НАДФН.
В нормальных условиях это защищает эритроциты от высоких доз аскорбата. Однако человеческие эритроциты без Г6ФД не могут продуцировать достаточное количество НАДФ молекулы для восстановления сниженных уровней глутатиона, вызванных окислительным стрессом в результате воздействия витамина С. Это приводит к гибели эритроцитов, вызывая тем самым анемию. Для того, чтобы избежать этого осложнения, пациенты, которым планируется добавлять к терапии витамин С, должны пройти предварительный скрининг на дефицит Г6ФД.
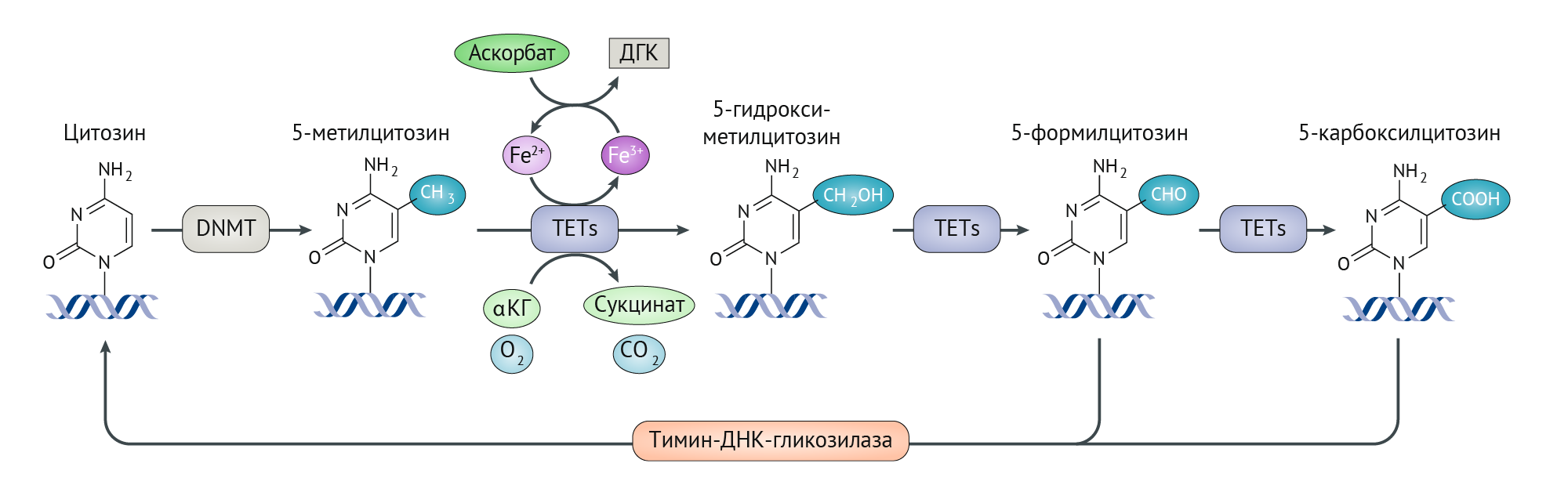
Рисунок 2 | Регуляция ТеТ ферментов аскорбатом.
Катализируемое ДНК-метилтрансферазами (DNMT) метилирование ДНК происходит в положении С-5 молекулы цитозина. Внутриклеточный аскорбат влияет на метилирование ДНК, усиливая ферментативную активность ферментов транслокации (10;11) (TETs), которые активно удаляют метилированный цитозин посредством ряда реакций окисления, зависящих от кислорода, α-кетоглутарата (αKG), Fe2+ и аскорбата на основе его функции как αKG-зависимой диоксигеназы (αKGDD). Сначала 5-метилцитозин превращается в 5-гидроксиметилцитозин, который окисляется до 5-формилцитозина и 5-карбоксилцитозина. Впоследствии эти вещества превращаются в цитозин с помощью основного фермента пути эксцизионной репарации, тиминовой ДНК-гликозилазы. Способствуя рециркуляции Fe3+ в Fe2+, аскорбат обеспечивает постоянную активность транслокационных ферментов.
Источник: Targeting cancer vulnerabilities with high-dose vitamin C
