Уязвимость раковых клеток к высоким дозам витамина С. Часть 1

Мы предлагаем вам краткий пересказ эссе Брайана Нго, опубликованного в Nature Reviews Cancer, в котором он достаточно интересно рассуждает о потенциальном влияния витамина C на опухолевые клетки. Автор предупреждает, что излагаемые механизмы являются мнением исследователя и требуют дальнейших исследований.
Биологические свойства аскорбата, взаимодействие с раковыми клетками
Синтез витамина C
В организме большинства животных витамин С синтезируется из глюкозы в почках или печени. Однако в организме людей витамин С не может синтезироваться из-за мутаций гена, кодирующего L-гулонолактоноксидазу (GULO), фермент, ответственный за катализ последней стадии синтеза витамина С. Поэтому люди получают витамин С из продуктов питания. Рекомендуемая ежедневная доза витамина С 75–90 mg, при которой концентрация аскорбата в плазме составляет 30–80 μM.
Редокс-формы витамина С
Витамин С может существовать в разных редокс-формах (Рисунок 1a). Полностью восстановленный витамин С может окисляться как внутриклеточно, так и внеклеточно. Внеклеточный аскорбат окисляется свободными радикалами или активными формами кислорода (АФК), образуя промежуточный слабо радикальный аскорбатный радикал (Asc•−), который затем полностью окисляется в дегидроаскорбиновую кислоту, период полураспада которой менее 1 минуты. ДГК составляет лишь 1–5% витамина С в организме человека и либо транспортируется внутри клетки (Вставка 1), либо необратимо гидролизуется в 2,3-L-дикетоглутонат (2,3-ДКГ). Затем 2,3-ДКГ разлагается на щавелевую и треоновую кислоты, что приводит к полной потере витамина С.
Вставка 1 | Транспорт витамина С
Самые высокие концентрации витамина С обнаруживаются в мозге, надпочечниках и лейкоцитах с концентрацией от 1 до 15 мМ.
Эти концентрации в 15–200 раз выше, чем в плазме, благодаря активным транспортным механизмам, главным образом через натрийзависимые транспортеры витамина С (svCt1 и svCt2). svCt1 в основном экспрессируется в эпителиальных клетках кишечника и почек, где он опосредует всасывание и повторную абсорбцию витамина С, соответственно.
svCt2 экспрессируется во всех клетках организма и считается основным переносчиком витамина С.
В отличие от аскорбата, дегидроаскорбиновая кислота (ДГК) транспортируется классом переносчиков глюкозы (GLUT). Среди более чем 12 различных переносчиков GLUT1 и GLUT3 имеют более высокое сродство к дегидроаскорбиновой кислоте, чем к глюкозе.
Однако в физиологических условиях транспортеры глюкозы вряд ли являются доминирующим путем накопления аскорбата в большинстве тканей, поскольку уровни глюкозы в плазме (2–5 мМ) значительно выше, чем уровни ДГК (5–10 мкМ).
Эритроциты и некоторые раковые клетки не экспрессируют svCts, но транспортируют витамин C в основном в виде ДГК через GLut1.
Скорость поглощения ДГК через GLUT1 или GLUT3, по крайней мере, в 10–20 раз выше, чем поглощение аскорбата через svCts.
Это различие связано с тем, что чрезвычайно благоприятное снижение внутриклеточного ДГК до аскорбата стимулирует поглощение ДГК клетками.
Кроме того, локальные концентрации ДГК в жидкостях организма могут быть выше при патологических состояниях, таких как рак, когда АФК, высвобождаемые из раковых клеток, могут способствовать окислению внеклеточного аскорбата до ДГК.
Например, в моделях кишечных опухолей у мышей, содержащих мутации KRAS, наблюдалось увеличение уровня внутриклеточного аскорбата со 100 мкМ (базальный уровень) до более 10 мМ в течение 1 часа после внутрибрюшинной инъекции аскорбата в высоких дозах.
Такое резкое повышение уровня внутриклеточного аскорбата в мутантных опухолях Kras можно объяснить селективным поглощением ДГК посредством ГЛЮТ1 и его последующим восстановлением до аскорбата.
Опухоли Apc−/−; KrasG12D/+ активнее экспрессируют GLUT1 по сравнению с APC−/−, но обе опухоли экспрессируют низкие уровни svCts.
Внутри клетки дегидроаскорбиновая кислота быстро восстанавливается обратно в аскорбат, реагируя с восстановленным глутатионом. Окисленный глутатион (глутатион дисульфид) затем быстро превращается снова в глутатион с участием НАДФН.
Биологическая роль витамина C
Биологические функции витамина С обусловлены его способностью отдавать электроны. В качестве антиоксиданта физиологический аскорбат в микромолярных концентрациях может снижать уровень АФК. Он может функционировать и в качестве прооксиданта при миллимолярных концентрациях в плазме, что может быть достигнуто путем внутривенного введения фармакологического аскорбата.
Помимо окислительно-восстановительных функций, витамин С влияет на метаболизм железа: увеличивает синтез ферритина, ингибируя деградацию ферритина и подавляя отток железа, усиливает всасывание железа в кишечнике. Витамин С также является критическим кофактором для многих ферментов, легко отдает свои электроны простетическим группам (ионам металлов) для достижения полной ферментативной активности. В целом, эти ферменты подразделяются на два семейства: медьсодержащие монооксигеназы и Fe2+-зависимые и α-кетоглутарат-зависимые диоксигеназы, которые являются железосодержащими ферментами. Они используют кислород и αКГ в качестве субстратов, производя CO2 и сукцинат.
α-Кетоглутарат-зависимые диоксигеназы катализируют широкий спектр реакций гидроксилирования, участвующих в синтезе коллагена, стабильности фактора 1α (HIF1α), синтезе карнитина, катаболизме тирозина и деметилировании белка, ДНК и РНК.
Витамин С и рак
По современным данным миллимолярные концентрации фармакологического витамина С могут убивать раковые клетки in vitro и замедлять рост опухоли in vivo. Механизм, с помощью которого некоторые раковые клетки оказываются чувствительны к витамину С, в то время как нормальные клетки остаются резистентными, плохо изучен. С учетом разнообразия процессов, на которые влияет витамин С, механизм действия витамина С может зависеть от множества различных факторов.
В данной статье речь идет о действии фармакологического аскорбата на три слабых места рака.
Направленность на окислительно-восстановительного дисбаланс
Известно, что раковые клетки из-за повышенной скорости метаболизма и дефектных митохондрий испытывают больший окислительный стресс по сравнению с нормальными клетками. Хотя активные формы кислорода могут способствовать развитию опухоли, стимулируя пролиферацию клеток и способствуя генетической нестабильности, избыточное количество АФК также может быть вредным для раковых клеток.
Раковые клетки стремятся минимизировать токсические эффекты АФК. Исходя из предположения, что АФК способствует развитию рака, антиоксидантное лечение было рассмотрено как один из вариантов. Но доказательств пользы антиоксидантной терапии в качестве профилактики или лечения рака не найдено.
Более того, в некоторых случаях антиоксидантное лечение даже ускоряет прогрессирование рака: метастазирование аденокарциномы легкого и меланомы у мышей, повышение риска возникновения рака простаты и легких у пациентов. Вместе эти результаты показывают, что определенные типы рака способны использовать антиоксиданты для выживания, и тогда они возможно станут реагировать на прооксидантную терапию. И действительно, прооксидантная противоопухолевая терапия, например облучение, широко используется.
Но эта методика имеет серьезные побочные эффекты и как следствие узкое терапевтическое окно. Эту проблему можно решить применением фармакологического аскорбата, основываясь на двух общих особенностях раковых клеток: высокий уровень неустойчивых переходных металлов, особенно железа, и повышенную зависимость от поглощения глюкозы и гликолиза. Хотя эти два механизма рассматриваются отдельно, они не являются взаимоисключающими и могут работать одновременно (Рисунок 1б).
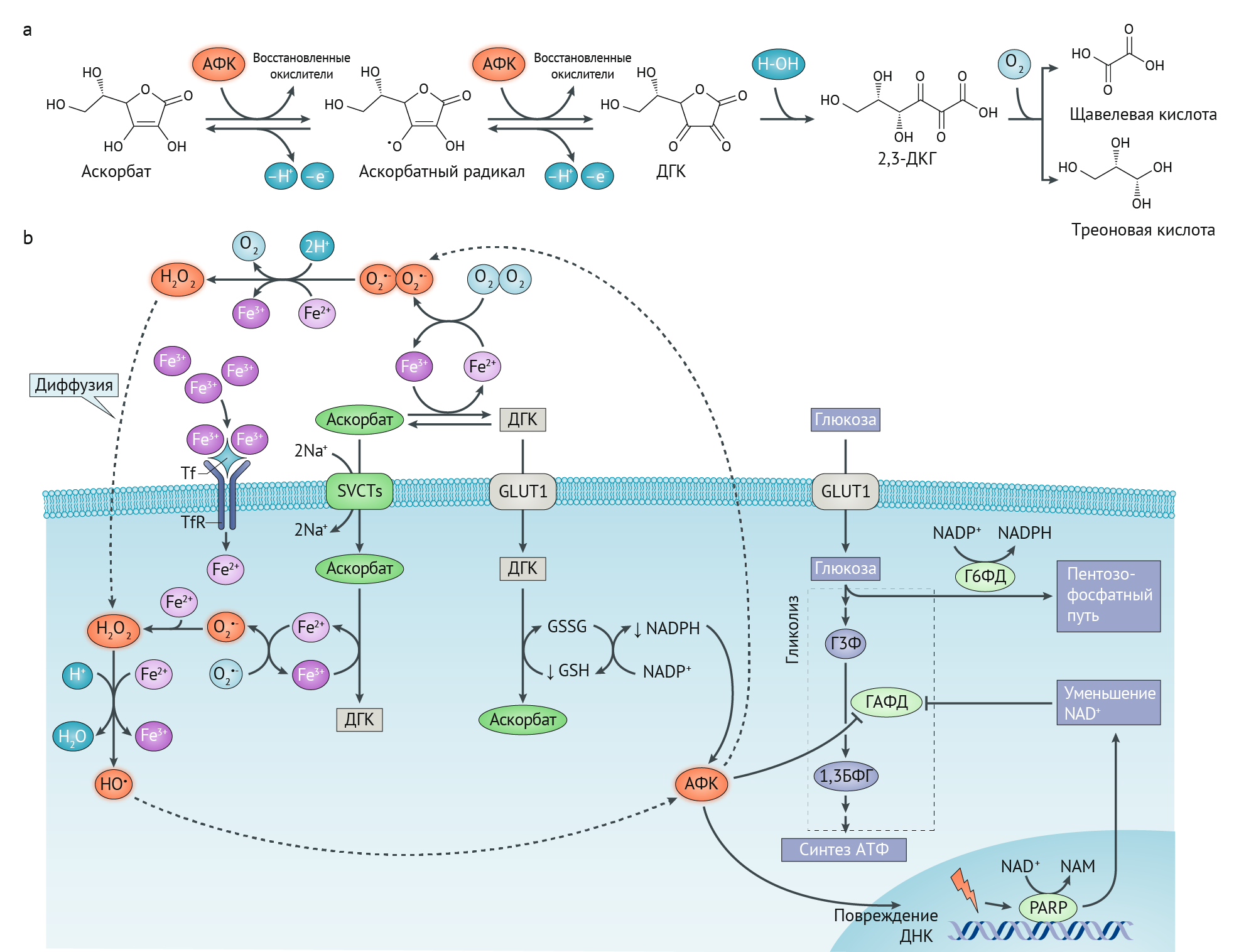
Рисунок 1 | Интегрированный прооксидантный механизм витамина С и цитотоксичность раковых клеток.
а — Аскорбат может окисляться во внеклеточном пространстве с помощью активных форм кислорода, образуя аскорбатный радикал, который может окисляться до дегидроаскорбиновой кислоты (ДГК). ДГК может поглощаться клетками или необратимо превращаться в 2,3-L-дикетоглутонат (2,3-ДКГ), который разлагается на щавелевую и треоновую кислоты.
б — Фармакологический аскорбат может убивать раковые клетки, усиливая окислительный стресс с помощью двух возможных механизмов, которые дополняют друг друга.
1. Внеклеточный H2O2 может непосредственно убивать раковые клетки, генерируя •ОН через реакцию Фентона. Повышенные уровни неустойчивого трехвалентного железа Fe3+ в микроокружении опухоли могут способствовать окислению аскорбата, что приводит к образованию аскорбатного радикала ДГК и двухвалентного железа Fe2+.
После образования Fe2+, он может окисляться кислородом с образованием супероксидных анионов O2•-. Супероксиддисмутаза катализирует превращение O2•- в H2O2 и O2. Fe3+ может проникать в клетку, связываясь с трансферрином (Tf), который связывается с рецептором трансферрина (TfR), далее Fe3+ окисляется в эндосоме, чтобы затем стать частью внутриклеточного пула Fe2+.
H2O2 может проникнуть в клетку посредством диффузии, которой способствуют аквапорины. H2O2 реагирует с внеклеточным или внутриклеточным неустойчивым Fe2+ с образованием высокореакционноспособных гидроксильных радикалов (•OH), которые вредны для клеток. Эти реакции в дальнейшем продолжаются за счет рециркуляции Fe3+ в Fe2+ аскорбатом и аскорбатным радикалом с образованием полностью окисленного витамина C, ДГК.
2. H2O2 может способствовать повышению уровня внеклеточного ДГК, делая микроокружение опухоли более кислым. Затем ДГК может эффективно проникать в клетки через транспортер глюкозы-1 (GLUT1) и использовать внутриклеточный восстановительный потенциал восстановленного глутатиона и НАДФН, что приводит к повышению уровня внутриклеточных активных форм кислорода.
Это приводит к активации поли(АДФ-рибоза)-полимеразы, фермента репарации ДНК, тем самым снижая клеточные уровни НАД+, кофактора этого фермента.
НАД+ необходим глицеральдегид-3-фосфатдегидрогеназе (ГАФД) в качестве кофактора.
Последующее ингибирование активности ГАФД ингибирует гликолиз в раковых клетках, что приводит к подавлению синтеза АТФ и гибели клеток. Кроме того, клеточные активные формы кислорода также могут высвобождаться из клеток, что приводит к цепи положительной обратной связи.
Поскольку высокие уровни неустойчивого Fe2+, избыточная экспрессия GLUT1 и склонность к гликолизу часто встречаются во многих типах раковых клеток, некоторые раковые клетки могут проявлять все три из этих характеристик, и эти популяции могут быть более чувствительными к лечению аскорбатом.
1,3-БФГ — 1,3-бисфосфоглицериновая кислота; Г-3-Ф — глицеральдегид-3-фосфат; Г6ФД — глюкозо-6-фосфатдегидрогеназа; GSSG — глутатион дисульфид; пентозофосфатный путь; SVCT — натрий-зависимые переносчики витамина С.
Источник: Targeting cancer vulnerabilities with high-dose vitamin C
