CCN3 — новый биомаркер костных метастазов при раке предстательной железы
Смертность при раке простаты коррелирует с агрессивностью и скоростью метастазирования. Особый риск представляют костные метастазы, обладающие высокой агрессивностью и крайне тяжелым течением за счет выраженного болевого синдрома [1].
Согласно недавнему исследованию группы ученых из Филадельфии, штат Пенсильвания, ген CCN3 и его продукт (небольшой секреторный белок) могут быть важными факторами инвазии опухолевых клеток рака предстательной железы в костные структуры [2].
CCN3 (также известный как сверхэкспрессируемый ген нефробластомы (NOV)) является членом семейства CCN сигнальных белков, секретируемых во внеклеточный матрикс. Это семейство белков участвует в широком спектре биологических процессов, таких как пролиферация клеток, мобильность, инвазивный потенциал и ангиогенез. Имеются данные о роли CCN3 в костном метастазировании при раке молочной железы [3].
Экспрессию CCN3 анализировали в двух независимых сериях образцов первичных опухолей предстательной железы, предоставленных Центром медицинских исследований университета Монреаля, биобанка Канадской сети биомаркеров рака предстательной железы. В материале, представленном 285 образцами злокачественных опухолей предстательной железы, высокая экспрессия CCN3 (данные иммуногистохимического исследования) достоверно соответствовала сокращению общей выживаемости и развитию костных метастазов в течении 10 лет с момента выставления диагноза. Аналогичные результаты наблюдались при анализе 1259 образцов первичного рака предстательной железы с использованием иммунофлюоресценции. Пациенты с максимально высокой экспрессией CCN3 демонстрировали предрасположенность к развитию костного метастазирования через 15 лет после первичной диагностики, также имели более высокую вероятность развития биохимического рецидива через три и пять лет по сравнению с группой с низким уровнем экспрессии CCN3 [2].
При этом экспрессия CCN3 отрицательно коррелирует с экспрессией простат-специфического антигена (PSA), маркера передачи сигналов рецепторов андрогенов. Предполагается, что CCN3 ингибирует передачу сигналов рецепторов андрогенов, активность которых, в свою очередь, угнетает экспрессию CCN3 [4].
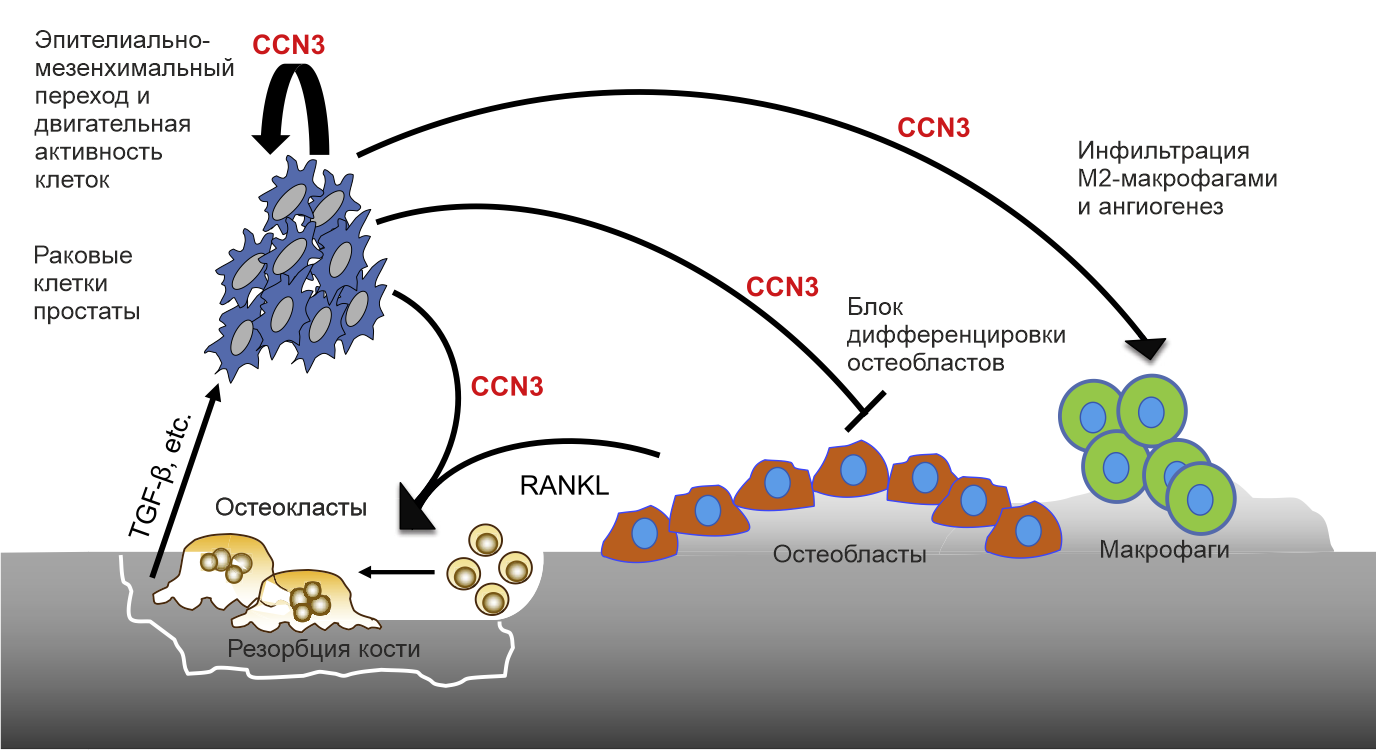
Рисунок 1 | Роль CCN3 в развитии и агрессивности костного метастазирования при раке предстательной железы.
Экспрессия CCN3 рассматривается как механизм индукции эпителиально-мезенхимальной пластичности и миграции клеток рака предстательной железы посредством экспрессии молекулы межклеточной адгезии. Кроме того, CCN3 способствует остеокластогенезу и блокирует дифференцировку остеобластов, что приводит к резорбции костного матрикса и высвобождению сохраненных факторов роста, таких как трансформирующий фактор роста-β, которые усиливают пролиферацию и инвазивную способность злокачественно трансформированных клеток. Также секретированный CCN3 способствует инфильтрации стромы опухоль-ассоциированными макрофагами М2-подобного типа, что приводит к усилению ангиогенеза, активации RANKL, рецепторного активатора ядерного фактора каппа-β и его лиганда [2].
Уровень экспрессии CCN3 был различен в опухолевой популяции. Максимально высокие значения отмечены в клеточных линиях рака предстательной железы, которые обладают остеолитической активностью in vivo, самые низкие — в менее агрессивных пулах клеток, которые образуют остеобластический тип метастазов. Исследователи также обнаружили, что C-концевой домен белка CCN3 (СТ, С-терминальная область, богатая цистеином), который обусловливает связывающую способность белка с различными молекулами (такими как тромбоцитарный фактор роста, Notch1 и трансформирующий фактор роста-β), также значим и для лизиса «таргетной» кости за счет ингибирования дифференцировки остеобластов. Трансформирующий фактор роста-β является широко признанным медиатором остеолитического метастазирования в кости; таким образом, вполне вероятно, что связывание CCN3 с трансформирующим фактором роста-β в микроокружении кости может усилить эту функцию. Подтверждался данный факт тем, что остеолитические эффекты, вызванные экспрессией CCN3, отсутствовали при удалении CT-домена CCN3 (см. рис.). При этом сверхэкспрессия CCN3 не оказывала влияния на пролиферативную, миграционную или инвазивную способность опухолевых клеток. В связи с этим повышенная способность образовывать костные метастазы в образцах с высоким уровнем CCN3 рассматривается на данном этапе как обусловленная взаимодействиями с микроокружением остеоидных клеток. CCN3 запускает модуляцию остеопротегерина (который также «замешан» в путях васкулярного ремоделирования, обеспечивающих питание метастатического опухолевой ткани, то есть осуществляет антиостеокластогенез), рецепторного активатора ядерного фактора каппа-бета и его лиганда (RANKL) что приводит к RANKL-зависимому остеокластогенезу и в итоге к повышенной резорбции кости [2].
Также CCN3 может рекрутировать макрофаги и запускать их дифференциацию до фенотипа M2 (альтернативно активированные, реагирующие на сигналы интерлейкина (IL) 4 или 13), продуцирующие противовоспалительные цитокины в отличие от классически активированных макрофагов (М1), которые отвечают на сигналы липополисахарида (LPS), интерферона (IFN) и продуцируют провоспалительных цитокины. В свою очередь, CCN3-стимулированные макрофаги способствуют VEGF-зависимому ангиогенезу [5,6]. Нейтрализующее анти-CCN3 антитело блокирует данный процесс, что может быть использовано как новый таргетный агент при терапии рака предстательной железы [6], А учитывая его доказанную роль в формировании костных метастазов, эта молекула представляет собой новую мишень диагностической и терапевтической тактики при раке предстательной железы.
Источники:
1. Li J., Ye L., Owen S., Weeks H.P., Zhang Z., and Jiang W.G. Emerging role of CCN family proteins in tumorigenesis and cancer metastasis (review). Int J Mol Med. 2015; 36: 1451–1463.
2. Dankner M. et al. CCN3/Nephroblastoma Overexpressed Is a Functional Mediator of Prostate Cancer Bone Metastasis That Is Associated with Poor Patient Prognosis The American Journal of Pathology, Volume 0, Issue 0.
3. Wu L., Runkle C., Jin H.J., Yu J., Li J., Yang X., Kuzel T., Lee C., and Yu J. CCN3/NOV gene expression in human prostate cancer is directly suppressed by the androgen receptor. Oncogene. 2014; 33: 504–513.
4. Ouellet V., Aprikian A., Bergeron A. et al. The Terry Fox Research Institute Canadian Prostate Cancer Biomarker Network: an analysis of a pan-Canadian multi-center cohort for biomarker validation. BMC Urol. 2018; 18: 78.
5. Goswami K.K., Ghosh T., Ghosh S. et al. Tumor promoting role of anti-tumor macrophages in tumor microenvironment. Cell Immunol. 2017 Jun;316:1-10.
6. Chen P.C., Cheng H.C., Wang J. et al. Prostate cancer-derived CCN3 induces M2 macrophage infiltration and contributes to angiogenesis in prostate cancer microenvironment. Oncotarget. 2014 Mar 30;5(6):1595-608.
